Académique Documents
Professionnel Documents
Culture Documents
Informe Calorimetria
Transféré par
Diana Catalina CruzTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Informe Calorimetria
Transféré par
Diana Catalina CruzDroits d'auteur :
Formats disponibles
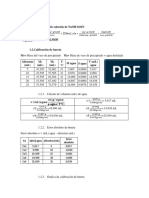
CALIBRACIN DEL CALORMETRO Y DETERMINACIN DEL CALOR
ESPECFICO DE LA PAPA.
Diana C. Cruz Gonzlez, Karen D. Lopez Gaitn, Dana L. Rodrguez
Sistemas Fisicoqumicos I, Facultad de Ciencia y tecnologa, Universidad
pedaggica Nacional, Colombia.
1. Objetivos (cada una hace uno)
2. Marco Terico (Dana)
3. Clculos y resultados (cata)
3.1. CALIBRACIN DEL CALORMETRO
Datos obtenidos experimentalmente para determinar la capacidad calorfica del
calormetro empleado en la prctica.
Volumen H2O Temperatura
(ml) C Masa H2O (kg)
100 20 0,1
100 70 0,1
Tabla 1.Datos experimentales para la calibracin del calormetro.
TEMPERATURA DEL CALORIMETRO EN EQUILIBRIO
TC de TC de
Tiempo Promedio de
Calibracin Calibracin
(s) calibracin
No.1 No.2
10 42 47 44,5
20 42 46 44
30 42 46 44
40 42 46 44
50 41 46 43,5
60 41 46 43,5
70 40 46 43
80 40 46 43
90 40 45 42,5
100 40 45 42,5
110 40 45 42,5
120 40 45 42,5
130 40 45 42,5
160 40 45 42,5
190 40 45 42,5
220 40 44 42
250 39 44 41,5
280 39 44 41,5
310 39 44 41,5
340 39 44 41,5
370 38 44 41
400 38 43 40,5
430 38 43 40,5
Tabla 2.Determinacin de la temperatura de equilibrio, en el calormetro.
Calibracion del calorimetro
45
44.5
44
Temperatura C
43.5
43
42.5
42
41.5
41
40.5
40
0 100 200 300 400 500
Tiempo (s)
Grafica. 1. Temperatura Vs. Tiempo en la calibracin del calormetro.
DETERMINACION DE LA CONSTANTE CALORIMETRICA
Ensayo #
Unidades Ensayo # 1 2
Masa inicial del agua fra. g 100 100
Temperatura inicial del
agua fra a temperatura C 20 20
ambiente.
Temperatura inicial del
C 70 70
agua caliente.
Temperatura mxima de
C 42 47
la mezcla.
Calor que cede kJ -11,704 -9,614
Calor que gana kJ 9,196 11,286
Constante del calormetro kJ/C 0,114 -0,0619
Valor promedio de la
kJ/C 0,0261
constante del calormetro.
Tabla 3. Datos para determinar la constante calorimtrica.
3.1.1. CALCULO PARA DETERMINAR LA CAPACIDAD CALORFICA DEL
CALORMETRO
- Qcedido= Qganado
-m agua caliente CpT1= m agua fra CpT2 + kcalT2
Ensayo No.1
Kcal1 =
[(0,14,18 )(4270)][(0,1 4,18)(4220)]
Kcal1 = (4220)
Kcal1= 0,114
Ensayo No.2
Kcal2 =
[(0,14,18 )(4770)][(0,1 4,18)(4720)]
Kcal2 = (4720)
Kcal2= -0,0619
Valor promedio de la constante del calormetro
+ (0,114 )+(0,0619 )
= 0,0261
Kcal promedio= 0,0261
3.2. DETERMINACIN DEL CALOR ESPECFICO (CP.) DE LA PAPA.
Datos obtenidos experimentalmente para la determinacin del calor especifico de
la papa.
Volumen Temperatura Masa H2O
H2O (ml) C (H2O) (kg)
200 67 0,2
Temperatura
Masa papa Masa papa
C
(g) (kg)
(H20)
4,2223 17,5 0,0042223
Tabla 4. Datos experimentales para la determinacin del calor especifico de la papa.
TEMPERATURA DEL CALORIMETRO
EN EQUILIBRIO
Tiempo (s) TC del alimento + H20
10 62
20 61
30 61
40 60
50 59
60 59
70 58
80 58
90 58
100 58
110 58
120 58
130 58
160 57
190 57
220 57
250 56
280 56
310 55
340 55
370 55
400 55
430 54
Tabla 5. Determinacin de la temperatura de equilibrio de la papa.
Determinacion del Cp. de la papa
64
Temperatura C
62
60
58
56
54
52
0 100 200 300 400 500
Tiempo (s)
Grafica. 2. Temperatura Vs. tiempo, en la determinacin del calor especifico de la
papa.
Calor 1 = cedido por el agua
Q1 TC de H20 (L) de 67C a TE (62) C
Q1 m de H20 (L) * Cp. H20 (L) * (TE TO)
Tabla 6. Calor cedido por el agua, en la determinacin del calor especifico de la
papa.
Calor 2= cedido por el calormetro
Q2 TC del calormetro de 67C a TE (62) C
Q2 Kcal * (TE- TO )
Tabla 7.Calor cedido por el agua, en la determinacin del calor especifico de la
papa.
Calor 3 = absorbido por la papa
Q3 TC de la papa 17,5 C a TE (62) C
Q3 m de papa * Cp. papa * (TE - TO )
Tabla 8. Calor absorbido por la papa.
Q1+Q2+Q3 = 0
[0,2kg*4,18 * (62 67) C] + [0,0261 * (62-67) C] +
[0,00422kg *Cp. Papa * (62 17,5) C] = 0
[-4,180 kJ ] + [-0,131 kJ] + [0,188 kJ*Cp. Papa C]
4,180 kJ+0,131 kJ
Cp. Papa = 0,188 kg C
Cp. papa = 22,931
4. Anlisis
Como ya se mencion anteriormente el propsito de este trabajo experimental, fue
la determinacin de la capacidad calorfica del calormetro y el calor especfico
(Cp.) de un alimento que en este caso fue de la papa. En esa parte se analizar
cada proceso.
4.1. Calibracin del calormetro para determinar la capacidad
calorfica del calormetro.
El calormetro es considerado un sistema aislado que no permite el intercambio de
energa ni de masa, por eso se emple para determinar qu cantidad de energa
requiere la papa para cambiar su temperatura sin que haya prdida o ganancia de
calor. Sin embargo hay que tener en cuenta que para procesos de intercambio de
energa calorfica se debe incluir al calormetro y sus componentes en la bsqueda
de los calores involucrados, puesto que este tomara parte del calor suministrado
por el agua, en este caso. Por este motivo es necesario conocer la capacidad
calorfica del calormetro, que es el producto de la masa y el calor especfico del
calormetro, la cual indica la cantidad de calor cedido o absorbido por las paredes
del mismo cuando se aumenta o se disminuye su temperatura en 1C.
Esta calibracin se realiz con agua destilada; tomando un volumen determinado
a temperatura ambiente y otro volumen igual con una temperatura mayor (valores
registrados en la Tabla 1). Posteriormente se registr en la Tabla 2 la temperatura
de la mezcla medida con la termocupla en intervalos de 10 segundos y cuando
pareca constante la temperatura, se midi cada 30 segundos durante 5 minutos y
esta segua descendiendo, como se puede evidenciar en la Grfica. 1. Lo cual se
debe a la ley de enfriamiento de Newton, que afirma que cuando ms caliente est
un sistema ms rpido se enfra y ms lentamente cuando su temperatura se
acerca a la temperatura del entorno (CARRASCO, G. 2002), debido a que hay una
interaccin leve con el entorno ya que la efectividad del calormetro no es de un
100%, posiblemente a causa de las aberturas donde se introduce el agitador y el
termmetro. Despus de los 5 minutos de medicin de la temperatura se repiti el
proceso y se registraron los datos en la misma Tabla 1, para as poder establecer
un acercamiento ms acertado al valor de la constante del calormetro. De esta
manera se determin la capacidad calorfica con los dos ensayos realizados y los
valores se registraron en Tabla 3, teniendo en cuenta la primera ley de la
termodinmica, que nos indica que la energa total del universo se conserva. As
que el calor aportado es igual al absorbido por el sistema y la energa interna (U)
aumenta una cantidad exactamente igual al calor aportado (LAIDLER. MEISER,
1998).
Teniendo en cuenta la ley cero de la termodinmica la cual dice que si inicialmente
un cuerpo C est en equilibrio trmico con un cuerpo A y con un cuerpo B,
entonces A y B estn en equilibrio trmico entre s, se realizaron dos ensayos para
determinar de la capacidad calorfica del calormetro tomando como temperatura
de equilibrio trmico la temperatura mxima que alcanzo el sistema al mezclarse.
En el apartado 3.1.1 se disponen los clculos realizados para su obtencin,
teniendo para el ensayo No 1 un valor 0,114 kJ(C) y en el ensayo No.2. Un valor
de -0,0619 kJ(C). El valor positivo nos indica que el calormetro absorbe calor del
sistema, y el valor negativo nos indica que el calormetro cede calor al sistema, lo
cual es poco probable, no obstante esta imprecisin se debe a la dificultad de
mantener una temperatura constante, la cual no interacte con el ambiente. Sin
embargo estos dos ensayos se promedian para obtener un constante calorimtrica
ms precisa con un valor de 0,0261 kJ(C) que no indica que el calormetro est
absorbiendo 0,061 kJ por cada grado de elevacin en la temperatura. Con este
valor se procede a determinar el calor especfico de la papa.
4.2. Determinacin del calor especifico de la papa
5. Conclusiones
La capacidad calorfica en el ensayo 2 nos arroj un valor negativo, indicando que el
calormetro cede calor al sistema, cuando en realidad esto es improbable. sin embargo
esto se debe a la dificultad de mantener la temperatura constante en un sistema aislado,
puesto que en el simple hecho de abrir el calormetro para agregar el agua caliente ya hay
interaccin con el ambiente y estos buscan rpidamente alcanzar el equilibrio trmico,
perdiendo as energa al mezclarse. Por esta razn al estar mezclados y medir su
temperatura existe un margen de error considerable. Por otra parte las grficas 1 y 2 nos
muestran el decaimiento de la temperatura en relacin con el tiempo debido a la ley de
enfriamiento de newton, lo cual nos indica que el calormetro no est totalmente aislado y
que busca un equilibrio trmico con el ambiente por eso su temperatura desciende.
6. Bibliografa
LAIDER. K, MEISER. J. Fisicoqumica. 2ed. Compaa editorial continental, S.A.
Mexico.1998. Pgina 57.
CARRASCO. G. Enfriamiento de un cuerpo Estudio de la ley de enfriamiento de
Newton. 2002. Buenos Aires.
https://es.scribd.com/doc/186452733/constante-calorimetrica (consultada
septiembre 2017)
file:///C:/Users/diana/Documents/SEXTO%20SEMESTRE/FISICOQUIMICA/Equilib
rio-T%C3%A9rmico.pdf (consultada septiembre 2017)
Vous aimerez peut-être aussi
- Informe N°seis Calor Específico de SólidosDocument9 pagesInforme N°seis Calor Específico de SólidosSolanke VinchalesPas encore d'évaluation
- 5 Ejemplo de Método CientíficoDocument6 pages5 Ejemplo de Método CientíficoSamuel Brenda Ordoñez50% (2)
- Determinación Del Calor EspecíficoDocument8 pagesDeterminación Del Calor Específicokaren lopezPas encore d'évaluation
- Reporte 7 (Capacidad Calorífica)Document8 pagesReporte 7 (Capacidad Calorífica)Oscar Daniel Ramirez MercadoPas encore d'évaluation
- Ley Cero de La TermodinámicaDocument7 pagesLey Cero de La TermodinámicaGilbert GómezPas encore d'évaluation
- P1 Datos, Cálculos 1 y 2, Conclusiones, Aplicación Industrial, Diagrama Del Equipo y Cuestionario Preguntas 4 y 5Document7 pagesP1 Datos, Cálculos 1 y 2, Conclusiones, Aplicación Industrial, Diagrama Del Equipo y Cuestionario Preguntas 4 y 5Nora ProaPas encore d'évaluation
- PRACTICA 06 CalorimetroDocument7 pagesPRACTICA 06 CalorimetroernestoPas encore d'évaluation
- Informe de Curvas de CalentamientoDocument9 pagesInforme de Curvas de CalentamientoMIGUEL ANGEL ROLDAN MARTINPas encore d'évaluation
- 1212 Práctica 7 CASI SUBIRDocument9 pages1212 Práctica 7 CASI SUBIRAXEL URIEL VILLEDA CORONAPas encore d'évaluation
- Informe 4-TemperaturaDocument14 pagesInforme 4-Temperaturajhonathan ever meneses lopezPas encore d'évaluation
- Practica 3 Equivalente Termico Del Calorimetro Temperatura de EquilibrioDocument11 pagesPractica 3 Equivalente Termico Del Calorimetro Temperatura de EquilibrioMary LokisPas encore d'évaluation
- P.8 Cambio de EntalpíaDocument7 pagesP.8 Cambio de Entalpíamauricio ortegaPas encore d'évaluation
- Informe Capacidad CalorificaDocument10 pagesInforme Capacidad Calorificaalejitoceron2013Pas encore d'évaluation
- PRACTICA 09 FisicoquímicaDocument11 pagesPRACTICA 09 FisicoquímicaYanided ValladolisPas encore d'évaluation
- Andrea Armijos-Informe 7. DETERMINACIÓN DEL TÍTULO DE VAPOR.Document8 pagesAndrea Armijos-Informe 7. DETERMINACIÓN DEL TÍTULO DE VAPOR.brigethPas encore d'évaluation
- Medición capacidades caloríficas metal cobreDocument6 pagesMedición capacidades caloríficas metal cobreAlejandra Lopez RuizPas encore d'évaluation
- Calorimetría: Medida de calor de reacción químicaDocument26 pagesCalorimetría: Medida de calor de reacción químicaFránkitóó Fèèstt ʚïɞPas encore d'évaluation
- Capacidad calorífica de un calorímetro y calor de disoluciónDocument20 pagesCapacidad calorífica de un calorímetro y calor de disoluciónAtnissPas encore d'évaluation
- Calor Especifico Del AguaDocument9 pagesCalor Especifico Del AguaMariana Rosas MorilloPas encore d'évaluation
- Determinación Del Equivalente Mecánico Del Calor Por Método EléctricoDocument5 pagesDeterminación Del Equivalente Mecánico Del Calor Por Método EléctricoSantiago VallejoPas encore d'évaluation
- Laboratorio 1 Termodinámica 2022-2Document15 pagesLaboratorio 1 Termodinámica 2022-2Benja AstudilloPas encore d'évaluation
- Laboratorio 6 Fisicoquimica Sistema BianriosDocument8 pagesLaboratorio 6 Fisicoquimica Sistema Bianriosyerson mendoza roblesPas encore d'évaluation
- Lab Fisicoq 5Document9 pagesLab Fisicoq 5Sebastian ZuluagaPas encore d'évaluation
- Calorímetro-Temperatura EquilibrioDocument12 pagesCalorímetro-Temperatura EquilibriojrPas encore d'évaluation
- Calor-trabajo UNAMDocument7 pagesCalor-trabajo UNAMGeorgina GarciaPas encore d'évaluation
- Determinación del Título de VaporDocument10 pagesDeterminación del Título de VaporandreslarahernandezPas encore d'évaluation
- Curva de CalentamientoDocument11 pagesCurva de Calentamiento11B CAMILA CONDE PEÑARANDAPas encore d'évaluation
- Informe de Calor EspecificoDocument11 pagesInforme de Calor EspecificoAlex Fark75% (4)
- Informe Práctica 1Document5 pagesInforme Práctica 1ALEJANDRO RODAS MONTOYAPas encore d'évaluation
- El Calor Específico Es La Cantidad de CalorDocument7 pagesEl Calor Específico Es La Cantidad de CalorYeimi PérezPas encore d'évaluation
- Actividad 1 Sensores Temperatura (3) GrupoooooooDocument8 pagesActividad 1 Sensores Temperatura (3) GrupoooooooLaura RPas encore d'évaluation
- Informe de Laboratorio No9 QuimicaDocument9 pagesInforme de Laboratorio No9 QuimicaMarlin Julieth LozadaPas encore d'évaluation
- Lab 61Document8 pagesLab 61isaacnormanaPas encore d'évaluation
- Equivalecia Calor TrabajoDocument16 pagesEquivalecia Calor TrabajoIsaacSerraldePas encore d'évaluation
- Informe de Laboratorio de Fisica DestilacionDocument8 pagesInforme de Laboratorio de Fisica DestilacionMichael PachecoPas encore d'évaluation
- Calorímetro de Joule: conservación energíaDocument5 pagesCalorímetro de Joule: conservación energíalinaPas encore d'évaluation
- Ley Cero de La Termodinamica.Document9 pagesLey Cero de La Termodinamica.Teodulo LaraPas encore d'évaluation
- Ley de Enfriamiento de NewtonDocument3 pagesLey de Enfriamiento de NewtonLuis ArcosPas encore d'évaluation
- Annotated-Calor Especifico Del Agua LDocument10 pagesAnnotated-Calor Especifico Del Agua LEstefani ZSPas encore d'évaluation
- Reporte 5Document17 pagesReporte 5Montse VenegasPas encore d'évaluation
- Fisico Informe 3Document10 pagesFisico Informe 3Ana Maria Rojas PereaPas encore d'évaluation
- Neutrilización DefinitivaDocument7 pagesNeutrilización DefinitivaMAYCOL ESTI VENPas encore d'évaluation
- La Ecuacion Calorimetrica Informe 2Document8 pagesLa Ecuacion Calorimetrica Informe 2ALEJANDRA GUTIERREZ SAAVEDRAPas encore d'évaluation
- Practica - Ley Cero 1Document10 pagesPractica - Ley Cero 1Juan Escutia ReyesPas encore d'évaluation
- Informe 1 FísicoquímicaDocument4 pagesInforme 1 FísicoquímicaKevin CueroPas encore d'évaluation
- Informe Práctica FisicoquímicaDocument33 pagesInforme Práctica FisicoquímicaWilliam LozanoPas encore d'évaluation
- Calorimetria InfDocument10 pagesCalorimetria InfAlexander Toro TorrezPas encore d'évaluation
- Determinacion Del Calor Especifico de Los LiquidosDocument4 pagesDeterminacion Del Calor Especifico de Los Liquidosfernanda oviedoPas encore d'évaluation
- Practica 1Document9 pagesPractica 1Armando Frias RangelPas encore d'évaluation
- Ley de Newton en metalesDocument7 pagesLey de Newton en metalesLizeth HigueraPas encore d'évaluation
- Diagrama de Fases 2Document17 pagesDiagrama de Fases 2Alexhitoo TlvPas encore d'évaluation
- Grupo 1 Práctica 1Document20 pagesGrupo 1 Práctica 1Nora ProaPas encore d'évaluation
- Calor, Temperatura, Energía, Transferencia de Energía y Capacidad CaloríficaDocument7 pagesCalor, Temperatura, Energía, Transferencia de Energía y Capacidad CaloríficaValentina Cabal RestrepoPas encore d'évaluation
- 3er Informe Presión de Vapor de Un Líquido PuroDocument5 pages3er Informe Presión de Vapor de Un Líquido PuroAlejandro González33% (3)
- Calor Latente de Fusión Del HieloDocument9 pagesCalor Latente de Fusión Del HieloLeslie Fernanda Ramos GarcíaPas encore d'évaluation
- REACCIONES QUIMICAS II REACTOR BATCHDocument9 pagesREACCIONES QUIMICAS II REACTOR BATCHYeraldin PachecoPas encore d'évaluation
- CALORIMETRIADocument13 pagesCALORIMETRIADanilo Arias RojasPas encore d'évaluation
- Laboratorio Sobre TemperaturaDocument11 pagesLaboratorio Sobre TemperaturaKata RoaPas encore d'évaluation
- IL Nº03-Ley de Enfriamiento-Virtual-MachadoDocument8 pagesIL Nº03-Ley de Enfriamiento-Virtual-MachadoAlejandra Céspedes TejadaPas encore d'évaluation
- Curso Práctico de Química GeneralD'EverandCurso Práctico de Química GeneralÉvaluation : 4 sur 5 étoiles4/5 (4)
- Informe MetodosDocument20 pagesInforme MetodosDiana Catalina CruzPas encore d'évaluation
- Informe CalibracionDocument7 pagesInforme CalibracionDiana Catalina CruzPas encore d'évaluation
- Concepto de Gas PDFDocument2 pagesConcepto de Gas PDFDiana Catalina CruzPas encore d'évaluation
- Gua Laboratorio de Anlisis Elemental CualitativoDocument6 pagesGua Laboratorio de Anlisis Elemental CualitativoRicardo DelgadoPas encore d'évaluation
- Ciclo Del Nitrogeno. de Lo Esencial A Lo ExcesivoDocument3 pagesCiclo Del Nitrogeno. de Lo Esencial A Lo ExcesivoDiana Catalina CruzPas encore d'évaluation
- Prueba de AlcoholesDocument18 pagesPrueba de AlcoholesDiana Catalina CruzPas encore d'évaluation
- Concepto de Gas PDFDocument2 pagesConcepto de Gas PDFDiana Catalina CruzPas encore d'évaluation
- Practica de Analisis Elemental 2Document3 pagesPractica de Analisis Elemental 2Diana Catalina CruzPas encore d'évaluation
- Lab 2. Analisis Preliminar FinalDocument17 pagesLab 2. Analisis Preliminar FinalDiana Catalina CruzPas encore d'évaluation
- Lab 2. Analisis Preliminar FinalDocument17 pagesLab 2. Analisis Preliminar FinalDiana Catalina CruzPas encore d'évaluation
- Lab 2. Analisis Preliminar FinalDocument17 pagesLab 2. Analisis Preliminar FinalDiana Catalina CruzPas encore d'évaluation
- Determinación de coordenadas GPS para el proyecto Presa ChontaDocument40 pagesDeterminación de coordenadas GPS para el proyecto Presa ChontaDavidPas encore d'évaluation
- Examen de Apoyo 11 Mecanica de Fluidos Hidrostatica 2023 II PDocument2 pagesExamen de Apoyo 11 Mecanica de Fluidos Hidrostatica 2023 II Pmggp100% (1)
- Informe Ensayo de Tracción Acero 1020Document5 pagesInforme Ensayo de Tracción Acero 1020Edwin R RiveraPas encore d'évaluation
- Tesis Saraín Flores Bautista, Juan Flores VillaDocument62 pagesTesis Saraín Flores Bautista, Juan Flores VillayonnysainzPas encore d'évaluation
- Cuevass 16.1.2Document12 pagesCuevass 16.1.2SVGC870Pas encore d'évaluation
- Deflexiones concreto armadoDocument10 pagesDeflexiones concreto armadoluispccomputerPas encore d'évaluation
- Sistemas Aguas-Parámetros-DosificaciónDocument2 pagesSistemas Aguas-Parámetros-DosificaciónCesar RiscoPas encore d'évaluation
- Solucionario de QuimicaDocument5 pagesSolucionario de Quimicaana luciaPas encore d'évaluation
- Ecuación de Estado SOLVEDDocument24 pagesEcuación de Estado SOLVEDJazmin BDH100% (1)
- ResilienciaDocument4 pagesResiliencialuz ZabaletaPas encore d'évaluation
- Informe de CalorimetriaDocument11 pagesInforme de CalorimetriaYorka Yeivin Arce Gutierrez50% (2)
- II Practica Calificada de Ingenieria de Operaciones IIDocument9 pagesII Practica Calificada de Ingenieria de Operaciones IIARNALDO AURELIO ALCALDE CORREAPas encore d'évaluation
- Flexion ResisDocument14 pagesFlexion ResisMATIASPas encore d'évaluation
- Compresor de dos etapas: análisis termodinámico y funcionamientoDocument27 pagesCompresor de dos etapas: análisis termodinámico y funcionamientoDavid Ninaquispe BardalesPas encore d'évaluation
- Lab3. Mant - Sist.electroDocument17 pagesLab3. Mant - Sist.electroPedro Odiaga LapierrePas encore d'évaluation
- Cambio ClimaticoDocument132 pagesCambio ClimaticoUlises Jarkin100% (4)
- Transferencia de Calor en Intercambiadores de CalorDocument12 pagesTransferencia de Calor en Intercambiadores de CalorGiovannyAndradePas encore d'évaluation
- Precipitacion RecicladaDocument12 pagesPrecipitacion RecicladaNancy Carolaim VelandiaPas encore d'évaluation
- Sistema ACUPRODocument4 pagesSistema ACUPROSomLivPas encore d'évaluation
- Gases Ideales y Reales 2016-2Document85 pagesGases Ideales y Reales 2016-2josePas encore d'évaluation
- Fisica SegundoDocument23 pagesFisica SegundoProf. Leonardo Sanabria chaparroPas encore d'évaluation
- Guia de Laboratorio N°02Document5 pagesGuia de Laboratorio N°02James AnthonyPas encore d'évaluation
- Practica 3 Mec 2255 A 2-21Document2 pagesPractica 3 Mec 2255 A 2-21JUAN FLORESPas encore d'évaluation
- PresostatosDocument11 pagesPresostatosmiguelPas encore d'évaluation
- IE23 T12B Calculo InstalacionesDocument56 pagesIE23 T12B Calculo InstalacionesmanuelposefuentesPas encore d'évaluation
- Facultad de Ingeniería Mecánica LabDocument3 pagesFacultad de Ingeniería Mecánica LabEricka VásquezPas encore d'évaluation
- FatigaDocument17 pagesFatigaDerlin CondoriPas encore d'évaluation
- Pre Wiener 2021: Física Aplicada A La MedicinaDocument28 pagesPre Wiener 2021: Física Aplicada A La MedicinaJikeyPas encore d'évaluation
- Guía Problemas de EntropíaDocument3 pagesGuía Problemas de EntropíaFabián Lezama DezaPas encore d'évaluation