Académique Documents
Professionnel Documents
Culture Documents
Ley de Conservacion de La Masa
Transféré par
NataliaEstefaníaSolarteImbachiCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Ley de Conservacion de La Masa
Transféré par
NataliaEstefaníaSolarteImbachiDroits d'auteur :
Formats disponibles
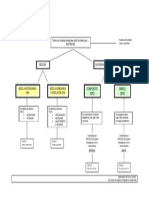
UNIVERSIDAD DE NARIO
QUIMICA GENERAL
ESTEQUIOMETRIA DE LAS REACCIONES QUIMICAS
1. OBJETIVOS
Obtener informacin cuantitativa a partir de una reaccin qumica y realizar clculos estequimetricos
Comprobar experimentalmente la ley de conservacin de la masa.
2. FUNDAMENTO TEORICO
Brown, Lemay y Bursten1 en su libro Qumica la ciencia central, en la introduccin al captulo de estequiometria afirman lo
siguiente.
La ley de conservacin de la masa de Lavoisier, es una de las leyes fundamentales del cambio qumico. En 1789
Lavoisier public un libro de texto en el que afirmaba: Podemos asentar como axioma incontrovertible que, en
todas las operaciones del arte y la naturaleza, nada se crea; existe una cantidad igual de materia tanto antes como
despus del experimento. Con el advenimiento de la teora atmica, los qumicos comenzaron a entender las bases
de esta ley: los tomos no son creados ni se destruyen durante ninguna reaccin qumica. La misma coleccin de
tomos est presente antes y despus de una reaccin. Los cambios que ocurren durante una reaccin solo implican
un reacomodo de los tomos.
La ley de la conservacin de la masa es uno de los principios bsicos que se tiene que comprender en los cursos de qumica,
segn el cual, durante una reaccin qumica no se presentan cambios en la cantidad de masa total de un sistema. Debido a
que la cantidad de materia puede ser determinada fcilmente por medida de su masa, esta ley puede ser demostrada y
comprobada experimentalmente, siguiendo la masa total de un sistema durante el curso de una reaccin qumica, o una serie
de reacciones.
Las reacciones qumicas que tienen lugar en esta prctica son:
3. MATERIALES
Pipeta de 10 mL 2 Tubos de ensayo
Vidrio de reloj Balanza semianalitica
Erlenmeyer de 125 mL Varilla de vidrio
2 beaker de 50 mL Estufa de secado
Desecador
4. REACTIVOS
Carbonato de calcio Pb(NO3)2 0,1 M
cido Clorhdrico 2 M KI 0,1 M
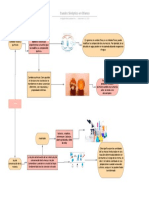
5. PROCEDIMIENTO:
A. Lavar un Erlenmeyer de 125 mL y secar en estufa a 100 oC, enfriar y determinar su masa. Depositar en el Erlenmeyer 20
mL de HCl 2 M y volver a pesar en la balanza. Pesar 2 g de CaCO3 y agregarlo al erlemmeyer que contiene cido
clorhdrico; agitar, esperar a que finalice la reaccin y determinar nuevamente la masa.
Para el anlisis del procedimiento tener en cuenta las siguientes preguntas:
Cmo explica la ecuacin qumica la reaccin realizada?
Cul es la sustancia que se desprende?
Para realizar clculos estequiomtricos tenga en cuenta las siguientes preguntas y recomendaciones:
Cuntos gramos de HCl hay en 20 mL de solucin 2 M de este cido?
Con los gramos de HCl obtenidos en el punto anterior determine cuanto dixido de carbono se forma en la reaccin.
Teniendo en cuenta las masas anotadas en el procedimiento, por diferencia determine la masa de dixido de carbono
desprendida y compare este valor con el clculo terico realizado. Si hay diferencias a que se deben?
Cmo demostrara la ley de conservacin de la masa en esta reaccin utilizando solo datos experimentales? Es decir,
la masa del Erlenmeyer vaco, Erlenmeyer con solucin de HCl y los gramos de carbonato de calcio.
B. Lave 2 beakers de 50 mL y dos tubos de ensayo y seque por calentamiento en estufa a 100 oC, deje enfriar en un
desecador, rotule cada beaker con los nombres de las soluciones a utilizar (Pb(NO3)2 y KI). En uno de los tubos de ensayo
verter 1 mL de solucin de Pb(NO3)2 0,1 M y en el otro tubo 2 mL de solucin de KI 0,1 M. Colocar los tubos de ensayo en
cada uno de los beakers previamente marcados. Llevar los dos beakers a una balanza y determinar la masa en conjunto,
anotar la masa reportada. Mezcle el contenido de un tubo de ensayo en el otro. Qu sucede? Determine nuevamente la
masa de los dos beaker y los tubos de ensayo en conjunto. Cul es el valor de la masa?
Para el anlisis del procedimiento tener en cuenta las siguientes preguntas:
Cmo explica la ecuacin qumica la reaccin realizada?
Qu es una reaccin de precipitacin?
A qu sustancia corresponde el compuesto formado?
Para realizar clculos estequiomtricos tenga en cuenta las siguientes preguntas y recomendaciones:
Cuntos gramos Pb(NO3)2 hay en 1 mL de solucin 0,1 M y cuantos gramo de KI hay en 2 mL solucin 0,1 M?
A partir de los gramos de cualquiera de los dos reactivos, determine cuantos gramos se obtendr de cada uno de los
productos.
Teniendo en cuenta los datos de los puntos anteriores, como se demuestra tericamente la ley de conservacin de la
masa.
Con base en los datos de masa obtenidos experimentalmente como explicara la demostracin de la ley de conservacin
de la masa.
REFERENCIAS
1. Brown, T.L., Lemay, H.E. & Bursten, B.E. (1998). Qumica la ciencia central (7a edicin). Mxico:Prentice Hall
Hispanoamericana S.A.
Vous aimerez peut-être aussi
- Factores Que Afectan La Velocidad de Una ReacciónDocument3 pagesFactores Que Afectan La Velocidad de Una ReacciónCarlos SanchezPas encore d'évaluation
- Isotopos EstablesDocument51 pagesIsotopos EstablesJHOEL_GEOPas encore d'évaluation
- Investigacion de Acidos y BasesDocument9 pagesInvestigacion de Acidos y BasesSofia Robles PerezPas encore d'évaluation
- Ensayo Estequiometria Carlos SalazarDocument4 pagesEnsayo Estequiometria Carlos SalazarCarlos SalazarPas encore d'évaluation
- Modelos AtomicosDocument10 pagesModelos AtomicosNico GonzaPas encore d'évaluation
- Reacciones químicas y sus aplicacionesDocument42 pagesReacciones químicas y sus aplicacionesjorge albertoPas encore d'évaluation
- Qué Es EstequiometríaDocument3 pagesQué Es EstequiometríaNorkis Mejias100% (1)
- Fundamentos de Quimica PDFDocument312 pagesFundamentos de Quimica PDFCesar Daniel Medina Mejia0% (1)
- QGU1 Problemas y AutoevaluacionDocument4 pagesQGU1 Problemas y AutoevaluacionMirna Sardella50% (2)
- La Sociologia Como Ciencia de La SociedadDocument12 pagesLa Sociologia Como Ciencia de La SociedadIsis Schmitt CernaPas encore d'évaluation
- UNIDAD IV Quimica ResumenDocument5 pagesUNIDAD IV Quimica ResumenDanny BarreraPas encore d'évaluation
- Número de AvogadroDocument16 pagesNúmero de Avogadroalberto narvarzPas encore d'évaluation
- Resumen Cap. 3 y 4Document6 pagesResumen Cap. 3 y 4Leslie Priscila Vel100% (1)
- Ley de La Viscosidad de NewtonDocument11 pagesLey de La Viscosidad de NewtonSusan Cárdenas Flores De GanchozoPas encore d'évaluation
- Ley Combinada de GasesDocument1 pageLey Combinada de GasesSandra Milagros Benito ChacnamaPas encore d'évaluation
- HibridacionDocument79 pagesHibridacionGabriella ApPas encore d'évaluation
- Ley de LavoisierDocument2 pagesLey de LavoisierNicole LoorPas encore d'évaluation
- Equipo - 1 - Practica Leyes de Los GasesDocument12 pagesEquipo - 1 - Practica Leyes de Los GasesFernando AvilaPas encore d'évaluation
- Ensayo - 2da Ley de La Termodinamica - Procesos BiologicosDocument5 pagesEnsayo - 2da Ley de La Termodinamica - Procesos BiologicosALMA PACHECO HUICOZAPas encore d'évaluation
- Practicas de Disolucion PDFDocument18 pagesPracticas de Disolucion PDFEmilyPas encore d'évaluation
- Linea Del Tiempo Tabla PeriodicaDocument1 pageLinea Del Tiempo Tabla PeriodicaMarcos MarcelPas encore d'évaluation
- Isotopos EstablesDocument13 pagesIsotopos EstablesJunior Andrade JaquePas encore d'évaluation
- Ley conservación masa, estequiometría práctica laboratorioDocument4 pagesLey conservación masa, estequiometría práctica laboratorioCristian Alarcon0% (1)
- Modelos Atomicos y Problemas.Document22 pagesModelos Atomicos y Problemas.Patty VasquezPas encore d'évaluation
- Química reaccionesDocument4 pagesQuímica reaccionesLuis Enrique sosa pachecoPas encore d'évaluation
- Experimento 6 GasesDocument17 pagesExperimento 6 GasesRicardo Calderon100% (1)
- Los tres principales enlaces químicos: iónico, covalente y metálicoDocument7 pagesLos tres principales enlaces químicos: iónico, covalente y metálicoJessica De Jesus AlvaradoPas encore d'évaluation
- NMX-V-006-1983 ArtDocument4 pagesNMX-V-006-1983 ArtAndreitha Alvarado RangelPas encore d'évaluation
- Química AnalíticaDocument2 pagesQuímica AnalíticaYobana RomeroPas encore d'évaluation
- Primera Ley de La TermodinámicaDocument8 pagesPrimera Ley de La TermodinámicaAriana AlarcoPas encore d'évaluation
- Trabajo DefinitivoDocument33 pagesTrabajo DefinitivoCata ManriquǝPas encore d'évaluation
- Reacciones QuimicasDocument3 pagesReacciones QuimicasJosé HernandezPas encore d'évaluation
- Acidos y Bases Capitulo de Libro - Octubre de 2008Document23 pagesAcidos y Bases Capitulo de Libro - Octubre de 2008Nicolas Ojeda100% (1)
- Tabla PeriodicaDocument10 pagesTabla PeriodicaMa BermPas encore d'évaluation
- Determinación del agua de hidratación de una salDocument1 pageDeterminación del agua de hidratación de una salMan FenixPas encore d'évaluation
- Generar energía con vinagreDocument12 pagesGenerar energía con vinagreManuel PérezPas encore d'évaluation
- Ecuación de Hagen-PoisevilleDocument9 pagesEcuación de Hagen-PoisevilleAdi JcPas encore d'évaluation
- Equilibrio QuímicoDocument11 pagesEquilibrio QuímicoFlor EstefanyPas encore d'évaluation
- Universidad Del Atlantico Facultad de IngenieriaDocument14 pagesUniversidad Del Atlantico Facultad de IngenieriaRAUL ALEJANDRO ORTIZ GARCIAPas encore d'évaluation
- Ley Periodica: Elementos Del Grupo 1, Periodo 3 y Elementos Del Grupo 12Document13 pagesLey Periodica: Elementos Del Grupo 1, Periodo 3 y Elementos Del Grupo 12Miguel Betancourt G100% (1)
- Quimica Semana 1-5Document74 pagesQuimica Semana 1-5Mamani Vasquez GodoPas encore d'évaluation
- Bioquimica Informe PH - FINALDocument10 pagesBioquimica Informe PH - FINALAlexis PavaPas encore d'évaluation
- Separacion y FraccionamientoDocument3 pagesSeparacion y FraccionamientoGastonViettoPas encore d'évaluation
- Investigacion Energia de ActivacionDocument10 pagesInvestigacion Energia de ActivacionAnne AlcantaraPas encore d'évaluation
- ESTEQUIOMETRÍADocument11 pagesESTEQUIOMETRÍAgora27100% (3)
- Informe de ViscosidadDocument25 pagesInforme de ViscosidadAaronLopezRPas encore d'évaluation
- Clasificación de SustanciasDocument1 pageClasificación de SustanciasalmarpaPas encore d'évaluation
- Calorimetría y termoquímica: medición y cálculo de entalpíasDocument16 pagesCalorimetría y termoquímica: medición y cálculo de entalpíasAlejandro Concha SalazarPas encore d'évaluation
- Integración Areal 2Document11 pagesIntegración Areal 2ChiquitoPlusPas encore d'évaluation
- Revista de QuimicaDocument50 pagesRevista de QuimicaFernando Angel GORDILLO RUIZPas encore d'évaluation
- 3B Numero de Oxidacion y NomenclaturaDocument15 pages3B Numero de Oxidacion y NomenclaturalujulPas encore d'évaluation
- Contaminacion Del Aire Por Los VolcanesDocument4 pagesContaminacion Del Aire Por Los VolcanesErick Manosalvas100% (4)
- Teoría EndosimbionteDocument3 pagesTeoría EndosimbionteAlex TeijeiroPas encore d'évaluation
- INTRODUCCIÓNDocument12 pagesINTRODUCCIÓNEsmeralda SanchezPas encore d'évaluation
- Balanceo de Ecuaciones Redox Por El Método de Número de Oxidación II SemDocument3 pagesBalanceo de Ecuaciones Redox Por El Método de Número de Oxidación II SemHelenPas encore d'évaluation
- Modelo atómico de SchrödingerDocument2 pagesModelo atómico de SchrödingerDEINERPas encore d'évaluation
- Reacciones Guia LabDocument2 pagesReacciones Guia LabBrayan MaciasPas encore d'évaluation
- ESTEQUIOMETRIA DE UNA REACCIONDocument12 pagesESTEQUIOMETRIA DE UNA REACCIONSergio Leonardo Elias Carbajal DiazPas encore d'évaluation
- Practica 8. PRINCIPIO DE LA CONSERVACIÓN DE LA MATERIA-1Document4 pagesPractica 8. PRINCIPIO DE LA CONSERVACIÓN DE LA MATERIA-1lyfaPas encore d'évaluation
- Elementos de Proteccin Personal para Riesgo QumicoDocument11 pagesElementos de Proteccin Personal para Riesgo Qumicoedison condoyPas encore d'évaluation
- Medici OnDocument41 pagesMedici OnLazaro PerezPas encore d'évaluation
- GUIA 2-Material - Prevencion - Riesgos PDFDocument62 pagesGUIA 2-Material - Prevencion - Riesgos PDFDANELLY CALDERÓN GONZALEZPas encore d'évaluation
- SO-G13 Guia para La Elaboracion de Planes de Emergencias - PuDocument19 pagesSO-G13 Guia para La Elaboracion de Planes de Emergencias - PuOscar Javier Alarcon AlvaradoPas encore d'évaluation
- Actividad 4 AditivosDocument5 pagesActividad 4 AditivosNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- Servicio Nacional de AprendizajeDocument31 pagesServicio Nacional de AprendizajeNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- Fipronil SEGURIDADDocument13 pagesFipronil SEGURIDADjuan carlos bernatePas encore d'évaluation
- Almacenamiento Seguro Sustancias QuimicasDocument8 pagesAlmacenamiento Seguro Sustancias Quimicasluis eduardo ortizPas encore d'évaluation
- Etiqueta de cloro: identificación y explicación de elementosDocument4 pagesEtiqueta de cloro: identificación y explicación de elementosNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- Peligros QuímicosDocument5 pagesPeligros QuímicosNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- Evidencia 1Document27 pagesEvidencia 1NataliaEstefaníaSolarteImbachiPas encore d'évaluation
- Caso Ladrillera ColombiaDocument5 pagesCaso Ladrillera ColombiaSilvia Paola Hernàndez Molina67% (3)
- Etiqueta QuímicaDocument1 pageEtiqueta QuímicaNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- Guía aprendizaje productos químicosDocument11 pagesGuía aprendizaje productos químicosluis eduardo ortizPas encore d'évaluation
- Manual para Analisis Basicos de Calidad Del AguaDocument147 pagesManual para Analisis Basicos de Calidad Del AguaRomulo Aycachi Inga75% (4)
- Manual Anal Is Is AguaDocument154 pagesManual Anal Is Is AguadavismoodyPas encore d'évaluation
- Mapa ConceptualDocument2 pagesMapa ConceptualNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- NEMS OkDocument14 pagesNEMS OkNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- Plantilla Libro TGDocument24 pagesPlantilla Libro TGEmiliano Gonzalez RodriguezPas encore d'évaluation
- AnexosDocument9 pagesAnexosNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- Guía de Estequiometría PDFDocument13 pagesGuía de Estequiometría PDFAlejandro Andres Garrido SanchezPas encore d'évaluation
- Plantilla Libro TGDocument24 pagesPlantilla Libro TGEmiliano Gonzalez RodriguezPas encore d'évaluation
- AnexosDocument9 pagesAnexosNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- AnexosDocument9 pagesAnexosNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- Ley de Conservacion de La MasaDocument2 pagesLey de Conservacion de La MasaNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- El Vino Su Composicion y Nuestros SentidosDocument44 pagesEl Vino Su Composicion y Nuestros SentidosManu San ClementePas encore d'évaluation
- BP Quimica PDFDocument12 pagesBP Quimica PDFelixabethPas encore d'évaluation
- Nomeclatura QuimicaDocument29 pagesNomeclatura QuimicaAlfonso Martinez RoblesPas encore d'évaluation
- Anexo 1b Tabla Solubiiidad EstudiantesDocument2 pagesAnexo 1b Tabla Solubiiidad EstudiantesNataliaEstefaníaSolarteImbachiPas encore d'évaluation
- Capacitores y sus característicasDocument25 pagesCapacitores y sus característicasDaniela GudiñoPas encore d'évaluation
- EcosistemaDocument10 pagesEcosistemaTania VarelaPas encore d'évaluation
- Cuadro Sinóptico en BlancoDocument1 pageCuadro Sinóptico en BlancoKarla VásquezPas encore d'évaluation
- GFPI-F-019 - Formato - Guia - de - Aprendizaje R2Document11 pagesGFPI-F-019 - Formato - Guia - de - Aprendizaje R2Andrea Sanchez MPas encore d'évaluation
- Tarea Sobre Las Cpas de La TierraDocument5 pagesTarea Sobre Las Cpas de La TierraAshley BernardiPas encore d'évaluation
- AndeDocument65 pagesAndeEsteban PeraltaPas encore d'évaluation
- Manual-RBPCH Digital 2Document132 pagesManual-RBPCH Digital 2Analia QuiñonesPas encore d'évaluation
- Cinematica M Bidimensional 11Document6 pagesCinematica M Bidimensional 11Josue DávilaPas encore d'évaluation
- Temperatura AdiabaticaDocument9 pagesTemperatura AdiabaticaahsimPas encore d'évaluation
- Sistema Neumatico b200Document38 pagesSistema Neumatico b200Yul Sanchez SguerraPas encore d'évaluation
- Registros Sistema de Permisos de Trabajos.Document16 pagesRegistros Sistema de Permisos de Trabajos.SIHOA CONCRELANDPas encore d'évaluation
- Caracteristicas de Calderas de BiomasaDocument21 pagesCaracteristicas de Calderas de BiomasaChUi MartinezPas encore d'évaluation
- Clase 2 (Asincrónica) - Solución Sólida MineralDocument26 pagesClase 2 (Asincrónica) - Solución Sólida MineralhernanxlrPas encore d'évaluation
- Introducción Al Desarrollo AmbientalDocument13 pagesIntroducción Al Desarrollo AmbientalDominique DidymeDome FuentesPas encore d'évaluation
- Capítulo III: HidrometeorologíaDocument28 pagesCapítulo III: HidrometeorologíaSalvatory EdwardPas encore d'évaluation
- Crecimiento Demografico, Industrializacion y Uso de La Energía-Fenomenos NaturalesDocument20 pagesCrecimiento Demografico, Industrializacion y Uso de La Energía-Fenomenos NaturalesElvira Muñoz100% (1)
- Manual de Suelos Hidraulica PDFDocument394 pagesManual de Suelos Hidraulica PDFLeo Li100% (3)
- WAIN JOHN - Por La Cuerda Floja PDFDocument47 pagesWAIN JOHN - Por La Cuerda Floja PDFAnonymous M1fQ1aFPas encore d'évaluation
- Reflexiones Cabo GataDocument299 pagesReflexiones Cabo GatayagueyPas encore d'évaluation
- Tabla NDocument3 pagesTabla NMiguel HernanPas encore d'évaluation
- Solucionario de CTM 1 1Document19 pagesSolucionario de CTM 1 1Maria Pilar Nengono Edu MokomoPas encore d'évaluation
- Taller - Edan Peru - Ep 2023Document57 pagesTaller - Edan Peru - Ep 2023metallica810717Pas encore d'évaluation
- PDFDocument143 pagesPDFJOSE HERMES VANEGAS VARONPas encore d'évaluation
- Actividad 1.3 UNAC PDFDocument2 pagesActividad 1.3 UNAC PDFLorian HgPas encore d'évaluation
- AGROCLIMATOLOGIADocument8 pagesAGROCLIMATOLOGIASol Aura CamargoPas encore d'évaluation
- Guía Física II TVDocument3 pagesGuía Física II TVEmanuel Perez ReyesPas encore d'évaluation
- 2 Ope GoniDocument10 pages2 Ope GoniChambi GonxaloPas encore d'évaluation
- Química SM10 San MarcosDocument4 pagesQuímica SM10 San MarcosHéctor Freddy Diaz MoscolPas encore d'évaluation
- La Bendicion Original Fox MatthewDocument206 pagesLa Bendicion Original Fox Matthewprocosta7548100% (3)
- Coliona Baja en SupteDocument21 pagesColiona Baja en Suptecharles hernanPas encore d'évaluation
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanD'EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanÉvaluation : 4.5 sur 5 étoiles4.5/5 (63)
- Cómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaD'EverandCómo hacer que te pasen cosas buenas: Entiende tu cerebro, gestiona tus emociones, mejora tu vidaÉvaluation : 5 sur 5 étoiles5/5 (1864)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaD'EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaÉvaluation : 5 sur 5 étoiles5/5 (200)
- El lenguaje del cuerpo: Una guía para conocer los sentimientos y las emociones de quienes nos rodeanD'EverandEl lenguaje del cuerpo: Una guía para conocer los sentimientos y las emociones de quienes nos rodeanÉvaluation : 4 sur 5 étoiles4/5 (49)
- Tu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaD'EverandTu cerebro emocional: Saca partido de lo que sientes y transforma tu vidaÉvaluation : 5 sur 5 étoiles5/5 (2)
- El poder del optimismo: Herramientas para vivir de forma más positivaD'EverandEl poder del optimismo: Herramientas para vivir de forma más positivaÉvaluation : 4.5 sur 5 étoiles4.5/5 (15)
- Resetea tu mente. Descubre de lo que eres capazD'EverandResetea tu mente. Descubre de lo que eres capazÉvaluation : 5 sur 5 étoiles5/5 (195)
- Terapia cognitivo-conductual (TCC) y terapia dialéctico-conductual (TDC): Cómo la TCC, la TDC y la ACT pueden ayudarle a superar la ansiedad, la depresión, y los TOCSD'EverandTerapia cognitivo-conductual (TCC) y terapia dialéctico-conductual (TDC): Cómo la TCC, la TDC y la ACT pueden ayudarle a superar la ansiedad, la depresión, y los TOCSÉvaluation : 5 sur 5 étoiles5/5 (1)
- Pensamiento Crítico: Utiliza modelos mentales para desarrollar tomas de decisiones efectivas y habilidades de resolución de problemas. Supera los obstáculos cognitivos y las falacias en los sistemas para pensar con claridad en tu vida cotidiana.D'EverandPensamiento Crítico: Utiliza modelos mentales para desarrollar tomas de decisiones efectivas y habilidades de resolución de problemas. Supera los obstáculos cognitivos y las falacias en los sistemas para pensar con claridad en tu vida cotidiana.Évaluation : 4.5 sur 5 étoiles4.5/5 (33)
- Nunca fuimos modernos: Ensayos de antropología simétricaD'EverandNunca fuimos modernos: Ensayos de antropología simétricaPas encore d'évaluation
- Disciplina con amor para adolescentes (Discipline With Love for Adolescents): Guía para llevarte bien con tu adolescente (A Guide for Getting Along Well With Your Adolescent)D'EverandDisciplina con amor para adolescentes (Discipline With Love for Adolescents): Guía para llevarte bien con tu adolescente (A Guide for Getting Along Well With Your Adolescent)Évaluation : 5 sur 5 étoiles5/5 (10)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoD'EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoÉvaluation : 5 sur 5 étoiles5/5 (2)
- Influencia. La psicología de la persuasiónD'EverandInfluencia. La psicología de la persuasiónÉvaluation : 4.5 sur 5 étoiles4.5/5 (14)
- Cómo terminar lo que empiezas: El arte de perseverar, pasar a la acción, ejecutar los planes y tener disciplinaD'EverandCómo terminar lo que empiezas: El arte de perseverar, pasar a la acción, ejecutar los planes y tener disciplinaÉvaluation : 4.5 sur 5 étoiles4.5/5 (6)
- Te odio - no me abandones: Comprender el trastorno límite de personalidadD'EverandTe odio - no me abandones: Comprender el trastorno límite de personalidadÉvaluation : 5 sur 5 étoiles5/5 (3)
- Ansiedad infantil. Los trastornos explicados a los padresD'EverandAnsiedad infantil. Los trastornos explicados a los padresÉvaluation : 4.5 sur 5 étoiles4.5/5 (25)
- Maneja tus emociones: Curso intensivo de mindfulness y regulación emocionalD'EverandManeja tus emociones: Curso intensivo de mindfulness y regulación emocionalÉvaluation : 4.5 sur 5 étoiles4.5/5 (140)
- Psiconeuroinmunología para la práctica clínicaD'EverandPsiconeuroinmunología para la práctica clínicaÉvaluation : 5 sur 5 étoiles5/5 (4)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasD'EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasPas encore d'évaluation
- Resumen de El Sutil Arte de que te Importe un Carajo, de Mark MansonD'EverandResumen de El Sutil Arte de que te Importe un Carajo, de Mark MansonÉvaluation : 4.5 sur 5 étoiles4.5/5 (15)
- ¿Por qué mis padres no me aman?: Empezando a sanarD'Everand¿Por qué mis padres no me aman?: Empezando a sanarÉvaluation : 4.5 sur 5 étoiles4.5/5 (33)
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreD'EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreÉvaluation : 5 sur 5 étoiles5/5 (3)
- Cómo Conversar Con Cualquier Persona: Mejora tus habilidades sociales, desarrolla tu carisma, domina las conversaciones triviales y conviértete en una persona sociable para hacer verdaderos amigos y construir relaciones significativas.D'EverandCómo Conversar Con Cualquier Persona: Mejora tus habilidades sociales, desarrolla tu carisma, domina las conversaciones triviales y conviértete en una persona sociable para hacer verdaderos amigos y construir relaciones significativas.Évaluation : 5 sur 5 étoiles5/5 (54)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleD'EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleÉvaluation : 4.5 sur 5 étoiles4.5/5 (15)
- Diagnóstico y tratamiento del canino retenido: Aspectos clavesD'EverandDiagnóstico y tratamiento del canino retenido: Aspectos clavesÉvaluation : 3.5 sur 5 étoiles3.5/5 (9)