Académique Documents
Professionnel Documents
Culture Documents
Detallles Experimentales 9
Transféré par
Neil Palacios0 évaluation0% ont trouvé ce document utile (0 vote)
7 vues8 pagesDETALLLES-EXPERIMENTALES-9
Titre original
DETALLLES-EXPERIMENTALES-9
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDETALLLES-EXPERIMENTALES-9
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
7 vues8 pagesDetallles Experimentales 9
Transféré par
Neil PalaciosDETALLLES-EXPERIMENTALES-9
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 8
DETALLLES EXPERIMENTALES
Prctica 8
Materiales y Reactivos
Materiales
Tubos de ensayo
Rejilla
Termmetro
Soporte universal
Vaso precipitado 600mL
Matraz Erlenmeyer
Bureta
Cocinilla
Probeta
Piceta
Gotero
Pipeta
Propipeta
Piceta
Reactivos
Solucin saturada de Ca(OH)2
H2SO4 0.085N
NiSO4 0.1M
Na2SO4 0.1M
BaCl2
Na2SO3
Fenolftalena
Agua destilada
Parte Experimental
Variacin de la solubilidad del Na(OH)2 con la temperatura
1. Sobre un vaso precipitado de 600mL
medimos aproximadamente 400 mL
de una sal saturada de Ca(OH)2.
2. Dejamos el vaso sobre una cocinilla y lo
dejamos hirviendo hasta que alcance la
medida en el termmetro de 95.
3. sobre la bureta, medimos un valor
estndar de H2SO4 0.085M para el proceso de
titulacin.
4. Sacamos una alcuota de 5mL de la
solucin anterior para verterlo sobre un
matraz Erlenmeyer y proceder a la titulacin
de la alcuota, indicando los valores a
continuacin.
Clculo:
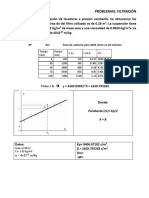
Para hallar los valores de S (solubilidad), aplicamos el siguiente clculo:
#eq-g Ca(OH)2 = #eq-g H2SO4
( ) () = ( )
W Ca(OH)2 = 0.085N *Vg *37
W Ca(OH) 5mL sol
S 100mL
Entonces:
T (C) V Ca(OH)2 mL Vg H2SO4 S ( g sto/100mL )
20 5mL 2.3 0.145
30 5mL 1.9 0.119
35 5mL 2.1 0.132
40 5mL 2.0 0.126
45 5mL 2.0 0.126
50 5mL 1.9 0.119
55 5mL 1.9 0.119
60 5mL 1.9 0.119
65 5mL 1.8 0.113
70 5mL 1.7 0.107
75 5mL 1.6 0.101
80 5mL 1.5 0.094
85 5mL 1.3 0.082
90 5mL 1.2 0.075
Producto de solubilidad y formacin de precipitados
I. BaCl2 (ac) + Na2SO3(ac) BaSO4(s) + 2NaCl(ac)
BaSO4(s) Ba2+(ac) SO2-(ac)
Kps = [Ba2+] [SO2-] = S2
5. Sobre un tubo de ensayo, vertimos 5mL
de BaCl2 (ac) 0.1M y 5mL de Na2SO3(ac) 0.1M.
6. Para obtener resultados de precipitaciones
a distintas concentraciones, a un 1mL de
solucin, le vertimos 9mL de agua destilada y
as sucesivamente.
7. Como se pudo observar, hubo precipitado
en la primera, pero fue descendiendo.
Los valores estn indicados a continuacin:
Analizando el precipitado con respecto a sus concentraciones
5mL 10-1M 10-2M 10-3M 10-4M 10-5M
BaCl2
5mL 10-1M 10-2M 10-3M 10-4M 10-5M
Na2SO4
hay S poco Muy poco Casi nada nada
precipitado?
II. NaCO3(ac) + NiSO4(ac) NiSO3(s) + Na2SO4(ac)
NiCO3(s) Ni+2(ac) + CO2-(ac)
Kps = [Ni2+] [CO32-] = S2
8. Sobre un tubo de ensayo, vertimos 5mL de
Na2CO3 (ac) 0.1M y 5mL de NiSO4(ac) 0.1M.
9. Para obtener resultados de precipitaciones
a distintas concentraciones, a un 1mL de
solucin, le vertimos 9mL de agua destilada y
as sucesivamente.
10. Como se pudo observar, hubo
precipitado en la primera, pero fue
descendiendo.
Los valores estn indicados a continuacin:
Analizando el precipitado con respecto a sus concentraciones
5mL 10-1M 10-2M 10-3M 10-4M
Na2CO3
5Ml 10-1M 10-2M 10-3M 10-4M
NiSO4
hay S poco Casi nada nada
precipitado?
P-3) Para la temperatura de 50C y 10mL de solucin saturada de
Ca(OH)2. cul fue el gasto de H2SO4?
En la experiencia, a temperatura de 50 el volumen gastado de H2SO4 es
de 1.9 mL ,pero en piden para 10mL .
Por lo tanto: Vg H2SO4 = 3.8 mL
Calcule:
a) Hallar el N de equivalente del Ca(OH)2
#eq-g Ca(OH)2 = #eq-g H2SO4 = N*V=0.085*3.8*10-3=0.323*10-3
b) La solubilidad en g/100mL de sol
A la solucin anterior se hall con 10mL , ahora:
0.323*10-3 10mL sol
S 100mL
Por lo tanto, S = 0.323*10-2
C) Comparar el Kps del Ca(OH)2 entre 50C y 25C
Ca(OH)2 Ca+2 + 2OH-
En la solucin anterior: S = 0.323*10-2
Kps (50C)= 4*S3 = 4*(0.323*10-2)3 = 0.135*10-6
Kps (25C) = 5.5*10-6
Por lo tanto, a mayor temperatura, mayor solubilidad.
P-6) Enumere los posibles errores en el experimento.
Si le viertes mucho indicador a la solucin, el volumen
gastado en la titulacin ser mayor.
Al proceso de titular, no dejar que la solucin se enfre ms
de lo previsto.
Vous aimerez peut-être aussi
- Semana 1 - Sesión 1 - Diseño Conceptual - Información de Entrada - Uso de HeuristicosDocument39 pagesSemana 1 - Sesión 1 - Diseño Conceptual - Información de Entrada - Uso de HeuristicosNeil PalaciosPas encore d'évaluation
- UNIDAD 2019 4to - Secundaria v1Document5 pagesUNIDAD 2019 4to - Secundaria v1Neil PalaciosPas encore d'évaluation
- Tubo de PitotDocument12 pagesTubo de PitotNeil PalaciosPas encore d'évaluation
- 03 ElectroDocument36 pages03 ElectroNeil PalaciosPas encore d'évaluation
- Manual Autoclave Olsotek 1800 AuDocument21 pagesManual Autoclave Olsotek 1800 Auangie93% (14)
- Elementos Del LaboratorioDocument31 pagesElementos Del LaboratorioVianys RojanoPas encore d'évaluation
- Vidrio SevprendoDocument64 pagesVidrio SevprendoArturo PerezPas encore d'évaluation
- Filt RadoDocument9 pagesFilt RadoShirley Vargas RamosPas encore d'évaluation
- ABACODocument10 pagesABACODannjerly J. Villanueva PalaciosPas encore d'évaluation
- METODO DE PONCHON SAVARIT TAREA EjerciciosDocument23 pagesMETODO DE PONCHON SAVARIT TAREA EjerciciosspiokPas encore d'évaluation
- Ejemplo de CalculoDocument6 pagesEjemplo de CalculoCesar Guevara GamarraPas encore d'évaluation
- CromatografíaDocument31 pagesCromatografíasofia garcia moralesPas encore d'évaluation
- Trabajo QuimicaDocument26 pagesTrabajo QuimicaFred PérezPas encore d'évaluation
- Ejercicios de HPLC Standar InternoDocument3 pagesEjercicios de HPLC Standar InternolePas encore d'évaluation
- 15 Materiales de Laboratorio y UsoDocument3 pages15 Materiales de Laboratorio y UsoFrida Miranda100% (2)
- 0.16957600 1317655670Document234 pages0.16957600 1317655670Gardner1983Pas encore d'évaluation
- Practica # 11Document6 pagesPractica # 11Jimena AlvaradoPas encore d'évaluation
- Métodos en Biociencias - Guillermo BodegaDocument404 pagesMétodos en Biociencias - Guillermo BodegaEVA EUNICE VENTURA MARTINEZ100% (1)
- Identificación Del Material de Laboratorio y Preparación de SolucionesDocument7 pagesIdentificación Del Material de Laboratorio y Preparación de SolucionesOSCAR DANIEL BOLAÑOS TOROPas encore d'évaluation
- 3FM2Cintilla de Identificación MicrobiologíaDocument2 pages3FM2Cintilla de Identificación MicrobiologíaYuki LozanoPas encore d'évaluation
- Resumen Capitulo 3.6 de LodishDocument2 pagesResumen Capitulo 3.6 de LodishDanii AlejandraPas encore d'évaluation
- Elementos de LaboratorioDocument5 pagesElementos de LaboratoriodianaPas encore d'évaluation
- Metodo DSC en Excel (Davies Swann y Campey)Document6 pagesMetodo DSC en Excel (Davies Swann y Campey)ALeDuckBoanergesPas encore d'évaluation
- Cálculo Kla (OTROS DATOS)Document10 pagesCálculo Kla (OTROS DATOS)Jessica SuastesPas encore d'évaluation
- Informe#2 AnalisisGranulometrico Agregado GruesoDocument15 pagesInforme#2 AnalisisGranulometrico Agregado GruesoMarco ArcePas encore d'évaluation
- Practica 3 Principios de La MicrotomiaDocument5 pagesPractica 3 Principios de La MicrotomiaFERNANDO MIGUEL CRUZ ZAPATAPas encore d'évaluation
- Í Í Teoría, Instrumentación, Técnicas de Separación: Cromatograf A L Quida (HPLC)Document105 pagesÍ Í Teoría, Instrumentación, Técnicas de Separación: Cromatograf A L Quida (HPLC)Jose Carlos Paredes MálagaPas encore d'évaluation
- Practica Del HemocitómetroDocument2 pagesPractica Del HemocitómetrogabyPas encore d'évaluation
- Alargamiento y AplanamientoDocument3 pagesAlargamiento y AplanamientoDanilo RodríguezPas encore d'évaluation
- Calculo Hoja de Filtros Arena y CarbonDocument9 pagesCalculo Hoja de Filtros Arena y CarbonIngeniero AmbientalPas encore d'évaluation
- Problema 2. FiltraciònDocument2 pagesProblema 2. FiltraciònFRANCISCO JAVIER YEPEZ RAMIREZPas encore d'évaluation
- Destilación de Amoníaco/Agua - Comparativa de Métodos de Dimensionamiento de TorreDocument36 pagesDestilación de Amoníaco/Agua - Comparativa de Métodos de Dimensionamiento de TorreSANTIAGO FIUMEPas encore d'évaluation
- HPLC Ejercicios: Domínguez Estrada Valeria MontserratDocument4 pagesHPLC Ejercicios: Domínguez Estrada Valeria MontserratVALERIA MONTSERRAT DOMINGUEZ ESTRADAPas encore d'évaluation
- Herramientas Instrumentos de Laboratorio y Materiales de Uso Común - QuímicaDocument1 pageHerramientas Instrumentos de Laboratorio y Materiales de Uso Común - QuímicaAngelica SalazarPas encore d'évaluation