Académique Documents
Professionnel Documents
Culture Documents
Afinidad Electronica1 PDF
Transféré par
Anonymous vd5JxNCTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Afinidad Electronica1 PDF
Transféré par
Anonymous vd5JxNCDroits d'auteur :
Formats disponibles
AFINIDAD ELECTRONICA
Qu es la afinidad elctrica?
La afinidad elctrica, afinidad electrnica o
AE es la energa intercambiada cuando un
tomo neutro, gaseoso, y en su estado
fundamental, capta un electrn y se
convierte en un in mononegativo.
La afinidad electrnica es la cantidad de
energa absorbida por un tomo aislado en
fase gaseosa para formar un in con una
carga elctrica de 1. Si la energa no es
absorbida, sino liberada en el proceso, la
afinidad electrnica tendr, en
consecuencia, valor negativo tal y como sucede para la mayora de los elementos
qumicos; en la medida en que la tendencia a adquirir electrones adicionales sea mayor,
tanto ms negativa ser la afinidad electrnica. De este modo, el flor es el elemento que
con mayor facilidad adquiere un electrn adicional, mientras que el mercurio es el que
menos.
Aunque la afinidad electrica parece variar de forma catica y desordenada a lo largo de la
tabla peridica, se pueden apreciar patrones. Los no metales tienen afinidades
electrnicas ms bajas que los metales, exceptuando los gases nobles que presentan
valores positivos por su estabilidad qumica, ya que la afinidad electrnica est
influenciada por la regla del octeto.
Los elementos del grupo 1, tienden a ganar un electrn y formar aniones 1, completando
el subnivel s, mientras que los elementos del grupo 2, que ya lo tienen completo, no
presentan esa tendencia. Anlogamente sucede en el bloque p, donde las afinidades
electrnicas se van haciendo ms negativas a medida que nos acercamos a los gases
nobles.
Existen tomos que presentan capas de valencia con lugares vacantes o "huecos", que
pueden ser ocupados por electrones.
Entonces cuando a un tomo neutro se le aaden uno o ms electrones se presenta un
desprendimiento de energa, conocida como afinidad elctrica, obtenindose como
resultado la formacin de aniones.
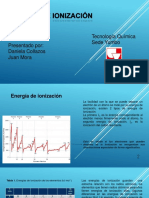
Aunque la magnitud de dicha energa liberada slo puede determinarse indirectamente y
muy rara vez con gran exactitud, en la tabla peridica la podemos predecir en orden
ascendente en un mismo perodo, de izquierda a derecha, y en un mismo grupo, de abajo
hacia arriba.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
Periodo
H He
1
-73 21
Li Be B C N O F Ne
2
-60 19 -27 -122 7 -141 -328 29
Na Mg Al Si P S Cl Ar
3
-53 19 -43 -134 -72 -200 -349 35
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
4
-48 10 -18 -8 -51 -64 -16 -64 -112 -118 47 -29 -116 -78 -195 -325 39
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe
5
-47 -30 -41 -86 -72 -53 -101 -110 -54 -126 32 -29 -116 -103 -190 -295 41
Cs Ba Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn
6
-45 -31 -79 -14 -106 -151 -205 -223 61 -20 -35 -91 -183 -270 41
Fr Ra Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo
7
-44
tabla peridica de afinidades electrnicas, en kJ/mol
Vous aimerez peut-être aussi
- Afinidad Electronica1Document3 pagesAfinidad Electronica1Diego HernandezPas encore d'évaluation
- Afinidad Electronica QuimicaDocument4 pagesAfinidad Electronica QuimicaJorge Quintero100% (1)
- Afinidad ElectrónicaDocument4 pagesAfinidad ElectrónicaGabino Garcia SorianoPas encore d'évaluation
- AFINIDAD ELECTRÓNICA Segunda Unidad QuimicaDocument10 pagesAFINIDAD ELECTRÓNICA Segunda Unidad QuimicaAbel Nohpal BrionesPas encore d'évaluation
- Afinidad ElectrónicaDocument1 pageAfinidad ElectrónicaHugo Alonso Rodriguez CasasPas encore d'évaluation
- Potencial de IonizacionDocument10 pagesPotencial de IonizacionLuisa SierraPas encore d'évaluation
- Serie 2 2022Document25 pagesSerie 2 2022Fidel GonzalezPas encore d'évaluation
- ElectronegatividadDocument3 pagesElectronegatividadjovmac2uPas encore d'évaluation
- Cuestionario Propiedades PeriodicasDocument4 pagesCuestionario Propiedades PeriodicasErnesto ZavalaPas encore d'évaluation
- Afinidad ElectrónicaDocument9 pagesAfinidad ElectrónicaWill Morales de la Cuba0% (1)
- Afinidad ElectronicaDocument4 pagesAfinidad ElectronicaHilda Araceli Flores CabralPas encore d'évaluation
- 4 - Propiedades PeriodicasDocument12 pages4 - Propiedades PeriodicasKatherin AitePas encore d'évaluation
- Clase 4Document46 pagesClase 4Matias AcostaPas encore d'évaluation
- Configuracion Electronica PDFDocument9 pagesConfiguracion Electronica PDFun usuario más0% (1)
- Orbitales SDocument8 pagesOrbitales SDianita LozaPas encore d'évaluation
- ElectronegatividadDocument7 pagesElectronegatividadNicol VázquezPas encore d'évaluation
- ElectronegatividadDocument4 pagesElectronegatividadOliver Martínez BermúdezPas encore d'évaluation
- Capitulo Nº6Document18 pagesCapitulo Nº6EDDY0% (1)
- Garritz, (2005), PP. 108-110Document3 pagesGarritz, (2005), PP. 108-110Esmeralda Belén DomínguezPas encore d'évaluation
- Enlace IonicoDocument68 pagesEnlace IonicoKevin VilcamangoPas encore d'évaluation
- Unidad 2-Configuración Electrónica, Tabla Periódica y NomenclaturaDocument33 pagesUnidad 2-Configuración Electrónica, Tabla Periódica y NomenclaturaDaniel BedriñanaPas encore d'évaluation
- Química 5to Secundaria 6Document18 pagesQuímica 5to Secundaria 6Metade Marvel A ChPas encore d'évaluation
- Configuraciones Electrónicas (2023)Document9 pagesConfiguraciones Electrónicas (2023)Daniel Sánchez PovedaPas encore d'évaluation
- Taller2operaciones MatematicasDocument5 pagesTaller2operaciones MatematicasFranquy Carmona GomezPas encore d'évaluation
- Resolucion Problemes Tema 1 - Generalidades - 2022 - 23Document21 pagesResolucion Problemes Tema 1 - Generalidades - 2022 - 23nacho cervantesPas encore d'évaluation
- Afinidad Electrónica Es La Cantidad de Energía Absorbida Por Un Átomo Aislado en Fase Gaseosa para Formar Un Ión Con Una Carga Eléctrica deDocument8 pagesAfinidad Electrónica Es La Cantidad de Energía Absorbida Por Un Átomo Aislado en Fase Gaseosa para Formar Un Ión Con Una Carga Eléctrica deJorge AndresPas encore d'évaluation
- Enlace IonicoDocument21 pagesEnlace IonicopatriciaPas encore d'évaluation
- Energía de Ionización PDFDocument8 pagesEnergía de Ionización PDFSofii melendez100% (1)
- Tabla Períodica 2013 SalaDocument112 pagesTabla Períodica 2013 SalaAndrés De la GranaPas encore d'évaluation
- Tema 1. Introducción SemiconductoresDocument29 pagesTema 1. Introducción SemiconductoresJuanfran Martínez LópezPas encore d'évaluation
- Propiedades Atómicas y Su Variación PeriódicaDocument7 pagesPropiedades Atómicas y Su Variación PeriódicaMauricio MauPas encore d'évaluation
- Estructura Atomica: 2.1) Generalidades. 2.1.1) Tamaño de Los ÁtomosDocument12 pagesEstructura Atomica: 2.1) Generalidades. 2.1.1) Tamaño de Los Átomosgd6s2bpj25Pas encore d'évaluation
- 01 - Propiedades PeriódicasDocument40 pages01 - Propiedades PeriódicasLuciaAngrigianiPas encore d'évaluation
- PT Química Sem-03 Sesión-05 2022-2Document60 pagesPT Química Sem-03 Sesión-05 2022-2Javier Rime SalvatierraPas encore d'évaluation
- Ejercicios Resueltos Del LibroDocument7 pagesEjercicios Resueltos Del LibroDaniel Sopla CubasPas encore d'évaluation
- Tema 2. Hibridación y EnlacesDocument78 pagesTema 2. Hibridación y EnlacesAriana HerreraPas encore d'évaluation
- Fisica Del Estado SolidoDocument22 pagesFisica Del Estado SolidoGerardo Parra GutierrezPas encore d'évaluation
- Asm-Semana 07 (Propiedades Periódicas)Document20 pagesAsm-Semana 07 (Propiedades Periódicas)Jazmin Parí quispePas encore d'évaluation
- Qui MicaDocument13 pagesQui MicaRobochipPas encore d'évaluation
- Estructura Basica Del Atomo y Sus InteraccionesDocument32 pagesEstructura Basica Del Atomo y Sus InteraccionesJUAN CAMILO RUIZ LINARESPas encore d'évaluation
- S09.s1 - MaterialllDocument35 pagesS09.s1 - MaterialllKaterine HuamanPas encore d'évaluation
- 1 - Configuración ElectrónicaDocument5 pages1 - Configuración ElectrónicaDennisAlexanderPérezRobinsonPas encore d'évaluation
- Dispositivos Electrónicos - Carlos Novillo MonteroDocument51 pagesDispositivos Electrónicos - Carlos Novillo MonteroEdison Patricio Crucerira100% (1)
- Clase 2 ElectronegatividadDocument25 pagesClase 2 ElectronegatividadIrenePas encore d'évaluation
- Química - Propiedades Periódicas de Los Elementos.Document23 pagesQuímica - Propiedades Periódicas de Los Elementos.Noel MatíasPas encore d'évaluation
- Power Point Clase Del 25-8-21Document38 pagesPower Point Clase Del 25-8-21Maria Julia GomezPas encore d'évaluation
- Radio AtómicoDocument13 pagesRadio AtómicoGabriela AvilesPas encore d'évaluation
- Estructura Molecular Unidad 4 Física ModernaDocument50 pagesEstructura Molecular Unidad 4 Física ModernaNico FernandezPas encore d'évaluation
- Clase 5A Estructura ElectrónicaDocument16 pagesClase 5A Estructura ElectrónicaDan Levi ArratiaPas encore d'évaluation
- Acordeón InorganicaDocument5 pagesAcordeón InorganicamarkoagustinPas encore d'évaluation
- Radio Atomico Energia de Ionizacion Electronegatividad Carácter MetalicoDocument21 pagesRadio Atomico Energia de Ionizacion Electronegatividad Carácter MetalicoRoberto CastañoPas encore d'évaluation
- Transp Tema 2 RDocument6 pagesTransp Tema 2 RMEUBROPas encore d'évaluation
- Seminario 1 Con AudioDocument22 pagesSeminario 1 Con AudioViole BoschettiPas encore d'évaluation
- ElectronegatividadDocument6 pagesElectronegatividadAbby AvendañoPas encore d'évaluation
- Presentación - Métodos ElectroquímicosDocument33 pagesPresentación - Métodos Electroquímicosreinaldo rodriguezPas encore d'évaluation
- 1 Conocimientos Básicos de ElectricidadDocument25 pages1 Conocimientos Básicos de Electricidadalejandro sanchez manteroPas encore d'évaluation
- Texto 9Document28 pagesTexto 9Pedro MartinezPas encore d'évaluation
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaD'EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaPas encore d'évaluation
- Estructura atómica y enlace químicoD'EverandEstructura atómica y enlace químicoÉvaluation : 3 sur 5 étoiles3/5 (2)
- Conversion 1Document23 pagesConversion 1DanielPas encore d'évaluation
- Características de Magnetización Wilmer PDFDocument16 pagesCaracterísticas de Magnetización Wilmer PDFwilmerPas encore d'évaluation
- Diapositivas Aisladores de PorcelanaDocument15 pagesDiapositivas Aisladores de PorcelanaAnonymous vd5JxNCPas encore d'évaluation
- Definicion de EmprendimientoDocument17 pagesDefinicion de EmprendimientoAnonymous vd5JxNCPas encore d'évaluation
- Capitulo Octavo (CARDENAS)Document23 pagesCapitulo Octavo (CARDENAS)CarlosLacanPas encore d'évaluation
- Capitulo Octavo (CARDENAS)Document23 pagesCapitulo Octavo (CARDENAS)CarlosLacanPas encore d'évaluation
- Diseño de PeltonDocument137 pagesDiseño de PeltonhugochocPas encore d'évaluation
- Momento de Inercia 1Document13 pagesMomento de Inercia 1Charlie HultgreenPas encore d'évaluation
- Proyecto Electrolisis Del Agua Equipo 1Document3 pagesProyecto Electrolisis Del Agua Equipo 1Patricia Aide MartinezPas encore d'évaluation
- CIZALLADORADocument123 pagesCIZALLADORASebastian LópezPas encore d'évaluation
- B1 - Grupo1 - Colector SolarDocument18 pagesB1 - Grupo1 - Colector SolarNeira PertuzPas encore d'évaluation
- Guia de Manejo Microscopio Nikon Eclipse E200Document2 pagesGuia de Manejo Microscopio Nikon Eclipse E200Diego AlexPas encore d'évaluation
- CMR XDocument8 pagesCMR XsodecasurPas encore d'évaluation
- Práctica EYCDocument7 pagesPráctica EYCTania MorenoPas encore d'évaluation
- Práctica No 6. Ensayos para El Control de CalidadDocument7 pagesPráctica No 6. Ensayos para El Control de CalidadJorge Adolfo Valencia MonroyPas encore d'évaluation
- Serie m01Document2 pagesSerie m01Leslie Flores0% (1)
- Regular El Caudal y Potencia de Una Turbina HidráulicaDocument3 pagesRegular El Caudal y Potencia de Una Turbina HidráulicaGustavo Arturo Villar HidalgoPas encore d'évaluation
- Firesyl 3400 WDocument2 pagesFiresyl 3400 WJulio JiménezPas encore d'évaluation
- El Ciclo Del AguaDocument2 pagesEl Ciclo Del AguaIE Ciudad IpialesPas encore d'évaluation
- SENSORESDocument25 pagesSENSORESJuan Ramón ResendizPas encore d'évaluation
- El Motor Térmico PDFDocument32 pagesEl Motor Térmico PDFCristian DawkinsPas encore d'évaluation
- Perfil de Trabajo de Grado II-20 05.11.20Document34 pagesPerfil de Trabajo de Grado II-20 05.11.20MarioMamaniPas encore d'évaluation
- Folleto Paneles Evaporativos v1.0Document4 pagesFolleto Paneles Evaporativos v1.0Walter naspiranPas encore d'évaluation
- Informe de Altimetría y NivelaciónDocument22 pagesInforme de Altimetría y NivelaciónJosé Víctor Becerra Cotrina100% (6)
- Examen Acdb 2 15sup 1 Actividad Suplementaria Desarrolle El Cuestionario Relacionado Con Calor y TermodinamicaDocument5 pagesExamen Acdb 2 15sup 1 Actividad Suplementaria Desarrolle El Cuestionario Relacionado Con Calor y TermodinamicaDaniel JarrinPas encore d'évaluation
- Tarea Grupal #2-4531Document2 pagesTarea Grupal #2-4531veronica fontanaPas encore d'évaluation
- Informe 12 DDocument7 pagesInforme 12 Ddaryany medinaPas encore d'évaluation
- Clase Tre DestilacionDocument5 pagesClase Tre DestilacionarmandaPas encore d'évaluation
- Clase de Auxiliatura Mec 2251 A Nro. 01Document8 pagesClase de Auxiliatura Mec 2251 A Nro. 01Gustavo Leandro Quispe PaquiPas encore d'évaluation
- Rueda de MaxwellDocument11 pagesRueda de MaxwellJuan Espinoza ConisllaPas encore d'évaluation
- Fuerza Resultante PDFDocument45 pagesFuerza Resultante PDFCarmen ZapataPas encore d'évaluation
- Geografía 05 CNDocument4 pagesGeografía 05 CNlizeth çPas encore d'évaluation
- I Deriva ContinentalDocument30 pagesI Deriva ContinentalRonald Angel Suca ChoquePas encore d'évaluation
- PEDocument3 pagesPEHenry CaballeroPas encore d'évaluation
- Armado Sismorresistente - USAC - 2019Document190 pagesArmado Sismorresistente - USAC - 2019Miguel LuquePas encore d'évaluation
- Movimiento SemiparabolicoDocument3 pagesMovimiento SemiparabolicoAnonymous QM2BatSS1wPas encore d'évaluation
- Esquema Ventanas PVCDocument16 pagesEsquema Ventanas PVCJosé luis ReyesPas encore d'évaluation