Académique Documents
Professionnel Documents
Culture Documents
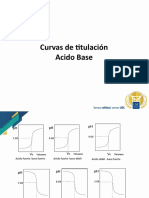
Diagramas de Flujo
Transféré par
Sharlot Rossi Ticona MezaCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Diagramas de Flujo
Transféré par
Sharlot Rossi Ticona MezaDroits d'auteur :
Formats disponibles
Practica N°: 11,12
Grupo:
Mesón: 3
15-11.16
Fecha:
Diagrama de Flujo – Soluciones amortiguadoras Buffer
Citrato
EXPERIENCIA N°1: PREPARACION DE DISOLUCIONES REGULADORAS DE
DIFERENTES PH
TAMPÓN CITRATO
INDICAR QUE
REALIZAR LOS PREPARAR 100ML DE 0,1 A PARTIR DEL MATERIAL
CALCULOS NECESARIOS M DE C6H5O7Na3.2H2O UTILIZA, Y EL
REACTIVO SOLIDO
PROCEDER
PARA
PREPARAR
REALIZAR LOS PREPARAR 100ML DE A PARTIR DEL DICHA
CALCULOS NECESARIOS 0.1M C6H8O7.H2O REACTIVO SOLIDO DISOLUCION
25ML DE C6H8O7 25 ml DE C6H5O7Na3
0.1 M 0.1 M AGITAR BIEN Y
DETERMINAR
EL PH CON EL
10 ML DE C6H8O7 40 ml DE C6H5O7Na3 MEDIDOR DE
0.1 M 0.1 M PH Y
COMPARAR
CON EL
40 ML DE C6H8O7 10 ml DE C6H5O7Na3 CALCULADO
0.1 M 0.1 M
EXPERIENCIA N°2: CAPACIDAD BUFFER FRENTE A ACIDOS Y BASES FUERTES
SOLUCION REGULADORA ACIDA
PREPARAR UNA numer
mezclando 50 ml DE ACIDO 50 ml DE CITRATO 6 BEAKERS DE 50 ml c/
SOLUCION BUFFER ar
CITRICO 0.1 M DE SODIO 0.1M u.
ACIDA
A LOS BEAKERS 2 Y 5
MEDIR EL PH DE AÑADIR 5ml DE HCL 0.1 A LOS 3 RESTANTES 30 A LOS 3 PRIMEROS
TODOS LOS BEAKERS M, A LOS 3 Y 6 5ml DE ml DE SOLUCION AÑADIR 30 ML DE
NAOH BUFFER PREPARADA AGUA DESTILADA
SOLUCION REGULADORA ALCALINA
PREPARAR UNA 50 ml de 50 ml de numer
mezclando 6 BEAKERS DE 50
SOLUCION BUFFER CARBONATO DE BICARBONATO DE ar
ML C/U
BASICA SODIO 0.1 M SODIO 0.1M
A LOS BEAKERS 2 Y 5
MIRE EL PH DE TODOS AÑADIR 5ML DE HCL A LOS 3 PRIMEROS
A LOS 3 RESTANTES 30
LOS BEAKERS 0.1M, A LOS 3 Y 6 5ML AÑADIR 30 ML DE
ML DE SOLUCION
DE NaOH 0.1M BUFFER PREPARADA AGUA DESTILADA
EXPERIENCIA N°3: ACCION DEL BUFFER CITRATO EN UNA BEBIDA COMERCIAL
AGREGAR 5ML FR
BUFFER AC. AÑADIR 3ML
DE ACIDO
CLORHIDRICO
AGREGAR 5 ML DE
AGUA DESTILADA
0.1M AGITAR Y
EVALUAR EL
AÑADIR 5ML PH CON EL
AGREGAR 3 ML DE
DE AGUA PHMETRO
ACIDO CLORHIDRICO
0.1M DESTILADA
AÑADIR 5ML
ÁCIDO SALICÍLICO DE BUFFER
ACIDO CITRICO
Diagrama de Flujo – Identificación de metales
pesados en matrices ambientales
EXPERIMENTO 1: ENSAYO DE AMONIACO
COLOCAR 5 ML DE LA agregar 2 ml de COMPROBAR CON calent COLOCAR UNA TIRA
DISOLUCION ORIGINAL NaOH 2M HASTA PAPEL INDICADOR ar DE PAPEL
EN UNA CAPSULA DE PH>7 DE PH INDICADOR PH
PORCELANA
No sumergir
En medio SI EXISTE EL ION
El NH4 se basico AMONIO EL PAPEL
transforma en
VIRA A UN PH DE 8 A
NH3
8.5
EXPERIMENTO 2: ENSAYO DE LOS METALES
IDENTIFICACION DE CROMO (si hay cromo VI en la disolución, esta debe
ser de color amarillo)
PONER 3ML DE Color cambia D AMARILLLO A añadir GOTA AGOTA
añadir 10 GOTAS DE HCL
DISOLUCION Y AÑADIR NARANJA POR PEROXIDO DE
FORMACIOND E 2M HIDROGENO AL 3%
1ML HCL 2M
DICROMATO
HERVIR POR UN
MINUTO Y SEGUIR SE ORGINA UN COLOR
AÑADIR 1ML DE AÑADIENDO AZUL INTENSO POR
Na2 H2 al 5% PEROXIDO CR2O5
EXPERIENCIA N°3: IDENTIFICACION PLOMO
COLOCAR 3 ml DE
SOLUCION
AL PRIMER TUBO
calentar POR 2 MIN añadir AÑADIR 1ML DE KI
2 ml DE HCL 2M 0.5M
HASTA
PRECIPITACION calentar
COMPLETA
DE OBTENER UNA AL SEGUNDO HASTA DISOLUCION DEL
DISPERSION NARANJA TUBO AÑADIR 1 PRECIPITADO, ENFRIAR
AÑADIR GOTAS DE NAOH ML DE CROMATO CON UN CHORRO DE
2M PORASICO 0.5M AGUA
Vous aimerez peut-être aussi
- Practica-01-PH y Preparcion BuffersDocument3 pagesPractica-01-PH y Preparcion BuffersKaren Sifuentes LopezPas encore d'évaluation
- Practica 14Document4 pagesPractica 14Pau FlurscheimPas encore d'évaluation
- Reporte Titulación Del Ácido Fuerte y Base FuerteDocument9 pagesReporte Titulación Del Ácido Fuerte y Base FuerteErnesto Sanchez Soberane50% (2)
- Pro - Practica 5Document6 pagesPro - Practica 5Ronald BsaPas encore d'évaluation
- PRACTICA N (2) Sistema Amortiguador de PHDocument7 pagesPRACTICA N (2) Sistema Amortiguador de PHzoraidaPas encore d'évaluation
- Pruebas Bioquímicas, Practica 12Document6 pagesPruebas Bioquímicas, Practica 12Aaron De JesusPas encore d'évaluation
- Titulación ácido débil-base fuerteDocument6 pagesTitulación ácido débil-base fuerteIvanPas encore d'évaluation
- Retrotitulación - Guía LabDocument3 pagesRetrotitulación - Guía LabEDWIN A. TAMAYO R.Pas encore d'évaluation
- Pasos del análisis gravimétricoDocument3 pagesPasos del análisis gravimétricoPilar Jesus MontoyaPas encore d'évaluation
- Volumetría potenciometría ácido-baseDocument3 pagesVolumetría potenciometría ácido-baseVanessa CamachoPas encore d'évaluation
- Curvas de titulación de ácidos y basesDocument34 pagesCurvas de titulación de ácidos y basesvalmerPas encore d'évaluation
- Determinación del porcentaje de acidez en vinagreDocument3 pagesDeterminación del porcentaje de acidez en vinagreDayana BotelloPas encore d'évaluation
- Informe 12 Quimica Analitica IIDocument8 pagesInforme 12 Quimica Analitica IIGeorge Saavedra ZamoraPas encore d'évaluation
- Practica 6 - Disocicación de AminoácidosDocument6 pagesPractica 6 - Disocicación de AminoácidosQuebin González50% (2)
- Determinación de aminoácidos azufrados en proteínasDocument1 pageDeterminación de aminoácidos azufrados en proteínasLiz SalazarPas encore d'évaluation
- Cuestionario Previo Práctica 1Document4 pagesCuestionario Previo Práctica 1Ricardo MarquezPas encore d'évaluation
- Determinación del punto isoeléctrico de la caseínaDocument3 pagesDeterminación del punto isoeléctrico de la caseínaDarien Molina100% (1)
- Informe Determinaciones de CalcioDocument20 pagesInforme Determinaciones de CalcioJohan RiveraPas encore d'évaluation
- 1014Document3 pages1014Jhoan RiveraPas encore d'évaluation
- Análisis Cualitativo de EnzimasDocument7 pagesAnálisis Cualitativo de EnzimasMontse RcPas encore d'évaluation
- Informe de Curva de CalibracionDocument7 pagesInforme de Curva de Calibracionbelkys del vallePas encore d'évaluation
- 02furanospirrolesytiofenos 8241Document26 pages02furanospirrolesytiofenos 8241Miguel Anastacio VPas encore d'évaluation
- REACION D SCHOTTEN BAUMANN Obtencion D Benzoato de FeniloDocument12 pagesREACION D SCHOTTEN BAUMANN Obtencion D Benzoato de Fenilo.:("*"BLacK BuLLeT"*"):.63% (8)
- BufferDocument27 pagesBufferberthaPas encore d'évaluation
- Cartel 2Document1 pageCartel 2Berenice Sanchez GalindoPas encore d'évaluation
- Ácido AscórbicoDocument15 pagesÁcido AscórbicomariaPas encore d'évaluation
- Practica 3 BioquímicaDocument1 pagePractica 3 BioquímicaFlor Carrera50% (2)
- Aplicaciones de Volumetría Ácido-BaseDocument22 pagesAplicaciones de Volumetría Ácido-BaseSheyla Nuñez CoronelPas encore d'évaluation
- Grupo 3 - Informe N°4 - Estandarización de SoluciónDocument19 pagesGrupo 3 - Informe N°4 - Estandarización de SoluciónRicardo SandovalPas encore d'évaluation
- Aislamiento de La Caseína de La LecheDocument4 pagesAislamiento de La Caseína de La Lechedaniela arteaga0% (1)
- Mecanismos de La Inducción y Represión EnzimáticaDocument46 pagesMecanismos de La Inducción y Represión Enzimáticahiroshy555Pas encore d'évaluation
- Reporte Reacciones de AminoácidosDocument1 pageReporte Reacciones de AminoácidosIvanPas encore d'évaluation
- Practica 7 TerminadaDocument7 pagesPractica 7 TerminadaJorge L. TorresPas encore d'évaluation
- Practica 5. Determinacion de Acidez en VinoDocument13 pagesPractica 5. Determinacion de Acidez en VinoEmely Suhuchery Alfonso DiazPas encore d'évaluation
- Reporte de Complejos LecheDocument9 pagesReporte de Complejos LecheDaniel Díaz díaPas encore d'évaluation
- Determinación de Cafeína y Ácido Benzoico en Bebidas Comerciales Mediante HPLCDocument9 pagesDeterminación de Cafeína y Ácido Benzoico en Bebidas Comerciales Mediante HPLCSamuel Fernando DelgadoPas encore d'évaluation
- Práctica Desnaturalizacion de Proteínas.Document2 pagesPráctica Desnaturalizacion de Proteínas.Karen MonserratePas encore d'évaluation
- Soluciones y diluciones: concentraciones, normalidad, molaridad y preparaciónDocument2 pagesSoluciones y diluciones: concentraciones, normalidad, molaridad y preparaciónTeresa Castro Hurtado100% (1)
- Disoluciones Vilatomo 1Document32 pagesDisoluciones Vilatomo 1Nattaly VillegasPas encore d'évaluation
- Desnaturalizacion de Proteinas 1Document14 pagesDesnaturalizacion de Proteinas 1Juan Pablo Cruz Sanchez100% (1)
- Laboratorio 3Document2 pagesLaboratorio 3Nicols Bustamante MolinaPas encore d'évaluation
- AminoácidoDocument7 pagesAminoácidoBetty LopezPas encore d'évaluation
- Practica 7 y 8Document12 pagesPractica 7 y 8Efraín100% (1)
- Síntesis Del CiclohexenoDocument5 pagesSíntesis Del CiclohexenoSalvador Nicosia GironPas encore d'évaluation
- Práctica 5 Determinacion de La Acidez Total en Un Vinagre (Cuantitativa de Acido-Base)Document10 pagesPráctica 5 Determinacion de La Acidez Total en Un Vinagre (Cuantitativa de Acido-Base)MisaelPas encore d'évaluation
- Práctica No 4 Propiedades Químicas de Las Proteínas - 2021Document8 pagesPráctica No 4 Propiedades Químicas de Las Proteínas - 2021Ceily Janine AcevedoPas encore d'évaluation
- Separación de Lipidos Por Cromatografia en Capa FinaDocument9 pagesSeparación de Lipidos Por Cromatografia en Capa FinaLinaRodriguez0126Pas encore d'évaluation
- Análisis Químico Cuantitativo (3a. Ed.) - (1. Medidas) PDFDocument13 pagesAnálisis Químico Cuantitativo (3a. Ed.) - (1. Medidas) PDFvickyPas encore d'évaluation
- Reacciones de Identificacion de Ag, HG y PBDocument13 pagesReacciones de Identificacion de Ag, HG y PBDeysiCarolina0% (1)
- Actividad Práctica 5 Técnicas de Inoculación y Caracterización MicrobianaDocument16 pagesActividad Práctica 5 Técnicas de Inoculación y Caracterización MicrobianaLUIS ROJAS REYESPas encore d'évaluation
- Informe N.2 de B.Q 2015Document21 pagesInforme N.2 de B.Q 2015Suat PizarroPas encore d'évaluation
- Practica No 3-Guía-Estandarización de Un Método EspectrofotométricoDocument3 pagesPractica No 3-Guía-Estandarización de Un Método EspectrofotométricoGINNA LORENA GOMEZ RONCANCIOPas encore d'évaluation
- Espectroscopia de Absorción Atómica DETERMINACIÓN DE HIERRO EN UN SUPLEMENTO VITAMÍNICODocument6 pagesEspectroscopia de Absorción Atómica DETERMINACIÓN DE HIERRO EN UN SUPLEMENTO VITAMÍNICOcarolm1pPas encore d'évaluation
- Reporte Práctica 7 y 8 BioquímicaDocument5 pagesReporte Práctica 7 y 8 BioquímicaNora EdthPas encore d'évaluation
- Obtención de Salicilato de MetiloDocument4 pagesObtención de Salicilato de MetiloJoelnat AndradePas encore d'évaluation
- Extracción ácido-base 40cDocument6 pagesExtracción ácido-base 40cKevin ZuritaPas encore d'évaluation
- Orina Con Olor A Jarabe de ArceDocument1 pageOrina Con Olor A Jarabe de ArceGabi BermudezPas encore d'évaluation
- DisolucionesDocument2 pagesDisolucionesLebrónPas encore d'évaluation
- PR Ctica para Reconocer Disoluciones Amortiguadoras y El PH de Unas SustanciasDocument16 pagesPR Ctica para Reconocer Disoluciones Amortiguadoras y El PH de Unas SustanciasEliPas encore d'évaluation
- Informe Laboratorio #2Document8 pagesInforme Laboratorio #2Laura Sofia BotinaPas encore d'évaluation
- Efecto InvernaderoDocument5 pagesEfecto InvernaderoSharlot Rossi Ticona MezaPas encore d'évaluation
- Lugar y Fecha Saludo: 1. Teniendo en Cuenta Las Partes de Una Carta. Escribe Una para Tu Mejor AmigoDocument2 pagesLugar y Fecha Saludo: 1. Teniendo en Cuenta Las Partes de Una Carta. Escribe Una para Tu Mejor AmigoSharlot Rossi Ticona MezaPas encore d'évaluation
- Ejemplos de SolverDocument15 pagesEjemplos de SolverSantiago Bejarano AlfaroPas encore d'évaluation
- Reglamento de La LeyDocument44 pagesReglamento de La LeySharlot Rossi Ticona MezaPas encore d'évaluation
- Jesus en El Monte de GetsemaniDocument1 pageJesus en El Monte de GetsemaniSharlot Rossi Ticona MezaPas encore d'évaluation
- Teoría de Los Mercados ImperfectosDocument1 pageTeoría de Los Mercados ImperfectosSharlot Rossi Ticona MezaPas encore d'évaluation
- Definición de FinanzasDocument4 pagesDefinición de FinanzasSharlot Rossi Ticona MezaPas encore d'évaluation
- Reglamento de La LeyDocument44 pagesReglamento de La LeySharlot Rossi Ticona MezaPas encore d'évaluation
- Definición de FinanzasDocument4 pagesDefinición de FinanzasSharlot Rossi Ticona MezaPas encore d'évaluation
- Métodos de Cálculo y Aplicación Eoq 1Document11 pagesMétodos de Cálculo y Aplicación Eoq 1Sharlot Rossi Ticona MezaPas encore d'évaluation
- Comercio y GlobalizacionDocument6 pagesComercio y GlobalizacionSharlot Rossi Ticona MezaPas encore d'évaluation
- Acciones para Mejorar El Medio AmbienteDocument16 pagesAcciones para Mejorar El Medio AmbienteSharlot Rossi Ticona MezaPas encore d'évaluation
- Plan de Negocios para La Creacion de Una Panaderia AlipanDocument101 pagesPlan de Negocios para La Creacion de Una Panaderia AlipanFhernando BermejoPas encore d'évaluation
- Manual de Seguridad y Salud en El TrabajoDocument19 pagesManual de Seguridad y Salud en El TrabajoSharlot Rossi Ticona MezaPas encore d'évaluation
- Almacen 2Document2 pagesAlmacen 2Sharlot Rossi Ticona MezaPas encore d'évaluation
- Método Estándar Alternativo (ASA)Document7 pagesMétodo Estándar Alternativo (ASA)Sharlot Rossi Ticona MezaPas encore d'évaluation
- Motivacion Del PerrsonalDocument1 pageMotivacion Del PerrsonalSharlot Rossi Ticona MezaPas encore d'évaluation
- El problema de los limones en el mercado de coches de segunda manoDocument4 pagesEl problema de los limones en el mercado de coches de segunda manoSharlot Rossi Ticona MezaPas encore d'évaluation
- Interes Continu oDocument5 pagesInteres Continu oPaulo Victor Vargas CastilloPas encore d'évaluation
- Proyecto de Inversión para La Creación de Un Restaurante de Dietas Variadas en La Ciudad de GuayaquilDocument9 pagesProyecto de Inversión para La Creación de Un Restaurante de Dietas Variadas en La Ciudad de GuayaquilPuly VelaPas encore d'évaluation
- Emision de ObligacionesDocument28 pagesEmision de ObligacionesSharlot Rossi Ticona MezaPas encore d'évaluation
- Diapos Talento HumanoDocument11 pagesDiapos Talento HumanoSharlot Rossi Ticona MezaPas encore d'évaluation
- Ficha 19Document2 pagesFicha 19Sharlot Rossi Ticona MezaPas encore d'évaluation
- IntroducciónDocument1 pageIntroducciónSharlot Rossi Ticona MezaPas encore d'évaluation
- GradientesDocument182 pagesGradientesSharlot Rossi Ticona MezaPas encore d'évaluation
- Modelo de ArticuloDocument2 pagesModelo de ArticuloJoyce CardenasPas encore d'évaluation
- Constitucion de Una EmpresaDocument21 pagesConstitucion de Una EmpresaSharlot Rossi Ticona MezaPas encore d'évaluation
- Mercados FinancierosDocument8 pagesMercados FinancierosLuis DiazPas encore d'évaluation
- Mercado de LimonesDocument9 pagesMercado de LimonesEstephania AbrilPas encore d'évaluation
- Ficha Tecnica Productos Pastel de CarneDocument17 pagesFicha Tecnica Productos Pastel de Carnelorens landazuryPas encore d'évaluation
- Modelo Atomico de DaltonDocument4 pagesModelo Atomico de DaltonAventur2014Pas encore d'évaluation
- Componentes y Funcionamiento Del Sistema de Frenos Por AireDocument14 pagesComponentes y Funcionamiento Del Sistema de Frenos Por AireCarlos LópezPas encore d'évaluation
- Informe Tecnico Piso Elevado MetalicoDocument11 pagesInforme Tecnico Piso Elevado MetalicoJairo Reinoso CastroPas encore d'évaluation
- Gestion de Residuos en EeuuDocument9 pagesGestion de Residuos en EeuuJhampool Christopher Monge AtencioPas encore d'évaluation
- Informe TESCODocument10 pagesInforme TESCOFRANCISCO JAVIER BORJA SACHERIPas encore d'évaluation
- LABORATORIO N3 EnzimasDocument11 pagesLABORATORIO N3 EnzimasJosset GómezPas encore d'évaluation
- Procesos de humidificación: ecuaciones y conceptos claveDocument3 pagesProcesos de humidificación: ecuaciones y conceptos claveGabriela G. ChPas encore d'évaluation
- Óxidos e HidróxidosDocument7 pagesÓxidos e HidróxidosAna Rojas RomeroPas encore d'évaluation
- P8 Principios de Analisis CuantitativoDocument16 pagesP8 Principios de Analisis CuantitativoNadia Montero GonzálezPas encore d'évaluation
- Ingeniería de Materiales Producto Academico #1Document3 pagesIngeniería de Materiales Producto Academico #1Angel Eduardo Prado Solórzano100% (1)
- Ensayo 1 - REACCIONES QUÍMICAS Y ESTEQUIOMETRÍADocument6 pagesEnsayo 1 - REACCIONES QUÍMICAS Y ESTEQUIOMETRÍAPedro Pablo Carrera AstudilloPas encore d'évaluation
- Ejercicios Estaticas de FluidosDocument5 pagesEjercicios Estaticas de FluidosJesus David Florez BustamantePas encore d'évaluation
- Calculo Del Diagrama de Precipitacion de Hidroxidos de FeDocument4 pagesCalculo Del Diagrama de Precipitacion de Hidroxidos de FeJulio Campos CardenasPas encore d'évaluation
- 156 - Antimicóticos LocalesDocument19 pages156 - Antimicóticos LocalesPedro Alejandro Saldaña Villaseñor100% (1)
- Akemy BalanceDocument11 pagesAkemy BalanceAlanis MayuriPas encore d'évaluation
- Sistema de Combustible GLP Kubota2.5 (12 2014) US ESDocument60 pagesSistema de Combustible GLP Kubota2.5 (12 2014) US ESFelipe Molina DiazPas encore d'évaluation
- Analisis Instrulemtal 2Document21 pagesAnalisis Instrulemtal 2Anggie Velasquez RuizPas encore d'évaluation
- Especificaciones TécnicasDocument80 pagesEspecificaciones TécnicasHeber Darwin Gutierrez VallejoPas encore d'évaluation
- Terminos y Definiciones de SeguridadDocument2 pagesTerminos y Definiciones de SeguridadKarol Roxana Aguilar FlorezPas encore d'évaluation
- Tarea Cuestionario AguaDocument7 pagesTarea Cuestionario AguanataliaPas encore d'évaluation
- Balanceo de Ecuaciones QuímicasDocument4 pagesBalanceo de Ecuaciones QuímicasjuanpabloizuPas encore d'évaluation
- Principios fisiológicos de los líquidos y electrolitos en pediatríaDocument16 pagesPrincipios fisiológicos de los líquidos y electrolitos en pediatríaKarla Margarita Muñoz Rico100% (2)
- Cartilla Sobre Las Condiciones de Seguridad Adecuadas para - PPTX OriginalDocument84 pagesCartilla Sobre Las Condiciones de Seguridad Adecuadas para - PPTX OriginalIndy Romero100% (1)
- Tincion de Gram y Tinciones SelectivasDocument2 pagesTincion de Gram y Tinciones SelectivasAlice Correa33% (3)
- CerejaDocument4 pagesCerejaeneoron1406Pas encore d'évaluation
- Evaluación T1 Procesos Unitarios Ingeniería AmbientalDocument5 pagesEvaluación T1 Procesos Unitarios Ingeniería AmbientalEstefano BlasPas encore d'évaluation
- Bacteriologia 1Document5 pagesBacteriologia 1PetResort PetResortmxPas encore d'évaluation
- Unidad 6Document8 pagesUnidad 6Jose MendozaPas encore d'évaluation