Académique Documents
Professionnel Documents
Culture Documents
Calor Espacifico y Calor Latente
Transféré par
diego davidCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Calor Espacifico y Calor Latente
Transféré par
diego davidDroits d'auteur :
Formats disponibles
CALOR ESPECÍFICO Y CALOR LATENTE
LABORATORIO DE: APLICACIONES DE PROPIEDADES DE LA
MATERIA.
TEMA: CALOR ESPECÍFICO Y CALOR LATENTE.
SUBTEMA: CAPACIDAD TÉRMICA ESPECÍFICA.
CALOR LATENTE.
PERSONAL PROFESORES DE LA ASIGNATURA O
PERSONAL DOCENTE CAPACITADO PARA
IMPARTIR EL LABORATORIO.
LUGAR: LABORATORIO DE TERMODINÁMICA.
Normas de seguridad
• Trabajar dentro de la línea de seguridad
• No comer alimentos dentro del laboratorio
• Manejar con precaución el equipo para evitar quemaduras
Equipo de seguridad
•Bata de laboratorio
•Guante de asbesto
APLICACIONES DE PROPIEDADES DE LA MATERIA 41
CALOR ESPECÍFICO Y CALOR LATENTE
ACTIVIDAD DEL ALUMNO:
Previamente a la realización de esta práctica se deberá entregar totalmente resuelto
el siguiente cuestionario, aplicando los conceptos teóricos expuestos en clase.
1. Que entiendes por energía.
2. Defina calor específico.
3. ¿Qué es la capacidad calorífica?
4. Cuantos tipos de energía conoces.
5. ¿El calor se le podría considerar como una energía? ¿Por qué?
6. ¿Qué característica tiene el calor sensible?
7. ¿Qué característica tiene el calor latente?
8. Explicar la ley de Joule.
9. ¿A cuánto equivale una caloría en Joules?
10. ¿Cómo se puede transformar energía mecánica en energía térmica?
11. ¿Cómo interpretas la entalpía?
12. A que se refiere el equivalente mecánico de calor.
13. ¿Cuáles son los cambios de fase?
14. Explicar la relación entre el calor y la primera ley de la termodinámica.
15. ¿Qué es el calor latente de vaporización?
APLICACIONES DE PROPIEDADES DE LA MATERIA 42
CALOR ESPECÍFICO Y CALOR LATENTE
OBJETIVO:
El alumno:
a) Comprenderá y aplicará el concepto de calor específico y calor latente.
ACTIVIDADES:
1) Determinar el calor específico de un metal.
2) Determinar el calor latente de vaporización del agua.
MATERIAL Y/O EQUIPO:
1 Parrilla eléctrica de 750W.
1 Cronómetro.
1 Calorímetro (recipiente de aluminio).
2 Termómetros.
1 Vaso de precipitado de 500 ml.
1 Balanza granataria.
1 Multímetro.
1 Pesa de 1 kg .
1 Pesa de ½ kg.
1 Par de guantes de asbesto.
1 Agitador de vidrio.
1 Cubo de metal.
Agua potable.
1 Cafetera.
1 Pinzas de sujeción.
ASPECTOS TEÓRICOS:
Las observaciones de los fenómenos en que intervenían la temperatura, como el
calentamiento y el enfriamiento de los cuerpos, se cuantificaron mediante la
definición de calor.
En el siglo XVII Joseph Black, estableció que había fenómenos en la misma
naturaleza de los considerados como “calor”, pero que no se manifestaban en una
variación en la temperatura del sistema. Por lo que a partir de estas observaciones
se definen dos tipos de calor: el sensible y el latente.
A principios de siglo XIX se especula con la idea de que el calor no era sino una
manifestación de los fenómenos mecánicos. En aquellos días, muchos científicos
consideraban que el calor y los fenómenos mecánicos eran manifestaciones
totalmente diferentes e independientes.
APLICACIONES DE PROPIEDADES DE LA MATERIA 43
CALOR ESPECÍFICO Y CALOR LATENTE
Joule hizo el experimento que arrojaron resultados cuantitativos y objetivos para
demostrar que siempre que se realiza una cierta cantidad de trabajo se produce una
cierta cantidad equivalente de calor, en el cual se demuestra que por cada joule de
trabajo se producen 0.24 calorías y que cuando una caloría de energía térmica se
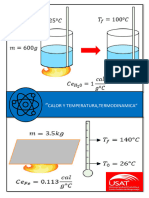
transforma en trabajo se obtienen 4.2 Joules. Por tanto:
1 cal = 4.2 J
1 Joule = 0.24 cal.
Y apoyado por William Thompson, publica sus resultados, los que condujeron
eventualmente al enunciado del postulado general de la conservación de la energía,
conocido actualmente como la primera ley de la termodinámica.
Calor.- El calor es energía en transferencia del tipo térmico, debido a la
modificación de la temperatura o por el cambio de fase de un sistema.
La ley cero de la termodinámica indica que si dos sistemas con diferente temperatura
se ponen en contacto estos alcanzarán el equilibrio térmico. Lo anterior es
provocado por intercambio de energía en forma de calor, por lo tanto el sistema de
mayor temperatura la decrementará y el de menor la incrementará.
Recordar que un cambio de fase está ligado al movimiento molecular, y que este se
realiza a temperatura constante, por lo que aún no existiendo cambio de
temperatura, este proceso se realiza porque existe un intercambio de energía en
forma de calor. Por lo anterior, se definirán dos tipos de intercambio de calor:
Calor Sensible y Calor Latente.
Calor sensible.- Es la cantidad de energía en forma de calor que se intercambia
entre dos sistemas termodinámicos por la diferencia de temperaturas, sin que exista
un cambio de fase.
Antes de establecer un modelo para el calor sensible se definirá una propiedad de
los sistemas relacionada con el intercambio de calor.
Calor específico.- Esta propiedad mide la cantidad de calor que requiere una
unidad de materia de un sistema para variar su temperatura un grado.
Cuando se suministra la misma cantidad de calor a dos sistemas diferentes estos
varían su temperatura en forma diferente, lo cual estará relacionada directamente
con su calor específico.
Basándose en la definición de esta propiedad, se tendrá:
Q Q J
Ce
(m)T (m)(T2 T1 ) kgK
Por lo tanto a partir de la definición de calor específico, se puede establecer que el
calor sensible se determina a partir de la expresión siguiente:
Q mCe (T2 T1 )
APLICACIONES DE PROPIEDADES DE LA MATERIA 44
CALOR ESPECÍFICO Y CALOR LATENTE
Calor latente.- Es la transferencia de energía en forma de calor entre dos sistemas
termodinámicos, ocasionando un cambio de fase de un sistema, siempre y cuando la
temperatura se mantenga constante.
Antes de establecer un modelo para este tipo de intercambio de energía se definirá
otra propiedad de los sistemas.
Calor latente de cambio de fase.- Esta propiedad indica la cantidad de calor que
requiere una unidad de masa para cambiar de fase; ya sea de líquido a sólido,
líquido a vapor, etc, de esto se puede expresar:
QL J
CL
m kg
Por lo tanto, a partir de la definición de calor latente de cambio de fase se tiene que:
QL mCL
Cambio de fase.- Un cambio de fase es cuando la materia pasa de un estado a otro,
la fase de la materia depende de su temperatura y de la presión que se ejerce sobre
ella. En los cambios de fase se produce normalmente una transferencia de energía.
a) Evaporación.- Cambio de fase de líquido a gas que se lleva a cabo en la
superficie del líquido; este cambio de fase sucede en un proceso de
enfriamiento.
b) Condensación. - Es la transformación de un gas a líquido; este cambio de fase
sucede en un proceso de calentamiento.
c) Ebullición.- Es el cambio de fase que ocurre en cualquier región del líquido y se
forma burbujas de gas.
d) Fusión.- cambio de fase que ocurre cuando pasa del estado sólido al estado
liquido.
e) Solidificación.- Cambio de fase que ocurre cuando se pasa del estado liquido al
estado sólido.
f) Sublimación progresiva.- Cambio de fase que ocurre cuando se pasa desde el
estado sólido hasta el estado gaseoso.
g) Sublimación regresiva.- Cambio de fase que ocurre cuando se pasa desde el
estado gaseoso hasta el estado sólido.
h) Ionización.- Cambio de fase que ocurre cuando se pasa desde el estado
gaseoso a plasma.
DESARROLLO DE LA PRÁCTICA:
ACTIVIDAD I: CALOR ESPECÍFICO DE UN SÓLIDO.
1. Calibrar la balanza.
2. Medir la masa del calorímetro, anotar su valor en la tabla 3.1A.
3. Verter de la llave del fregadero en el calorímetro aproximadamente 1/3 de su
capacidad de agua fría, determinar su masa y su temperatura. Anotarlas en
la tabla 3.1A.
4. Para determinar la masa del agua, esto va así: masa del calorímetro con
agua - la masa del calorímetro solo. Anotar su valor en la tabla 3.1A.
APLICACIONES DE PROPIEDADES DE LA MATERIA 45
CALOR ESPECÍFICO Y CALOR LATENTE
5. Determinar la masa del metal. Anotar su valor en la tabla 3.1A.
6. En el vaso de precipitado, verter aproximadamente 300 ml de agua.
7. Introducir el metal en el vaso de precipitado.
8. Coloca el vaso en la parrilla. Conéctala.
9. Introducir el termómetro en el vaso para medir la temperatura hasta que
llegue a su punto de ebullición el agua. Anotar el valor en la tabla 3.1A.
(Está es considerada como la temperatura inicial del metal).
Termómetro Temperatura
inicial del
agua
Calorímetro
Figura 3.1
Termómetro (temperatura
inicial de cubo=temperatura
de ebullición del agua)
Vaso de precipitado con 300
ml de agua
Agua hirviendo
Cubo metálico
Parrilla eléctrica
Figura 3.2
10. Una vez que el agua este hirviendo (se pueden dar cuenta que la
temperatura se mantiene constante y que existe un cambio de fase de liquido
a vapor, estamos ante la presencia de un calor latente), con las pinzas sacar
el trozo del metal e introducirlo en el calorímetro.
11. Inmediatamente agitar el agua (con el trozo de metal dentro) para lograr el
equilibrio térmico y, esperarse hasta observar y medir la temperatura máxima
que alcanza el agua en el calorímetro. Anotar el valor en la tabla 3.1A. (Está
APLICACIONES DE PROPIEDADES DE LA MATERIA 46
CALOR ESPECÍFICO Y CALOR LATENTE
es considerada como la temperatura que se alcanza en el equilibrio térmico,
o la temperatura final del agua y la temperatura final del metal, figura 3.3).
Figura 3.3. Vista normal de la práctica y vista interior del calorímetro con el cubo
metálico.
El calor específico se determina con un balance térmico:
QM QH 2O 0
Donde:
QM = la energía cedida por el metal (cal)
QH 2O = la energía absorbida por el agua (cal)
QM mM CeM (T2 M T1M )
QH 2O mH 2O CeH 2O (T2 H 2O T1H 2O )
Donde:
mM = masa del metal (gr)
mH 2O = masa del agua (gr)
CeH 2O = calor específico del agua (1 cal/groC)
CeM = calor específico del metal (cal/groC)
T2M = temperatura final del metal (oC)
NOTA: EL Ce ES POSITIVO,
T1M = temperatura inicial del metal ( oC)
YA QUE T1M T2 M
T2 H 2O = temperatura final del agua (oC)
T1H 2O = temperatura inicial del agua ( oC)
Sustituyendo en la ecuación anterior
mM CeM (T2 M T1M ) mH 2O CeH 2O (T2 H 2O T1H 2O ) 0
Despejando CeM del metal, tenemos:
mH 2OCeH 2O (T2 H2O T1H2O )
CeM
mM (T2 M T1M )
De esta forma se obtiene el calor específico del metal. Anotar su valor en la tabla
3.1B. Checar en su manual de formulas técnicas para ver de que material esta hecho
el cubo.
APLICACIONES DE PROPIEDADES DE LA MATERIA 47
CALOR ESPECÍFICO Y CALOR LATENTE
ACTIVIDAD II: CALOR LATENTE VAPORIZACIÓN.
1. Medir la resistencia eléctrica de la cafetera. Anotar el valor en la tabla 3.2A.
2. Medir el voltaje de línea. Anotar el valor en la tabla 3.2A.
3. Verter agua en la cafetera, aproximadamente 2/3 de su capacidad.
4. Determinar la masa del agua con todo y cafetera y esta será m1 . Anótalo en
la tabla 3.2A.
5. Conectar la cafetera a la toma de corriente.
6. Con el agitador de vidrio, mezclar continuamente para uniformar la
temperatura dentro de la cafetera.
7. Esperar a que el agua alcance la temperatura de ebullición. En ese
momento, cronometrar el tiempo de vaporización en un lapso de 5 min, para
que se consuma algo del agua contenida en la cafetera. Anotar el tiempo en
la tabla 3.2A.
8. Con los guantes de asbesto, retirar la cafetera y depositarla en la zona de
trabajo de la mesa de prácticas del laboratorio.
9. Esperar al menos otros 5 minutos para dejar que se termine de evaporar el
agua.
10. Medir la masa de agua con todo y cafetera otra vez y esta será m2 . Anotar el
valor en la tabla 3.2A.
11. Para medir la masa de agua que se evaporo, solo se resta la masa inicial del
agua fría con la masa final del agua caliente. Anótalo en la tabla 3.2A. la
ecuación será:
mV m1 m2
Multímetro digital
Conexión en paralelo a la
línea eléctrica
Display
Perilla selectora de
función
Figura 3.4. Medición del voltaje de línea.
APLICACIONES DE PROPIEDADES DE LA MATERIA 48
CALOR ESPECÍFICO Y CALOR LATENTE
Cafeteras
m1
m2
Figura 3.5. Antes y después de la evaporación.
Para determinar el calor que se requiere para evaporar el agua, se usa el
modelo:
QV mV hV
Donde:
QV = calor de vaporización (cal)
mV = masa de vaporización (gr)
hV = calor latente de vaporización (cal/gr)
La potencia de la resistencia (que será el calor suministrado):
W VI
Pero por ley de Ohm se tiene:
V RI
Por lo que:
V
I
R
Sustituyendo en la ecuación anterior se tiene que:
V2
W
R
O bien
V2
Q
R
Donde:
W = potencia de la resistencia (Watts)
R = resistencia de la parrilla ( )
I = intensidad de corriente (Amp)
V = voltaje de línea (Volts)
APLICACIONES DE PROPIEDADES DE LA MATERIA 49
CALOR ESPECÍFICO Y CALOR LATENTE
Esta última ecuación nos da el resultado en Watts que son Joules/seg por lo
que debemos eliminar los segundos, esto se hará multiplicando por el tiempo
en que tardo en evaporarse el agua. Quedando de la siguiente manera:
V2
Q (t )
R
Donde:
R = resistencia de la parrilla ( )
V = voltaje de línea (Volts)
Q = calor (J)
t = tiempo que tarda en evaporarse la masa de agua (recomendado de 300 s)
Pero:
Q QV
y si:
QV mV hV
Despejando:
QV
hV
mV
Donde:
hV = calor latente de vaporización (J/gr)
QV = calor de vaporización (J)
mV = masa de vaporización (gr)
Se recomienda checar el resultado de hV con su manual técnico para determinar el
grado de error obtenido.
TABLAS DE LECTURAS:
TABLA 3.1A.
Concepto Símbolo Unidad Lectura
Masa del metal mM gr
Masa del calorímetro mcal gr
Masa del calorímetro con agua mcal H 2O gr
Masa del agua. mcal H 2O mcal mH 2O gr
o
Temperatura inicial del metal T1M C
o
Temperatura final del metal T2M C
o
Temperatura final del agua T2 H 2O C
o
Temperatura inicial del agua T1H 2O C
APLICACIONES DE PROPIEDADES DE LA MATERIA 50
CALOR ESPECÍFICO Y CALOR LATENTE
TABLA 3.2A.
Concepto Símbolo Unidad Lectura
Resistencia de la cafetera R
Voltaje de línea V V
Masa de vapor mV gr
Masa inicial del agua m1 gr
Masa final del agua m2 gr
Tiempo de vaporización t s
MEMORIA DE CÁLCULOS:
El alumno hará un desarrollo DETALLADO de acuerdo a lo que se pide en la tabla
de resultados:
TABLAS DE RESULTADOS:
TABLA 3.1B.
Concepto Símbolo Unidades
o
kJ/kg K kcal/kg oC BTU/lb oF
Calor especifico del metal CeM
TABLA 3.2B.
Concepto Símbolo Unidades
Calor de vaporización QV cal J BTU
Calor latente de vaporización hV cal/gr J/kg BTU/lb
APLICACIONES DE PROPIEDADES DE LA MATERIA 51
CALOR ESPECÍFICO Y CALOR LATENTE
TABLA 3.3B.
Concepto Símbolo error
%
Calor especifico del metal CeM
Calor latente de vaporización hV
CUESTIONARIO
1) Explicar que es el calor sensible y en que parte dentro de la práctica se
demostró.
2) Explicar que es el calor latente y en que parte dentro de la práctica se
demostró.
3) Investigar en tablas de acuerdo al calor específico obtenido del metal, de que
material esta hecho, determinar su valor teórico del metal.
4) Investigar en tablas de acuerdo al calor latente del agua, cual es su valor
teórico.
5) En un sistema de refrigeración por compresión mecánica, tenemos cuatro
componentes básicos, en cuál de ellos se presenta el calor latente y en cual el
calor sensible, justifique su respuesta.
6) En un ciclo Rankine también consta de cuatro componentes básicos,
investigue donde se presenta el calor sensible y el calor latente, justifique su
respuesta.
7) ¿Por qué causa más daño una quemadura con vapor de agua que una
quemadura con agua hirviendo a la misma temperatura?
8) ¿Qué significa afirmar que un material tiene una capacidad calorífica grande o
pequeña?
9) ¿Por qué es incorrecto decir, la materia “contiene” calor?
10) ¿A qué temperatura alcanza el agua su máxima densidad y cual es valor de
dicha densidad?
11) ¿Por qué los lagos y estanques se congelan de arriba hacia abajo y no de
abajo hacia arriba?
12) Investigar las tres formas de transmisión de calor.
APLICACIONES DE PROPIEDADES DE LA MATERIA 52
CALOR ESPECÍFICO Y CALOR LATENTE
13) En esas tres formas de transmisión de calor, donde se involucra el calor latente
y en donde el calor sensible.
14) Determine el porcentaje de error en los calores obtenidos en la práctica, si se
considera que los valores teóricos obtenidos de tablas esta sin error. Anotarlo
en la tabla 3.3B.
15) Con tus propias palabras define el calor específico.
16) Con tus propias palabras define a la energía.
17) Por que se dice que el calor es una energía virtual.
18) Se desea pasar agua desde una temperatura de -50 oC hasta una temperatura
de 200 oC. Haga un croquis describiendo todos los tipos de calores que se
requieren para que el agua llegue hasta esa temperatura.
19) ¿Porque en los procesos industriales donde se maneja agua, se dice que el
calor latente es el peor enemigo del ingeniero?
20) Explique en qué parte de la actividad diaria de un ser humano, está involucrado
el calor latente.
BIBLIOGRAFÍA:
El alumno deberá de incluir toda aquella fuente de información a la que haya
recurrido.
APLICACIONES DE PROPIEDADES DE LA MATERIA 53
Vous aimerez peut-être aussi
- Practica 6 TMDocument16 pagesPractica 6 TMYAHIR GONZALEZ BARAJASPas encore d'évaluation
- Informe CalorimetríaDocument11 pagesInforme CalorimetríaJOSE DAVID CORCHO0% (1)
- Practica # 6 Ime Ago 2023 - Ene 2024Document7 pagesPractica # 6 Ime Ago 2023 - Ene 2024rjgarciahernandezPas encore d'évaluation
- 2-Pres. Calorimet - Unidad Nº1Document32 pages2-Pres. Calorimet - Unidad Nº1Ana MoranoPas encore d'évaluation
- Calorimetria Infor 11Document12 pagesCalorimetria Infor 11Emanuel C QuisbertPas encore d'évaluation
- Calor EspecificoDocument4 pagesCalor EspecificoJuan Alexis Peña ValeraPas encore d'évaluation
- CALORIMETRIA LabDocument15 pagesCALORIMETRIA LabRenancho BelPas encore d'évaluation
- Q-A Informe 2Document7 pagesQ-A Informe 2Marjhury Sanchez PerezPas encore d'évaluation
- Práctica #10Document4 pagesPráctica #10Elizabeth GutierrezPas encore d'évaluation
- Practica 3. ReporteDocument15 pagesPractica 3. ReporteALDO URIEL FLORES DE LA ROSAPas encore d'évaluation
- Energia TermicaDocument16 pagesEnergia TermicaRuperto CahuanaPas encore d'évaluation
- Calorimetria - TeoriaDocument15 pagesCalorimetria - TeoriapopiamapeiPas encore d'évaluation
- Informe - Calor EspecíficoDocument23 pagesInforme - Calor EspecíficoLili CastroPas encore d'évaluation
- Laboratorio 5 de Fisica 2Document11 pagesLaboratorio 5 de Fisica 2amelyn31Pas encore d'évaluation
- Laboratorio 9 - DETERMINACION DEL CALOR ESPECÍFICO DE SÓLIDOSDocument11 pagesLaboratorio 9 - DETERMINACION DEL CALOR ESPECÍFICO DE SÓLIDOSHarold Choque CanquiPas encore d'évaluation
- Lab. 3 Calor Especifico Liq FQDocument8 pagesLab. 3 Calor Especifico Liq FQCharl GrymPas encore d'évaluation
- Calor Especifico y Calor LatenteDocument14 pagesCalor Especifico y Calor LatenteNadiaPas encore d'évaluation
- Laboratorio Practica 05Document7 pagesLaboratorio Practica 05Jhonnatan NùñezPas encore d'évaluation
- Laboratorio 2 Quimica Industrial 1Document44 pagesLaboratorio 2 Quimica Industrial 1juanPas encore d'évaluation
- Determinación de Entalpías de Reacción y de SoluciónDocument14 pagesDeterminación de Entalpías de Reacción y de Soluciónvalentina torresPas encore d'évaluation
- Practica 7 Determinación de Entalpías de Reacción y de SoluciónDocument13 pagesPractica 7 Determinación de Entalpías de Reacción y de SoluciónMariana SorianoPas encore d'évaluation
- Ley de Newton de Enfriamiento-CalentamientoDocument18 pagesLey de Newton de Enfriamiento-CalentamientoRoberto Carlos Munoz VillegasPas encore d'évaluation
- Calor Especifico y Cambios de FaseDocument13 pagesCalor Especifico y Cambios de FaseDaniel ChávezPas encore d'évaluation
- 10 CALORIMETRÍA JosiDocument16 pages10 CALORIMETRÍA JosiDavid GirondaPas encore d'évaluation
- 10 Calorimetría JosiDocument16 pages10 Calorimetría JosiEvanz Gutierrez QuispePas encore d'évaluation
- FQ TermoquimicaDocument21 pagesFQ TermoquimicaMax Gerson Fer FernandezPas encore d'évaluation
- Temperatura y Calor 2Document23 pagesTemperatura y Calor 2Er CbPas encore d'évaluation
- Informe 8 Calor Específico UTPDocument14 pagesInforme 8 Calor Específico UTPE. R. Reinoso NúñezPas encore d'évaluation
- 10 CalorimetríaDocument18 pages10 CalorimetríaJorge Enrique MolloPas encore d'évaluation
- Calor Específico de MetalesDocument13 pagesCalor Específico de MetalesKimberly MinayaPas encore d'évaluation
- Tema 5 - Los Principios de La TermodinámicaDocument17 pagesTema 5 - Los Principios de La TermodinámicaDiegoGarcíaMolinaPas encore d'évaluation
- Calorimetria MDocument21 pagesCalorimetria MCristian Alejandro Gonzales MendozaPas encore d'évaluation
- Calorimetria ImprimirDocument11 pagesCalorimetria ImprimirPablo MacuchapiPas encore d'évaluation
- Informe de Laboratorio Calor Especifico de Los SolidosDocument17 pagesInforme de Laboratorio Calor Especifico de Los SolidosJhon JefferPas encore d'évaluation
- Reporte 4Document6 pagesReporte 4OdinAguilarPas encore d'évaluation
- Calor Especifico RicardoDocument15 pagesCalor Especifico Ricardoangielol02100% (1)
- Practica Calor Especifico de SolidosDocument8 pagesPractica Calor Especifico de Solidosfer piñaPas encore d'évaluation
- Calor Especifico en SolidosDocument8 pagesCalor Especifico en SolidosSofia Castillo RamirezPas encore d'évaluation
- QuimicaDocument38 pagesQuimicaMaría Pía Lupérdiga CavaPas encore d'évaluation
- Informe Termoquímica UNASAM CALORIMETRÍA A PRESIÓN CONSTANTEDocument23 pagesInforme Termoquímica UNASAM CALORIMETRÍA A PRESIÓN CONSTANTEMaycol Richard Leyva PatricioPas encore d'évaluation
- Proyecto 8Document26 pagesProyecto 8Dayanna PitaPas encore d'évaluation
- Laboratorio de Calor LatenteDocument17 pagesLaboratorio de Calor LatenteLeonardo Rey Castro NeiraPas encore d'évaluation
- Gamma PYCDocument33 pagesGamma PYCPablo Yujra CusiPas encore d'évaluation
- ACTIVIDAD1 ElianPalacios 4049Document5 pagesACTIVIDAD1 ElianPalacios 4049Elian PalaciosPas encore d'évaluation
- Cuestionarios Practica 4Document6 pagesCuestionarios Practica 4jopisteck01Pas encore d'évaluation
- LABORATORIO EXPERIMENTAL #05. Calor Específico de Los Cuerpos SolidosDocument17 pagesLABORATORIO EXPERIMENTAL #05. Calor Específico de Los Cuerpos SolidosCarlos Becerra salazarPas encore d'évaluation
- TRABAJO PRACTICO N 1.docx SICORA - 082250Document5 pagesTRABAJO PRACTICO N 1.docx SICORA - 082250milagrosmaribel37Pas encore d'évaluation
- Pre3 - Laboratorio de Termo 1Document6 pagesPre3 - Laboratorio de Termo 1Lolito PerezPas encore d'évaluation
- LAB 2 Calor EspecificoDocument10 pagesLAB 2 Calor EspecificoAracely Cruzado BlancoPas encore d'évaluation
- Práctica de Termodinámica: CalorimetríaDocument2 pagesPráctica de Termodinámica: CalorimetríaMiguel L. ToledanoPas encore d'évaluation
- Laboratorio de Fisica Ii Calor Especifico de Los SolidosDocument10 pagesLaboratorio de Fisica Ii Calor Especifico de Los SolidosBrian Alberto Chaupín HuariPas encore d'évaluation
- Depto. Ing. Química Universidad Rafael Landívar: Reporte Virtual No. 4 - Laboratorio de Termodinámica QuímicaDocument7 pagesDepto. Ing. Química Universidad Rafael Landívar: Reporte Virtual No. 4 - Laboratorio de Termodinámica QuímicaAbner AlvizuresPas encore d'évaluation
- Calor Especifico de SolidosDocument4 pagesCalor Especifico de SolidosGeanpiero Touzet MálagaPas encore d'évaluation
- Actividad # 6Document4 pagesActividad # 6FRANCISCO JAVIER FUNDADOR RODRIGUEZPas encore d'évaluation
- Laboratorio 3. Capacidad Calorica. Calor EspecificoDocument11 pagesLaboratorio 3. Capacidad Calorica. Calor EspecificoGISLEYN ALEJANDRA ATENCIA POVEDAPas encore d'évaluation
- Laboratorio 4 Grupo #5 CALOR ESPECIFICODocument12 pagesLaboratorio 4 Grupo #5 CALOR ESPECIFICONayrha Mostacero PastorPas encore d'évaluation
- Laboratorio N°05 - Calor Específico en Los Cuerpos SólidosDocument16 pagesLaboratorio N°05 - Calor Específico en Los Cuerpos SólidosJosé Enmanuel Guevara GamarraPas encore d'évaluation
- Practica 3 Calor LatenteDocument6 pagesPractica 3 Calor LatenteAntonio PeñaPas encore d'évaluation
- Tarea QuimicaDocument1 pageTarea Quimicadiego davidPas encore d'évaluation
- Ciclo de Refrigeración y Segunda Ley de La TermodinamicaDocument19 pagesCiclo de Refrigeración y Segunda Ley de La Termodinamicadiego davidPas encore d'évaluation
- EcuacionesDocument4 pagesEcuacionesdiego davidPas encore d'évaluation
- Tarea QuimicaDocument4 pagesTarea Quimicadiego davidPas encore d'évaluation
- Tarea QuimicaDocument4 pagesTarea Quimicadiego davidPas encore d'évaluation
- Tarea QuimicaDocument4 pagesTarea Quimicadiego davidPas encore d'évaluation
- Reporte 2Document4 pagesReporte 2diego davidPas encore d'évaluation
- LineasDocument4 pagesLineasdiego davidPas encore d'évaluation
- ProgramaDocument2 pagesProgramaFortunato CerecedoPas encore d'évaluation
- EjercicioDocument2 pagesEjercicioFortunato CerecedoPas encore d'évaluation
- Anexo A Tarea 2Document1 pageAnexo A Tarea 2diego davidPas encore d'évaluation
- Resume Con Mapas y Esquemas Ebook DocsityDocument1 pageResume Con Mapas y Esquemas Ebook Docsitydiego davidPas encore d'évaluation
- Manual de Solid Works 2014Document208 pagesManual de Solid Works 2014Obler Edwin Duran SacramentoPas encore d'évaluation
- Manual de Solid Works 2014Document208 pagesManual de Solid Works 2014Obler Edwin Duran SacramentoPas encore d'évaluation
- Práctica Calificada #6 - BDocument2 pagesPráctica Calificada #6 - Bjoseph gonzalesPas encore d'évaluation
- BIOFISICADocument63 pagesBIOFISICAAshh LuPas encore d'évaluation
- Simulacion Tuberias ANSYS-texDocument10 pagesSimulacion Tuberias ANSYS-texElias GarciaPas encore d'évaluation
- Preparación Examen FinalDocument34 pagesPreparación Examen Finalmaria jose chisco casallasPas encore d'évaluation
- Practica 6 TermoDocument6 pagesPractica 6 TermoyekahPas encore d'évaluation
- Informe 5Document6 pagesInforme 5Jesús Alfonso Castro ParraPas encore d'évaluation
- Analisis de Arenas Final JCCDocument7 pagesAnalisis de Arenas Final JCCLaura AguilarPas encore d'évaluation
- Valvulas Mariposa ES GBL TSM 3W-3L 20211213 01Document26 pagesValvulas Mariposa ES GBL TSM 3W-3L 20211213 01Gabino DiazPas encore d'évaluation
- Ejercicios 4Document23 pagesEjercicios 4LUNA ISANNETTE FERNANDEZ VIEYRAPas encore d'évaluation
- Ayudantias Fisica DDocument3 pagesAyudantias Fisica DLuis Angel RGPas encore d'évaluation
- Simulación Con Geant4 de La Radiación Directa Recibida Por El Paciente e Indirecta Por El Equipo Médico en Un Proceso Quirúrgico Usando Fluoroscopia.Document87 pagesSimulación Con Geant4 de La Radiación Directa Recibida Por El Paciente e Indirecta Por El Equipo Médico en Un Proceso Quirúrgico Usando Fluoroscopia.DiegoPas encore d'évaluation
- Informe 3 CualitattivaDocument19 pagesInforme 3 CualitattivaSHANTAL LUCIA TABOADA QUISPEPas encore d'évaluation
- Contenido de Humedad en GranosDocument5 pagesContenido de Humedad en GranosNelson EstelaPas encore d'évaluation
- PresentacionDocument20 pagesPresentacionJeancarlis Victoria Hernandez GonzalezPas encore d'évaluation
- T2. Proceso de Fabricación de Lentes MineralesDocument22 pagesT2. Proceso de Fabricación de Lentes MineralesAndrés Leví Cornejo ArbildoPas encore d'évaluation
- Solución T.P.Nº10Document16 pagesSolución T.P.Nº10Alfredo MIKEPas encore d'évaluation
- Tema 07Document2 pagesTema 07Antony SánchezPas encore d'évaluation
- DiamantinaDocument25 pagesDiamantinaPaulina Fuentes MPas encore d'évaluation
- Resolucion BalotariosDocument21 pagesResolucion BalotariosLuz Marp50% (2)
- Dosificacion Cal 2%Document6 pagesDosificacion Cal 2%Alfredo Gaspar ApazaPas encore d'évaluation
- Definicion y Causas de Un Brote Mapa ConceptualDocument10 pagesDefinicion y Causas de Un Brote Mapa Conceptualalex garcia bernalPas encore d'évaluation
- ChatLog Preparación para Inspector de Soldadura - AWS 2020 - 04 - 16 19 - 52Document5 pagesChatLog Preparación para Inspector de Soldadura - AWS 2020 - 04 - 16 19 - 52Roberto DavilaPas encore d'évaluation
- Lodos de PerforacionDocument47 pagesLodos de PerforacionIvan Noya100% (1)
- Fisica 3 AmortiguadoDocument21 pagesFisica 3 AmortiguadojoselopyPas encore d'évaluation
- Tema 2 Deformacion Simple 2 1 ContenidosDocument26 pagesTema 2 Deformacion Simple 2 1 ContenidosfernandaPas encore d'évaluation
- Marco Teórico 2222Document4 pagesMarco Teórico 2222Wicho :vPas encore d'évaluation
- Universidad Mayor de San Andres Nro 7Document10 pagesUniversidad Mayor de San Andres Nro 7Ale MachacaPas encore d'évaluation
- Teoria de Mecanica de Rocas IDocument103 pagesTeoria de Mecanica de Rocas IIsaac StichPas encore d'évaluation
- Sustitución NucleofílicaDocument19 pagesSustitución NucleofílicaedisonPas encore d'évaluation
- Unidad 2 S7 Deformacion Volumétrica - LaminaciónDocument24 pagesUnidad 2 S7 Deformacion Volumétrica - LaminaciónMiguel Angel Vilca AdcoPas encore d'évaluation