Académique Documents
Professionnel Documents
Culture Documents
Guia 1 Minería Del Hierro
Transféré par
José Daniel Marañón MolinaCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Guia 1 Minería Del Hierro
Transféré par
José Daniel Marañón MolinaDroits d'auteur :
Formats disponibles
Hierro - EcuRed https://www.ecured.
cu/Hierro
Hierro
Hierro. Elemento químico, símbolo: Fe, número atómico 26 y
peso atómico 55.847. El hierro es el cuarto elemento más
abundante en la corteza terrestre (5%). Es un metal maleable, Hierro
tenaz, de color gres plateado y magnético. Los cuatro isótopos
estables, que se encuentran en la naturaleza, tienen las masas
54, 56, 57 y 58. Los dos minerales principales son la hematita,
Fe2O3, y la limonita, Fe2O3.3H2O. Las piritas, FeS2, y la
cromita, Fe(CrO2)2, se explotan como minerales de azufre y
de cromo, respectivamente. El hierro se encuentra en muchos
otros minerales y está presente en las aguas freáticas y en la
hemoglobina roja de la sangre.
Información general
Contenido ombre,símbolo,número: Fe
Grupo,período,bloque: Grupo 8, Período 4,
1 Historia
Bloque d.
1.1 Edad del Hierro
2 Características Densidad: 7874 kg/m3
2.1 Estructura Apariencia: Aspecto metálico
2.2 Compuestos brillante con un tono
3 Propiedades grisáceo
4 Aplicaciones y producción
Propiedades atómicas
5 Efectos sobre la salud
6 Efectos ambientales Radio medio: 140 pm
7 Fuentes Radio atómico(calc): 156
Radio covalente: 126 pm
Configuración electrónica: [Ar]3d64s2
Historia
Electrones por nivel de
2, 8, 14, 2
El hierro fue descubierto en la prehistoria y era utilizado como energía:
adorno y para fabricar armas. El objeto más antiguo existente, Estado(s) de oxidación: 2,3
es un grupo de cuentas oxidadas encontrado en Egipto, y data Cúbica centrada en el
Estructura cristalina:
del 4000 a.c. El término arqueológico edad del hierro se aplica cuerpo
sólo al periodo en el que se extiende la utilización y el trabajo
del hierro. El procesado moderno del hierro no comenzó en Propiedades físicas
Europa central hasta la mitad del siglo XIV. Estado ordinario: Sólido
Punto de fusión: 1808 K
Edad del Hierro
Punto de ebullición: 3023 K
Los primeros en entrar en la Edad del Hierro fueron los hititas Presión de vapor: 7,05 Pa a 1808 K
en el área de Palestina y solo fueron necesarios unos siglos
para que a continuación lo hiciera todo el mundo antiguo.
Aunque el trabajo del hierro es el más difícil de realizar de entre todos los metales, las posibilidades que ofrece, su mayor
eficacia y la dificultad de abastecerse de cobre y estaño hicieron que el hierro substituyera a las labores asociadas al
cobre de manera bastante rápida. Estas circunstancias estimularon el perfeccionamiento de la siderurgia, que llevaron a
que en épocas prehistóricas se consiguieran temperaturas de hasta 1.300º C. El mineral de hierro es muy abundante en la
tierra, supone el 5% del peso de la corteza terrestre, por lo que su aprovisionamiento no es difícil, pero sin embargo, son
necesarios combustibles de una alta capacidad calorífica para su reducción, generalmente se utilizó el carbón vegetal.
1 de 4 28/10/2017 04:21 a.m.
Hierro - EcuRed https://www.ecured.cu/Hierro
Existen diferentes procedimientos para la obtención del metal de hierro. El primero, llamado procedimiento directo, se
obtiene en horno de cubeta. La reducción se realiza a una temperatura menor que la de fusión (1536º C). Mediante este
procedimiento se obtiene una mezcla de hierro y escoria que, tras un insistente martillado, nos proporciona un metal más
o menos homogéneo. Así se obtiene el hierro dulce, muy puro (con menos de un 0’02 % de carbono), pero a la vez
excesivamente dúctil y de escasa dureza. Si queremos aumentar esta lo podemos conseguir mediante su introducción en
carbono, con lo que conseguimos un mayor nivel de carburación del metal, lo que aumenta la dureza. El hierro
carburado no es otra cosa que el acero. El hierro se puede trabajar mecánicamente, es lo que se llama el forjado, método
por el que se pueden conseguir artefactos de una gran variedad. También se puede tratar térmicamente de varias formas:
a)- mediante el recocido, calentarlo y dejarlo enfriar lentamente, con lo que se obtiene una estructura de mayor
equilibrio, b)- a través del templado, que consiste en enfriarlo bruscamente en agua lo que lo hace duro y fácil de afilar,
aunque quebradizo y c)- por el método del revenido, que consiste en, tras el templado, volverlo a calentar y dejarlo
enfriar lentamente, lo que hace disminuir su fragilidad.
Otro método general de trabajo del hierro es el indirecto, que se realiza en altos hornos y produce un metal fundido, que
se puede llevar a moldes y tiene un alto porcentaje de carbono (de un 1’7% a un 6’7%). Este método de obtención del
hiero colado no se conoció en Europa hasta el siglo XI-XII d.c., pero se dominaba ya en China desde el IV a.c. Antes de
la revolución industrial el mejor metal de hierro era el damasquinado, que se fabricaba mediante varillas de hierro dulce
y hierro carburado soldadas y martilladas conjuntamente, dando como resultado un material que aúna flexibilidad,
resistencia y dureza. La Edad del Hierro comienza a finales del II Milenio a.c. y el conocimiento del carburado fue
decisivo en su expansión. El conocimiento de la siderurgia se extendió rápidamente por el Próximo Oriente, Chipre y el
Egeo y, en algunos siglos se hizo asidua en Europa, gracias a la abundancia de hierro que existía en esta y a los
numerosos bosques que posibilitaban la obtención de grandes cantidades del carbón vegetal necesario para su
tratamiento. La colonización griega y fenicia hizo que el hierro se difundiera rápido por la Península Ibérica, el norte de
Africa y, seguramente, por la fachada atlántica, alcanzando su apogeo en el mundo celta donde se integra en los objetos
de la vida cotidiana. El bronce, de todos modos, se sigue utilizando con fines decorativos.
Características
El hierro puro tiene una dureza que oscila entre 4 y 5. Es blando, maleable y dúctil. Se
magnetiza fácilmente a temperatura ordinaria, y es difícil magnetizarlo en caliente. A unos
790 °C desaparecen las propiedades magnéticas. El punto de fusión del hierro, es de unos
1.535 °C, un punto de ebullición de 2.750 °C. La densidad relativa de este metal es de 7,86.
Su masa atómica es 55,847.
Estructura
El hierro tiene una estructura centrada en el cuerpo, a temperaturas normales. A Hierro puro
temperaturas más altas, tiene una estructura cúbica centrada en la cara. Este hecho es de
gran importancia práctica. En su forma de acero, el hierro siempre contiene una pequeña
cantidad de carbono. Los átomos de carbono son menores que los átomos de hierro y, a temperaturas altas, se encajan
en los espacios abiertos de la estructura centrada en la cara. Cuando el hierro se enfría, adquiere una forma cúbica
centrada en el cuerpo. En esa forma, los átomos de carbono no pueden colocarse en los espacios más pequeños.
Entonces, la red cristalina del hierro se distorsiona, debido al tamaño tan grande de los átomos de carbono, o el carbono
se separa del hierro como carburo de hierro, Fe 3C.
Los cristales del hierro y del Fe3 existen en muchos tamaños y formas. La estructura final del cristal está determinada
por el por ciento del hierro y la rapidez de enfriamiento. Estas diferencias en la estructura cristalina, le dan la gran
versatilidad que tiene el acero como un material industrial. También explican el hecho de que las propiedades del acero
se pueden cambiar gradualmente por el tratamiento del calor.
Químicamente el hierro es un metal activo. Se combina con los halógenos (flúor, cloro, bromo, yodo y astato) y con el
azufre, fósforo, carbono y silicio. Desplaza al hidrógeno de la mayoría de los ácidos débiles. Arde con oxígeno formando
tetróxido triférrico (óxido ferrosoférrico), Fe3O4. Expuesto al aire húmedo, se corroe formando óxido de hierro
hidratado, una sustancia pardo-rojiza, escamosa, conocida comúnmente como orín. La formación de orín es un
fenómeno electroquímico en el cual las impurezas presentes en el hierro interactúan eléctricamente con el hierro metal.
Se establece una pequeña corriente en la que el agua de la atmósfera proporciona una disolución electrolítica. El agua y
los electrólitos solubles aceleran la reacción. En este proceso, el hierro metálico se descompone y reacciona con el
oxígeno del aire para formar el orín. La reacción es más rápida en aquellos lugares donde se acumula el orín, y la
superficie del metal acaba agujereándose, osea, se corroe.
2 de 4 28/10/2017 04:21 a.m.
Hierro - EcuRed https://www.ecured.cu/Hierro
Al sumergir hierro en ácido nítrico concentrado, se forma una capa de óxido que lo hace pasivo, es decir, no reactivo
químicamente con ácidos u otras sustancias. La capa de óxido protectora se rompe fácilmente golpeando o sacudiendo el
metal, que vuelve así a ser activo.
Compuestos
Los compuestos de hierro (II) se oxidan fácilmente a compuestos de hierro (III). El compuesto más importante de hierro
(II) es el sulfato de hierro (II), FeSO4, denominado caparrosa verde, que normalmente existe en forma de cristales verde
pálido que contienen siete moléculas de agua de hidratación. Se obtiene en grandes cantidades como subproducto al
limpiar el hierro con baño químico, y se utiliza como mordiente en el teñido, para obtener tónicos medicinales y para
fabricar tinta y pigmentos.
El óxido de hierro (III), un polvo rojo amorfo, se obtiene tratando sales de hierro (III) con una base, y también oxidando
pirita. Se utiliza como pigmento, y se denomina rojo de hierro o rojo veneciano. También se usa como abrasivo para pulir
y como medio magnetizable de cintas y discos magnéticos. El cloruro de hierro (III), que se obtiene en forma de cristales
brillantes de color verde oscuro al calentar hierro con cloro, se utiliza en medicina y como una disolución alcohólica
llamada tintura de hierro.
Los iones de hierro (II) y hierro (III) se combinan con los cianuros para formar compuestos de coordinación. El
hexacianoferrato (II) de hierro (III) o ferrocianuro férrico, Fe4[Fe(CN)6]3, es un sólido amorfo azul oscuro formado por
la reacción de hexacianoferrato (II) de potasio con una sal de hierro (III) y se conoce como azul de Prusia. Se usa como
pigmento en pintura y como añil en el lavado de ropa para corregir el tinte amarillento dejado por las sales de hierro (II)
en el agua. El hexacianoferrato (III) de potasio, K3Fe(CN)6, llamado prusiato rojo, se obtiene del hexacianoferrato (III)
de hierro (II), Fe3[Fe(CN)6]2. A éste se le llama también azul de Turnbull y se usa para procesar el papel de calco. El
hierro experimenta también ciertas reacciones fisicoquímicas con el carbono, que son esenciales para fabricar el acero.
Propiedades
1. Presenta un color blanco.
2. Muy abundante en la tierra, pocas veces aparece en estado puro.
3. Tiene una gran densidad.
4. Es un material magnético.
5. Cuando entra en contacto con el aire, se forma en su superficie una capa de óxido, razón por la cual no puede
utilizarse sin protección superficial.
6. Tiene una conductividad eléctrica baja.
Aplicaciones y producción
El hierro puro, preparado por la electrólisis de una disolución de sulfato de hierro (II), tiene un
uso limitado. El hierro comercial contiene invariablemente pequeñas cantidades de carbono y
otras impurezas que alteran sus propiedades físicas, pero éstas pueden mejorarse
considerablemente añadiendo más carbono y otros elementos de aleación.
La mayor parte del hierro se utiliza en formas sometidas a un tratamiento especial, como el
Polvo de hierro
hierro forjado, el hierro colado y el acero. Comercialmente, el hierro puro se utiliza para
obtener láminas metálicas galvanizadas y electroimanes. Los compuestos de hierro se usan en
medicina para el tratamiento de la anemia, es decir, cuando desciende la cantidad de hemoglobina o el número de
glóbulos rojos en la sangre. En 1994, la producción anual de hierro se aproximaba a los 975 millones de toneladas.
Efectos sobre la salud
El Hierro puede ser encontrado en carne, productos integrales, patatas y vegetales. El cuerpo humano absorbe Hierro de
animales más rápido que el Hierro de las plantas. El Hierro es una parte esencial de la hemoglobina: el agente colorante
rojo de la sangre que transporta el oxígeno a través de nuestros cuerpos.
Puede provocar conjuntivitis, coriorretinitis, y retinitis si contacta con los tejidos y permanece en ellos. La inhalación
crónica de concentraciones excesivas de vapores o polvos de óxido de hierro puede resultar en el desarrollo de una
neumoconiosis benigna, llamada sideriosis, que es observable como un cambio en los rayos X. Ningún daño físico de la
3 de 4 28/10/2017 04:21 a.m.
Hierro - EcuRed https://www.ecured.cu/Hierro
función pulmonar se ha asociado con la siderosis. La inhalación de concentraciones excesivas de óxido de hierro puede
incrementar el riesgo de desarrollar cáncer de pulmón en trabajadores expuestos a carcinógenos pulmonares. LD50 (oral,
rata) =30 gm/kg. (LD50: Dosis Letal 50. Dosis individual de una sustancia que provoca la muerte del 50% de la
población animal debido a la exposición a la sustancia por cualquier vía distinta a la inhalación. Normalmente expresada
como miligramos o gramos de material por kilogramo de peso del animal.)
Efectos ambientales
El hierro (III) -O-arsenito, pentahidratado puede ser peligroso para el medio ambiente; se debe prestar especial atención
a las plantas, el aire y el agua. Se recomienda encarecidamente que no se permita que el producto entre en el medio
ambiente porque persiste en éste.
Fuentes
Hierro (http://www.lenntech.es/periodica/elementos/fe.htm#ixzz1zXDpBY00). Visitado el 2 de julio de 2012.
Historia (http://www.monografias.com/trabajos/metalprehis/metalprehis.shtml). Visitado el 2 de julio de 2012.
propiedades (http://www.estudiantes.info/tecnologia/metales/hierro.htm). Visitado el 2 de julio de 2012.
Características (http://html.rincondelvago.com/el-hierro.html). Visitado el 2 de julio de 2012.
Efectos ambientales del hierro (http://www.lenntech.es/periodica/elementos/fe.htm). Visitado el 2 de julio de
2012.
Hierro (http://elementos.org.es/hierro). Visitado el 2 de julio de 2012.
Obtenido de «https://www.ecured.cu/index.php?title=Hierro&oldid=2278599»
Categorías: Metales Elementos químicos Elementos de transición
4 de 4 28/10/2017 04:21 a.m.
Vous aimerez peut-être aussi
- Tema 10 - Yac. MetamórficosDocument10 pagesTema 10 - Yac. MetamórficosJosé Daniel Marañón MolinaPas encore d'évaluation
- T4-Migración Fluidos MineralizantesDocument15 pagesT4-Migración Fluidos MineralizantesJoseHerrera100% (3)
- Tema 7 - Yac. MagmáticosDocument21 pagesTema 7 - Yac. MagmáticosJosé Daniel Marañón Molina100% (1)
- Guía Sebastián Grande Tema 6 - Clasif - Yac.mineralesDocument8 pagesGuía Sebastián Grande Tema 6 - Clasif - Yac.mineralesBianca SulbaranPas encore d'évaluation
- Tema 2 - Fluidos Mineralizantes y Yac. MineralesDocument19 pagesTema 2 - Fluidos Mineralizantes y Yac. MineralesJosé Daniel Marañón MolinaPas encore d'évaluation
- Yac SedimentariosDocument7 pagesYac SedimentariosJosé Daniel Marañón MolinaPas encore d'évaluation
- Tema 10 - Anexo-Cortes-Dep - Endog.Document2 pagesTema 10 - Anexo-Cortes-Dep - Endog.José Daniel Marañón MolinaPas encore d'évaluation
- Técnicas de Geot e Isótopos EstablesDocument19 pagesTécnicas de Geot e Isótopos EstablesJosé Daniel Marañón MolinaPas encore d'évaluation
- Artculo Sobre Las Heraminetas Estadisticas en AgronomiaDocument17 pagesArtculo Sobre Las Heraminetas Estadisticas en AgronomiaJosé Daniel Marañón MolinaPas encore d'évaluation
- Mantenimiento de Equipos en Minas A Cielo Abierto Victor BarrientosDocument2 pagesMantenimiento de Equipos en Minas A Cielo Abierto Victor BarrientosJosé Daniel Marañón Molina33% (3)
- YMM-Tema 2-Fluidos Mineralizantes y Yac. MineralesDocument5 pagesYMM-Tema 2-Fluidos Mineralizantes y Yac. MineralesJoseHerreraPas encore d'évaluation
- ¿Qué Son Los Diseños de Superficie de Respuesta, Los Diseños Centrales Compuestos y Los Diseños de Box-Behnken - MinitabDocument4 pages¿Qué Son Los Diseños de Superficie de Respuesta, Los Diseños Centrales Compuestos y Los Diseños de Box-Behnken - MinitabJosé Daniel Marañón MolinaPas encore d'évaluation
- Tema 10 - Yac. MetamórficosDocument10 pagesTema 10 - Yac. MetamórficosJosé Daniel Marañón MolinaPas encore d'évaluation
- Aplicacion de Diseño Central Compuesto PDFDocument135 pagesAplicacion de Diseño Central Compuesto PDFJosé Daniel Marañón MolinaPas encore d'évaluation
- Dise - o Geotecnico Taludes y TunelesDocument6 pagesDise - o Geotecnico Taludes y TunelesJosé Daniel Marañón MolinaPas encore d'évaluation
- Pensum Minas1 PDFDocument3 pagesPensum Minas1 PDFAriel Toño Vaquera ZeballosPas encore d'évaluation
- Hinojosa PDFDocument13 pagesHinojosa PDFFederico TitoPas encore d'évaluation
- Concentracion de MineralesDocument83 pagesConcentracion de MineralesJhon UlarioPas encore d'évaluation
- Diseño de Taludes y Tuneles 3-1Document16 pagesDiseño de Taludes y Tuneles 3-1José Daniel Marañón MolinaPas encore d'évaluation
- Motores ElectricosDocument30 pagesMotores ElectricosJosé Daniel Marañón MolinaPas encore d'évaluation
- Curso Tecnologia CentrifugaDocument100 pagesCurso Tecnologia CentrifugaJuan Carlos Quintuna EspinPas encore d'évaluation
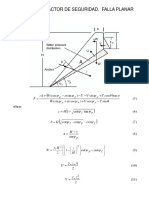
- Lamina Calculo Del Factor de Seguridad Falla PlanarDocument1 pageLamina Calculo Del Factor de Seguridad Falla PlanarJosé Daniel Marañón Molina100% (1)
- Instructivo para La Realización de Tesis en La Facultad de Ingeniería de La UCVDocument57 pagesInstructivo para La Realización de Tesis en La Facultad de Ingeniería de La UCVkevinPas encore d'évaluation
- ComportamientoTunel Profundo LAMINADocument2 pagesComportamientoTunel Profundo LAMINAJosé Daniel Marañón MolinaPas encore d'évaluation
- Manual de Perforación y Voladura. Temas 6 Voladuras Subterraneas PDFDocument55 pagesManual de Perforación y Voladura. Temas 6 Voladuras Subterraneas PDFJosé Daniel Marañón MolinaPas encore d'évaluation
- Tema 1 PerforacionDocument96 pagesTema 1 PerforacionJosé Daniel Marañón MolinaPas encore d'évaluation
- Revestimiento DefinitivoDocument5 pagesRevestimiento DefinitivoJosé Daniel Marañón MolinaPas encore d'évaluation
- Diseño de Taludes y Tuneles 3-2Document6 pagesDiseño de Taludes y Tuneles 3-2José Daniel Marañón MolinaPas encore d'évaluation
- Ucven-Manual de Perforacion y Voladura de RocaDocument20 pagesUcven-Manual de Perforacion y Voladura de RocaCristian Andre Mejia ChachapoyasPas encore d'évaluation
- Manual de Perforación y Voladura. Tema 2, 3 y 4 Variables, Explosivos y Mecanica PDFDocument88 pagesManual de Perforación y Voladura. Tema 2, 3 y 4 Variables, Explosivos y Mecanica PDFJosé Daniel Marañón MolinaPas encore d'évaluation
- Ejercicios FluidosDocument3 pagesEjercicios FluidoseusebioPas encore d'évaluation
- NootrópicosDocument12 pagesNootrópicosrotuarterenPas encore d'évaluation
- Fisiologia y Metabolismo Microbiano - Elio Espinoza FarfanDocument62 pagesFisiologia y Metabolismo Microbiano - Elio Espinoza FarfanDante Esteban Malpartida CapchaPas encore d'évaluation
- Electricitat 3 EsoDocument20 pagesElectricitat 3 EsoAnonymous ZUaUz1wwPas encore d'évaluation
- Reporte Final Aislantes TermicosDocument25 pagesReporte Final Aislantes TermicosDonovan OSPas encore d'évaluation
- Regularizaciones ZapallarDocument49 pagesRegularizaciones ZapallarRegularizaciones Zapallar PuchuncavíPas encore d'évaluation
- PROY-NRF-275-PEMEX-2011 Compresores Centrífugos para Aire de Instrumentos.Document18 pagesPROY-NRF-275-PEMEX-2011 Compresores Centrífugos para Aire de Instrumentos.Ildefonso FloresPas encore d'évaluation
- TuberiasDocument40 pagesTuberiasKarina HerreraPas encore d'évaluation
- Agitadores Milton RoyDocument2 pagesAgitadores Milton RoymiguelPas encore d'évaluation
- Horno Simple para Fundir Aluminio Con Lata de 20 LitrosDocument13 pagesHorno Simple para Fundir Aluminio Con Lata de 20 LitrosArmando Campos SalazarPas encore d'évaluation
- Universidad Privada de Tacna Trabajo de DinamicaDocument32 pagesUniversidad Privada de Tacna Trabajo de DinamicaGyver Asqui CastellanosPas encore d'évaluation
- Tarea 16Document3 pagesTarea 16jhonathanPas encore d'évaluation
- Informe #1Document13 pagesInforme #1Fernando RamirezPas encore d'évaluation
- Defectos de VinosDocument5 pagesDefectos de VinosYeni Merma OlartePas encore d'évaluation
- PNP BlueDocument2 pagesPNP Blueespia_smith096226Pas encore d'évaluation
- Corrosion Bajo TensionDocument18 pagesCorrosion Bajo TensionJeans Heysen ZavalaPas encore d'évaluation
- Procesos de Conformación de PlásticosDocument3 pagesProcesos de Conformación de PlásticosJacqueline de ElcoroPas encore d'évaluation
- Energia HidraulicaDocument69 pagesEnergia HidraulicaMarina Ferradas0% (1)
- Pruebas de Sensibilidad y DiscriminantesDocument26 pagesPruebas de Sensibilidad y DiscriminantesMaria Fernanda MendezPas encore d'évaluation
- Ejercicio Biela Procesos 1Document19 pagesEjercicio Biela Procesos 1Elver Rivera100% (1)
- Caracteristicas y Propiedades de Las RocasDocument17 pagesCaracteristicas y Propiedades de Las RocasRonald MartinezPas encore d'évaluation
- Info 1 PDFDocument3 pagesInfo 1 PDFAlejandro AstudilloPas encore d'évaluation
- Cómo Hacer Una Mascarilla de Aguacate para El PeloDocument17 pagesCómo Hacer Una Mascarilla de Aguacate para El Pelorcuc58820% (1)
- MEZCLA Y ALEACION Quinto de Secundaria AritmeticaDocument4 pagesMEZCLA Y ALEACION Quinto de Secundaria AritmeticaRoberto Felipe Espinoza Guzman100% (2)
- MartínBlancoPrego - InyecciónDePlásticoEnPiezasLEGODocument10 pagesMartínBlancoPrego - InyecciónDePlásticoEnPiezasLEGOMmrtnPas encore d'évaluation
- ElectricidadDocument7 pagesElectricidadDeby PrietoPas encore d'évaluation
- Tablas de DiseñoDocument5 pagesTablas de DiseñoBrian EscobarPas encore d'évaluation
- Calculo Estructural - Vivenda UnifamiliarDocument26 pagesCalculo Estructural - Vivenda UnifamiliarorteanPas encore d'évaluation
- Soldadura Por Arco EléctricoDocument6 pagesSoldadura Por Arco EléctricoRichard SanchezPas encore d'évaluation
- 2 PoliglucósidoDocument7 pages2 PoliglucósidojucarpisaPas encore d'évaluation