Académique Documents
Professionnel Documents
Culture Documents
Practica No 7 Reacciones de Sustitucion Electrofilica Aromatica
Transféré par
ErickDescription originale:
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Practica No 7 Reacciones de Sustitucion Electrofilica Aromatica
Transféré par
ErickDroits d'auteur :
Formats disponibles
lOMoARcPSD|2957915
Práctica No. 7 Reacciones de sustitución electrofílica
aromática
Química orgánica II (Universidad Nacional Autónoma de México)
StuDocu no está patrocinado ni avalado por ningún colegio o universidad.
Descargado por Erick Camacho (emcgre.v0c4l0id@gmail.com)
lOMoARcPSD|2957915
LABORATORIO QUÍMICA ORGÁNICA II
Fernando Torres Santander
Práctica No. 7 “Reacciones de sustitución electrofílica aromática: Nitración del benzoato de metilo”
Clave: 18
Problema a resolver
Figar las condiciones y precauciones que se debe tener para la obtención de Nitro benzoato de metilo
en condiciones de un laboratorio común de orgánica.
Resumen
La reacción más común de los compuestos aromáticos es la sustitución electrofílica aromática. Esto es, un
electrófilo reacciona con un anillo aromático y sustituye a uno de los hidrógenos; la reacción es característica
para todos los anillos aromáticos, no sólo benceno y bencenos sustituidos; de hecho, la habilidad de un
compuesto para experimentar la sustitución electrofílica es una buena prueba de la aromaticidad. Pueden
introducirse varios tipos de sustituyentes diferentes en un anillo aromático a través de las reacciones de
sustitución electrofílica, como lo fue el caso de la presente práctica en la cual se sustituyó un hidrogeno por
un grupo nitro, éstos compuestos son muy usados en la industria y tienen muchos usos prácticos por lo que
es una reacción realmente importante.
Resultados
Rendimiento crudo:
á 𝑖 𝑖 í𝑖
. 𝑔 × = . 𝑧 𝑖
. 𝑔á 𝑖 𝑖 í𝑖
. 𝑔 × = . − 𝑖 𝑧 𝑖
. 𝑔
%
. × = . %
.
Rendimiento lavado:
á 𝑖 𝑖 í𝑖
𝑔 × = . 𝑧 𝑖
. 𝑔á 𝑖 𝑖 í𝑖
. 𝑔 × = . − 𝑖 𝑧 𝑖
. 𝑔
%
. × = . %
.
Laboratorio de Química Orgánica II Química Farmacéutico Biológica
Descargado por Erick Camacho (emcgre.v0c4l0id@gmail.com)
lOMoARcPSD|2957915
LABORATORIO QUÍMICA ORGÁNICA II
Fernando Torres Santander
Análisis de Resultados
En la presente práctica se realizó la nitración del benzoato de metilo, las reacciones de sustitución sobre
anillo bencénico son interesantes.
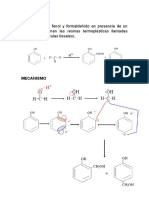
Figura 1. Mecanismo de reacción de la nitración del benzoato de metilo y formación del ión nitronio.
Un punto muy importante es la formación del ión nitronio ya que se establece un equilibrio entre el ácido
nítrico y el ácido sulfúrico, como podemos observar en la figura 1, este paso es sumamente esencial ya que
es el ion que se sustituirá en nuestro anillo bencénico. Un factor de suma importancia en la presente práctica
es el orden de adición de los reactivos a utilizar, es importante tomar las medidas de seguridad ya que por
ejemplo en el paso uno en donde se realiza la mezcla la adición del ácido sulfúrico debe ser poco a poco,
esto porque la reacción es exotérmica y podría afectar a nuestra reacción haciendo que la temperatura suba
muy rápidamente y provocar que el compuesto sufra una segunda nitración y obtengamos el correspondiente
compuesto dinitrado, dicho lo anterior es por esta razón que el control de la temperatura es decisivo para el
buen rendimiento de la práctica.
Laboratorio de Química Orgánica II Química Farmacéutico Biológica
Descargado por Erick Camacho (emcgre.v0c4l0id@gmail.com)
lOMoARcPSD|2957915
LABORATORIO QUÍMICA ORGÁNICA II
Fernando Torres Santander
Figura 2. Compuesto dinitrado (3,5-Dinitrobenzoato de metilo)
Continuando con lo anterior (orden de los reactivos) es muy importante que el agua o hielo se agregue una
vez que la reacción haya terminado, ya que nos ayudará a precipitar el compuesto; si llegara a caer un poco
de agua o hielo antes de que la reacción finalice causará que la reacción se retarde, porque la misma interfiere
con el equilibrio ácido nítrico-ácido sulfúrico que forma los iones nitronio. A menor cantidad de agua
presente, más activa la mezcla nitrante.
Analizando nuestro mecanismo encontramos un paso que resultará lento en la reacción, éste paso es la
sustitución del ion nitronio por el hidrógeno, esto porque es muy complicado romper la estabilidad del anillo
bencénico, una molécula demasiado estable por sus dobles enlaces conjugados, para llegar a una molécula
con carga mucho menos estable (carbocatión), esto es lo que hace también que el tiempo de reacción sea
más lento.
Un factor importante a analizar es la sustitución en posición meta del ion nitronio, como sabemos las
sustituciones cuando tenemos un radical unido al anillo bencénico pueden darse en tres lugares distintos
dando así origen a los compuesto orto, meta y para. Justamente lo que nos indicará en que posiciones se
sustituirán los grupos será el sustituyente que se encuentre pegado al anillo bencénico.
Los sustituyentes afectan la reactividad del anillo aromático. Algunos sustituyentes activan el anillo,
haciéndolo más reactivo que el benceno, y algunos desactivan el anillo, haciéndolo menos reactivo que el
benceno; por ejemplo, en la nitración aromática un sustituyente 𝐻 − hace al anillo 1000 veces más reactivo
que el benceno, mientras que un sustituyente 2 hace al anillo más de 10 millones de veces menos
reactivo.
Figura 3. Reactividad del anillo bencénico con respecto a sustituyentes.
Laboratorio de Química Orgánica II Química Farmacéutico Biológica
Descargado por Erick Camacho (emcgre.v0c4l0id@gmail.com)
lOMoARcPSD|2957915
LABORATORIO QUÍMICA ORGÁNICA II
Fernando Torres Santander
Los desactivadores y orientadores meta, como el −𝐶𝐻 , actúan a través de una combinación de efectos
inductivos y de resonancia atractores de electrones que se refuerzan entre sí y se sienten más poderosamente
en las posiciones orto y para. Como resultado, los intermediarios orto y para son menos estables así que la
reacción con un electrófilo ocurre en la posición meta
Figura 4. Estabilidad de los carbocationes generados para sustituciones orto, mete y para.
Conclusión
En las reacciones de sustitución electrofílica aromática es importante el sustituyente que pueda tener el anillo
aromático ya que éste indicará la posición en la cual se sustituirá el anillo, por lo que podemos manejar esto
a nuestra conveniencia y de esa manera obtener más fácilmente un producto para después quitar el
sustituyente inicial. De igual manera siempre debemos cuidar las medidas de seguridad y adición de
reactivos ya que esto nos dará la pauta para obtener o no mejores rendimientos.
Bibliografía
Mc Murry, J. Química Orgánica, 7a ed.; Cengage Learning: México, 2008; pp. 560-569.
Laboratorio de Química Orgánica II Química Farmacéutico Biológica
Descargado por Erick Camacho (emcgre.v0c4l0id@gmail.com)
Vous aimerez peut-être aussi
- Practica 8 - Obtencion de ColestenonaDocument7 pagesPractica 8 - Obtencion de ColestenonaJesus Tacuba Larumbe0% (1)
- Hidroxilación de UpjohnDocument3 pagesHidroxilación de UpjohnAlejandra Sanchez PiñaPas encore d'évaluation
- Obtención de BenzofenonaDocument9 pagesObtención de BenzofenonaPaola RamirezPas encore d'évaluation
- B NerolinaDocument3 pagesB NerolinaIrving Cerino CarrascoPas encore d'évaluation
- Practica2 172735Document10 pagesPractica2 172735luis marioPas encore d'évaluation
- Cuestionario de Práctica 4Document4 pagesCuestionario de Práctica 4Athenas A.PPas encore d'évaluation
- 5 Ingridh. Elkinv PDFDocument73 pages5 Ingridh. Elkinv PDFOscar Fernando Portilla GómezPas encore d'évaluation
- Regla de Markovnikov y AntimarkovnikovDocument2 pagesRegla de Markovnikov y AntimarkovnikovosjamePas encore d'évaluation
- Ejercicio Analitica PDFDocument10 pagesEjercicio Analitica PDFAyazo Lopez Daladiel100% (1)
- Practica 4.CINÉTICA QUÍMICA DE LA HIDRÓLISIS DEL CLORURO DE terc-BUTILODocument4 pagesPractica 4.CINÉTICA QUÍMICA DE LA HIDRÓLISIS DEL CLORURO DE terc-BUTILOAlex RamosPas encore d'évaluation
- Cuestionario 4 Orga 2Document8 pagesCuestionario 4 Orga 2Gianpierre Rojas AgapitoPas encore d'évaluation
- Capitulo 17 WadeDocument45 pagesCapitulo 17 WadeAngie Remache TipánPas encore d'évaluation
- Conformación de Los CicloalcanosDocument2 pagesConformación de Los CicloalcanosMelisa Martin100% (1)
- Informe 7 Sintesis de Williamson 1Document7 pagesInforme 7 Sintesis de Williamson 1Humberto Flores LealPas encore d'évaluation
- Calores Especificos de Gases PDFDocument1 pageCalores Especificos de Gases PDFingenio gysPas encore d'évaluation
- 111 - 115Document1 page111 - 115JORDAN OSCAR MARCA TORRESPas encore d'évaluation
- Baquelita Medio ÁcidoDocument2 pagesBaquelita Medio ÁcidoAntonia RojoPas encore d'évaluation
- Práctica PHDocument2 pagesPráctica PHDiego MoralesPas encore d'évaluation
- Practica 6 Sintesis de 2,4 DinitrofenílhidracinaDocument21 pagesPractica 6 Sintesis de 2,4 DinitrofenílhidracinaHeidi Mau0% (2)
- Dokumen - Tips Prob 39Document3 pagesDokumen - Tips Prob 39Percy Axel Cholan RoquePas encore d'évaluation
- Halogenación Del BencenoDocument1 pageHalogenación Del BencenoAkary Cevallos100% (1)
- 04 Ejercicios Red OxDocument16 pages04 Ejercicios Red OxEduard RomeroPas encore d'évaluation
- Cap 10Document25 pagesCap 10Jessy RamirezPas encore d'évaluation
- Terminado NitracionDocument19 pagesTerminado NitracionANDERSSONPas encore d'évaluation
- Determinación de La Entalpía de Mezcla en Fluidos BinariosDocument2 pagesDeterminación de La Entalpía de Mezcla en Fluidos BinariosAnge Neira100% (1)
- Balance de Masa Reactor de Acido NitricoDocument4 pagesBalance de Masa Reactor de Acido NitricoJairo GarciaPas encore d'évaluation
- Ácido FenoxiaceticoDocument2 pagesÁcido FenoxiaceticoGammaCSPas encore d'évaluation
- Compuesto de DiazonioDocument9 pagesCompuesto de DiazonioAlberto Antonio Alvarez AlvaradoPas encore d'évaluation
- Calif:9.0: Benemérita Universidad Autónoma de PueblaDocument12 pagesCalif:9.0: Benemérita Universidad Autónoma de PueblaMonserrat HernandezPas encore d'évaluation
- Práctica 4Document8 pagesPráctica 4Ioskani EstradaPas encore d'évaluation
- Antecedentes Practica 8Document9 pagesAntecedentes Practica 8Tania MorenoPas encore d'évaluation
- Laboratorio #4 Síntesis, Purificación y Caracterización de Acetanilida - Grupo NDocument18 pagesLaboratorio #4 Síntesis, Purificación y Caracterización de Acetanilida - Grupo NBeatriz godoyPas encore d'évaluation
- Practica 8.1 PDFDocument8 pagesPractica 8.1 PDFEdwin ArevaloPas encore d'évaluation
- CuestionarioDocument10 pagesCuestionarioapi-2713394650% (1)
- Problemas CombustionDocument27 pagesProblemas CombustionAndrea del AguilaPas encore d'évaluation
- Alquilación de Friedel-CraftsDocument2 pagesAlquilación de Friedel-Craftsariel100% (1)
- Practica Obtención de La BenzofenonaDocument11 pagesPractica Obtención de La BenzofenonaLeón Santiago BarqueraPas encore d'évaluation
- Eq Parte V PDFDocument6 pagesEq Parte V PDFketzel ego0% (1)
- Datos: M: 131g Xe, V 1,0dm 1,0L, R 0,0821 T 25°C+273 298°KDocument3 pagesDatos: M: 131g Xe, V 1,0dm 1,0L, R 0,0821 T 25°C+273 298°Kluis cardenasPas encore d'évaluation
- AcetofenonaDocument6 pagesAcetofenonafranklinmeraPas encore d'évaluation
- Cuestionario Practica 5 NitroDocument2 pagesCuestionario Practica 5 NitroErnesto RuizPas encore d'évaluation
- Problemario de Termodinámica AplicadaDocument27 pagesProblemario de Termodinámica AplicadaCesar GonzalezPas encore d'évaluation
- Practica 6 Preparacion Del Ciclohexeno Laboratorio de Quimica de Los HidrocarburosDocument5 pagesPractica 6 Preparacion Del Ciclohexeno Laboratorio de Quimica de Los HidrocarburosJAVIER GutierrezPas encore d'évaluation
- 3-Síntesis de Anilina Por Reduccion de NitrobencenoDocument5 pages3-Síntesis de Anilina Por Reduccion de NitrobencenoLAURA MERCEDES TELLEZ IBA�EZPas encore d'évaluation
- Problemas de Propiedades ColigativasDocument1 pageProblemas de Propiedades ColigativasRodolfo Alejandro Vazquez RamirezPas encore d'évaluation
- Transposición de CarbocationesDocument7 pagesTransposición de CarbocationesUwOPas encore d'évaluation
- Tarea 1 - MasDocument21 pagesTarea 1 - MasDiana AvilaPas encore d'évaluation
- Quimica de CoordinacionDocument21 pagesQuimica de CoordinacionDenisse Alcarraz Loa0% (1)
- Trabajo Unidad IIDocument2 pagesTrabajo Unidad IIJuan MartínezPas encore d'évaluation
- Obtencion de B-NerolinaDocument8 pagesObtencion de B-NerolinaAndres Rosas100% (1)
- QA Inf. 1 - Determinacion de PH en Una Mezcla Acido-BaseDocument7 pagesQA Inf. 1 - Determinacion de PH en Una Mezcla Acido-BaseJacqueline Velázquez JuarezPas encore d'évaluation
- Analisis Quimico - Tercera SemanaDocument18 pagesAnalisis Quimico - Tercera SemanaYudithMontalvoRamirezPas encore d'évaluation
- Laboratorio Semana 7 - 8990Document4 pagesLaboratorio Semana 7 - 8990Ela NuñuveroPas encore d'évaluation
- Reacciones de CondensacionDocument10 pagesReacciones de CondensacionMari Marisol RodriguezPas encore d'évaluation
- La Nitracion y Dinitracion Del BencenoDocument6 pagesLa Nitracion y Dinitracion Del BencenoGuillermo VelezPas encore d'évaluation
- Quimica Uno Bromacion Alilica de AlquenosDocument2 pagesQuimica Uno Bromacion Alilica de AlquenosDionisio MayorgaPas encore d'évaluation
- Ejercicios Semana 9Document3 pagesEjercicios Semana 9Gabriel AgripinoPas encore d'évaluation
- Pruebas para Caracterizar Compuestos OrganicosDocument7 pagesPruebas para Caracterizar Compuestos OrganicosLAURY ESTELA VILLADIEGO SUAREZ ESTUDIANTE ACTIVOPas encore d'évaluation
- Efecto de La Orientacion en Bencenos Disustituidos Durante Reacciones de SeaDocument2 pagesEfecto de La Orientacion en Bencenos Disustituidos Durante Reacciones de SeaestebanmolyPas encore d'évaluation
- ESTEQUIOMETRIADocument10 pagesESTEQUIOMETRIAReyes Garcia RuizPas encore d'évaluation
- 5P Burbuja en Moldeo Por InyecciónDocument7 pages5P Burbuja en Moldeo Por InyecciónErickPas encore d'évaluation
- Errores de Ingenieria (Cap2)Document6 pagesErrores de Ingenieria (Cap2)ErickPas encore d'évaluation
- DMA (Análisis Mecánico Dinámico)Document19 pagesDMA (Análisis Mecánico Dinámico)ErickPas encore d'évaluation
- Tarea 1 MercadotecniaDocument5 pagesTarea 1 MercadotecniaErickPas encore d'évaluation
- Actividad 3 Vendedor de HumoDocument2 pagesActividad 3 Vendedor de HumoErickPas encore d'évaluation
- Proyección HulesDocument17 pagesProyección HulesErickPas encore d'évaluation
- Reporte Seminario Online WEBINARDocument3 pagesReporte Seminario Online WEBINARErickPas encore d'évaluation
- ChemipalDocument6 pagesChemipalErickPas encore d'évaluation
- Horarios 2020B UAEMEX IPL P8 & P7Document7 pagesHorarios 2020B UAEMEX IPL P8 & P7ErickPas encore d'évaluation
- Costo Unitario Variable Construcción P6Document4 pagesCosto Unitario Variable Construcción P6ErickPas encore d'évaluation
- Esfuerzos TérmicosDocument14 pagesEsfuerzos TérmicosErickPas encore d'évaluation
- Guión para La ExposiciónDocument3 pagesGuión para La ExposiciónErickPas encore d'évaluation
- Biorremediación de Suelos Contaminados Por HidrocarburosDocument28 pagesBiorremediación de Suelos Contaminados Por HidrocarburosMayckCristianMezaRiosPas encore d'évaluation
- ActividadesDocument4 pagesActividadesMoisés ChucPas encore d'évaluation
- Taller 2 Analisis Instrumental FinalDocument10 pagesTaller 2 Analisis Instrumental FinalSonia LadinoPas encore d'évaluation
- Castillo Montaño Emeredis Julieth - 11 Grado Guia 10b Comp Aromaticos Reacciones (Continuacion)Document10 pagesCastillo Montaño Emeredis Julieth - 11 Grado Guia 10b Comp Aromaticos Reacciones (Continuacion)Emeredis CastilloPas encore d'évaluation
- Hidrocarburos Cíclicos y AromáticosDocument18 pagesHidrocarburos Cíclicos y Aromáticosmaria100% (3)
- Tesis de Compuestos OrgánicosDocument135 pagesTesis de Compuestos OrgánicosAlbertoPas encore d'évaluation
- Nomenclatura ARENOS 2020Document7 pagesNomenclatura ARENOS 2020Elmer CanelPas encore d'évaluation
- Benceno 1Document53 pagesBenceno 1Raul CabreraPas encore d'évaluation
- Alcoholes Problemas ResueltosDocument20 pagesAlcoholes Problemas ResueltosMariana MejiaPas encore d'évaluation
- Pre-Informe Nitración Del BencenoDocument8 pagesPre-Informe Nitración Del Bencenomiguel olivesPas encore d'évaluation
- ParafinasDocument74 pagesParafinasSheilita SivPas encore d'évaluation
- Indices de Refraccion de Solventes Comunes en ExtraccionDocument11 pagesIndices de Refraccion de Solventes Comunes en ExtraccionLuisGuillermoHuamánVilcaPas encore d'évaluation
- Nomenclatura Del Benceno y DerivadosDocument8 pagesNomenclatura Del Benceno y DerivadosEduardovegabPas encore d'évaluation
- Taller Compuestos AromaticosDocument4 pagesTaller Compuestos AromaticosRamón Ocampo Gomez100% (1)
- Ejercicios de QuimicaDocument6 pagesEjercicios de QuimicaAiron VillegasPas encore d'évaluation
- Nitracion Del CloroBencenoDocument4 pagesNitracion Del CloroBencenoDaniel MurilloPas encore d'évaluation
- Biorremediacion de Suelos Contaminados Por HidrocarburosDocument28 pagesBiorremediacion de Suelos Contaminados Por HidrocarburosNestor Daniel Romero GarciaPas encore d'évaluation
- 05 - SNA y BencinoDocument96 pages05 - SNA y BencinoGianpiero GirardiPas encore d'évaluation
- Los Hidrocarburos Cíclicos y Aromáticos QuimicaDocument11 pagesLos Hidrocarburos Cíclicos y Aromáticos QuimicaMateo Uribe RuizPas encore d'évaluation
- PRACTICA #12.docx OrganicaDocument4 pagesPRACTICA #12.docx Organicaruben100% (2)
- Test Diagnóstico para Hidrocarburos Aromáticos - Test de Le Rosen y Test de Friedel y CraftsDocument13 pagesTest Diagnóstico para Hidrocarburos Aromáticos - Test de Le Rosen y Test de Friedel y Craftslemuel avilaPas encore d'évaluation
- QMC 200Document11 pagesQMC 200Luis MoralesPas encore d'évaluation
- Para Determinar La Peligrosidad de Un LubricanteDocument3 pagesPara Determinar La Peligrosidad de Un LubricanteAlexandher1985Pas encore d'évaluation
- EXPOSICION AL BENCENO Y SUS DERIVADOS HoyDocument9 pagesEXPOSICION AL BENCENO Y SUS DERIVADOS HoyShirley CORTES SUSUNAGAPas encore d'évaluation
- Propiedades Químicas de Hidrocarburos AromáticosDocument3 pagesPropiedades Químicas de Hidrocarburos Aromáticos70817075% (4)
- Resonancia o MesomeríaDocument71 pagesResonancia o MesomeríaLuis E Aguilar RPas encore d'évaluation
- MTQO2Document2 pagesMTQO2___ASCE100% (1)
- PRÁCTICA #4 Hidrocarburos AromáticosDocument14 pagesPRÁCTICA #4 Hidrocarburos AromáticosJoseLuis CardichPas encore d'évaluation
- 027 - Formacion Espacios ConfinadosDocument24 pages027 - Formacion Espacios ConfinadosRaul GranadosPas encore d'évaluation
- Sustitución Nucleofilica AromaticaDocument9 pagesSustitución Nucleofilica AromaticaEzequiel Hernández100% (1)