Académique Documents
Professionnel Documents
Culture Documents
Formulario Termodinamica 19-2 PBB
Transféré par
alan sanchezDescription originale:
Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Formulario Termodinamica 19-2 PBB
Transféré par
alan sanchezDroits d'auteur :
Formats disponibles
Formulario de termodinámica.
19 2 bimestral
Densidad ρ x Calidad del vapor
m mg Masa del vapor saturado
ρ=
V mg=x mt
Volumen específico del vapor v mf Masa del líquido saturado
1 V
v= = mf =( 1−x ) mt
ρ m
mt=mg +mf Masa total
Fuerza F
F=m× g Calidad del vapor x en función del volumen
P(kPa)
específico del vapor y del líquido saturado.
Presión P
F N
P= = 2 =pa o
A m [ lbf
pulg ][
2
=Psi
]
Presión manométrica o relativa Pman
|¿|−P
atm
Pman=P¿
|¿|
Presión absoluta
P¿
|¿|=P + P
v (m3/kg)
atm man
P¿
Patm Presión atmosférica local Calidad del vapor x
Patm=101.325 kPa a nivel del mar v−v f
x=
m =masa total (kg) o (lbm) v g −v f
V = volumen geométrico (m3) o (ft3) Dónde:
g =constante gravitacional (9.81m/s2) o (32.174ft/s2) x Calidad del vapor
F Fuerza (Newton) o (lb.f=32.174lbmft/ s2) v g Volumen específico del vapor saturado
A Área normal a la aplicación de la fuerza m2 v f Volumen específico del líquido saturado
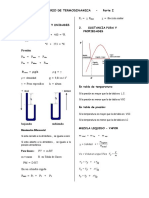
Sustancia pura v Volumen específico de la mezcla (líquido-vapor)
Proceso isobárico a P=Patm H20 Volúmenes específicos
Diagrama T-v (Sustancia pura)
T (°C)
P=Cte.
Vg
Punto
vapor v g= Volumen específico
critico
mg
Curva de del vapor
líquido Vapor
saturado sobrecalentado
Líquido Vf
100 Líquido
isobárico y v f= Volumen específico
comprimido
isotérmico
Líquido-vapor Curva de mf
Zona de mezcla vapor
saturado del líquido
Volumen geométrico del vapor V g y del líquido
Vf se obtienen como:
0.001 1.67 V (m3/kg)
Para la zona de mezcla V g =v g m g
Calidad del vapor x calidad del vapor V f =v f mf
mg Masa del vapor mg y del líquido mf son:
x=
mt
Donde
Formulario de termodinámica.
19 2 bimestral
Vg El líquido comprimido está caracterizado por
m g= Masa del vapor Presiones superiores ( P> Psat a una T dada)
vg
Temperaturas inferiores ( T <T sat a una P dada)
Vf
mf = Masa del líquido Volúmenes específicos inferiores ( v < v f a una P
vf o T dada)
Propiedades de mezcla líquido-vapor saturado. Energías internas inferiores ( u<u f a una P o T
v =x v g + ( 1−x ) v f volumen especifico dada)
Entalpías inferiores ( h<h f a una P o T dada)
u=x ufg +u f energía interna especifica A falta de datos para líquido comprimido, una
aproximación general es considerar al líquido
comprimido como un líquido saturado a la temperatura
h=x h fg+h f entalpía especifica dada
s=x s fg +s entropía especifica
Trabajo de frontera:
Sustancia pura
Proceso isobárico a P=Patm H20 ∂ W =F ( dl ) Trabajo
Diagrama T-v (Sustancia pura)
T (°C) F=PA Fuerza
Punto ∂ W =PA ( dl )
critico
dV = A ( dl )
Líquido
comprimido Vapor
isobárico y sobrecalentado
100
Líquido sat. isotérmico
Líquido-vapor
Zona de mezcla Vapor sat.
vf vg V (m3/kg
Mezcla liquido vapor
Presione ( P=P sat a una T dada)
Temperaturas ( T =T sat a una P dada) ∂ W =PdV Trabajo de frontera
2
Volúmenes específicos ( v f <v < v g a una P o T
dada) W 1−2=∫ P dV Trabajo de frontera
1
Energías internas ( uf < u<u g a una P o T dada) 2
Entalpías ( hf <h<h g ) a una P o T dada) W 1−2=∫ P dV Trabajo de frontera
1
Vapor sobrecalentado Proceso isobárico P=Cte
En comparación con el vapor saturado, el sobrecalentado se W 1−2=P ( V 2−V 2 ) =[ Joules ]
caracteriza por:
Trabajo de frontera especifico
Presiones menores ( P< Psat a una T dada) w 1−2 =P ( v 2−v1 ) =[ J /kg ]
Temperaturas superiores ( T >T sat a una P dada)
Volúmenes específicos superiores ( v > v g a una P Primera ley para un sistema cerrado
o T dada)
Energías internas superiores ( u>u g a una P o T
dada)
Entalpías superiores ( h>h g a una P o T dada) Sistema cerrado
El líquido comprimido m=Cte.
Formulario de termodinámica.
19 2 bimestral
Ru
∆ U + ∆ E p +∆ E K =Q−W R=
M
∆ E p =0 Energía potencial Ru = Constante universal del gas ideal
∆ E K =0 Energía cinética M =peso molecular o masa molecular del gas
El cambio de energía interna 1era Ley cerrado
R = Constante del gas
v = volumen especifico
∆ U 1−2=Q 1−2−W 1−2 [ kJ ] o [ Btu ]
Ecuación del gas ideal
El cambio de energía interna especifica 1era Ley PV =mRT
cerrado Pv=RT
∆ u1−2=q1−2−w 1−2 [ ][ ]
kJ
kg
o
Btu
lbm v = volumen especifico
V = volumen
Primera ley de la termodinámica en forma diferencial
T = Temperatura absoluta (K o R)
dU =∂ Q−∂ W
P = Presión absoluta
El cambio de energía interna ∆U de un sistema es igual
al calor transferido o cedido al sistema Q menos el Factor de compresibilidad
trabajo realizado o admitido sobre el sistema W PV =ZmRT
Q1−2 Flujo de calor entra al sistema (+) Pv=ZRT
Q1−2 Flujo de calor sale del sistema (-) Z = Factor de compresibilidad
W 1−2 Trabajo se realiza sobre el sistema (-) Donde Z =Z ( Pr , T r )
W 1−2 Trabajo se realiza sobre los alrededores del
Presión reducida
sistema (+) P
Pr= .
Pcr
Temperatura reducida
Ecuación del gas ideal T
T r= .
Pcr
PV =n Ru T
Ru = Constante universal del gas ideal
V = volumen
Ecuación de la Energía mecánica
T = Temperatura absoluta (K o R) Ecuación de la energía mecánica (energía especifica)
P = Presión absoluta
Vel 2
El número de moles esta dado como:
n=
m
e= ( 2
+ gz + Pv →
J
) [ ][ ]
kg
o
Btu
lbm
M
Ecuación de la energía mecánica (energía)
m=masa del gas
M=peso molecular o masa molecular del gas
n=número de moles del gas 2
Ecuación del gas ideal
E=m ( Vel
2 )
+ gz + Pv → [ J ] o [ Btu ]
Ru Ecuación de la energía mecánica (Potencia)
PV =m T
M
Vel 2
Constante particular del gas.
É= ḿ ( 2 )
+ gz + Pv [ Watts ] o [ Btu /s ]
Formulario de termodinámica.
19 2 bimestral
m
Flujo másico ḿ=
∆t
ḿ=ρ ( Vel ) A → [ ][ ]
kg
s
o
lbm
s
Vol
Flujo volumétrico ϑ́=
∆t
ϑ́= (Vel ) A → [ ][ ]
m3
s
o
ft 3
s
Nomenclatura.
kg lbm
ρ Densidad o
m3 ft 3
m ft
Vel Velocidad o
s s
2 2
A Área m o ft
m masa del sistema
z Altura
g constante gravitacional (9.81m/s2) o (32.174ft/s2)
P Presion Pa o Psi
v Volumen especifico m3/kg o ft3/bm
Vous aimerez peut-être aussi
- Formulario Termodinamica 21-2 PBBDocument5 pagesFormulario Termodinamica 21-2 PBBReikor RamirezPas encore d'évaluation
- 1 Sustancia Pura 19-2Document49 pages1 Sustancia Pura 19-2alan sanchezPas encore d'évaluation
- Ley de Charles y PresiónDocument7 pagesLey de Charles y PresiónmarkPas encore d'évaluation
- TermodinámicaDocument27 pagesTermodinámicaalexander0% (1)
- Formulario Termodinamica ITCHDocument19 pagesFormulario Termodinamica ITCHOscar canoPas encore d'évaluation
- Clase 4 Mayo 2022 - Apuntes EntregadosDocument9 pagesClase 4 Mayo 2022 - Apuntes EntregadosFabián MontielPas encore d'évaluation
- Formulario TermodinamicaDocument25 pagesFormulario TermodinamicafanfanfanPas encore d'évaluation
- Formulario TermodinamicaDocument25 pagesFormulario TermodinamicaPenélope ManzurPas encore d'évaluation
- Formulario TermodinamicaDocument25 pagesFormulario TermodinamicaMiguel AcostaPas encore d'évaluation
- TERMODINAMICAFORMULASDocument2 pagesTERMODINAMICAFORMULASKevin ReinosoPas encore d'évaluation
- Formulario TermodinamicaDocument26 pagesFormulario TermodinamicaSaul Alex Mendoza67% (3)
- Formulario Gases IdealesDocument1 pageFormulario Gases IdealesLuis Fernando Perez Apaza75% (4)
- 02 - MF Ip0284 - Prop - Fluidos 20192Document54 pages02 - MF Ip0284 - Prop - Fluidos 20192Valen RamiirezPas encore d'évaluation
- Sistema Aire - AguaDocument6 pagesSistema Aire - AguaStyven GonzalezPas encore d'évaluation
- Termodinamica I Tema 2Document40 pagesTermodinamica I Tema 2Jorge Ramirez VelasquezPas encore d'évaluation
- 1 FormularioDocument7 pages1 FormularioJose de la BarreraPas encore d'évaluation
- Sustancia PuraDocument54 pagesSustancia PuraCARDENAS SANCHEZ GRACE NALLELYPas encore d'évaluation
- Tarea 2 - Equilibrio de FasesDocument26 pagesTarea 2 - Equilibrio de FasesJhon Ramirez TamayoPas encore d'évaluation
- FORMULARIO Mecanica de FluidosDocument2 pagesFORMULARIO Mecanica de FluidosMarcos Hernandez GarciaPas encore d'évaluation
- HumidificacinDocument4 pagesHumidificacinIsaac Elihu Reyes BarrientosPas encore d'évaluation
- Psicrometria FormDocument1 pagePsicrometria FormDavid AraquePas encore d'évaluation
- 4.4 Masa 3Document13 pages4.4 Masa 3DULCE GARCIAPas encore d'évaluation
- 3.4. Sustancias Puras ConceptosDocument25 pages3.4. Sustancias Puras ConceptosFlorentino ArosemenaPas encore d'évaluation
- Propiedades de La Sustancia PuraDocument49 pagesPropiedades de La Sustancia PuraSantiago RomeroPas encore d'évaluation
- Termodinamica Propiedades Sustancias PurasDocument12 pagesTermodinamica Propiedades Sustancias PurasJob Alvarez ChavezPas encore d'évaluation
- Formula RioDocument5 pagesFormula RioKarelys ZambranoPas encore d'évaluation
- Ecuaciones Cúbicas de EstadoDocument24 pagesEcuaciones Cúbicas de EstadoEsteban LesmesPas encore d'évaluation
- Clase 1. Definiciones Importantes Sustancia Pura. Termodinámica II 2023-IDocument3 pagesClase 1. Definiciones Importantes Sustancia Pura. Termodinámica II 2023-IFrancesco TuanamaPas encore d'évaluation
- Formulario de TermodinamicaDocument5 pagesFormulario de TermodinamicaAylin PérezPas encore d'évaluation
- 4.4 - 4.6 Ejemplos Masa 3Document13 pages4.4 - 4.6 Ejemplos Masa 3DULCE GARCIAPas encore d'évaluation
- Ejercicios Resueltos Fis 1102a Estatica de FluidosDocument7 pagesEjercicios Resueltos Fis 1102a Estatica de FluidosGonzalo Gregorio Pacheco ViaPas encore d'évaluation
- Formulario y Tabla de Equivalencias de Fisica II de Prepa 1 y Prepa 4Document8 pagesFormulario y Tabla de Equivalencias de Fisica II de Prepa 1 y Prepa 4Diego Armando Jimebez RiveraPas encore d'évaluation
- Formulario Final de Mecanica de FluidosDocument10 pagesFormulario Final de Mecanica de FluidosJhonny Wladimir Peñaloza CabelloPas encore d'évaluation
- PsicometriaDocument15 pagesPsicometriaJose ChambiPas encore d'évaluation
- 0482-MyC-Humedad Problemas ResueltosDocument9 pages0482-MyC-Humedad Problemas ResueltosTatiana Diaz ChalarcaPas encore d'évaluation
- 0482 MyC Humedad Problemas ResueltosDocument9 pages0482 MyC Humedad Problemas ResueltosPaul Dirac CruzPas encore d'évaluation
- TripticoDocument5 pagesTripticoJoahan Anderson Estela NuñezPas encore d'évaluation
- Formulario Termodinamica I PDFDocument14 pagesFormulario Termodinamica I PDFPaúl Alexander Mora VireriPas encore d'évaluation
- Autoevaluacion 2º Parcial PDFDocument50 pagesAutoevaluacion 2º Parcial PDFKANDERMORADOPas encore d'évaluation
- Tema 3a. Propiedades Agua PDFDocument24 pagesTema 3a. Propiedades Agua PDFmarco_reategui_2Pas encore d'évaluation
- Estados de Liquido Saturado y de Vapor SaturadoDocument3 pagesEstados de Liquido Saturado y de Vapor SaturadoING. Miguel Angel Sanchez MonzonPas encore d'évaluation
- Termodinamica de La AtmosferaDocument57 pagesTermodinamica de La AtmosferaAranValdomeroPas encore d'évaluation
- 2-9 Seminario 2Document7 pages2-9 Seminario 2Maximiliano TarifaPas encore d'évaluation
- NTC 2505 Instalaciones Suministro de GasDocument43 pagesNTC 2505 Instalaciones Suministro de GasJuan AmorPas encore d'évaluation
- 4.4 Masa 3Document5 pages4.4 Masa 3Dulce Rubi García AlfonsoPas encore d'évaluation
- Formulario Modulos 1 y 2Document1 pageFormulario Modulos 1 y 2Jenni SanchezPas encore d'évaluation
- PsicrometrÍaDocument42 pagesPsicrometrÍaCursos Facultad de Ingeniería100% (1)
- Cap 4 Mezclas de Gases Sin ReacciónDocument23 pagesCap 4 Mezclas de Gases Sin ReacciónMARCOS LUIS LUJAN PEREZPas encore d'évaluation
- pSCROMETRIA PDFDocument17 pagespSCROMETRIA PDFJason MalonePas encore d'évaluation
- Balance de Materia y GasesDocument28 pagesBalance de Materia y GasesGerardo VazquezPas encore d'évaluation
- FormulrioDocument2 pagesFormulrioJHOEL GONZALO GALINDO FABIANPas encore d'évaluation
- Mezcla de Gases y Vapores - Acondicionamiento AireDocument26 pagesMezcla de Gases y Vapores - Acondicionamiento AirestalinPas encore d'évaluation
- 1ra Ley de La TermodinamicaDocument5 pages1ra Ley de La TermodinamicaFernando GuastavinoPas encore d'évaluation
- 04a 10 PDFDocument3 pages04a 10 PDFJuliza Angela Tupa HuancaPas encore d'évaluation
- FormularioDocument5 pagesFormularioAntonio GómezPas encore d'évaluation
- Gases Reales Química GeneralDocument19 pagesGases Reales Química GeneralJoséMaríaSerrudoPas encore d'évaluation
- Unidad 1 Sistemas de Dos Fases PDFDocument55 pagesUnidad 1 Sistemas de Dos Fases PDFRuben PaguayPas encore d'évaluation
- Estequiometria - de - La - Combustion PARTE 2Document23 pagesEstequiometria - de - La - Combustion PARTE 2Miriam Morales AjilaPas encore d'évaluation
- DISEÑO Spicometrico Con LabviewDocument7 pagesDISEÑO Spicometrico Con LabviewnetwalterPas encore d'évaluation
- UPONOR Calefacción AnexoDocument42 pagesUPONOR Calefacción AnexoRaul WilliamPas encore d'évaluation
- Silabo TERMODINÁMICADocument4 pagesSilabo TERMODINÁMICAOmar OlivaPas encore d'évaluation
- PLICACIONES DE LA TERMODINAMICA La Termodinámica Se Puede Aplicar A Una Amplia Variedad de Temas de Ciencia e IngenieríaDocument1 pagePLICACIONES DE LA TERMODINAMICA La Termodinámica Se Puede Aplicar A Una Amplia Variedad de Temas de Ciencia e IngenieríaPAOLA ANDREA GUATIBONZA LUNAPas encore d'évaluation
- Ejercicios de Presion de VaporDocument5 pagesEjercicios de Presion de VaporRodrigo ZevallosPas encore d'évaluation
- Ecuación de Van Der WaalsDocument11 pagesEcuación de Van Der WaalsDaniel SosePas encore d'évaluation
- Termodinamica Quimica PDFDocument20 pagesTermodinamica Quimica PDFGabys Elizabeth100% (1)
- Práctica 2. GuíaDocument6 pagesPráctica 2. GuíaMoncerrat OrtizPas encore d'évaluation
- Rite KflexDocument6 pagesRite KflexPEROLADICKERTPas encore d'évaluation
- La Materia y Sus TransformacionesDocument57 pagesLa Materia y Sus TransformacionesSidney D'andreaPas encore d'évaluation
- Experimento de JouleDocument5 pagesExperimento de JouleJhoel Jesus Baca PumaPas encore d'évaluation
- Flujo de Fluidos PreguntasDocument2 pagesFlujo de Fluidos PreguntasDiego Alexis100% (1)
- Tarea 3 QGDocument2 pagesTarea 3 QGEddi Giovanny Zavala MendozaPas encore d'évaluation
- 1er Examen de Termo 1 A 5 PDFDocument3 pages1er Examen de Termo 1 A 5 PDFjimenaPas encore d'évaluation
- Camisa y SerpentinDocument16 pagesCamisa y SerpentinDavid Gaytán SmithPas encore d'évaluation
- Termodinamica Problemas 2do ParcialDocument8 pagesTermodinamica Problemas 2do ParcialiiascribdPas encore d'évaluation
- Características de La TemperaturaDocument2 pagesCaracterísticas de La TemperaturaLexmari sarahiPas encore d'évaluation
- Ley de Enfriamiento de NewtonDocument2 pagesLey de Enfriamiento de NewtonISABELLA ESCOBAR MARINPas encore d'évaluation
- U1 Prop. Termod. de Los FluidosDocument73 pagesU1 Prop. Termod. de Los Fluidos21690017 FERNANDA AGUILERA QUIROZPas encore d'évaluation
- El Diseño de Intercambiadores de Calor en DetalleDocument10 pagesEl Diseño de Intercambiadores de Calor en Detallerefrigeracion10Pas encore d'évaluation
- Metodología Geoquímica Aplicada A Fluidos GeotermalesDocument65 pagesMetodología Geoquímica Aplicada A Fluidos GeotermalesFrank Kleber García YaretaPas encore d'évaluation
- Silabo de Física II PDFDocument6 pagesSilabo de Física II PDFHenry Sanchez Jr.Pas encore d'évaluation
- Expo Termo AbsorcionDocument30 pagesExpo Termo AbsorcionErikaPas encore d'évaluation
- TermodinamicaDocument41 pagesTermodinamicajerzonrojasPas encore d'évaluation
- Trabajo Termodinamica Conservacion de La Masa - DocxaDocument23 pagesTrabajo Termodinamica Conservacion de La Masa - DocxaThomas CañonPas encore d'évaluation
- Tema 2Document27 pagesTema 2VandeverdPas encore d'évaluation
- Ensayo JouleDocument2 pagesEnsayo JouleDavid DuranPas encore d'évaluation
- Trabajo Práctico #2: Unlz - Fi - Transferencia de Calor Y MasaDocument1 pageTrabajo Práctico #2: Unlz - Fi - Transferencia de Calor Y MasaAgus CadezPas encore d'évaluation
- Conversión de UnidadesDocument5 pagesConversión de Unidadesraulosvaldo_1Pas encore d'évaluation
- 10 Secado - IIDocument9 pages10 Secado - IIEsteban Cortes MoralesPas encore d'évaluation