Académique Documents
Professionnel Documents
Culture Documents
TareaFQ3 GasesIdeales
Transféré par
David MolinaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TareaFQ3 GasesIdeales
Transféré par
David MolinaDroits d'auteur :
Formats disponibles
UNIVERSIDAD MICHOACANA DE SAN NICOLÁS DE HIDALGO
FACULTA DE INGENIERÍA QUÍMICA
FISICOQUÍMICA
Tarea. No. 3: Gases Ideales
1. Si a partir de 1.3 g de un metal X se obtienen 1.9 g de X2O3, ¿cuál será la masa atómica de X?
2. ¿Cuál es la densidad (en g/L) del amoniaco a TPE si el gas en un matraz de 1.000 L pesa 0.672 g a 25°C
y una presión de 733.4 mm Hg?
3. Un recipiente de 2.00 L se llena con Ar (g) a 752 mm Hg y 35°C. A continuación, se le añade una muestra
de 0.728 g de vapor de C6H6. ¿Cuál es la presión total en el recipiente?
4. Un bulbo con metano de 1.00 L a una presión 10.0 kPa, se conecta a un bulbo con hidrógeno de 3.00
L y una presión de 20.0 kPa; ambos bulbos están a la misma temperatura. (a) Después de que los gases
se hayan mezclado, ¿cuál será la presión total? (b) ¿Cuál será la fracción molar de cada componente
de la mezcla?
5. Un tanque cilíndrico de tapas planas de 152 mm de diámetro por 4 pies de longitud contenía acetileno
a 17.6 Kgf/cm2 y a 26.7ºC. Después de haberse consumido una parte, el acetileno está a 145 PSI y a
70ºF. (a) ¿Qué porcentaje de acetileno en el tanque se consumió? (b) ¿Qué volumen ocuparía el
acetileno consumido a condiciones normales?
6. Un sistema formado por 5 g de argón, 5 g de helio y 10 g de hidrógeno, a 540°R, ocupa un volumen de
100 L.
a) ¿Cuál es la presión total del sistema y cuál la presión parcial de cada gas?
b) ¿Cuántas moléculas de cada gas están presentes en 1 mL?
c) ¿Cuántos gramos de hidrógeno habría que sacar de este volumen para reducir la presión a la mitad
de su valor original, a temperatura constante?
7. Después de colocar 1.60 mol de gas amoniaco en un recipiente de 1600 cm3 a 25C, éste se calienta a
500 K. A esta temperatura el amoniaco está parcialmente descompuesto en H2 y N2, y una medida de
la presión da 4.85106 Pa. Encuentre la composición molar a 500 K.
8. Por desplazamiento de agua se han recogido 0.40 galones de un gas a 86F y a la presión barométrica
de 14.39 psi. Si el gas tiene una masa de 1.98 g y la presión de vapor del agua a 30C es 32 mm Hg,
¿cuál es la masa molecular del gas?
9. Un gas tiene la siguiente composición a 120F y 13.8 PSIA:
Componente % masa
N2 15
CH4 60
C2H6 25
a) ¿Cuál es la presión parcial de cada componente?
b) ¿Cuál es la fracción en volumen de cada componente?
c) ¿Cuál es el número de moléculas/cm3 de cada gas?
10. Una mezcla de gases (A) contiene 85% mol de CH4; 10% de C2H6 y 5% de C2H4 y una mezcla (B) contiene
89% mol de C2H4 y 11% C2H6; y una tercera mezcla (C) contiene 94% mol de C 2H6 y 6% de CH4. ¿Qué
cantidad de (A), (B) y (C) deben mezclarse a fin de producir 100 moles de una mezcla que contenga
partes iguales de CH4, C2H4 y C2H6?
M.C. LUIS NIETO LEMUS TAREA 3: FISICOQUÍMICA FIQ-UMSNH
UNIVERSIDAD MICHOACANA DE SAN NICOLÁS DE HIDALGO
FACULTA DE INGENIERÍA QUÍMICA
FISICOQUÍMICA
11. Una mezcla de gas contiene 5% mol de butano y 95% mol de argón y se va a preparar permitiendo que
el butano gaseoso llene un cilindro evacuado a 1 atmósfera de presión. Posteriormente se pesa el
cilindro de 40.0 dm3. La masa molar del argón es 39.9 g/mol.
a) Calcule la masa de argón que da la composición deseada si la temperatura se mantiene a 25C.
b) Calcule la presión total de la mezcla final.
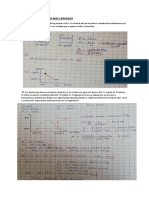
12. Un gas muestra la siguiente relación PV a temperatura constante:
P (atm) 1 20 40 60 80 100 120
V (L) 5 0.21 0.090 0.058 0.050 0.044 0.042
¿Es este un gas ideal? Explique y justifique su respuesta.
M.C. LUIS NIETO LEMUS TAREA 3: FISICOQUÍMICA FIQ-UMSNH
Vous aimerez peut-être aussi
- EJERCICIOS 02 Mezcla de Gases PDFDocument2 pagesEJERCICIOS 02 Mezcla de Gases PDFMaricielo CerroPas encore d'évaluation
- Tarea 4 Gases Reales Luis Nieto LemusDocument36 pagesTarea 4 Gases Reales Luis Nieto LemusJimena MoralesPas encore d'évaluation
- Momento1 Grupo 12Document25 pagesMomento1 Grupo 12TCOAndres15 xPas encore d'évaluation
- Evaluacion2 2018Document4 pagesEvaluacion2 2018Fidel Sanchez GallegosPas encore d'évaluation
- Genesis HernandezDocument8 pagesGenesis HernandezgenesisPas encore d'évaluation
- Informe Practica 3 AnaliticaDocument7 pagesInforme Practica 3 AnaliticaAnabel HernándezPas encore d'évaluation
- Grupo 2Document5 pagesGrupo 2Jhonatan choquePas encore d'évaluation
- Capitulo 4 FUNDAMENTOS DE QUÍMICA ANALÍTICA SKOOG - WESTDocument7 pagesCapitulo 4 FUNDAMENTOS DE QUÍMICA ANALÍTICA SKOOG - WESTJuana Estefania Lopez DumesPas encore d'évaluation
- Ejercicios de FisicoquímicaDocument1 pageEjercicios de FisicoquímicaLuce Dávila FernandezPas encore d'évaluation
- Trabajo Etapa 2 FinalDocument16 pagesTrabajo Etapa 2 FinalAngelo LopezPas encore d'évaluation
- Datos: M: 131g Xe, V 1,0dm 1,0L, R 0,0821 T 25°C+273 298°KDocument3 pagesDatos: M: 131g Xe, V 1,0dm 1,0L, R 0,0821 T 25°C+273 298°Kluis cardenasPas encore d'évaluation
- Presion VaporDocument17 pagesPresion VaporWilson Zelaya HerediaPas encore d'évaluation
- Ejercicios 4. Volumetria RespuestasDocument4 pagesEjercicios 4. Volumetria RespuestasJuan Esteban Gonzalez OrdoñezPas encore d'évaluation
- INCROPERA - Transferencia de CalorDocument23 pagesINCROPERA - Transferencia de CalorMiguel Montero Alonso100% (1)
- Problemas de Propiedades ColigativasDocument1 pageProblemas de Propiedades ColigativasRodolfo Alejandro Vazquez RamirezPas encore d'évaluation
- Universidad de Guadalajara: Centro Universitario de Ciencias Exactas E IngenieríasDocument6 pagesUniversidad de Guadalajara: Centro Universitario de Ciencias Exactas E IngenieríasEdith A CamposPas encore d'évaluation
- Informe Capacidad Calorific A de Un SolidoDocument13 pagesInforme Capacidad Calorific A de Un SolidoAngélica María Castañeda RivasPas encore d'évaluation
- Sintesis de TaurinaDocument2 pagesSintesis de TaurinaKevin MendezPas encore d'évaluation
- Intercambiador de CalorDocument8 pagesIntercambiador de CalorLizbeth Huayta CayroPas encore d'évaluation
- Problemas Sobre CalorímetrosDocument1 pageProblemas Sobre CalorímetrosAndres Valencia50% (2)
- Informe #2-Dterminaciòn de La Constante de Un Calorímetro - GonzalezDocument12 pagesInforme #2-Dterminaciòn de La Constante de Un Calorímetro - GonzalezalexandraPas encore d'évaluation
- Resumen Equipo 1Document6 pagesResumen Equipo 1Tano TGPas encore d'évaluation
- Ejercicios PropuestosDocument22 pagesEjercicios PropuestosAlexander Gutierrez ChirinosPas encore d'évaluation
- Taller 1Document10 pagesTaller 1Juan Camilo DicuePas encore d'évaluation
- Reporte P2 - Lab - TermodinamicaDocument15 pagesReporte P2 - Lab - TermodinamicaAnnel AquinoPas encore d'évaluation
- Tarea 23Document5 pagesTarea 23ODALYSPas encore d'évaluation
- 2.5 Cinética QuímicaDocument18 pages2.5 Cinética QuímicaCarlos Enrique Aguilar MazaPas encore d'évaluation
- Pauta Control 1BDocument8 pagesPauta Control 1BJuan SebastianPas encore d'évaluation
- Práctica2 - PRQ500 - 1PDocument1 pagePráctica2 - PRQ500 - 1PJuanPas encore d'évaluation
- Quimica Analitica #1Document13 pagesQuimica Analitica #1Jorge Angulo Gomez0% (1)
- YodoDocument14 pagesYodoJose Luis S Garcia100% (1)
- Tarea 3Document7 pagesTarea 3MIGUEL ANGEL HERRERA MARTINEZPas encore d'évaluation
- Deber1 2Document5 pagesDeber1 2STEEVEN ORDOÑEZPas encore d'évaluation
- YODOMETRIADocument17 pagesYODOMETRIASalazar Terrazas Nicole VivianaPas encore d'évaluation
- Problemas de GasesDocument2 pagesProblemas de GasesEDISON PALMAPas encore d'évaluation
- Informe 3 Calor IntegralDocument12 pagesInforme 3 Calor IntegralJose LuisPas encore d'évaluation
- BalanceDocument8 pagesBalanceAlex Pascual ToapantaPas encore d'évaluation
- UDocument2 pagesURandyPas encore d'évaluation
- Ejercicios Viscosidad de LíquidosDocument2 pagesEjercicios Viscosidad de LíquidosIncodecsa PerusacPas encore d'évaluation
- Comparación Del Contenido Ácido Láctico en La Carne de Res y La Carne de CerdoDocument13 pagesComparación Del Contenido Ácido Láctico en La Carne de Res y La Carne de CerdoCarlos PozoPas encore d'évaluation
- Evaluación 2 de Fisicoquímica-Grupo2Document5 pagesEvaluación 2 de Fisicoquímica-Grupo2Yanira Ruiz RiosPas encore d'évaluation
- Universidad de Guayaquil: Facultad de Ingeniería Química Carrera de Ingeniería QuímicaDocument4 pagesUniversidad de Guayaquil: Facultad de Ingeniería Química Carrera de Ingeniería QuímicaMarcos ParedesPas encore d'évaluation
- Guia de Soluciones ReguladorasDocument9 pagesGuia de Soluciones ReguladorasPaola Serena Galean AyardePas encore d'évaluation
- FQ - Aplicaciones de Beta y Kappa - MCBVDocument2 pagesFQ - Aplicaciones de Beta y Kappa - MCBVMARIA DEL CARMEN BARAJAS VALDIVIAPas encore d'évaluation
- Ilovepdf MergedDocument18 pagesIlovepdf MergedJulia BarrosPas encore d'évaluation
- Cuestionario de Intercambiadores de Tubo y CorazaDocument8 pagesCuestionario de Intercambiadores de Tubo y Corazacelesteperezcolin926Pas encore d'évaluation
- Tarea 1Document9 pagesTarea 1Goretti Uribe FloresPas encore d'évaluation
- Hoja de Seguridad: 2-Butanol MSDSDocument7 pagesHoja de Seguridad: 2-Butanol MSDSVictor AristizabalPas encore d'évaluation
- Ejercicios Diametro Molecular.Document6 pagesEjercicios Diametro Molecular.Nilton CesarPas encore d'évaluation
- Hexofuranosas de La Serie DDocument4 pagesHexofuranosas de La Serie DIsac Uc MooPas encore d'évaluation
- Cuestionario 1 FQIIDocument4 pagesCuestionario 1 FQIIBryan BautistaPas encore d'évaluation
- Laboratorio Analítica Práctica 9Document10 pagesLaboratorio Analítica Práctica 9Ethel DekkerPas encore d'évaluation
- PRACTICA 2 Determinacion de La Constante Adiabatica Del Aire PDFDocument14 pagesPRACTICA 2 Determinacion de La Constante Adiabatica Del Aire PDFNeil MontañoPas encore d'évaluation
- Problemario U2Document6 pagesProblemario U2JUAN GERARDO CIGARROA RENDONPas encore d'évaluation
- Cuestionario Práctica 2. Quimica Organica IIDocument2 pagesCuestionario Práctica 2. Quimica Organica IIKarla Alonso100% (1)
- Serie de Ejercicios - Orgánica 1Document4 pagesSerie de Ejercicios - Orgánica 1HuesoVázquezPas encore d'évaluation
- 9.6 El Formaldehído Puede Producirse en La Reacción Entre Metanol y OxígenoDocument1 page9.6 El Formaldehído Puede Producirse en La Reacción Entre Metanol y OxígenoAZALEA LARA GARCIAPas encore d'évaluation
- Taller de QuimicaDocument1 pageTaller de QuimicaSilvana Torres GallegosPas encore d'évaluation
- Ecuaciones Termodinamica Capitulo 2Document25 pagesEcuaciones Termodinamica Capitulo 2SaraMendoza100% (1)
- Gases IdealesDocument3 pagesGases IdealesJuan GarciaPas encore d'évaluation
- Extraccion de AceiteDocument20 pagesExtraccion de AceiteJose HuapayaPas encore d'évaluation
- Mecanica de Fractura BasicaDocument15 pagesMecanica de Fractura Basicazemog001100% (1)
- Mantenimiento Bombas CentrifugasDocument56 pagesMantenimiento Bombas CentrifugasGonzalo Vega CampillayPas encore d'évaluation
- Factores Influyen Radiac UVDocument4 pagesFactores Influyen Radiac UVCésar Morales100% (1)
- R-Ac-02-14 Registro Recepcion Granalla Pintura 2341-04 Afd4 1Document3 pagesR-Ac-02-14 Registro Recepcion Granalla Pintura 2341-04 Afd4 1Luis Enrique Aguilar MontoyaPas encore d'évaluation
- Organica 1 Cristalizacion SimpleDocument5 pagesOrganica 1 Cristalizacion SimpleJosé Luis FerrerPas encore d'évaluation
- Extracción de La MescalinaDocument6 pagesExtracción de La MescalinaBebeto Mou100% (4)
- Ejercicios Resueltos de Gases IdealesDocument5 pagesEjercicios Resueltos de Gases IdealesProf. diseñoPas encore d'évaluation
- Instalacion Medio FiltranteDocument6 pagesInstalacion Medio Filtranteazultenue78Pas encore d'évaluation
- PRACTICA No 1 REACCIONES QUIMICASDocument2 pagesPRACTICA No 1 REACCIONES QUIMICASDiana Carolina Burbano RuanoPas encore d'évaluation
- Reporte Metodo de Winkler ODDocument3 pagesReporte Metodo de Winkler ODAlejandra NuñezPas encore d'évaluation
- El Mecanismo de Leucemia Inducido Por BencenoDocument9 pagesEl Mecanismo de Leucemia Inducido Por BencenoMario César Bartra FloresPas encore d'évaluation
- Xenoinjertos y Sustitutos Oseos 1Document20 pagesXenoinjertos y Sustitutos Oseos 1Pam Ramirez75% (4)
- Marcelo Alonso, Edward Finn-Física. Vol. 3. Fundamentos Cuánticos y Estadísticos. 3 (1971)Document631 pagesMarcelo Alonso, Edward Finn-Física. Vol. 3. Fundamentos Cuánticos y Estadísticos. 3 (1971)Karencita Martínez100% (1)
- Sevilla Cruz Alfredo Salomón 3BM2 MC P7Document3 pagesSevilla Cruz Alfredo Salomón 3BM2 MC P7Alfredo SevillaPas encore d'évaluation
- Análisis de Una Sección "T" Con Falla Dúctil Determinación Básica y Cuantía MínimaDocument8 pagesAnálisis de Una Sección "T" Con Falla Dúctil Determinación Básica y Cuantía MínimaDavid Daniel Brener TicsePas encore d'évaluation
- Preinforme CromatografíaDocument5 pagesPreinforme CromatografíaIsabellaNoreñaPas encore d'évaluation
- Clase1-Tecnología de Los Tintes NaturalesDocument10 pagesClase1-Tecnología de Los Tintes NaturalestatianamelinaPas encore d'évaluation
- Velocidad de Detonación Del ANFODocument12 pagesVelocidad de Detonación Del ANFOeisaacmaxPas encore d'évaluation
- Avance 2 ProcesosDocument20 pagesAvance 2 ProcesosLuisMPortillaBenavidesPas encore d'évaluation
- Costes Platanera - Miguel Rguez - Coplaca 10feb2012Document13 pagesCostes Platanera - Miguel Rguez - Coplaca 10feb2012Teiste Delgado ArteagaPas encore d'évaluation
- Practica 2Document18 pagesPractica 2david gomezPas encore d'évaluation
- Control de Calidad 2Document30 pagesControl de Calidad 2Diana CevallosPas encore d'évaluation
- Recuperacion Secundaria Por Inyeccion de AguaDocument119 pagesRecuperacion Secundaria Por Inyeccion de AguaTiconaMamaniSusy100% (2)
- Dmitri MendeléyevDocument11 pagesDmitri MendeléyevSilvio CelinsPas encore d'évaluation
- Analisis DimensionalDocument16 pagesAnalisis DimensionalLuisa CastilloPas encore d'évaluation
- Pilotes de ConcretoDocument19 pagesPilotes de ConcretoSnowstormPas encore d'évaluation
- Se Le Llama Soldadura A La Unión de Dos MaterialesDocument17 pagesSe Le Llama Soldadura A La Unión de Dos Materialesbrainer canabalPas encore d'évaluation
- PetroquímicoDocument32 pagesPetroquímicoKarlos RoldanPas encore d'évaluation
- EjerciciosDocument2 pagesEjerciciosAnibal Enrique Rodríguez GonzalezPas encore d'évaluation