Académique Documents
Professionnel Documents
Culture Documents
Cálculos y Resultados
Transféré par
Anonymous 28dbyt0 évaluation0% ont trouvé ce document utile (0 vote)
9 vues5 pagescalculos de titulacion ptenciometrica
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentcalculos de titulacion ptenciometrica
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
9 vues5 pagesCálculos y Resultados
Transféré par
Anonymous 28dbytcalculos de titulacion ptenciometrica
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 5
Cálculos y resultados:
1. De 10 mL de H3PO4 0.1M
Primero hallamos la concentración de 10mL del ácido fosfórico 0.1M
disueltos en 110 mL de agua
[ ]𝐼𝑛𝑖𝑐. ∗ 𝑉𝑖𝑛𝑖𝑐. 0.09 𝑀 ∗ 10 𝑚𝐿
[]= = = 0.0082 𝑀
𝑉𝑡𝑜𝑡𝑎𝑙 110 𝑚𝐿
Luego en el punto inicial procedemos a hallar la concentración de iones H+
de acuerdo a su pH
[H+]=10-pH=10-2.3=4.7863*10-3
Con esto hallaremos la primera constante de acidez del ácido fosfórico.
𝐻3𝑃𝑂4 ⟷ 𝐻2𝑃𝑂4− + 𝐻+
Inicio 0.0091 M 0 0
Final 0.0091-10-2.3 10-2.3 10-2.3
K1=[𝐻2𝑃𝑂4−][𝐻+]/[𝐻3𝑃𝑂4]
K1=0.007924067 M
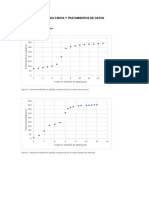
Procedemos a hallar el primer y segundo punto equivalente mediante el
método de las tangentes.
Trazamos una recta entre el primer y segundo punto equivalente para hallar
el punto semiequivalente.
Con este punto semiequivalente de acuerdo a la teoría hallamos la segunda
constante de acidez de la siguiente forma.
K2= [H+]=10-pH=10-7.14=7.24436*10-8 M
Procedemos a encontrar los puntos A y B y sus respectivos volúmenes para
el proceso del cálculo de la tercera constante de acidez, hallando
inicialmente [OH]1
VA=8.625 mL
VB=17 mL
MNaOH =0.09283 M
[OH]1= (VB - VA)*MNaOH/(Vinicio+VB) = 0.012426063M
Usando el pH en B hallamos su pOH para poder hallar le concentración
[OH]2.
pOH=14-pH=14-11.97=2.03
[OH]2=10-2.03=0.009332543
Usando ambos datos hallamos la cantidad de iones OH consumidos en la
conversión de HPO4- a PO4- y con el pH hallamos la concentración de iones
H+.
[ PO4-]=[OH]1-[OH]2=0.00309352M
[H+]=1.07152*10-12
Con estos datos hallamos la tercera constante de acidez.
[ HPO4-]=0.0082-0.00309352=0.00510648 M
K3=[𝑃𝑂4−][𝐻+]/[H𝑃𝑂4-]
K3= 6.51449*10-13 M
Con los datos obtenidos de la constante de acidez experimentales
procedemos a compararlos con los las constantes de la literatura hallando su
porcentaje de error.
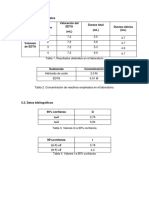
Teórica Experimental % Error
K1 0.007924067 M 0.0075 M 5.654231077
K2 7.24436*10-8 M 0.000000062 M 16.84450969
K3 6.51449*10-13 M 4.2*10-13 M 55.10688232
2. De 10 mL de una mezcla 50/50 en volumen de HCl 0.1M y H3PO4 0.1M
Primero hallamos la concentración de 10mL del ácido fosfórico 0.05M
disueltos en 110 mL de agua
[ ]𝐼𝑛𝑖𝑐. ∗ 𝑉𝑖𝑛𝑖𝑐. 0.045 𝑀 ∗ 10 𝑚𝐿
[]= = = 0.00409 𝑀
𝑉𝑡𝑜𝑡𝑎𝑙 2 ∗ 110 𝑚𝐿
Luego en el punto inicial procedemos a hallar la concentración de iones H+
de acuerdo a su pH
[H+]=10-pH=10-2.2=6.30957*10-3
Con esto hallaremos la primera constante de acidez del ácido fosfórico,
tomando en cuenta que el único cambio es que ahora inicialmente el ácido
fuerte HCl disocia completamente teniendo una concentración inicial de H+.
𝐻3𝑃𝑂4 ⟷ 𝐻2𝑃𝑂4− + 𝐻+
Inicio 0.0041 M 0 0.005
Final 0.0086-10-2.2 10-2.2-0.005 10-2.2
K1=[𝐻2𝑃𝑂4−][𝐻+]/[𝐻3𝑃𝑂4]
K1= 0.006016368 M
Procedemos a hallar el primer y segundo punto equivalente mediante el
método de las tangentes.
Trazamos una recta entre el primer y segundo punto equivalente para hallar
el punto semiequivalente.
Con este punto semiequivalente de acuerdo a la teoría hallamos la segunda
constante de acidez de la siguiente forma.
K2= [H+]=10-pH=10-7.14=7.24436*10-8 M
Procedemos a encontrar los puntos A y B y sus respectivos volúmenes para
el proceso del cálculo de la tercera constante de acidez, hallando
inicialmente [OH]1
VA=15.8 mL
VB=17.2 mL
MNaOH =0.09283 M
[OH]1= (VB - VA)*MNaOH/(Vinicio+VB) = 0.001021714 M
Usando el pH en B hallamos su pOH para poder hallar le concentración
[OH]2.
pOH=14-pH=14-10.97=3.03
[OH]2=10-3.03= 0.000933254 M
Usando ambos datos hallamos la cantidad de iones OH consumidos en la
conversión de HPO4- a PO4- y con el pH hallamos la concentración de iones
H+.
[ PO4-]=[OH]1-[OH]2= 8.84595*10-5M
[H+]= 1.07152*10-11 M
Con estos datos hallamos la tercera constante de acidez.
[ HPO4-]=0.0041-8.84595*10-5=0.0040115405 M
K3=[𝑃𝑂4−][𝐻+]/[H𝑃𝑂4-]
K3= 2.3682*10-13 M
Con los datos obtenidos de la constante de acidez experimentales
procedemos a compararlos con los las constantes de la literatura hallando su
porcentaje de error.
Teórica Experimental % Error
K1 0.006016368 M 0.0075 M 19.78176207
K2 7.24436*10-8 M 0.000000062 M 16.84450969
-13 -13
K3 2.3682*10 M 4.2*10 M 43.61423227
Vous aimerez peut-être aussi
- Diagramas de Flujo Orga.2.Informe.3 Avanzando 3Document7 pagesDiagramas de Flujo Orga.2.Informe.3 Avanzando 3Anonymous 28dbytPas encore d'évaluation
- Preparacion Del Anarajando II Falta Rendimiento DudaDocument5 pagesPreparacion Del Anarajando II Falta Rendimiento DudaAnonymous 28dbytPas encore d'évaluation
- Preparacion Del Anarajando II AvanzandoDocument4 pagesPreparacion Del Anarajando II AvanzandoAnonymous 28dbytPas encore d'évaluation
- Informe Determiancion de Hierro Por Dicromatometria TERMINADODocument16 pagesInforme Determiancion de Hierro Por Dicromatometria TERMINADOAnonymous 28dbyt100% (1)
- Discusion de Resultados Jabon FinishDocument4 pagesDiscusion de Resultados Jabon FinishAnonymous 28dbytPas encore d'évaluation
- Acido CitricoDocument4 pagesAcido CitricoAnonymous 28dbytPas encore d'évaluation
- Experimentos de Feeling, Shiff, Oxidacion de Aldehidos y CetonasDocument7 pagesExperimentos de Feeling, Shiff, Oxidacion de Aldehidos y CetonasAnonymous 28dbytPas encore d'évaluation
- Aea 123 FinishDocument8 pagesAea 123 FinishAnonymous 28dbytPas encore d'évaluation
- Aplicación Industrial y RecomendacionesDocument3 pagesAplicación Industrial y RecomendacionesAnonymous 28dbytPas encore d'évaluation
- Informe de Aldehidos y Cetonas II Terminado FinishDocument19 pagesInforme de Aldehidos y Cetonas II Terminado FinishAnonymous 28dbytPas encore d'évaluation
- Laboratorio de Aldehidos y Cetonas TerminadoDocument20 pagesLaboratorio de Aldehidos y Cetonas TerminadoAnonymous 28dbytPas encore d'évaluation
- DIAGRAMA DE FLUJO Y Discusion de Resultados Jabon FinishDocument5 pagesDIAGRAMA DE FLUJO Y Discusion de Resultados Jabon FinishAnonymous 28dbytPas encore d'évaluation
- Calculos y Resultados Valoracion PotenciometricaDocument15 pagesCalculos y Resultados Valoracion PotenciometricaAnonymous 28dbytPas encore d'évaluation
- Determinacion Del Oxido de Calcio en El Carbonato de Sodio Finish AeaDocument6 pagesDeterminacion Del Oxido de Calcio en El Carbonato de Sodio Finish AeaAnonymous 28dbytPas encore d'évaluation
- Determinación de La Dureza Del AguaDocument9 pagesDeterminación de La Dureza Del AguaAnonymous 28dbytPas encore d'évaluation
- Calculos de Resultados Del Informe de HalurosDocument6 pagesCalculos de Resultados Del Informe de HalurosAnonymous 28dbytPas encore d'évaluation
- Discusion de Resultados Jabon FinishDocument4 pagesDiscusion de Resultados Jabon FinishAnonymous 28dbytPas encore d'évaluation
- Espectroscopia IR y UV de compuestos químicosDocument10 pagesEspectroscopia IR y UV de compuestos químicosAnonymous 28dbytPas encore d'évaluation
- Labo 5Document11 pagesLabo 5Anonymous 28dbytPas encore d'évaluation
- Determinacion Del Oxido de Calcio en El Carbonato de Sodio Finish AeaDocument6 pagesDeterminacion Del Oxido de Calcio en El Carbonato de Sodio Finish AeaAnonymous 28dbytPas encore d'évaluation
- Experimentos de Feeling, Shiff, Oxidacion de Aldehidos y CetonasDocument7 pagesExperimentos de Feeling, Shiff, Oxidacion de Aldehidos y CetonasAnonymous 28dbytPas encore d'évaluation
- Laboratorio de Aldehidos y Cetonas TerminadoDocument20 pagesLaboratorio de Aldehidos y Cetonas TerminadoAnonymous 28dbytPas encore d'évaluation
- Labo 5Document11 pagesLabo 5Anonymous 28dbytPas encore d'évaluation
- Determinación de constantes de acididad de H3PO4Document20 pagesDeterminación de constantes de acididad de H3PO4Anonymous 28dbytPas encore d'évaluation
- Laboratorio Organica II Final 2.0Document13 pagesLaboratorio Organica II Final 2.0Anonymous 28dbytPas encore d'évaluation
- Calculos de Resultados Del Informe de HalurosDocument6 pagesCalculos de Resultados Del Informe de HalurosAnonymous 28dbytPas encore d'évaluation
- Informe 3 de Analisis Quimico Terminado FINISH FinishDocument15 pagesInforme 3 de Analisis Quimico Terminado FINISH FinishAnonymous 28dbytPas encore d'évaluation
- Informe 3 de Analisis Quimico Terminado FINISH FinishDocument15 pagesInforme 3 de Analisis Quimico Terminado FINISH FinishAnonymous 28dbytPas encore d'évaluation
- RESULTADOS Y TRATAMIENTOS de DATOS y Discusion Terminado Que Corriga Enoc Sus CalculosDocument6 pagesRESULTADOS Y TRATAMIENTOS de DATOS y Discusion Terminado Que Corriga Enoc Sus CalculosAnonymous 28dbytPas encore d'évaluation
- Cuadro Comparativo Karen Torres SocarrasDocument3 pagesCuadro Comparativo Karen Torres Socarraseverto gomezPas encore d'évaluation
- Arte Mesopotamia-EgiptoDocument17 pagesArte Mesopotamia-Egiptocancinogabriel07Pas encore d'évaluation
- Lectura Marco Teorico Metodologico Variables OperacionalizacionDocument12 pagesLectura Marco Teorico Metodologico Variables OperacionalizacionJesús Dionisio Huarcaya JesúsPas encore d'évaluation
- Fundamentos Fisiologicos PDFDocument3 pagesFundamentos Fisiologicos PDFEddimar DiazPas encore d'évaluation
- Ilceariadnaog Interaccionmedicamento Act1Document7 pagesIlceariadnaog Interaccionmedicamento Act1Ilse Ariadna Ordoñez GarciaPas encore d'évaluation
- Tertulia Dialógica Literaria - 3ro - C-DDocument9 pagesTertulia Dialógica Literaria - 3ro - C-Dkaorydurand28Pas encore d'évaluation
- 7.-TP y TTPaDocument11 pages7.-TP y TTPakorkotoPas encore d'évaluation
- Alexander Daniloff Lenormand Oracle PDF 2.en - Es TRADUCIDODocument8 pagesAlexander Daniloff Lenormand Oracle PDF 2.en - Es TRADUCIDOBlas RamirezPas encore d'évaluation
- La Paz y El HonorDocument2 pagesLa Paz y El HonorEduardo B. M. AllegriPas encore d'évaluation
- Caso SiriDocument4 pagesCaso Siriflor_c_sur100% (1)
- Planeacion1erbl3ero Formacion Civica y Etica 11 12Document12 pagesPlaneacion1erbl3ero Formacion Civica y Etica 11 12Alejandra PérezPas encore d'évaluation
- ISOTools Keynote 2 Lean Six Sigma Raul Molteni GGDocument41 pagesISOTools Keynote 2 Lean Six Sigma Raul Molteni GGAnonymous I29NP3cPas encore d'évaluation
- Hampshire Down: Luis Fernando Rodriguez Lopez Juan Aníbal AndinoDocument8 pagesHampshire Down: Luis Fernando Rodriguez Lopez Juan Aníbal AndinoJuanPas encore d'évaluation
- Introducción a la Sociología de la Salud - Primer cuatrimestre 2022Document206 pagesIntroducción a la Sociología de la Salud - Primer cuatrimestre 2022Andrea QuagliaroliPas encore d'évaluation
- Trabajo Final Oym - HialpesaDocument37 pagesTrabajo Final Oym - HialpesaBeatriz LatorrePas encore d'évaluation
- Introducción: Ble, Ecología y Multiculturalidad, Fue Posible Publicar Las Memorias Del Evento. No Se LoDocument18 pagesIntroducción: Ble, Ecología y Multiculturalidad, Fue Posible Publicar Las Memorias Del Evento. No Se LoBlithz Yorgen Lozada PereiraPas encore d'évaluation
- Fuerza sobre superficies sumergidas: estudio experimentalDocument4 pagesFuerza sobre superficies sumergidas: estudio experimentalkenneth100% (1)
- Estudios de MercadosDocument9 pagesEstudios de MercadosJonatha BenitezPas encore d'évaluation
- Examen PuerperioDocument4 pagesExamen PuerperioPatricia ZegarraPas encore d'évaluation
- Filosofia - y - Cultura - Inst 1 PDFDocument30 pagesFilosofia - y - Cultura - Inst 1 PDFjharnoldPas encore d'évaluation
- Modelo Educativo San MarcosDocument18 pagesModelo Educativo San MarcosAstrid Falla BarbozaPas encore d'évaluation
- Música medieval examen parcialDocument5 pagesMúsica medieval examen parcialSteven MartePas encore d'évaluation
- Edificio TerminalDocument78 pagesEdificio TerminalMauricio GarciaPas encore d'évaluation
- Tema - 1 - Protosumeria - Albert MazaDocument9 pagesTema - 1 - Protosumeria - Albert Mazaangelin82Pas encore d'évaluation
- Brucelosis y TriquinosisDocument8 pagesBrucelosis y TriquinosisFelipe Ignacio Alveal VásquezPas encore d'évaluation
- Antropología Forense: Identificación de restos humanos y perfiles biológicosDocument28 pagesAntropología Forense: Identificación de restos humanos y perfiles biológicosCarlos ChatoPas encore d'évaluation
- Charla para PadresDocument21 pagesCharla para PadresSucreCandoPas encore d'évaluation
- Acercamiento A Los Modelos de La EADocument17 pagesAcercamiento A Los Modelos de La EAJosé Luis Roque PPas encore d'évaluation
- Investigación de La Desviación de Resultados MicrobiológicosDocument39 pagesInvestigación de La Desviación de Resultados MicrobiológicosSolutam MoralePas encore d'évaluation