Académique Documents
Professionnel Documents
Culture Documents
MODULO 2 Periodoncia
Transféré par
Freddy Edwin QuezadaDescription originale:
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
MODULO 2 Periodoncia
Transféré par
Freddy Edwin QuezadaDroits d'auteur :
Formats disponibles
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 1
MODULO 2. PERIODONCIA
Anatomía del periodonto
El periodonto se compone de los tejidos que rodean el diente en el proceso alveolar maxilar y
mandibular. La única porción visible es el epitelio gingival. Cuando está sana, esta área de la encía
es normalmente rosa.
Partes del periodonto
La encía se distingue de la mucosa de la cara vestibular de los dientes superiores y los dientes de
la mandíbula por una línea mucogingival o unión. En las zonas donde hay contacto entre los
dientes adyacentes, la encía tiene un perfil típico de un punto triangular en la zona interproximal.
En algunos diagramas del diente y el hueso circundante, se puede discernir una capa delgada de
tejido mineralizado conocido como cemento. Las fibras del ligamento periodontal se insertan en
el cemento en el diente y en el hueso alveolar en el lado opuesto. Por lo tanto, podemos decir
que el ligamento periodontal es el principal mecanismo de anclaje del diente al hueso alveolar.
El espacio en este ligamento también proporciona nutrientes a la superficie del hueso alveolar a
través del suministro de sangre. Sus estructuras circundantes también proporcionan funciones
regenerativas y sensoriales.
El suministro de sangre para el periodonto proviene de las arterias alveolares inferiores y
superiores. Algunas ramas de la fuente de la sangre van directamente al ligamento periodontal y
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 2
al hueso alveolar. Otras ramas se extienden a lo largo de la superficie del hueso. Si se requiere
una intervención quirúrgica en la encía, la extensa circulación colateral puede ayudar a su
dentista en la clínica para realizar dichos tratamientos dentales sin comprometer su suministro
de sangre.
La inserción periodontal y los tejidos de soporte comienzan en las primeras etapas del desarrollo
de los dientes, generalmente entre la cuarta y quinta semana de gestación. El tejido conjuntivo
gingival de la corona a la zona de ligamento periodontal se llama el área reticular del tejido
conjuntivo gingival.
Esta área comparte algunas características estructurales con el ligamento periodontal. Se
compone de una red de diferentes fibras de colágeno. Estas fibras tienen distintas orientaciones
que salen desde la cresta alveolar en la encía, desde la superficie del diente y a través del periostio
bucal.
Algunas fibras también siguen un patrón circular alrededor del diente, así como a través de la
cresta alveolar y en la superficie de la raíz del diente adyacente.
El periodonto comprende los siguientes tejidos:
1) La encía.
2) El ligamento periodontal.
3) El cemento radicular.
4) El hueso alveolar.
El hueso alveolar consta de componentes, el hueso alveolar propiamente dicho y la apófisis
alveolar. El hueso alveolar propiamente dicho, también denominado "hueso fasciculado" se
continúa con la apófisis alveolar y forma la placa de hueso que revisté el alvéolo dental. La función
principal del periodonto consiste en unir el diente al tejido óseo de los maxilares y en mantener
la integridad en la superficie de la mucosa masticatoria de la cavidad oral.
Encía
Anatomía macroscópica
La mucosa bucal se continúa con la piel de los labios y con las mucosas del paladar blando y de la
faringe. La mucosa bucal consta de:
1) la mucosa masticatoria que incluye la encía y el recubrimiento del paladar duro.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 3
2) La mucosa especializada que cubre la cara dorsal de la lengua.
3) la parte restante denominada mucosa de revestimiento.
La encía es la parte de la mucosa masticatoria que recubre la apófisis alveolar y rodea la porción
cervical de los dientes. Está compuesta de una capa epitelial y un tejido conectivo subyacente
denominado lamina propia. La encía adquiere su forma y textura definitivas con la erupción de
los dientes.
En sentido coronario, la encía de color rosado coralino termina en el margen gingival libre, que
tiene contorno festoneado. En sentido apical, la encía se continúa con la mucosa alveolar laxa y
de color rojo oscuro, de la cual está separada por una línea demarcadora por lo general
fácilmente reconocible llamada unión mucogingival o línea mucogingival.
No existe una línea mucogingival en el lado palatino, pues el paladar duro y la apófisis alveolar
del maxilar superior están revestidos por el mismo tipo de mucosa masticatoria.
Se pueden distinguir dos partes de la encía:
- La encía libre.
- La encía adherida.
La encía libre es de color rosado coralino, con superficie opaca y consistencia firme. Comprende
el tejido gingival en las caras vestibular y lingual/palatina de los dientes y la encía interdental o
papilas interdentales. En las caras vestibular y lingual de los dientes, la encía libre se extiende
desde el margen gingival en sentido apical, hasta el surco gingival, ubicado al nivel
correspondiente al de la conexión cemento adamantina. La encía adherida está delimitada en
sentido apical por la conexión mucogingival.
El margen gingival libre a menudo es redondeado, de modo que se forma una pequeña
invaginación o surco entre el diente y la encía. Cuando se inserta más apicalmente una sonda
periodontal en esta invaginación, hacia la unión cemento adamantino, el tejido gingival es
separado del diente y se abre artificialmente una "bolsa gingival" o " surco gingival”. Por lo tanto,
en la encía normal o clínicamente sana no existe "bolsa gingival" o "surco gingival", sino que la
encía se halla en estrecho contacto con la superficie adamantina.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 4
La forma de la encía interdental (Ia papila interdental) está determinada por la relación de
contacto entre los dientes, el ancho de las superficies dentarias proximales y el delineado de la
unión cementoadamantina. En las regiones anteriores de la dentadura la papila interdental tiene
forma piramidal, mientras que en la región de los molares las papilas son más aplanadas en
sentido vestibulolingual. A causa de la presencia de las papilas interdentales, el margen gingival
libre sigue un curso festoneado, más o menos acentuado, a lo largo de los dientes. En las regiones
de premolares, /molares de la dentadura, los dientes tienen superficies de contacto proximal, en
lugar de puntos de contacto. Como la papila interdental está configurada según el contorno de
las superficies de contacto interdental se establece una concavidad, llamada col.
Por consiguiente, en estas áreas las papilas interdentales tienen a menudo una porción vestibular
y una porción lingual/palatina separadas por la región del col, que está cubierta por un epitelio
delgado no queratinizado. Éste posee muchas características en común con el epitelio de unión.
La encía adherida está delimitada en sentido coronal por el surco gingival o, cuando no está
presente ese surco, por un plano horizontal situado a nivel de la unión cemenloadamantina. En
exámenes clínicos se observó que el surco gingival solo está presente en 30-40% de los adultos.
El surco gingival a menudo es más pronunciado en la cara vestibular de los dientes y se observa
con mayor frecuencia en las regiones de los molares inferiores y de los premolares superiores. La
encía adherida se extiende en sentido apical hasta la unión mucogingival, desde donde se
continúa con la mucosa alveolar. La encía adherida es de textura firme, de color rosado coralino
y a veces presenta pequeñas depresiones en su superficie. Las depresiones, denominadas
"punteado", le dan aspecto de cáscara de naranja. Está adherida firmemente al hueso alveolar
subyacente y al cemento por fibras del tejido conectivo y por esa razón es comparativamente
inmóvil en relación con el tejido subyacente. Por otra parte, la mucosa alveolar, de color más
oscuro y situado hacia apical de la unión mucogingival, está vinculada laxamente al hueso
subyacente. Por consiguiente, a diferencia de la encía adherida, la mucosa alveolar es movible
en relación con el tejido subyacente.
Anatomía microscópica
Epitelio bucal
La encía libre comprende todas las estructuras epiteliales y del tejido conectivo situadas hacia
coronal de una línea horizontal trazada a nivel de la unión cementoadamantina. EI epitelio que
recubre la encía libre puede ser diferenciado en la siguiente forma:
• Epitelio bucal: que apunta a la cavidad bucal.
• Epitelio del surco: que enfrenta al diente sin contactar con la superficie del esmalte.
• Epitelio de unión: que provee el contacto entre la encía y el diente.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 5
El aparato dentogingival está formado por el epitelio del surco, por el epitelio de la unión y por
el tejido gingival.
1. Epitelio del surco.
Se llama surco gingival a una pequeña depresión que hay entre el diente y la encía y que debe
medir entre 0,15 y 3 mm. Cualquier tamaño mayor se considera patológico y se le llama bolsa
periodontal. El epitelio que reviste el surco es un ep. plano estratificado sin capa córnea y está
formado por varias capas de células que se caracterizan por tener escaso citoplasma y por dejar
espacios intercelulares entre ellas. A través de esos espacios intercelulares se filtra hacia el surco
agua y sustancias procedentes del filtrado celular. Entre esa sustancia puede haber aa., hidratos de
carbono, células e incluso bacterias. Ese liquido tiene una función de lavado del surco pero si hay
una mala higiene bucal la acumulación del líquido puede contribuir a la formación de caries y a la
inflamación del periodonto.
2. Epitelio de la unión.
Se extiende desde la parte superior del surco gingival hasta la unión cemento-esmalte formando
como un collar alrededor del diente. Es un ep. plano estratificado sin queratinizar. En su parte
superior está formado por 5 ó 6 capas de células, mientras que en su parte inferior sólo hay 2 ó 3
capas.
Estas c. epiteliales tienen mayor cantidad de citoplasma y organelas, también se unen dejando
espacios intercelulares a través de los cuales también se filtran sustancias y c. al surco gingival.
Este epitelio se caracteriza por una alta velocidad de regeneración a partir de su estrato basal, por
lo que es frecuente ver c. descamadas en el surco gingival.
3. Tej. conjuntivo gingival.
Formado por células, fibras y sustancia fundamental:
- Células. Son principalmente fibroblastos (que sintetizan las fibras y la sustancia fundamental).
Además hay en el tej. conjuntivo c. como neutrófilos y linfocitos, y mastocitos o c. cebadas.
También hay algún macrófago y c. mesenquimáticas indiferenc.
- Fibras. Son colágenas y elásticas.
+ Colágenas. Son las más abundantes y su cantidad y disposición es distinta según estén debajo
del epitelio de la unión o debajo de la encía. Bajo el epitelio de la unión son escasas y no forman
haces, mientras que debajo del epitelio de la encía son abundantes y se disponen formando haces
o grupos. Esos haces reciben distintos nombres:
-Grupo dentogingival . Haces de fibras (hdf) que van desde el cemento hasta la lámina propia o
corion de la encía, tanto libre como adherida.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 6
-Grupo dentoperióstico. Formado por hdf que van desde el cemento al hueso alveolar.
-Grupo alveologingival. Formado por hdf que van desde la cresta alveolar a la lámina propia de la
encía.
-Grupo . Formado por hdf que forman una banda alrededor del cuello del diente.
-Fibras o ligamento trapseptales o transeptales. Fibras que unen las coronas con la cresta alveolar
del diente adyacente.
-Sustancia fundamental; contiene: agua, glucoproteinas y glucosaminoglicanos.
Vascularización
La sangre arterial llega a la encía por medio de ramas arteriales que llegan de tres lugares:
1. Procedentes de los vasos del periostio que rodea el hueso alveolar para llegar a la encía.
2. Procedentes de las arterias dentarias que atraviesan el huso alveolar para llegar a la encía.
3. Procedentes del ligamento periodontal.
La inervación de la encía tiene lugar por fibras nerviosas que proceden de los nervios lingual,
palatino y bucal. Estas terminaciones se extienden por el tejido conjuntivo y llegan hasta la lámina
basal del epitelio.
Cambios con la edad
Con la edad existe una pérdida progresiva de los tejidos de sostén del diente. En el momento de la
erupción dentaria, el epitelio de la unión (eU) se extiende sobre la unión cemento-esmalte, que es
su posición normal.
Al aumentar la edad hay una migración apical del eU sobre el cemento, que puede quedar expuesto
a la cavidad bucal. La recesión o migración gingival tiene bastantes implicaciones clínicas: si el
cemento queda expuesto a la cavidad bucal se puede destruir con el cepillo de dientes y dejar la
dentina al aire. Además, el cemento expuesto a la cavidad bucal ocasiona decoloración y aparición
de caries en la raíz.
La recesión gingival produce una alargamiento de la corona y movilidad en los dientes.
Ligamento Periodontal
El ligamento periodontal es el tejido blando altamente vascularizado y celular que rodea a las
raíces de los dientes y conecta el cemento radicular con la pared del alvéolo. En sentido coronal,
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 7
el ligamento periodontal se continúa con la lámina propia de la encía y está delimitado respecto
de ella por los haces de fibras colágenas que conectan la cresta ósea alveolar con la raíz (las fibras
de la cresta alveolar).
El ligamento se ubica en el espacio situado entre las raíces dentales y la lámina dura o hueso
alveolar fasciculado. El hueso alveolar rodea al diente hasta un nivel situado a aproximadamente
1 mm hacia apical de la conexión cementoadamantina. El borde coronal del hueso se denomina
cresta alveolar.
El espesor del ligamento periodontal es de alrededor de 0,25 mm, la presencia de un ligamento
periodontal permite que las fuerzas generadas durante la función masticatoria y otros contactos
dentarios seas distribuidas en la apófisis alveolar y absorbidas por esta, mediante el hueso
alveolar fasciculado. El ligamento periodontal también es esencial para la movilidad de los
dientes.
El diente está conectado con el hueso mediante haces de fibras colágenas que pueden ser
clasificadas en los siguientes grupos:
1. fibras crestoalveolares.
2. fibras horizontales.
3. Fibras oblicuas.
4. Fibras apicales.
El ligamento periodontal y el tejido cemento radicular se desarrollan a partir del tejido conectivo
laxo (el saco dentario) que rodea al germen dental.
Cemento radicular
El cemento es un tejido mineralizado especializado que recubre las superficies radiculares y en
ocasiones, pequeñas porciones de la corona de los dientes. Posee muchas características en
común con tejido óseo. Sin embargo, el cemento no contiene vasos sanguíneos ni linfáticos,
carece de inervación, no experimenta remodelado o resorción fisiológica y se caracteriza porque
se deposita durante toda la vida. Al igual que otros tejidos mineralizados, contiene fibras
colágenas incluidas en una matriz orgánica. El contenido mineral del cemento, principalmente
hidroxiapatita, es del 65% en peso es decir un poco mayor que el del hueso (60%). El cemento
cumple diferentes funciones. En él se insertan las fibras del ligamento periodontal y contribuye
en el proceso de reparación cuando Ia superficie radicular ha sido dañada.
Se describieron diferentes formas de cemento:
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 8
• Cemento acelular con fibras extrínsecas. Se encuentra en las porciones coronal y media
de la raíz y contiene principalmente haces de fibras de Sharpey. Este tipo de cemento es
una parte importante del aparato de inserción que conecta el diente con el hueso
alveolar fasciculado.
• Cemento celular mixto estratificado que se sitúa en el tercio apical de las raíces y en las
furcaciones. Contiene fibras extrínsecas ó intrínsecas y cementocitos.
• Cemento celular con fibras intrínsecas. Se encuentra sobre todo en lagunas de resorción
y contiene fibras intrínsecas y cementocitos.
Hueso alveolar
La apófisis alveolar se define como la parte de los maxilares superior e inferior que forma y
sostiene los alvéolos de los dientes. La apófisis alveolar está compuesta de hueso que se forma
tanto por células del folículo dental (saco dentario), el hueso alveolar fasciculado, como por
células que son independientes del desarrollo dentario. Junto con el cemento radicular y el
ligamento periodontal, el hueso alveolar constituye el aparato de inserción del diente, cuya
función principal consiste en distribuir y absorber las fuerzas generadas por la masticación y otros
contactos dentarios.
El hueso que recubre las superficies radiculares es mucho más grueso en la cara palatina que en
la cara vestibular del maxilar. Las paredes de los alvéolos están revestidas por hueso cortical y el
área entre los alvéolos y las paredes de hueso compacto del maxilar está ocupada por hueso
esponjoso. Este ocupa la mayor parte de los tabiques interdentales, pero solo una porción
relativamente pequeña de las tablas óseas vestibular y palatina. El hueso esponjoso contiene
trabéculas oseas cuya arquitectura y dimensiones están determinadas en parte genéticamente y
en parte como resultado de las fuerzas a las cuales están expuestos los dientes durante su
función.
Espacio biológico
Concepto de espacio Biológico
Es el espacio que ocupa el epitelio de unión y las fibras de la inserción conectiva. No se incluye el
surco gingival.
Fue definido por Gargiulo A.W., Went F. y Orban B. en 1961. Realizaron un estudio en cadáveres
humanos y observaron que las dimensiones que existían desde la altura de la cresta alveolar
hasta la base del surco gingival eran constantes.
La anchura media del epitelio de unión era 0,97 mm.
La anchura media de la inserción conectiva era 1´07 mm.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 9
La dimensión total del espacio biológico es de 2,04 mm. Ésta es una medida de referencia
estándar pues existen variabilidades interindividuales y entre dientes de una misma arcada. Es el
mínimo espacio que debemos respetar para no producir la invasión del espacio biológico.
Podemos calcular la dimensión exacta del espacio biológico sondando hasta la cresta alveolar
(bajo anestesia) y a esa medida le restamos la profundidad del surco gingival.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 10
Relación con la preparación protésica
CONSIDERACIONES PERIODONTALES EN EL DISEÑO DE P.P.R.
Si el paciente parcialmente edéntulo presenta un periodonto saludable, si las alteraciones
periodontales han sido exitosamente tratadas y se ha establecido un pronóstico favorable, el
diseño de la P.P.R. debe ser realizado de manera tal que no se altere éste estado de salud.
(Jerbi, 1992). En tal sentido De Van referido por Thayer y Kratochvil (1980) y Jacobson
(1988), establece que el objetivo del tratamiento protésico debe ser la conservación constante
de lo remanente, más que la restauración meticulosas de lo perdido, esta afirmación deberá
ser el concepto básico de todo tratamiento protésico.
El protesista debe proteger y conservar los tejidos remanentes de la cavidad bucal y mejorar
la función del aparato masticatorio a través de una restauración funcional, cómoda y de
aspecto agradable.
En P.P.R., las fuerzas mecánicas o las tensiones transferidas a los dientes pilares deben
analizarse para determinar la influencia sobre los principios de diseño; cuando la inflamación
inducida por placa está ausente, las tensiones solo pueden llevar a síntomas como hiperemia
del diente o movilidad debido al aumento del ancho del ligamento periodontal; las tensiones
por si solas no inician la enfermedad periodontal, sin embargo, pueden acelerar el progreso
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 11
de la enfermedad periodontal cuando la inflamación inducida por placa esta presente.
(Jacobson, 1988).
El uso de algún tipo de prótesis con frecuencia se asocia con alteraciones de las estructuras
dentales y periodontales remanentes. A través del tiempo se han realizado muchos estudios
para determinar el efecto de la P.P.R. sobre las estructuras bucales especialmente el
periodonto y los dientes remanentes, utilizando como patrón de comparación estructuras
dentarias no relacionadas con la prótesis. Los resultados de estos estudios son contradictorios,
las primeras investigaciones reportan un incremento de la ocurrencia de caries y enfermedad
periodontal relacionado con el uso de P.P.R., algunos establecen una enfermedad periodontal
moderada en relación a la P.P.R. y otros reportan que prácticamente no existen caries o
progresión de la enfermedad periodontal después de la instalación de P.P.R. (Yusof e Isa,
1994).
Los resultados poco favorables de los primeros estudios, se relacionan con el hecho de que
durante la década de los sesenta se realizaron muchas investigaciones para evaluar los
efectos a largo plazo del uso de P.P.R., pero dichas prótesis no eran construidas de acuerdo
a los principios comúnmente enseñados en las escuelas de odontología de los Estados Unidos,
en algunos casos no se realizaba una preparación bucal previa a la colocación de la prótesis,
algunas dentaduras no tenían conectores rígidos o eran diseñadas sin descansos oclusales.
En la actualidad se han realizado muchas investigaciones para evaluar el estado periodontal
en relación al uso de P.P.R., la mayoría de estos a largo plazo; los parámetros utilizados
comúnmente en dicha evaluación son: la higiene bucal, inflamación gingival, la profundidad
de surco gingival, la movilidad dentaria y la pérdida de hueso alveolar. (Chandler y col.,1984).
En un estudio realizado en la Facultad de Odontología de la U.C.V. se evaluó el efecto del uso
de P.P.R. sobre la placa dental y la salud gingival, en casos clase I de Kennedy inferior, en los
cuales los pacientes eran sometidos a programas de higiene bucal controlado; se evidencio
que un buen programa de higiene bucal agregado a la cooperación y motivación del paciente,
son determinantes para mantener un bajo nivel de placa e inflamación gingival. (Angulo,
1983).
Chandler y Brudvick (1984), estudian un grupo de pacientes que portaban P.P.R. desde hace
8 o 9 años, para evaluar la higiene bucal, inflamación gingival, la profundidad de surco
gingival, la movilidad dentaria y la perdida de hueso alveolar; se evidencio que los cambios
en la profundidad de surco gingival y niveles de placa no son estadísticamente significativos
en los grupos que usaban o no P.P.R. y entre los dientes cubiertos o no por la dentadura; en
cuanto a la movilidad dental, no se observaron cambios significativos en los grupos que usan
o no P.P.R., pero si hubo un descenso de la movilidad en los dientes que no eran pilares; los
cambios en el hueso alveolar entre los dos grupos no son significativos y las pequeñas
alteraciones observadas se atribuyen a errores en la técnica de medición utilizada; la
inflamación gingival es mayor en las zonas cubiertas por la P.P.R. , esto se debe
probablemente a la deficiente higiene oral por parte del paciente. Se evidencio que la
enfermedad periodontal no avanza rápidamente debido a que todos los pacientes estudiados
recibieron una terapia periodontal completa previo a la colocación de la P.P.R.
Bergman (1987), estudia los factores etiológicos de la enfermedad periodontal en pacientes
portadores de P.P.R. y analizan básicamente tres factores: 1º la placa y la higiene bucal; 2º
cobertura del tejido periodontal por alguna parte de la P.P.R.; 3º la fuerza oclusal transmitida
a los dientes remanentes y su tejido periodontal. En cuanto al control de placa y la higiene
bucal, concluye que la inserción de la P.P.R. crea un cambio potencial cuantitativo y cualitativo
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 12
en la placa formada en los dientes remanentes, con el consecuente aumento de riesgo de
desarrollar gingivitis y periodontitis; establece que si la cobertura del tejido gingival por la
P.P.R. es inevitable, un ligero alivio debe ser realizado y regularmente debe ser controlado
para prevenir daño periodontal; las fuerzas transmitidas a los dientes pilares y sus tejidos de
soporte no parecen causar directamente daño periodontal; no existen evidencias
experimentales que muestren que las fuerzas transmitidas al diente pilar por la P.P.R. puede
iniciar, agravar o causar un incremento en la movilidad. Estudios clínicos longitudinales han
demostrado que si un diente tiene un buen soporte periodontal, si se establece un control de
placa y la prótesis es chequeada regularmente, dichas fuerzas no inducen cambios
periodontales.
En el trabajo de Bergman y Ericson (1989), se evidencia que no existe un deterioro
significativo de los tejidos periodontales en pacientes portadores de P.P.R. Los parámetros
registrados son: higiene oral, inflamación gingival, profundidad de surco gingival y movilidad
dental, aproximadamente 92% de las P.P.R. son prótesis a extensión distal bilateral. En este
estudio los pacientes son avisados para acudir a chequeos regulares después de cada año de
instalada la P.P.R., de un total de 34 pacientes, solo 14 asisten regularmente al chequeo; los
resultados, en los 14 pacientes que se examinaron regularmente, son similares a los de un
estudio realizado 10 años antes, esto confirma la conclusión previa donde se establece que
un cuidadoso plan de tratamiento y adecuados chequeos de la higiene bucal y de la dentadura,
con citas control regulares, resulta en poco o ningún daño a los tejidos periodontales por parte
de la P.P.R.
En otro estudio donde se evaluó separadamente en el maxilar superior e inferior la
probabilidad de aumentar los sacos periodontales asociados al uso de P.P.R., se evidenció que
los sacos periodontales son más frecuentes en el maxilar superior y que el uso de P.P.R.
incrementa significativamente la probabilidad de tener sacos periodontales de 4 mm o más,
tanto en el maxilar superior como inferior.
Esto indica que el uso de la P.P.R. puede ser una amenaza para los tejidos periodontales, por
tanto el odontólogo debe tener la precaución de controlar periódicamente los pacientes
portadores de P.P.R. (Tuominen y col, 1989).
También se ha comparado el estado periodontal en pacientes tratados con prótesis fijas y
P.P.R. En tal sentido Isidor, (1991), realizó un estudio donde evaluó la condición periodontal
en pacientes adultos después de 5 años de tratamiento con prótesis fijas a extensión distal o
P.P.R. a extensión distal.
Observó que los pacientes tratados con P.P.R. muestran mayor índice de placa y de
inflamación gingival que los pacientes tratados con prótesis fijas; no se evidenciaron cambios
en la profundidad de sacos periodontales en los dos grupos, y solo una pequeña alteración de
la altura de hueso alveolar es revelada. Concluye que solo cambios menores en la condición
periodontal ocurren durante 5 años de observación después del tratamiento con prótesis fija
o P.P.R. a extensión distal, un factor determinante en estos resultados es el hecho de que
todos los pacientes estaban sometidos a control de placa, dos veces al año, realizado por el
profesional.
En tal sentido Yusof e Isa (1994), concluyen que el uso de P.P.R. es perjudicial a la salud
periodontal en pacientes cuya higiene oral no es la adecuada. En éste caso el estudio consistió
en determinar el estado periodontal de los dientes en contacto con la P.P.R. y compararlo con
otros dientes del arco opuesto, no relacionado con algún tipo de prótesis, se evidencio que el
uso de P.P.R. resulta en mayor índice de placa, inflamación gingival y pérdida de la adherencia
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 13
cuando es comparado con el control (Tabla Nº 1 y 2 ); estos parámetros son más marcadas
a medida que aumenta el tiempo que se ha utilizado la prótesis, en cuanto a la movilidad
dental no se encontraron cambios significativos. El completo control de la placa supragingival
probablemente no es una meta factible para muchos pacientes; la presencia de algún grado
de placa es aun compatible con la salud de algunos individuos, pero la presencia de la P.P.R.
no solo incrementa la retención de placa, cuantitativamente, si no que el medio oral puede
ser también cambiado, reforzándose el crecimiento de la placa y el cambio de la flora. Este
cambio ecológico puede causar un sobrecrecimiento de la flora asociada con alteraciones
periodontales.
Tabla Nº 1: Distribución de los grupos de dientes en contacto con la dentadura, dientes
control y dientes pilares según el índice de inflamación gingival (Loe y Silness).
Tomado de: Yusof e Isa (1994).
Tabla Nº 2: Distribución de los grupos de dientes en contacto con la dentadura, dientes
control, y dientes pilares según el grado de pérdida de adherencia.
Tomado de: Yusof e Isa (1994).
Recientemente en el reporte de 25 años de estudio longitudinal en pacientes portadores de
P.P.R., Bergman y cols.,1995, evidenciaron que el índice de placa y el índice de inflamación,
no es significativamente diferente entre los dientes pilares y no pilares de la prótesis (Tabla
Nº 3); en lo referente a la profundidad de surco el 93,2% de los sacos son de 3 mm o menos;
la movilidad dental no muestra cambios significativos (Tabla Nº 4); el nivel de hueso alveolar
es analizado radiográficamente y no muestra cambios en la altura de hueso marginal. Esta
condición biológica favorable en pacientes portadores de P.P.R., en combinación con la
satisfacción y comodidad del paciente, refuerza la conclusión establecida en el estudio de
Brergman y Ericson (1989), por lo que la P.P.R. es un valioso procedimiento terapéutico para
pacientes con reducido número de dientes remanentes. (Bergman y col, 1995).
Tabla Nº 3: Indice de Placa e Inflamación Gingival (Loe & Silness 1963), en el total de
dientes y dientes pilares, de 18 pacientes después de 25 años de tratamiento con P.P.R.
(1969-1994)
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 14
X: promedio; M: mediana; R: rango. Tomado de: Bergman y col., 1995.
Tabla Nº 4: Movilidad dental del total de dientes y dientes pilares de 18 pacientes tratados
con P.P.R. examinados en 1969 y en 1994.
X: promedio; R: rango. Tomado de Bergman y col, 1995.
Bassi y col, (1996). realizan un estudio en pacientes portadores de P.P.R. para comparar la
condición clínica de los dientes pilares y no pilares de la prótesis, tomando como parámetro
la presencia de placa y calculo, presencia de caries, movilidad y sangramiento; evidenciaron
que la mayoría de los pacientes no son capaces de mantener una higiene oral satisfactoria,
en el grupo de pacientes con una higiene oral deficiente la condición clínica de los dientes
pilares es peor que en los dientes no pilares , en el grupo de pacientes con una higiene oral
optima la condición de los dientes pilares y no pilares es casi idéntica (Tabla Nº 5 y 6). El
hecho de que en el grupo de pacientes con higiene oral deficiente los dientes pilares estan en
peor condición que los dientes no pilares se debe posiblemente a que la acción de las tensiones
puede potenciar efecto negativo de la placa.
Tabla Nº 5: Distribución porcentual de dientes pilares y no pilares con caries, de 57
pacientes tratados con P.P.R. según el grado de higiene bucal.
Tomado de: Bassi y col, 1996.
Tabla Nº 6: Distribución porcentual de dientes pilares y no pilares de 57 pacientes
portadores de P.P.R. según la higiene bucal y el estado gingingival (Loe, 1967).
Tomado de: Yusof e Isa (1994).
Los principios de diseño de la P.P.R. deben incorporar rasgos que minimicen la tendencia a la
acumulación de placa y aumentar el potencial del paciente para mantener los niveles de
higiene oral. Los enfoques tradicionales del diseño de las P.P.R. han enfatizado una
distribución máxima de las fuerzas sobre los dientes remanentes, tales diseños incorporan
muchos componentes que resultan en una cobertura no deseable de los tejidos duros y
blandos. Aunque debe ponerse atención al control de las tensiones dirigidas hacia las
estructuras de soporte, la prioridad debe ser a los factores que contribuyen a la inflamación.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 15
Los diseños que controlan tensiones deben aplicarse dentro de un contexto que minimice la
tendencia a la acumulación de placa. (Jacobson, 1988).
Alteraciones periodontales
Prevención de alteraciones periodontales
Las medidas de prevención periodontal irán encaminadas a la eliminación de la placa bacteriana
o sarro, principal agente responsable de la periodontitis.
La herramienta más eficaz es el cepillo dental. Los cepillos suaves son más eficaces que los duros
para eliminar la placa. Sin embargo, lo más importante no es el tipo de cepillo sino la forma de
utilizarlo. Han sido desarrolladas varias técnicas para el cepillado dental aunque es recomendable
la instrucción guiada por un dentista en, por lo menos, una ocasión.
La capacidad que tiene un cepillo de dientes para eliminar la placa se reduce, notablemente,
cuando las cerdas del cepillo se abren. Por este motivo, los cepillos de dientes deben
reemplazarse al primer signo de desgaste.
Los cepillos eléctricos no representan ningún beneficio respecto a los convencionales. Pueden
estar indicados en personas con problemas de habilidad manual, como pacientes con artritis,
parálisis, etc...
El uso de hilo o seda dental por lo menos una vez al día disminuye el aumento de placa dental en
espacios interdentales donde el cepillo no llega.
La utilización de cepillos interdentales y los aparatos que irrigan agua a presión pueden
suplementar las técnicas de higiene. Aunque estos irrigadores no remueven la placa, pueden, sin
embargo, eliminar los restos de comida favorecedores de formación de placa.
El último pilar, y no por ello menos importante en la prevención, son las visitas periódicas al
dentista para vigilar la salud de nuestras encías. El odontólogo determinará si son necesarias y
con qué periodicidad las higienes orales o tartrectomías. Esta medida evitará la aparición de la
periodontitis completando así su profilaxis.
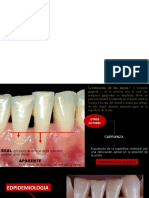
¿Qué son las enfermedades periodontales?
Hay muchos tipos de enfermedades de las encías, las más comunes son la gingivitis y la
periodontitis. Todas tiene en común la destrucción progresiva de los tejidos que deben soportar
los dientes.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 16
La gingivitis, es la inflamación superficial de las encías causada por irritantes de las bacterias
presentes en la boca (placa dental o bacteriana), y es común en todas las edades, incluyendo en
escolares.
La periodontitis, que normalmente se denomina "piorrea" (en griego "flujo de pus"), incluye la
inflamación crónica y destrucción del hueso que soporta los dientes. También, las fibras
gingivales y el ligamento periodontal son destruidos y el borde de las encías se desprende de los
dientes, formando lo que se llama una bolsa periodontal en la cual puede aparecer pus. La bolsa
periodontal se agranda si el hueso es destruido más severamente y, en consecuencia, los dientes
"se aflojan". Al avanzar la enfermedad los dientes se pueden mover aún más y es frecuente que
se forme un absceso e incluso que se caigan.
¿Cuáles son los síntomas de las enfermedades periodontales?
Las encías que sangran con frecuencia, lo que se conoce como el famoso "cepillo rosado", es la
señal más común que indica que uno padece enfermedades de las encías. Desafortunadamente
muchas personas aceptan la situación como normal, debido a que el desarrollo de la enfermedad
es lento y que las encías sangrantes causan poco dolor.
Hay muchos casos de enfermedades periodontales en donde, sin embargo, las encías no sangran.
Por esta razón quizás no se presta atención a la enfermedad hasta que está en una fase avanzada
y entonces el tratamiento requerido para su curación será largo.
Otros síntomas:
• si uno o más dientes "se aflojan"
• si se están desplazando o separando
• la encía puede mostrar recesión, exponiendo la raíz del diente
• se puede desarrollar un absceso doloroso debido a que el pus que se forma dentro de la
bolsa no tiene salida
Estas señales, sin embargo, no aparecen hasta que la enfermedad alcanza un estado avanzado.
Por este motivo las personas adultas deben preguntar al dentista si alguna de las señales que
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 17
presentan las enfermedades de las encías están presentes y, en su caso, solicitar un examen
periodontal.
¿Cuáles son las causas de las enfermedades periodontales?
La causa más común es la placa bacteriana. Está formada por una capa pegajosa, casi invisible,
que se acumula sobre la superficie de los dientes cada día. La placa proviene de la saliva, de los
restos de comida, del fluido que sale del borde de la encía y de varios tipos de bacterias y sus
productos. Con frecuencia la placa bacteriana se endurece (calcifica) convirtiéndose en tártaro
(lo que los dentistas llaman cálculo).
La placa es más abundante cerca de los bordes de la encía y entre los dientes. En las personas
que no mantienen una buena higiene bucal, la mayoría de las superficies dentales están cubiertas
por una capa bacteriana. Casi todos los adultos y niños tienen placa y cálculo. La placa se
compone en su mayoría de bacterias, sales minerales y agua. En el proceso de su formación en
capas, el cálculo se recubre sucesivamente con placa y con bacterias ocasionando la inflamación
de la encía como consecuencia de la acción bacteriana y de las defensas del cuerpo para
combatirla.
Factores que influyen en la enfermedad son: Predisposición hereditaria, falta de equilibrio
hormonal, por ejemplo, diabetes, embarazo y funcionamiento defectuoso del tiroides.
Dichos factores pueden empeorar la condición gingival por interferir con el sistema inmuno-
defensivo del cuerpo.
¿Cómo se pueden prevenir las enfermedades periodontales?
Es muy importante saber cómo limpiarse los dientes con la máxima eficacia. El verdadero peligro
lo representa la invisible acumulación de bacterias que crecen sobre y alrededor de los dientes,
o sea, la placa. Afortunadamente la placa bacteriana se puede ver aplicando unas pastillas
colorantes en la boca. Dichas pastillas tiñen la placa, no dejando ninguna duda sobre su presencia
y posición.
El dentista y la higienista dental deben establecer un programa de higiene bucal para cada
individuo. Tal programa debe incluir instrucción sobre cómo cepillarse de un modo apropiado
para no perjudicar ni a los dientes ni a las encías. El uso de la seda o cinta dental es la forma más
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 18
adecuada para eliminar la placa bacteriana de entre los dientes que es un lugar difícil de alcanzar.
Son en estos lugares donde se forman más comúnmente las bolsas periodontales. Por tal motivo,
y para evitar su formación, merece la pena dominar la técnica de usar la seda dental aunque sea
necesario emplear más tiempo en la higiene bucal.
El uso del cepillo interdental y los aparatos que irrigan agua a presión pueden suplementar las
técnicas de higiene en áreas que son difíciles de alcanzar con otros métodos. Aunque estos
irrigadores no remueven la placa, pueden, sin embargo, remover los restos de comida que
pueden favorecer la formación de placa.
La higiene bucal diaria puede reducir a un mínimo la formación de la placa bacteriana y cálculo.
Por medio de la higiene bucal no se puede eliminar el cálculo ya formado y adherido al diente
que aparece en los bordes o por debajo de la encía. Sólo un dentista o una higienista pueden
remover el cálculo. Dicha técnica se llama raspaje y se realiza con instrumentos especiales.
Diagnóstico de alteraciones periodontales
El dentista o el periodoncista están capacitados para juzgar el color y la forma de las encías, para
determinar la presencia de dientes flojos, y para utilizar instrumentos pequeños que se
introducen cuidadosamente debajo de las encías para conocer la profundidad de las bolsas
periodontales. A esta clase de examen se le llama sondeo periodontal y tiene que formar parte
de todo examen dental.
Las radiografías son necesarias para detectar, en caso de hayan ocurrido, lugares con pérdida de
hueso.
DIAGNÓSTICO PERIODONTAL
Como el concepto del cuidado periodontal ha ido cambiando con el creciente conocimiento de
la historia natural de las enfermedades periodontales, la Sociedad Española de Periodoncia y
Osteointegración (SEPA), basándose en las propuestas de la Sociedad Británica de Periodoncia,
ha propuesto una guía clínica de detección de pacientes con enfermedades periodontales
(gingivitis y periodontitis). El objetivo es el de ayudar en la práctica de la Periodoncia dentro de
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 19
la práctica general odontológica. Se hace especial énfasis en la evaluación periodontal minuciosa
como un requisito esencial en la planificación y ejecución de todo cuidado dental.
EXAMEN PERIODONTAL BÁSICO (EPB)
El EPB divide la dentición completa en sextantes. Los seis sextantes incluyen, por un lado, cuatro
grupos de dientes con los dientes molares (excluyendo el tercer molar) y premolares de cada lado
en cada maxilar (sextante 1 y 6 en el lado derecho y sextantes 3 y 4 en el lado izquierdo), y por
otro lado, dos grupos de dientes con los caninos e incisivos de cada maxilar (sextantes 2 y 5). Se
examinan todos los dientes de cada sextante. El resultado se introduce en un gráfico como este:
1 2 3
6 5 4
Los códigos y su significado se explican en el gráfico adjunto.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 20
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 21
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 22
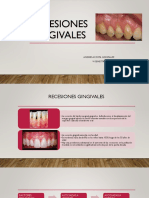
PRONÓSTICO DE LAS RECESIONES GINGIVALES
De acuerdo a Hall (1977) podemos diferenciar entre factores predisponentes, que serían aquellos
condicionantes anatómicos que influirían sobre la posición y estabilidad del margen gingival; y
factores desencadenantes o determinantes, que incidirían directamente en los anteriores
provocando la recesión gingival (tabla l).
La clasificación de las recesiones gingivales que actualmente se considera más válida es la de
Miller que, en 1985, las clasificaba desde un punto de vista clínico en cuatro clases (tabla 2). Esta
clasificación la realizaba atendiendo a la situación del margen más apical de la recesión respecto
a la línea mucogingival y a la cantidad de tejido perdido (encía y hueso) en las zonas
interproximales adyacentes a la recesión. Al mismo tiempo, pronosticaba el éxito terapéutico de
cada clase, considerando un recubrimiento total en las clase I y II, un recubrimiento parcial de la
raíz expuesta en las clases III y en la clase IV consideraba que no se podía realizar recubrimiento
radicular, pero sí aumentar la banda de encía queratinizada.
Miller (1985) define recubrimiento radicular completo, después de la cicatrización total de la
zona, cuando se consigue situar el margen gingival a nivel de la línea amelocementaria, el surco
gingival tiene una profundidad de sondaje inferior a los dos milímetros y no hay sangrado al
sondaje. Algunos autores proclaman que esta cobertura radicular puede ser alcanzada bien de
forma primaria (Miller 1985), o bien de forma secundaria como describía Goldman en 1964 como
"creeping attachment" al referirse a la migración que sufría el margen gingival en sentido coronal
en los meses posteriores a la cicatrización. Migración que se puede producir incluso hasta los
nueve meses posteriores a la cirugía (Harris 1997).
INDICACIONES
A lo largo de las últimas décadas se ha discutido sobre la necesidad o no de una mínima banda
de encía insertada en torno a los dientes para mantener su salud periodontal y sobre cuantos
milímetros serían necesarios. Así, diversos autores como Corn y cols. en 1962, Lang y Löe en 1972
0 Maynard y Wilson en 1979 realizaban distintos apuntes basándose en sus observaciones
clínicas.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 23
Factores predisponentes: Factores
desencadenantes
Banda de encía Traumatismo por
adherida estrecha. cepillado
Frenillos de inserción Gingivitis y enfermedad
aberrante. periodontal
Malposiciones dentarias Tratamiento ortodóncico
Disarmonías Iatrogenia.
dentoesqueléticas.
Fenestraciones y
dehiscencias alveolares
Tabla I. Factores asociados con la etiología de las recesiones gingivales.
Sin embargo, Dorfman y cols. en 1982 afirmaron que era posible mantener los niveles de
inserción de los injertos gingivales libres incluso en ausencia de encía adherida siempre que se
mantuviese un adecuado control de placa.
Por otro lado, en 1983, Wenströn y Lindhe realizaban un estudio histológico experimental en
perros en donde estudiaban la relación de la cantidad de encía adherida con el grado de
inflamación gingival. Estos autores no encontraban diferencias en el volumen del infiltrado
inflamatorio entre zonas con bandas anchas o estrechas de encía adherida, simplemente eran
más visibles clínicamente debido a un menor grosor de los tejidos gingivales en las zonas con
banda estrecha de encía adherida.
Posteriores estudios clínicos longitudinales como los de Kennedy y cols. (1985), Schoo y Van der
Velden y cols. (1985), Salkin y cols. (1987), Wennströn y cols. (1987), Freedman y cols. (1992),
confirmaban que no es necesario una cantidad mínima de encía adherida para conservar la salud
periodontal, siendo en la actualidad más correcto indicarlo como encía adherida adecuada o
inadecuada.
En la primera Reunión Europea de Periodoncia (1993) se acordaron las siguientes indicaciones de
cirugía mucogingival:
• Motivaciones estéticas
• Aquellas situaciones en las cuales al paciente le resulte difícil mantener un adecuado
control de placa en la zona de la recesión y que se pueda mejorar modificando el
contorno del margen gingival.
• Previo a tratamiento ortodóncico, en dientes con una encía vestibular fina, cuando se
prevé que como consecuencia del movimiento del diente se pueda provocar una
dehiscencia ósea.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 24
Clase I Recesión gingival que no llega a la línea mucogingival sin pérdida interproximal
de teiidos duros o blandos.
Clase 2 Recesión gingival que llega o sobrepasa la línea mucogingival sin pérdida de
teiidos duros o blandos interproximales.
Clase 3 Recesión gingival que se extiende o sobrepasa la línea mucogingival con pérdida de
soporte interproximal apical a la línea amelocementaria pero coronal a la extensión
más apical de la recesión o con malposición dentaria.
Clase IV Recesión gingival que se extiende o sobrepasa la línea mucogingival con pérdida de
soporte interproximal que se extiende hasta el nivel más epical de la recesión.
Control de los factores causales de la recesión gingival. El primer paso del tratamiento en un
paciente periodontal es controlar la inflamación de la enfermedad (remoción de placa bacteriana
y cálculo).
Recesión gingival inducida por trauma
La recesión de origen traumático se produce por un mecanismo patógeno, causando una
abrasión gingival, uno de los motivos suele estar causado por el Trauma por cepillado,
relacionado con este tipo de lesiones por la fuerza que se ejerce, comienza con forma de abrasión
en la capa epitelial, haciendo una reacción inflamatoria entre el tejido conectivo y epitelio
externo, llegando a formarse ulceras y recesiones gingivales.
Recesión gingival de origen bacteriano
Se forma por la acumulación de la placa, siendo el tejido es fino se verá afectada por el proceso
el margen gingival pierde soporte y migra apicalmente, este mecanismos patógeno se llama
“centrífugo” ya que actúa del interior al exterior, formando una bolsa periodontal con pérdida
de inserción.
Control de los factores causales de la recesión de las encías
Es de vital importancia modificar los hábitos incorrectos o insuficientes de higiene oral:
Los pacientes deben usar un cepillo intermedio para reducir el trauma a los tejidos. Esta
completamente contraindicado por el dentista de Propdental que el paciente use un cepillo muy
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 25
duro o realice una técnica de cepillado agresivo. Por ello se recomienda la técnica de Bass
modificada para el cepillado de los dientes.
Tanto el cepillo manual como los cepillos interdentales deben ser usados con suavidad y
cuidado para no causar trauma a los tejidos.
Es útil el uso de reveladores de placa bacteriana en la clínica para motivar a los pacientes sobre
la efectividad en las técnicas de cepillado.
Se recomienda el uso de dentífricos poco abrasivos o sin abrasivos. En algunos pacientes la
mejor solución a veces es eliminar el uso de dentífricos, sustituyéndolos por un gel de flúor, de
gran utilidad por su baja cantidad de abrasivos y alto potencial de remineralización, aumentando
así la resistencia a las erosiones.
Es importante dar instrucciones sobre una adecuada técnica de uso del hilo dental (poca fuerza
y presión lateral del hilo contra las superficies de los dientes).
A veces es necesario modificar la dieta del paciente ó diagnosticar otras enfermedades
gástricas o psiquiátricas (bulimia, anorexia).
La ortodoncia puede mejorar el estado del periodonto. El tejido blando y el hueso se mueven
junto con el diente durante el movimiento ortodóntico, siempre que haya una ausencia de
inflamación. En algunos casos puede eliminar la necesidad de realizar cirugía.
Si al paciente se le diagnostica bruxismo, es necesario iniciar un tratamiento para reducir el
estrés oclusal con férulas de descarga. Las fuerzas de mordida excesivas deben eliminarse con
ajustes oclusales, lo cual puede reducir la movilidad de los dientes y en algunos casos incluso
revertir la recesión de la encía.
Es importante para el Periodoncista registrar y documentar las recesiones , el grosor de encía y
el sondaje para poder reconocer cambios positivos o negativos en la exposición de la raíz. Nos
valemos de registros en modelos, fotografías, radiografías y valoración de la oclusión para
determinar la presencia de parafunciones, frémitus o movilidad de los dientes.
Tratamiento de recesiones y defectos mucogingivales mediante injertos de tejido conjuntivo
en piezas dentarias e implantes
INTRODUCCION
Las recesiones gingivales vestibulares son un hallazgo frecuente en la consulta diaria tanto en
pacientes con un control de placa correcto como incorrecto.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 26
Hoy día el motivo de consulta estético ha aumentado notablemente por lo cual este tipo de
terapeútica se ha impuesto en vuestros planes de tratamiento.
Las recesiones gingivales se definen como “ denudaciones parciales de una raíz debidas a la
migración apical del margen gingival”, por lo cual arrastra consigo pérdida de inserción
periodontal.
La etiología de las mismas se puede dividir en factores predisponentes y desencadenantes.
Los primeros representan a los factores anatómicos que condicionan la posición y estabilidad del
margen gingival (encía adherida estrechas, frenillos de inserción alta o baja, mal posiciones
dentarias, disarmonías dento esqueléticas, fenestraciones, dehiscencias óseas, biotipos finos).
Es sobre estos factores que actuarán los factores desencadenantes como ser inflamación gingival,
traumatismo por cepillado, movimientos ortodóncicos de riesgo e yatrogenia.
La población noruega , con buena higiene, presentaba recesiones en el 60% de los individuos de
20 años, a los 50 años más del 90% de la población presentaba recesiones.
En Sri Lanka, en una población con poca higiene dental el 30% de la población presentaba
recesiones antes de los 20 años y a los 40 años el 100% de la población presentaba recesiones.
Basándose en estos datos Loe y cols concluyeron que las recesiones gingivales son
multifactoriales.
Otro estudio realizado en una población sueca concluyó:
- Las recesiones gingivales son un hallazgo frecuente
- La proporción de sujetos con recesiones se incrementa con la edad
- Presentan diferentes patrones según la edad
- La pérdida interproximal esta relacionada a la presencia de recesión vestibular (4).
Las terapeúticas encaminadas a su resolución han variado a lo largo de la historia, desde los
conceptos de “cirugía mucogingival” de Friedman en la década de los 50 (5), luego el concepto
de “ cirugía plástica periodontal “ de Miller en la década de los 80 (6), y actualmente definimos
estos tratamientos como “ el conjunto de procedimientos de cirugía plástica destinados a
corregir defectos en la morfología, posición y-o cantidad de encía en torno a los dientes”(7).
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 27
Las indicaciones de su tratamiento son:
Estética
Mejorar el control de placa microbiana, en casos que este actuando como retenedor.
Previo movimiento de ortodóncia, en movimientos que comprometan el márgen gingival.
Se considera éxito de tratamiento de recesión gingival si luego de la cicatrización de vuestro
tratamiento quirúrgico:
el márgen gingival se sitúa a nivel de la línea amelocementaria.
Surco gingival con profundidad menor a 2mm.
Ausencia de sangrado al sondaje.
Estos resultados los podemos lograr a expensas de una cobertura primaria, dentro del primer
mes. Está la posibilidad de lograrlos a través de cobertura secundaria a expensas de la inserción
reptante, que sería dentro de los 6 a 9 meses postoperatorios. Siempre nos referimos a
recesiones clase 1 o 2 de Miller las cuales son posibles de tratar con éxito.
OPCIONES TERAPEÚTICAS.
1- COLGAJOS PEDICULADOS.
Dentro de estas técnicas podemos describir:
1- Colgajos rotados
2- Colgajos desplazados coronalmente.
Fue en el año 1956 que Grupe y Warren describieron el colgajo de reposición lateral (10), en 1926
Norberg describe el colgajo desplazado coronal, luego Allen y Miller en 1989 describen una
técnica de espesor parcial con acondicionamiento químico radicular en recesiones clase 1 de
Miller, logrando coberturas de hasta 84%.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 28
Wilderman y Wetz a través de estudios en perros describen que luego de 3 meses de realizar
estas técnicas se pierde 50% de la cobertura inicial.
Se observó que se obtenía epitelio de unión largo y hacia apical nueva inserción.
2- INJERTOS DE TEJIDO BLANDO.
En 1993 Miller, P los clasificó en: totales, epitelio conectivos o parciales únicamente conectivos.
Los primeros no tienen como objetivo cubrir la recesión con fines estéticos pero si se han usado
para evitar la progresión de la recesión con resultados satisfatorios.
De todas formas se obtienen coberturas totales con su utilización.
Estudios histológicos afirman la formación de nueva inserción, incluso nuevo hueso tras la
utilización de injertos epitelializados.
Los injertos subepiteliales o conectivos tienen su fundamento en los estudios de Karring, T que
demostró en estudios animales que las características del tejido epitelial no las define la
adaptación funcional sino la información genética del conectivo subyacente.
La técnica de Langer y Langer es una técnica destinada a cubrir recesiones gingivales donde se
describe el injerto conectivo subepitelial. Basicamente consiste en la realización de un colgajo de
espesor parcial en la zona de la recesión con descargas verticales, raspado y alisado de la raíz,
colocación del injerto, reposición del colgajo y sutura.
Luego Bruno, J hace una modificación evitando las descargas verticales, trata con tetraciclina la
raíz y el injerto incluía periostio.
Perez, A a través de un periostótomo o cureta crea un bolsillo de espesor parcial que rodea la
recesión y allí coloca un injerto conectivo. Recordamos que este autor español describió esta
técnica previamente a Langer y Langer.
Allen, A nos describe la técnica de bolsillo supraperiótico para múltiples recesiones contiguas
obteniendo una cobertura promedio de 84% .
Nelson, P nos describe una modificación de Langer, es un colgajo doble papila de espesor total
debajo del cual colocamos el injerto conectivo. Harris, R a su vez modificó esta técnica doble
papila preparando la raíz quimicamente con tetraciclina.
Tinti, C describe una técnica donde evita la toma palatina utilizando el conectivo de las papilas
adyacente para lo cual las mismas deben tener un volumen suficiente .
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 29
Bouchard, P documenta que si nosotros en la técnica clásica de Langer cubrimos totalmente con
el colgajo el injerto logramos mejores resultados estéticos. Si queremos lograr una mayor encía
insertada es aconsejable reposicionar el colgajo en su posición original.
Si evaluamos a los injertos conectivos concluímos que tienen ventajas notorias:
• Mejor resultado estético.
• Doble aporte vascular, por un lado perióstico y por otro conectivo del colgajo.
• Menor molestia para el paciente, suturando el área palatina y no dejando área
cruenta.
3- TÉCNICAS DE REGENERACIÓN TISULAR GUIADA.
Se han documentado técnicas de regeneración tisular guiada, especialmente de la escuela
italiana, con resultados que no superan a los injertos subepiteliales especialmente en casos de
biotipos finos.
Por otro lado algunos estudios encontraron que a través de RTG se gana más inserción clínica
que con la utilización de injertos pero con estos se gana más encía insertada.
El costo, manejo clínico y sus resultados han limitado estas técnicas.
4-US0 DE EMDOGAIN.
El uso de este producto de origen porcino (amelogenina porcina) en regeneración periodontal y
tratamiento de recesiones gingivales es prometedor.
Su uso combinado con injerto de tejido conectivo mostró formación de cemento y hueso, no se
observó formación de epitelio de unión largo .
Estudios que comparan el injerto conectivo con el colgajo desplazado coronal adicionándole
emdogain demuestran que el primero logra mayor ganancia de encía insertada , en cuanto a la
cobertura radicular se obtienen resultados similares ( 95%) . Hay estudios que indican mayor
cobertura al año con el injerto de conectivo.
La ventaja del colgajo desplazado coronal – emdogain es lo fácil de la técnica, el mejor
postoperatorio y la velocidad de cicatrización.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 30
Al comparar el colgajo desplazado coronal con o sin emdogain se observan mayores ventajas en
cuanto a cobertura radicular con la adición del producto.
5-USO DE ALLODERM.
El Alloderm o matriz dérmica acelular obtenida de humano cadavérico es un material que en
periodoncia se está usando en cirugía mucogingival.
Estudios que comparan este material con el injerto conectivo demostraron similares resultados
en cuanto a cobertura radicular y mayor ganancia de encía insertada con el último.
Mahn, D describe una técnica quirúrgica en túnel con el uso de Alloderm con la cual obtiene
resultados interesantes.
Harris, R se refiere a él como estético, predecible y estable en el tiempo, tomando como
parámetro 18 meses.
Se han realizado estudios que comparan el colgajo desplazado coronal con o sin Alloderm
obteniendo resultados más positivos en cuanto a cobertura radicular y ganancia de encía
insertada con la adición del mismo
Tratamiento de la recesión gingival
La solución encías retraídas son técnicas de cirugía estética periodontal como el injerto de tejido
conectivo del paladar destinadas a recubrir la raíz denudada.
Los pacientes se quejan a menudo de hipersensibilidad ante estímulos térmicos (especialmente
al frio), en dientes con exposiciones radiculares. Este hecho además de causas incomodidad y/o
dolor, puede dificultar una correcta higiene oral para el paciente. Si no hay necesidades estéticas
concomitantes, vinculadas a la excesiva longitud de los dientes con las encías retraídas, el
tratamiento menos invasivo y por lo tanto de primera elección consiste en la aplicación de
agentes químicos locales desensibilizantes. En este sentido, el periodoncista de Clínicas
Propdental recomienda la aplicación de sensikin en gel y en spray por 15 días.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 31
Las coronas clínicas insuficientes, se solucionan con técnicas de alargamiento coronario,
mediante un colgajo con eliminación de hueso hasta obtener la adecuada corona clínica y el
necesario espacio para la inserción conectiva.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 32
Tratamiento de las hendiduras gingivales
Las hendiduras gingivales son grietas en el margen gingival. Se dividen en hendidura blanca,
cuando se interrumpe el grosor gingival completo y hay exposición dentaria/radicular y, roja,
cuando la grieta es parcial y queda tejido conectivo cubriendo la superficie dental/radicular. Las
hendiduras blancas se dividen en “completas” e “incompletas” según alcancen o no la unión
mucogingival.
El tratamiento de las hendiduras rojas consiste en interrumpir el uso de instrumentación
mecánica para la higiene oral (cepillado y seda dental) y realizar el control químico de la placa
bacteriana mediante el empleo de clorhexidina (0.12%).
El tratamiento de las hendiduras blancas incompletas consiste en la gingivectomías (incisión
completa submucosa) del tejido afectado y un colgajo de reposición coronal del tejido
queratinizado remanente apical a la incisión. El empleo de injertos de tejido conectivo debajo de
la lesión y una reposición coronal dependerá de la cantidad y calidad de tejido remanente apical
a la zona de incisión.
El tratamiento de elección de la hendidura blanca completa es un colgajo de reposición lateral y
coronal. La alternativa es la técnica de dos pasos: o injerto de tejido conectivo seguido de
reposición coronal o lateral.
Cirugía estética de la sonrisa gingival
La sonrisa gingival (exposición mayor de 3 mm de encía en media sonrisa) tiene como causa más
frecuente la erupción pasiva alterada, en la cual parte de la corona anatómica queda cubierta por
encía debido a que en el proceso de erupción el tejido óseo y/o el componente mucogingival, no
hicieron la migración apical.
El tratamiento de la sonrisa gingival puede requerir desde una simple gingivectomía a bisel
interno, hasta un colgajo de reposición a nivel apical con o sin osteoplastia.
En los agrandamientos gingivales el margen gingival se encuentra por encima de la línea
amelocementaria. Estos agrandamientos pueden ser idiopáticos, o inducidos por una
medicación, o bien tener su origen en un proceso inflamatorio crónico.
Las asimetrías gingivales son habituales en el frente anterosuperior y pueden tener un origen
similar al de la sonrisa gingival aunque sin afectar a todo el sector anterior sino sólo a parte de
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 33
él. Se corregirán mediante gingivectomía a bisel interno con remodelado del margen gingival.
Pero sin eliminación de hueso alveolar. Sin embargo, cuando las asimetrías gingivales tienen
también un componente óseo, es necesario realizar una cirugía a colgajo con remodelado gingival
y/o reposición apical del colgajo y osteoplastia.
El margen gingival plano, consiste en la ausencia de papilas interdentarias ya sea de forma
generalizada o localizada. El tratamiento requiere casi siempre una técnica quirúrgica de
recontorneado gingival y/o del hueso alveolar con reposicionamiento apical.
Microorganismos
• Agregatibacter Actinobacilo Actinomicetecomitas
Introducción
La enfermedad periodontal presenta una etiología multifactorial, siendo el factor bacteriano de
gran importancia y de ellos el Aggregatibacter actinomycetemomitans (A.
actinomycetemcomitans), es el patógeno de mayor relevancia en la Periodontitis Agresiva
Localizada (PAL).1,3 Así también esta relacionada con todas las periodontitis asociadas a biofilm.
A. actinomycetemcomitans, patógeno oportunista, ha sido aislado de pacientes con
actinomicosis, endocarditis infecciosa, osteomielitis, glomerulonefritis, endoftalmitis, neumonía,
absceso cerebral y hepático, siendo en algunos casos, causante predominante en estas
patologías.4,6 Así también A. actinomycetemcomitans con otras bacterias periodontales,
podrían ser un factor de riesgo en el desarrollo de enfermedades cardiovascular7 ya que han sido
encontrado en placas ateromatosas de arterias coronarias
La revisión se basó en publicaciones de artículos científicos de diversas bases de datos,
complementándola con libros especializados para establecer las carac- terísticas
morfológicas, bioquímicas, patogénicas y de crecimiento, para su identificación, relación con
patologías periodontales y los posibles pasos en el tratamiento y control de los procesos
periodontales en donde está implicado.
Características:
Taxonomía
Este microorganismo fue aislado por primera vez por Klinger en 1912, quien lo denominó
Bacterium actinomycetum comitans, luego Lieske en 1921 lo mencionó como Bacterium
comitans; Topley y Wilson en 1929, con el nombre más conocido: Actinobacillus
actinomycetemcomitans. Neils y Mogens en el 2006, según estudios de ADN, encuentran gran
similitud en cuatro bacterias Actinobacillus actinomycetemcomitans, Haemophilus aphrophilus,
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 34
H. paraphrophilus y H. segnis, conformando estos un nuevo género llamado Aggregatibacter,
perteneciente a la familia Pasteurellacea.
Morfología y estructura
Es un cocobacilo, de 0.4-0.5x1.0-1.5 um, no movil,8 no esporulado, capsulado, con fimbrias,
anaerobio facultativo que desarrolla mejor en condicio nes de anaerobiosis. Su pared celular
presenta las llamadas endotoxinas o lipopolisacaridos típico de una bacteria gram negativa.
Factores de virulencia Presenta fimbrias, vesículas, así como produce un material amorfo
extracelular proteico, que le permite adherirse a las células huésped. Siendo esta adherencia el
primer paso de todo proceso infeccioso.
Leucotoxina: Es un miembro de la familia RTX (Repeats in toxin), el operón de esta leucotoxina
esta constituida por 4 genes ltxC, A, B, D,en orden de transcripción siendo el ltxA, la porción activa
de la toxina. Tiene actividad citoletal en polimorfonucleares, leucocitos, macrófagos, penetrando
y formando poros transmembranosos, que producen pérdida de potasio intracelular, con un
resultado fatal para la célula. Su nula acción, sobre determinadas células como epitelio,
fibroblastos, plaquetas, eritrocitos, esta comprobado de estudios in vitro.Toxina de distensión
citoletal (CDT): Esta toxina es codificado por el operón cdtABC, e inhibe la progresión del ciclo
celular en G2, llevándola a una apoptosis celular. Así también puede inhibir la proliferación de
linfocitos CD4, impidiendo una respuesta adecuada del sistema inmune.17 Endotoxina (LPS): Es
una toxina sumamente activa, causando reabsorción ósea, activando macrófagos para que
estimulados, produzcan IL1-B y factor de necrosis tumoral alfa, mediadores de la inflamación y
reabsorción ósea. Proteínas unidas a los receptores Fc: La región Fc de la inmunoglobulina, se
une a proteínas de superficie de la bacteria, haciendo que el complemento no cumpla su función
citoletal, ni se lleve una adecuada opsonización para la fagocitosis.18 Proteína similar a GROE1
(64 Kda.): es una proteína con acción osteolítica identificado en la
mayoría de pacientes con PAL. Colagenasa: enzima capaz de deteriorar el tejido conectivo del
periodonto. Citotoxinas: inhiben la proliferación de fibroblastos y la capacidad del huésped de
sintetizar colágeno, para la recuperación de los tejidos.9 Epiteliotoxinas: Destruye
hemidesmosomas de la unión intercelular, siendo un mecanismo de invasión y profundización de
la infeccion. Alteraciones locales inmunitarias: A. actinomycetemcomitans está asociado a la
activación temprana de los linfocitos T supresores, así como de inhibición de inmunoglobulinas
IgG, IgM por células B. Estos mecanismos no están muy bien definidos. Otros factores que
podrían aumentar su virulencia, son la producción de bacteriocinas, que producen un
antagonismo bacteriano contra Estreptococos mutans y otros microorganismos de la cavidad
oral. Altera la quimiotaxis de neutrófilos, ya que producen una molécula de bajo peso molecular,
que inhibe la sustancia quimioatrayente FMLP. Produce intraleucocitariamente catalasa y
superóxido dismutasa inhibiendo la destrucción intracelular así también presenta plásmidos y
bacteriofagos.8 Fisiopatología En el biofilm dental se han encontrado más de 700 tipos
bacteriano, siendo uno de ellos, A. actinomycetemcomitans, una bacteria residente del surco
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 35
gingival. Su agresividad se debe a muchos factores de virulencia ya mencionados, que actuando
en un huésped con algún grado de susceptibilidad, activa su me-canismo de proliferación y
destrucción, causando un gran daño al periodonto, pero no todos las cepas tienen la misma
importancia sino las que presentan ciertas características, como una mayor activación de su
leucotoxina16, que tiene dos funciones bien marcadas, daño de células de defensa y reabsorción
ósea. El daño producido por esta bacteria es rápida, más aun si se acompaña de abundante
biofilm alrededor del diente, llegando a deteriorar el periodonto con formación de bolsa
periodontal, pérdida de inserción, amplia movilidad del diente y con el tiempo pérdida de este,
típico caso de una PAL9 Aislamiento bacteriano El A.a es una típica bacteria que puede crecer en
medio enriquecidos como Agar sangre, chocolate, suplementado con hemina, vitamina K y
menadiona, en condiciones de CO2 al 5-10 %20 o anaerobiosis Hay muchos medios que han
permitido aislar la bacteria de forma selectiva, como el de Socransky, Medio MGB (bacitracina,
verde de malaquita), el de Slots, MedioTSBV 13 (bacitracina, vancomicina), el de Slots modificado
medio A21(TSBV con espiramicina, Ac. fusídico y carbenecilina) y el de Dentaid-121 (BHIA,
Vancomicina).
El aislamiento de A. actinomycetemcomitans empieza con una toma de muestra de placa
subgingival, con un cono de papel estéril Nº 30 o 40, se deja por 60 seg., luego se retira y se coloca
en un medio de transporte como, VMGA III22 (Viability Maintaining Microbiostatic Médium III,
Anaerobically Prepared), RTF22 (Reduced Transport Fluid), o BHIB (Brain Heart Infusion Broth).
El procesamiento deber realizarse en lo posible a los pocos minutos. sembrando en un medio
selectivo tipo TSBV y incubandolo en anaerobios a 37 ºC x 5-7 días. A la observación con
microscopio estereoscópico, las colonias tienen aproximadamente de 0.5 – 1 mm de diámetro
son de forma circular, bordes irregulares, convexa, con una estrella de 6 puntas en el centro, a la
coloración Gram, se observan como cocobacilos Gram negativos., se complementa esta
observación con pruebas de oxidasa y catalasa.
Para profundizar en el estudio de A. actinomycetemcomitans se puede biotipar haciendo pruebas
de fermentación de carbohidratos, dextrina, maltosa, mani-
tol y xilosa.23,25 Las pruebas serológicas se realizan para identificar los 7 serotipos (A – G).
Pruebas moleculares como PCR convencional y en tiempo real, son usados por ser muy sensibles
y específicos para el diagnóstico de microorganismos.
A. actinomycetemcomitans y su relación con la PAL
A. actinomycetemcomitans está presente en aproximadamente 95 % de las lesiones
periodontales en pacientes con PAL,8 aunque hay estudios que muestran porcentajes menores.
En el Perú no se tiene un valor de la prevalencia de PAL. En USA, la prevalencia es
aproximadamente de 0,5 %, en Brasil de 3,7 % en población adolescente entre 1516 años, y en
Nigeria presenta una prevalencia de 0,8 %.9 Así también se ha podido determinar que la
población negra presenta mayor prevalencia que la blanca. Siendo la cepa de A.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 36
actinomycetemcomitans JP2, gran productora de leucotoxina, generalmente aislada. Por
estudios de serología se a podido determinar que el serotipo B es la predominante en la PAL27 y
el serotipo C en pacientes sanos.
A. actinomycetemcomitans pertenece al grupo HACEK (H. aphrophilus, A.
actinomycetemcomitans, Cardiobacterium hominis, E. corrodens y Kingella Kingae), que puede
diseminarse de una PAL por vía hematógena o por secreciones a diversos órganos, produciendo
en ellos, endocarditis, glomerulonefriti, neumonía, osteomielitis, abscesos.6 Es de importancia
mencionar la transmisión del A. actinomycetemcomitans de padres a hijos, ya que estudios de
biotipos y serotipos bacterianos en los componentes de la familia, han demostrado un contagio
de tipo intrafamiliar. Tratamiento mecánico y antimicrobiano para A. actinomycetemcomitans
El tratamiento mecánico se basa en la fase I de la terapia periodontal, la cual consiste en la
eliminación de placa y tártaro supra y subgingival, así como un alisado de la superficie radicular,
para evitar superficies rugosas que permitan mayor retención de placa. Instruir al paciente en el
control de placa por debajo del 20 % del índice de higiene según O'leary y de una reevaluación
periódica de su caso.3,8,32 En la terapia antimicrobiana local se recomienda clorhexidina al 0,12
% ó 0,2 % 2 veces al día por un periodo de 10-14dias. Para la terapia sistémica, la doxiciclina,
ciprofloxacino,metro nidazol,azitromicina34 (500mg 1ra dosis, seguida de 4 dosis de 250mg/día),
y la tetraciclina35 son la elección, siendo esta última utilizada en dosis de 250 mg cada 6 horas
por 14 a 20 dias.3 En lo que concierne a utilizar combinaciones de antibióticos, han dado muy
buenos resultados amoxicilina 500mg con metronidazol 250mg c/ 8 h por 7 días32 o
ciprofloxacino con metronidazol.
• Prevotella Intermedia
Las especies que conforman el Género Prevotella, anteriormente clasificadas dentro del Género
Bacteroides; son bacilos cortos, pleomórficos, generalmente de 0,4um por 0,6 a 1um de longitud,
inmóviles, no esporulados. Capaces de producir pigmentos, moderadamente fermentativos,
sensibles a la bilis y resistentes a la vancomicina. Al igual que Porphyromonas, son exigentes en
cuanto a Vitamina K, hemina y sangre para su crecimiento.
Atendiendo a la producción de pigmento marrón oscuro o negro, característica que se observa
de 2 a 3 semanas en sus colonias desarrolladas en agar sangre; las especies de interés
odontológico se clasifican en dos grupos:
1) Especies pigmentadas: P. intermedia, P. melaninogenica,P. loescheii, P. corporis, P. nigrescens,
P. pallens,
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 37
2) Especies no pigmentadas: P. bivia, P. buccae, P. buccalis, P. disiens, P. oralis, P. oris, P.
oulorum, P. veroralis, P. heparinolytica, P. zoogleoformans.
Todas estas especies, tienen su hábitat en la cavidad bucal, principalmente en el surco gingival, y
de todas ellas, P. melaninogenica y P. loescheii son las de mayor poder fermentador; las demás
especies sólo poseen capacidad sacarolítica sobre un determinado numero de azúcares. Cabe
resaltar que P. nigrescens, fenotípicamente idéntica a P. intermedia, es una nueva especie
derivada de un grupo genotípicamente diferenciado de cepas incluidas antiguamente en P.
intermedia 3. Las especies más implicadas en la periodontitis son P. intermedia, P. loescheii y P.
melaninogenica, en las que se han descrito fimbrias, como adhesinas, que intervienen en la
adhesión y coagregación bacteriana. También se ha comprobado su capacidad para degradar
inmunoglobulinas, su acción tóxica sobre fibroblastos, su actividad fibrinolítica, y el estímulo de
su crecimiento por hormonas como estradiol y progesterona. Igualmente, se ha demostrado in
vitro que P. loescheii y P. melaninogenica tienen efecto inmunosupresor por inhibir la
proliferación de linfocitos B e inmunoglobulinas. La significación patógena en el resto de especies
no es bien conocida, por lo que se relacionan en esta enfermedad unidas a otras bacterias, con
carácter sinérgico y polimicrobiano.
SE CARACTERIZA POR:
• son bacilos cortos pleomórficos
• Inmóviles
• no esporulados
• Capaces de producir pigmentos
• moderadamente fermentativos
FACTORES DE VIRULENCIA
• fimbrias
• degrada inmunoglobulinas,
• acción tóxica sobre fibroblastos,
• actividad fibrinolítica
HABITAT:
Su hábitat primario es la cavidad oral en el surco gingival
PODER PATOGENO --- Periodontitis
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 38
• Bacteroides Forsythus
Pertenecen a este Género una gran variedad de especies ubicadas en el Grupo Bacteroides fragilis
(B. fragilis, B. caccae, B. distansonis, B. eggerthii, B. merdae, B. ovatus, B. stercoris, B. uniformis,
B. vulgatus), aisladas con frecuencia en infecciones de importancia clínica en el ser humano. Estas
especies forman parte de la microflora autóctona del tracto gastrointestinal, pero raramente se
encuentran en boca 3. En cavidad bucal solo tienen interés las especies, B. capillosus, B.
heparinolyticus, y B. forsythus, que frecuentemente habitan en el surco gingival. Estas especies
se caracterizan por ser bacilos pleomórficos, anaerobios estrictos, inmóviles, no esporulados, no
fermentativos y no crecen en bilis. Su crecimiento in vitro es difícil, sin embargo, el desarrollo de
sus colonias en placas de agar sangre es favorecido por la presencia de N-acetilmuramato,
hemina y vitamina K. Estas especies aunque se incluyen en el Genero Bacteroides, no pertenecen
al Grupo fragilis, ya que no cumplen con todas las características que definen el mismo, siendo
su situación taxonómica incierta y aun esperan por su reclasificación.
B. forsythus, se ha asociado frecuentemente con periodontitis refractaria. Al parecer, su
virulencia está relacionada con la producción de neuraminidasas y enzimas tripsicas con
especificidad sobre proteínas con residuos de arginina
• Espiroquetas
•Microorganismos Gram(-)
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 39
• Anaerobios
•Formas: helicoidales, finos y móviles
•Filamentos axiales (endoflagelos)
•Géneros : treponema, borrelia y leptospira
•Común en bolsas periodontales profundas, sobre todo en PERIODONTITIS AGRESIVA O
PERIODONTITIS ULCERONECROSANTE AGUDA(GUNA).
Son un grupo diverso de organismos espirales y móviles.
•Son bastoncillos helicoidales de 5 a 15 μm de longitud con diámetro de 0.5 μm.
•Presentan de 3 a 8 espirales irregulares
•Presencia en grandes cantidades en las biopsias de tejidos afectados
•Los sitios sanos muestran pocas espiroquetas o ninguna
FORMAS DE ESPIROQUETAS
Las especies clasificadas son:
Treponema denticola
Treponema vincentii
Treponema socranskii
Las espiroquetas como el TREPONEMA DENTICOLA se halla en lesiones periodontales según se
ve en cortes de placa subgingival mediante localización inmunohistoquimica.
Muchos investigadores afirman que curaban la enfermedad periodontal mediante combinación
de tratamiento local con el sistémico.
Las espiroquetas producen una amplia gama de factores de virulencia potenciales.
•Patogenicidad: degradan colágeno e incluso dentina, destrucción de inmunoglobulinas (IgA,
IgM, IgG)
•Entre los factores de virulencia que presenta están una enzimas como proteasa; esta enzima
afecta los sustratos proteínicos que incluye fibronectina, laminima y fibrinógeno.
Las espiroquetas pueden prolongar el remodelado de los tejidos y la cicatrización de las heridas
después de un tratamiento periodontal.
•El tratamiento favorable de las infecciones periodontales va acompañado de un descenso de la
cantidad y proporciones de espiroquetas bucales como grupo o especie individual.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 40
Mecanismos de patogenicidad de los Microorganismos.
El rasgo sobresaliente de la periodontitis crónica es la destrucción de los tejidos del soporte del
diente. La existencia de placa dental es fundamental en este proceso. La colonización de los
tejidos periodontales por especies bacterianas patógenas es el primer paso para el desarrollo de
esta enfermedad. Este proceso destructivo se debe a la entrada de la bacteria o de sus productos
bacterianos a los tejidos periodontales. En consecuencia, la destrucción periodontal deriva de
productos bacterianos que causan directa o indirectamente daño en los mismos.
Lindhe (2000), expresa que todos los tipos de enfermedad periodontal están asociados a la
presencia de microorganismos patógenos en la placa subgingival, principalmente por especies
Anaerobias Gram Negativas, que colonizan y proliferan en el tejido periodontal y a la
susceptibilidad del hospedero. El resultado de esta interrelación, en el caso de la periodontitis,
es la formación de un saco periodontal y una reacción inflamatoria del tejido mediada por células
fagocíticas, plasmáticas, linfocitos T y B, las cuales podrían dañar estructuras del tejido conectivo
y el hueso alveolar.
Marsh y Martin (2000), señalan que los determinantes de patogenicidad de los
periodontopatógenos comprenden factores que favorecen a una especie bacteriana para
colonizar e invadir el tejido periodontal, y mecanismos que permiten evadir las defensas del
hospedero y causar daño en el tejido periodontal.
1. Colonización e invasión de los periodontopatógenos en los tejidos:
La adherencia de bacterias a diferentes superficies del medio como placa, dientes y tejidos,
favorecen la colonización y posterior invasión de dichas bacterias a los tejidos periodontales. Las
bacterias que colonizan inicialmente el tejido periodontal probablemente se fijan a la superficie
dental, tal es el caso de A. viscosus que se adhiere mediante fimbrias a proteínas ricas en prolina
presentes en las superficies dentales.
De igual forma, las interacciones entre las especies bacterianas y diferentes superficies
determinadas por moléculas específicas, llamadas adhesinas, son importantes en la colonización
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 41
del tejido periodontal. Socransky (1991), describe las interacciones entre A. viscosus por medio
de fimbrias a un receptor polisacárido de S. sanguis, entre P. loescheii a través de fimbrias a
residuos de galactosil de S. sanguis y entre F. nucleatum por medio de proteínas de membrana
externa a residuos de galactosil de P. gingivalis que se encuentran en la masa de placa dental.
Moore (1991) y Kamma (1995), señalan que la colonización de los dientes por Actinomyces sp. y
Streptococcus sp. coagregados con F.nucleatum y otras especies, producen irritación de los
tejidos, sangramiento y exudado, y a su vez estimula el crecimiento de especies de
Porphyromonas, Prevotella y de otros microorganismos asociados con la destrucción del tejido,
confirmando así el escenario para el desarrollo de la enfermedad periodontal. Esta colonización
podría ser un paso crítico en el proceso de la invasión bacteriana y en consecuencia, permitir que
P. gingivalis, P. intermedia y F. nucleatum puedan fijarse a otras bacterias, a células epiteliales
del tejido, al fibrinógeno y fibronectina del tejido.
La invasión por parte de las bacterias o de sus productos metabólicos a los tejidos del periodonto
es esencial para el desarrollo de la enfermedad periodontal. Las bacterias pueden penetrar los
tejidos a través de ulceraciones en el epitelio del surco gingival o del saco periodontal, por la
penetración directa de las bacterias al interior del tejido conectivo del hospedero, y mediante la
acción de enzimas como las colagenasas, fibrinolisinas, hialuronidasa, entre otras.
Las especies bacterianas identificadas con capacidad para invadir los tejidos se asocian
firmemente con sitios enfermos. Investigaciones realizadas han demostrado la capacidad de A.
actinomycetemcomitans, P. gingivalis y T. denticola de invadir directamente las células del tejido
del hospedero. Esta capacidad de invasión por parte de las bacterias, se ha descrito como un
como factor clave para distinguir las especies patógenas Gram Negativas de otras no patógenas.
2. Mecanismos de evasión o alteración de las defensas del hospedero:
La capacidad de las bacterias de adherirse a superficies, no permite que sea desplazada por
secreciones en los tejidos del hospedero, y la invasión por parte de ellas a las células del tejido
favorece la alteración de las barreras naturales de defensa de los tejidos del hospedero. Otros
mecanismos mediante los cuales las bacterias periodontales pueden evadir las defensas del
hospedero se deben a la capacidad de algunas patógenos de producir proteasas que degradan
inmunoglobulinas producidas por el hospedero, las cuales, operan para facilitar la fagocitosis de
las bacterias o para bloquear la adherencia fijándose a la superficie de la célula bacteriana.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 42
Se ha demostrado que P. gingivalis, P. intermedia, P. melaninogenica y Capnocytophaga,
producen proteasas con capacidad de destruir las inmunoglobulinas (IgA, IgM e IgG), factores del
complemento (C3, C4 y C5), y otras proteínas plasmáticas importantes en la iniciación y control
de la respuesta inflamatoria como µ -2 macroglobulina, inhibidor de C1, antitrombina, µ -2
antiplasmina y plasminógeno. Asimismo, producen cambios en los polimorfonucleares, degradan
proteínas transportadoras de hierro, como albúmina haptoglobina, hemopoxina y transferrina
(27,28).
Diversos autores coinciden en señalar que las proteasas bacterianas pueden jugar un papel crítico
en la colonización y supervivencia de las bacterias en sitios subgingivales y posterior progresión
de la enfermedad periodontal. Estas enzimas alteran los mecanismos de defensa del hospedero,
degradan las proteínas del mismo, incluyendo componentes del tejido periodontal, sin embargo,
aun no se precisa la función de las proteasas bacterianas en la enfermedad, dado que enzimas
similares en el medio periodontal podrían provenir de células de los tejidos del hospedero
(13,29,30).
3. Mecanismos que inducen daño al tejido periodontal del hospedero:
Muchas de las investigaciones sobre los factores de virulencia de los patógenos periodontales se
han enfocado hacia las propiedades de las bacterias relacionadas con la destrucción de los tejidos
del hospedero. Dichas propiedades han sido clasificadas como las que producen daño
directamente a los tejidos y las que estimulan indirectamente la liberación de metabolitos
biológicamente activos a partir de las células de los tejidos del hospedero (7).
Estudios realizados señalan que dentro del grupo de Bacilos Aanaerobios Gram Negativos, P.
gingivalis y P. intermedia, junto con otras especies menos patógenas, producen una variedad de
enzimas, tales como hialuronidasas, condroitin sulfatasa, heparinasa, B-glucosidasa y N-
acetilglucosaminidasa, mediante la cual pueden hidrolizar componentes del tejido, lo que
favorece la destrucción del mismo (9).
Es importante señalar la gran actividad colagenolítica que posee P. gingivalis, la cual le permite
degradar el colágeno, principal constituyente de los tejidos gingivales humanos, favoreciendo así
la colonización e invasión del microorganismo y posterior destrucción del tejido. Asimismo,
produce ciertas proteasas tiolíticas y casenolíticas, conocidas como gingipainas, que contienen
cisteína y poseen especificidad sobre proteínas que contienen arginina o lisina. Estas proteasas
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 43
se comportan como colagenasas que actúan, degradando el colágeno, en consecuencia produce
daño en el ligamento periodontal, tejido conectivo del diente y resorción ósea; destruyen los
eritrocitos para la obtención de hierro; y provocan destrucción de las inmunoglobulinas y
proteínas reguladoras de la respuesta inmune (27,29).
Grenier y Turgeon (1994), determinaron la presencia de bacterias proteolíticas en placa
subgingival de pacientes adultos con periodontitis. P. gingivalis y P. intermedia, fueron las
especies más frecuentes aisladas en sacos periodontales en 11 de 13 pacientes estudiados. Otras
bacterias proteolíticas encontradas fueron Capnocythophaga sp., Actinomyces sp.,P. acnes y P.
micros, las cuales pueden contribuir significativamente a la actividad proteolítica en los sitios
afectados. Los resultados obtenidos de este estudio demuestran que las proteasas elaboradas
por estas bacterias, no solamente favorecen la progresión de la enfermedad, sino también
afectan la integridad del tejido y los mecanismos de defensa del hospedero (13).
Por otra parte, algunos periodontopatógenos producen ciertos metabolitos que contribuyen con
la destrucción del tejido periodontal, tales como: amoníaco, compuestos de sulfuro, ácidos
grasos, péptidos e indol. Estos metabolitos también pueden inhibir la quimiotaxis leucocitaria,
inducir la activación policlonal de los linfocitos B, ejercer una acción inhibidora de la proliferación
fibroblástica, e incluso inducir a las células del hospedero a elaborar una procolagenasa, que
determinaría, en ausencia de respuesta local del mismo, un fenómeno de autodestrucción (9).
Cabe destacar, que el sistema inmunológico del individuo es una compleja red de interacciones
entre células y moléculas reguladoras. Los productos bacterianos pueden afectar dicho sistema,
dando como resultado la inhibición del mismo. Una interacción bien definida abarca la liberación
de interleuquina 1, factor de necrosis tumoral y prostaglandinas de macrófagos y monocitos
expuestos a la endotoxina bacteriana (lipopolisacárido). Estas citocinas derivadas poseen el
potencial de estimular la reabsorción ósea y activar o inhibir otras células inmunitarias (7,9).
Métodos de identificación
Durante años el diagnóstico de la enfermedad periodontal se ha basado en las mediciones
clínicas y radiográficas. Los parámetros de evaluación como: inflamación de los tejidos,
profundidad del surco gingival y evidencias radiográficas de pérdida de hueso alveolar,
permanecen como las bases en el diagnóstico clínico de la enfermedad en los pacientes (16).
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 44
Sobre la base de que algunos autores definen a la periodontitis como un proceso infeccioso
relacionado con la acumulación de placa dental, así como también con la presencia de
microorganismos patógenos, siendo las bacterias anaerobias las principalmente involucradas
(7,31,32), se han realizado diferentes estudios con el objetivo de mejorar las técnicas para
cultivar, reconocer y enumerar dichos patógenos. A partir de 1960, las investigaciones realizadas
dieron a conocer la existencia de microorganismos específicos en la placa subgingival de
pacientes con periodontitis, diferentes a los microorganismos hallados en la placa subgingival de
pacientes periodontalmente sanos (33). Estas investigaciones permitieron la introducción de
métodos basados en técnicas de laboratorio, mucho más sensibles y específicas, para la
detección de patógenos específicos.
El desarrollo de las técnicas microbiológicas anaerobias durante los últimos 30 años, ha permitido
considerablemente la comprensión de la etiología de las infecciones periodontales; se sabe por
diversos estudios, que las infecciones son polimicrobianas, dominadas principalmente por
especies de bacilos anaerobios (31). Es por ello, la razón de utilizar métodos apropiados con el
fin de identificar este limitado número de bacterias específicas que se encuentran en la placa
dental subgingival de pacientes con la enfermedad.
Las pruebas microbiológicas convencionales para el aislamiento e identificación de bacterias
periodontopatógenas incluyen, el empleo de medios de cultivos enriquecidos y pruebas de
fermentación de azúcares para la diferenciación de las especies aisladas. Estas pruebas son las
únicas que permiten detectar un amplio número de bacterias, así como también, la sensibilidad
de los microorganismos aislados a los antibióticos (1,9,34).
Como medios de cultivos primarios para el aislamiento se recomiendan: Agar Base Shaeldler,
Agar Base Wilkins Chanlgren, Agar Base Columbia, Agar Base Brucella y Agar Base Tripticasa,
suplementados con ácido nalidíxico y vancomicina, además de, sangre, hemina y vitamina K, los
cuales favorecen el crecimiento de especies de Bacteroides, Fusobacterim y Prevotella
(3,4,31,34,35). No obstante, debido a la dificultad de cultivar y recuperar todos los
microorganismos periodontopatógenos en los medios de cultivos, y al tiempo prolongado de las
pruebas, aproximadamente de tres semanas para obtener los resultados; varios investigadores
han probado otras técnicas microbiológicas que permiten identificar y cuantificar bacterias
específicas en los diferentes tipos de periodontitis (5,6).
Como alternativa a los medios de cultivo enriquecidos, la microscopía de campo oscuro es un
método sencillo y rápido, que puede emplearse para reconocer morfotipos bacterianos difíciles
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 45
de cultivar, así como también, para determinar la movilidad de algunas especies bacterianas. Sin
embargo, la mayor parte de los periodontopatógenos como A. actinomycetemcomitans, P.
gingivalis y P. intermedia son bacilos inmóviles, por lo tanto, no pueden detectarse a través de
este método, además, tampoco permite diferenciar las diversas especies móviles de Treponema.
Por estas razones, las investigaciones realizadas señalan que este método solo es útil para
distinguir grupos bacterianos en pacientes con enfermedad periodontal y periodontalmente
sanos o tratados, y, relacionar la presencia de Treponema sp. con la profundidad de los sacos
periodontales (36,37,38).
También hoy en día, se disponen de sistemas microbioquímicos enzimáticos que permiten la
identificación rápida de especies de bacterias anaerobias a partir de cultivos puros de muestras
de placa subgingival, como: API Zym, API ANADENT, API 20A, Rapid ID 32A (35,39,40,41) y
substratos derivados del 4-metiyumbelliferone (42,43,44).
Por otra parte, debido a que la actividad enzimática proteolítica ha sido considerada un factor
clave en la destrucción del tejido periodontal, Loesche (1986), propuso la utilización de la
reacción BANA (N-benzoilo-D-L-arginina-2-naftilamida), que mide directamente la actividad de la
enzima tripsina en muestras de placa subgingival, producida por B. forsythus, P. gingivalis, T.
denticola y especies de Capnocytophaga . La actividad de dicha enzima se mide al observar la
hidrólisis del sustrato N-benzoilo-D-L-arginina-2-naftilamida, que sirve como marcador de riesgo
en el desarrollo de la enfermedad periodontal (45).
Los ensayos inmunológicos, también son usados para la detección de periodontopatógenos
específicos. Estos incluyen la utilización de anticuerpos monoclonales dirigidos contra antígenos
bacterianos o factores de virulencia, que solo reaccionan con la especie bacteriana "blanco".
Estas pruebas comprenden técnicas de inmunofluorescencia directa con substratos
fluorogénicos (44,46) y de inmunoabsorbencia ligado a enzimas (Elisa) (47).
Además de las pruebas microbiológicas convencionales, enzimáticas e inmunológicas antes
mencionadas, existen otros métodos para la detección de periodontopatógenos a través de
fragmentos específicos de ADN de las bacterias. Estas pruebas incluyen, Hibridrización de Sondas
de ADN (40,,46, 48,49), Análisis de Endonucleasas de Restricción de (AER) y la Reacción en
Cadena de la Polimerasa (RCP) (39,41). Las pruebas que utilizan fragmentos de ADN para la
detección de periodontopatógenos, son pruebas rápidas, sensibles y específicas, en comparación
con la utilización de los medios de cultivos, sin embargo, de acuerdo a la revisión realizada, se
encuentran disponibles sólo para unos cuantos patógenos, no permiten conocer la sensibilidad
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 46
de los microorganismos a los antibióticos y requieren de equipos muy costosos, por lo que se
utilizan principalmente en laboratorios especializados de investigación (48).
Estudios recientes en poblaciones humanas, señalan que determinaciones en suero de títulos de
anticuerpos IgG ante bacterias periodontopatógenas, principalmente P. gingivalis, sirven de
indicadores para: a) el diagnóstico de la enfermedad periodontal y los períodos de destrucción
activa del tejido periodontal, b) evaluar la respuesta al tratamiento y el pronóstico de la
enfermedad (50,51).
Botero (1995), recomienda como métodos diagnósticos para detectar la actividad de la
enfermedad periodontal, la detección de patógenos periodontales en cultivos enriquecidos, la
determinación de anticuerpos IgG específicos contra patógenos periodontales y análisis de los
componentes del fluido gingival crevicular, que contiene derivados de la placa microbiana
subgingival, del fluido intersticial y productos derivados del hospedero (52).
Por lo anteriormente señalado, actualmente, se disponen junto con las técnicas convencionales
de cultivo, de pruebas rápidas que permiten detectar bacterias específicas provenientes de
muestras de placas subgingival y sacos periodontales. De manera general, todas estas pruebas
constituyen una herramienta de ayuda en el diagnóstico de la periodontitis, que dependiendo
del perfil bacteriano permiten, no sólo diferenciar los tipos de enfermedad, sino también,
establecer que sitios periodontales en los pacientes corren más riesgo de sufrir destrucción
activa, así como, la erradicación de microorganismos periodontopatogénicos a través de la
implementación de un tratamiento adecuado.
Planificación del tratamiento de alteraciones
periodontales
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 47
FASES DEL TRATAMIENTO PERIODONTAL
• FASES TRATAMIENTO NO QUIRURGICO
• TRATAMIENTO QUIRURGICO
FASE I DEL TRATAMIENO PERIODONTAL
INTRODUCCION
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 48
Esta fase es el primer paso en la secuencia cronológica de procedimientos que constituye el
tratamiento periodontal. Su objetivo es alterar o eliminar la etiología microbiana y los factores
que constituyen a las enfermedades gingivales y periodontales. También denominada:
tratamiento inicial, tratamiento periodontal no quirúrgico, tratamiento relacionado con la causa
y fase etiotropica del tratamiento.
FUNDAMENTO
La reducción y eliminación de los factores etiológicos se logra por medio de la eliminación total
de los cálculos, la corrección de las restauraciones defectuosas, el tratamiento de lesiones
cariosas y un exceso control de placa.
Los procedimiento incluidos en le fase I pueden ser los únicos necesarios para solucionar los
problemas periodontales del paciente, o pueden constituir la fase de preparación para el
tratamiento quirúrgico.
Entre las opciones de control o eliminación de los factores locales se incluyen los siguientes
tratamientos:
SESIONES DEL TRATAMIENTO Una vez analizado el caso y el diagnostico especifico de la
enfermedad periodontal se determina el plan de tratamiento para la porción de raspado
radicular y curetaje. Esto es un estimado de los procedimientos y el numero de visitas requeridas
para completar la fase inicial del tratamiento.
Dar atención especial al control de los microorganismos infecciosos durante el periodo de la fase
I activa del tratamiento. Como alternativa programar una cita larga, o bien dos citas en días
consecutivos, para que el paciente reciba antimicrobianos. A esto se denomina tratamiento
“antiinfeccioso” o “desinfección”.
SECUENCIA DE PROCEDIMIENTOS
Paso 1.- instrucciones del control limitado de la placa: Empieza en la primera cita e incluye el uso
correcto del cepillo de dientes sobre superficies lisas y regulares de los dientes. El uso de hilo
dental debe esperar hasta que se eliminen los cálculos y restauraciones.
Paso 2.- eliminación supragingival de los cálculos: Se realizan con escariadores, curetas o
instrumentos ultrasónicos.
Paso 3.- delimitando el contorno de las restauraciones y coronas defectuosas: Reemplazo de
todas las restauraciones o coronas, o la corrección con la lima de acabado o cubierta con
diamante montada en una pieza manual especial.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 49
Paso 4.- obturación de las lesiones cariosas: Eliminación total del tejido carioso y la colocación de
una restauración final o temporal.
Paso 5.- instrucciones de control amplio de la placa: El paciente debe aprender a eliminar la placa
por completo de todas las áreas supragingivales usando el cepillo dental, hilo dental u otro
método complementario.
Paso 6.- tratamiento radicular subgingival: En este momento se puede realizar de forma exitosa
la eliminación completa de los cálculos y el alisado radicular y constituye el ultimo paso para
obtener contornos lisos y regulares en todas las superficies dentales.
Paso 7.- revaluación del tejido: Se vuelven a examinar los tejidos periodontales para determinar
la necesidad de tratamiento posterior. Se sondean las bolsas y se evalúan con cuidado las
condiciones anatómicas relacionadas para decidir si es tratamiento quirúrgico es indicado.
RESULTADOS
Esta fase incluye el tratamiento complejo e individualizado, requiere el análisis detallado de la
enfermedad de cada paciente y los factores que contribuyen a esta y un tratamiento
personalizado. El control de placa que realiza el paciente en casa es complejo y requiere modificar
hábitos de toda la vida.
CICATRIZACION
La revaluación del caso periodontal debe realizarse casi 4 semanas después de completar los
procedimientos de raspado radicular y curetaje. Esto da tiempo para que sane el tejido epitelial
y conectivo y da al paciente suficiente practica con las habilidades de higiene bucal para alcanzar
una mejora máxima.
Por lo general se reduce o elimina sustancialmente la inflamación gingival en 3 o 4 semanas
después de eliminar los cálculos e irritantes locales. “La cicatrización consiste en la formación de
un epitelio de unión largo mas que nueva inserción del tejido conectivo en superficies
radiculares”.
FASE II DEL TRATAMIENO PERIODONTAL
OBJETIVOS DE LA FASE QUIRURGICA
Son: 1. Mejorar el pronostico de los dientes y sus reemplazos. 2. Mejorar la estética. El propósito
del tratamiento quirúrgico de las bolsas consiste en eliminar los cambios patológicos en las
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 50
paredes de la bolsa. Crear un estado fácil de mantener y si es posible promover la regeneración
periodontal
Para lograr estos objetivos las técnicas quirúrgicas: a) Aumentan el acceso a la superficie radicular
haciendo posible la eliminación de todos los irritantes. b) Reducen o eliminan la profundidad de
la bolsa. c) Remodelan los tejidos blandos y duros.
TRATAMIENTO QUIRURGICO DE LA BOLSA Esta dirigido a: 1. Permitir la cirugía para asegurar la
eliminación de irritantes de la superficie dental. 2. Eliminar o reducir la profundidad de la bolsa
periodontal. La eliminación de la bolsa consiste en reducir la profundidad de las bolsas
periodontales a un surco fisiológico para permitir la limpieza por parte del paciente.
RESULTADO DEL TRATAMIENTO DE LA BOLSA Una bolsa periodontal puede estar en estado
activo o en periodo de inactividad o reposo. En una bolsa activa se pierde el hueso. La bolsa
permanecerá inactiva dependiendo de su profundidad y las características individuales de los
componentes de la placa y la respuesta del huésped.
RESULTADO DEL TRATAMIENTO DE LA BOLSA La creación de un surco saludable y un periodoncio
restaurado incluye una restauración total del estado que existía antes de que iniciara la
enfermedad periodontal, lo que es el resultado ideal del tratamiento.
ELIMINACION O MANTENIMIENTO DE LA BOLSA La eliminación de bolsas se ha considerado uno
de los principales objetivos del tratamiento periodontal, debido a la necesidad de mejorar el
acceso a superficies radiculares. Por otra parte la ausencia de bolsas profundas en el pacientes
tratados predice de manera excelente un periodoncio estable. Sin embargo después del
tratamiento quirúrgico, las bolsas que regresan a tener una profundidad superficial o moderada
se mantienen en un estado de salud y sin evidencia radiográfica de avance de la perdida ósea.
REVALUACION DESPUES DE LA FASE I DEL TRATAMIENTO Todos los pacientes deben ser tratados
al principio con raspado y alisado radicular, y si requieren cirugía periodontal se determina
después de una evaluación minuciosa de los efectos de la fase I . La valoración solo suele
realizarse después de uno a tres meses de completar la fase I. Esta revaluación del estado
periodontal debe incluir: el sonde de toda la boca, revaluando la presencia de cálculos, caries
radiculares, restauraciones defectuosas y todos los signos de inflamación persistente.
ZONAS CRITICAS EN LA CIRUGIA DE LA BOLSA
Los criterios para la selección de una de las diferentes técnicas quirúrgicas para el tratamiento
de la bolsa se base en los hallazgos clínicos: La pared de tejido blando de la bolsa La superficie
dental El hueso subyacente Encia insertada
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 51
Zona 1: la pared de tejido blando de la bolsa El clínico debe determinar las características
morfológicas, el grosor y la topografía de la pared de tejido blando de la bolsa y la persistencia
de los cambios inflamatorios den la pared.
Zona 2: la superficie dental El clínico debe identificar la presencia de depósitos y alteraciones en
la superficie de cemento y determinar la accesibilidad de la superficie radicular para la
instrumentación.
Zona 3: el hueso subyacente El clínico debe establecer la forma y altura del hueso alveolar junto
a la pared de la bosa, por medio del sondeo cuidadoso y el examen clínico radiográfico.
Zona 4: la encía insertada El clínico debe considerar la presencia o ausencia de una banda
adecuada de encía insertada cuando selecciona el método para tratar la bolsa.
INDICACIONES PARA LA CIRUGIA PERIODONTAL
Los siguientes hallazgos pueden indicar la necesidad de una fase quirúrgica de tratamiento:
1. Las áreas con contornos óseos irregulares, cráteres profundos y otros defectos.
2. Es posible que las bolsas sobre los dientes en que no se considera clínicamente posible la
eliminación de irritantes radiculares. (molares y premolares)
3. En casos de lesiones de furcacion grado II o III.
4. Las bolsas intraoseas en las áreas distales de los últimos molares.
5. La inflamación persistente en áreas con bolsas moderadas o profundas, en áreas con bolsas
superficiales o surcos normales.
METODOS PARA EL TRATAMIENTO DE LA BOLSA Se puede clasificar bajo las siguientes tres
categorías principales: Las técnicas de nueva inserción • La eliminación de la pared de la bolsa
Eliminación del lado dental de la bolsa
1.- Las técnicas de nueva inserción: Ofrecen el resultado ideal, ya que eliminan la profundidad de
las bolsas al reunir la encía con el diente en una posición coronal al fondo de la bosa preexistente.
2.- La eliminación de la pared de la bolsa: Se puede eliminar por medio de los siguientes métodos:
- Retracción o contracción, se contrae la encía reduciendo la profundidad de la
bolsa
- Eliminación quirúrgica, por medio de la técnica de la gingivectomia
- Desplazamiento apical con un colgajo desplazado apicalmente
3.- Eliminación del lado dental de la bolsa: Se logra por medio de la extracción dental o extracción
parcial del diente (hemisección)
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 52
Terapia periodontal básica
Es la terapia encaminada a la eliminación y control del factor etiológico primario de la
enfermedad periodontal, la biopelicula.
OBJETIVOS:
Eliminar la placa bacteriana
Eliminar los factores retentivos de biopelicula
Controlar la inflamación de los tejidos periodontales
Preparar los tejidos para una posterior fase correctiva
Ambientación Periodontal
Se enfoca hacia el tratamientode los tejidos periodontales y el control de la placa bacteriana a
través de los siguientes procedimientos.
MOTIVACION Y EDUCACION DEL PACIENTE
¿Qué es la enfermedad periodontal?
¿Cuál es la caua de la enfermedad?
¿Cuáles son las secuelas de la enfermedad?
¿Cómo puede controlarsu enfermedad?
INSTRUCCIÓN EN HIGIENE ORAL
Instrucción
Observación
Supervisión continua
CONTROL MECANICO DE LA BIOPELICULA
Cepillo dental
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 53
Cepillado
Dentrificos
Limpieza interproximal
Seda dental
Otros elementos de limpieza interproximal
Raspaje y alisado radicular
AMBITACION DENTARIA
En la terapia periodontal básica esta encaminada a facilitar el control de placa mediante el
mejoramiento de las necesidad restaurativa, estética y funcionales del paciente.
ELIMINACION DE CARIES Y OBTURACIONES DESAPTADAS
Retención de biopelicula
Análisis radiográfico
Presencia enfermedad periodontal
Cambio en la flora subgingival
AJUSTE OCLUSAL Y TALLADO SELECTIVO
Reforma de superficie oclusales, creando un contacto armonioso entre los dientes superiores e
inferiores.
Indicado en trauma de oclusión, bruxismo.
FERULIZACION
Diseñado para inmovilizar y estabilizar dientes móviles.
Cuando la movilidad se debe a la altura reducida de los tejidos de soporte periodontal y estos
interfieren en la masticación y comodidad del paciente es necesario ferulizar.
RESTAURACIONES PROVISIONALES
Su finalidad es conservar las relaciones entre los dientes de soporte, a función, la inegridad pulpar
y la salud del periodonto.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 54
EXONDONCIA
Debido a razones periodontales aumentan con la edad.
Preservación de la salud periodontal
Después de tratar la periodontitis se debe realizar un mantenimiento periodontal con el dentista
o periodoncista de clínicas Propdental para mantener una salud periodontal adecuada.
Una vez realizado el tratamiento periodontal con la eliminación del calculo supra y subgingival,
el paciente debe tener conciencia de la necesidad e importancia del mantenimiento de las encías
para evita recaídas. Para ello recomendamos a nuestros pacientes que acudan a la clínica
Propdental cada 6 meses.
Los cuidados de higiene oral por parte del paciente después del tratamiento de la periodontitis
también son de extremada importancia en el mantenimiento del tratamiento realizado.
Las visitas de mantenimiento periodontal se realizan de 4 a 6 meses en clínicas Propdental.
Se inician con una exploración oral, dental y periodontal, para descartar o confirmar la existencia
de nueva patología. A continuación se realiza un sondaje para comparar con el sondaje inicial o
de la visita anterior, con el fin de valorar si el tratamiento es efectivo o no.
Se realiza una higiene de la boca completa para eliminar cálculo supragingival, seguido del
raspado de los dientes que presenten sangrado al sondaje o bolsas periodontales.
Posteriormente se lleva a cabo el pulido con pasta de profilaxis.
Fase de mantenimiento periodontal o fase IV de tratamiento de la periodontitis
Tras finalizar la terapia periodontal, la periodontitis podría volver a recidivar si las bacterias con
potencial patógeno vuelven a alcanzar valores que sobrepasan la resistencia del huésped.
Por eso podemos considerar a las enfermedades periodontales potencialmente crónicas. La
efectividad del tratamiento a largo plazo dependerá del mantenimiento periodontal y de un
equilibrio huésped-parásito. Conseguir este equilibrio depende fundamentalmente del paciente
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 55
mediante la eliminación diaria de la placa bacteriana. Esta cooperación del paciente es difícil de
mantener a lo largo del tiempo y frecuentemente se precisa ayuda del Periodoncista.
La fase de mantenimiento periodontal empieza justo después de terminar la fase I de
tratamiento. Mientras el paciente está en esta fase de mantenimiento, se realizan los
procedimientos quirúrgicos y restauradores necesarios. Esto asegurará que pueda conservarse
el grado de salud obtenido después de la fase higiénica.
Objetivos del mantenimiento periodontal
Objetivo principal: prevenir o minimizar la recurrencia y progresión de la enfermedad
periodontal en pacientes tratados.
Otros objetivos: prevenir y reducir la pérdida dental en el tiempo y diagnosticar y tratar otras
condiciones patológicas encontradas en la cavidad oral.
Éxito de la terapia periodontal
Numerosos estudios han demostrado que la eficacia del tratamiento periodontal depende de un
programa estricto de mantenimiento. Becker et al realizaron tres estudios en pacientes con
niveles similares de enfermedad periodontal. En el primero, los pacientes no recibieron
tratamiento y la media de pérdida dental por paciente fue de 0,36/año.
En el segundo, los pacientes fueron tratados pero no mantenidos, y la tasa de pérdida dental fue
de 0,22/año por paciente. En el tercer estudio los pacientes fueron tratados y mantenidos,
presentando una pérdida dental de 0,11/año por paciente.
Se puede concluir que el tratamiento periodontal es exitoso, pero la suma de un programa de
mantenimiento adecuado mejora el pronóstico de los dientes.
Éxito del mantenimiento periodontal
La terapia de mantenimiento junto a un buen control de placa bacteriana por parte del paciente
constituyen un factor clave en el éxito del tratamiento. Se ha demostrado que todas las
modalidades de tratamiento quirúrgico son de éxito sólo en presencia de un excelente control
de placa y buen mantenimiento.
Intervalos de mantenimiento
El intervalo de mantenimiento de 3 meses es el más comúnmente utilizado, pero puede acortarse
o alargarse en función de los parámetros clínicos y las necesidades individuales de cada paciente.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 56
El fundamento de realizar el mantenimiento cada 3 meses por el periodoncista de Propdental es
que se trata del tiempo requerido para la repoblación bacteriana bajo las encías después del
desbridamiento. Por tanto, un programa regular de mantenimiento parece crítico para conservar
la salud periodontal.
Cumplimiento del mantenimiento
Se trata de un problema constante en la práctica clínica de Propdental. Las razones principales
por las que el paciente no acude a estas citas periódicas son: miedo, coste del tratamiento, tipo
de tratamiento recibido previamente, falta de motivación y tabaquismo.
Evaluación del riesgo de recurrencia de la enfermedad periodontal
Se puede determinar en base a una serie de parámetros clínicos, como son los siguientes:
porcentaje de sangrado al sondaje, prevalencia de bolsas residuales superiores a 4 mm, pérdida
de dientes en el tiempo, pérdida de soporte periodontal en relación con la edad del paciente,
estado general y condiciones genéticas, y factores ambientales, entre los cuales destaca el
tabaquismo.
Los no fumadores y exfumadores de más de 5 años tienen menor riesgo de recurrencia, mientras
que los fumadores de menos de 10 cig/día y los fumadores moderados tienen un riesgo
moderado de progresión de la enfermedad.
Procedimientos del mantenimiento periodontal
En las visitas de mantenimiento se monitorizan distintos parámetros tal y como se realiza en la
1º visita del paciente:
1. Actualización de la historia médica y dental.
2. Examen periodontal.
3. Examen radiográfico puntual para comparar con registros previos.
4. Control de placa bacteriana: indicará la necesidad de un cambio de las técnicas
empleadas. El paciente necesita con frecuencia un refuerzo de las instrucciones y
motivación mediante estimulación positiva.
5. Desbridamiento supra y subgingival según parámetros clínicos.
6. Retratamiento de áreas seleccionadas.
• INDICE DE PLACA BACTERIANA
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 57
Placa dentobacteriana y actualmente identificado como biofilm bacteriano es un agregado de
bacterias que constituyen una comunidad bacteriana en áreas sin limpieza donde la dieta blanda,
pegajosa o poco detergente se deposita sobre las superficies dentales, se puede decir que 1 mg
Peso equivale a 1 mm de placa dentobacteriana, en la cual se encuentran más de 1x10 bacterias,
que puede llegar a desmineralizar el esmalte, produciendo caries dental o bien, filtrarse al tejido
blando, provocando una inflamación gingival Clínicamente la placa dentobacteriana no es no
visible a menos que sea muy abundante, o se empleen sustancias reveladorascomo la
BixaOrellana (pigmento natural extraído de sus semillas o algún saponífero) en tabletas o
solución, usada como colorante tiñendo la PDB en dientes, encías, lengua y otras estructuras
bucodentales. Son excelentes elementos auxiliares de la higiene bucal, porque proporcionan al
paciente una herramienta de educación y auto
-motivación para mejorar la eliminación mecánica diaria de la PDB a través del cepillado dental,
es sencilla de usar en los niños para adquirir un buen hábito bucal, constituye un medio primario
de prevención de la enfermedad bucal y está indicada para todos los seres humanos, a lo largo
de su vida
El control de placa dentobacteriana consiste en detectar la presencia de la PDB mediante un
examen clínico, se puede observar por medio de exploración visual, con exploradores dentales o
con sustancia reveladoras; datos que pueden ser registrados a través de los índices de placa
dentobacteriana para hacer evaluaciones y analizar sus resultados estadísticamente por medio
de escalas graduadas basadas en patrones establecidos.
ÍNDICE DE PLACA DENTOBACTERIANA (I.P.D.B)
Evaluación de la placa.
Hay muchos índices para medir la placa, miden a) la presencia de placa en los dientes o b) la
cantidad de placa acumulada sobre los dientes. En cualquiera de los casos es imprescindible el
uso de compuestos relevantes para volver visible la placa.
Evaluación de la presencia de placa de índice O'Leary.
La ficha utilizada permite la comparación de tres evaluaciones sucesivas de placa y sangrado. En
esta ficha cada diente está dividido en 4 sectores, que corresponden a sus caras mesial,
vestibular, distal y lingual. Una vez que el paciente recibe el compuesto relevante, se anotan los
resultados. Las caras mesial y distal se revisan dos veces: una durante la evaluación de las caras
vestibulares y una segunda vez cuando se evalúe la cara lingual.
El puntaje final se determina contando el número total de caras con placa, dividiendo este
número por la cantidad total de caras presentes en la boca y multiplicando por 100. Este puntaje
cuando se compara con otros obtenidos anteriormente, provee un método para que el paciente
reconozca su evolución.
Evaluación de la cantidad de placa presente.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 58
Método desarrollado por Silness y Löe mide la cantidad de placa depositada sobre la superficie
de todos los dientes presentes en la boca de acuerdo con los siguientes criterios:
Puntaje Criterios
0 No hay placa en la zona gingival.
1 Una placa que se adhiere al margen gingival libre y a la zona adyacente del diente.
2 Acumulación moderada de depósitos blandos dentro de la bolsa gingival, y/o adyacente
a la superficie dentaria.
3 Abundancia del material blando dentro de la bolsa gingival y/o sobre el margen gingival
y la superficie dentaria adyacente.
Este procedimiento da un puntaje a cada una de las cuatro unidades gingivales de los dientes
(vestibular, lingual, mesial y distal) que oscila entre 0 y 3; este es el índice de placa para la unidad
gingival. Los puntajes de las 4 zonas de un diente pueden sumarse y dividirse por 4 para dar el
ídice de placa del diente. Los puntajes de los dientes individuales (incisivos, premolares y
molares) pueden agruparse para designar el índice de placa de grupos de dientes. Sumando los
índices de los dientes y dividiendo por el número de dientes examinados, se obtiene el índice de
placa del paciente.
Ostrom y col.
Emplean el índice de Silness y Löe con el objeto de obtener una línea de base para las
comparaciones futuras, y como elemento educacional para el paciente. Después se emplea un
índice de placa simplificado, el de I.P.−6. Los puntajes de la placa se registran sólo para los 6
dientes (generalmente un par de molares superiores, incisivos inferiores y molares inferiores)
que tuvieron el índice más alto en el examen inicial. Totalizan entonces los puntajes de estos 6
dientes y obtienen un número entero en lugar de las fracciones decimales que aparecen cuando
se emplea el índice original de Silness y Löe. Ostrom y col aplican los mismos criterios generales.
Clínicamente proveen la misma información dado que la cantidad de placa y el número de
superficies dentarias cubiertas por ella están relacionadas positivamente y la hemorragia del
surco es uno de los primeros signos de inflamación gingival.
Motivacionalmente, lo que importa es que se registren los puntajes de manera que intente llegar
a valores cero. Desde el punto de vista de la evaluación, los puntajes decrecientes reflejan la
capacidad del paciente para lograr un buen control de placa y uso del hilo. Si los puntajes se
mantienen estacionarios, pude haber ocurrido una de dos cosas: 1) que los objetivos y
direcciones del programa no hayan sido claros y necesiten ser modificados, o 2) el paciente ha
alcanzado su límite y no puede obtenerse más progreso no importa cuanto esfuerzo se le
dedique.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 59
• Control mecánico de la placa.
De los varios métodos con que puede con que puede controlarse la placa, el más efectivo en el
momento actual es su remoción mecánica por medio del cepillo de dientes, el hilo dental y
algunos coadyuvantes; sin embargo estos procedimientos tienen sus limitaciones. Para el
paciente bien motivado y correctamente instruido que desea invertir el tiempo y el esfuerzo
necesarios, las medidas mecánicas son efectivas en el control de la placa.
Los procedimientos mecánicos pueden no ofrecer una solución completa al problema de la
prevención de la placa. Así la profesión dental debe continuar en la investigación de otros
procedimientos que no requieren tanta cooperación del paciente.
Se pude determinar con facilidad que un programa de control de placa es esencialmente un
programa educacional; primero educar al paciente en lo que es la placa y cuales son sus efecto,
y en segundo lugar como controlar esos efectos.
El éxito del tratamiento dependerá del deseo del paciente de controlar la placa.
Un control de placa debe ser llevado acabo paso a paso, al ritmo de la comprensión de cada
paciente lo permita. Con el objeto de no lastimar psicológicamente al paciente, debe tenerse
cuidado con la implicación de que la placa representa una falta de cuidado personal y de higiene.
El control de placa debe realizarse siguiendo las pautas:
1.− Aliviar la ansiedad del paciente.
2.− Determinar las necesidades educacionales del paciente.
3.− Hacer que el paciente reconozca y exprese sus propias necesidades.
4.− Relacionar las necesidades dentales con las psicológicas.
5.−Estimular la motivación.
6.− Establecer objetivos a largo y corto plazo.
7.− Comenzar la acción.
8.−Evaluar los resultados.
INTENSIDAD DE AFECTACIÓN
Una aproximación más profunda al conocimiento del problema de la caries dental consiste en
valorar la intensidad de afectación de la población.
Podemos utilizar, para ello, como unidades de medida la pieza o las superficies dentales. Si
empleamos como unidad de medida la pieza dental, lo que vamos a determinar es el promedio
de piezas afectadas por individuo.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 60
Para evaluar la afección por caries de la dentición definitiva se emplea desde 1938 (Klein, Palmer
y Knutson) el índice CAO o CAO (D).
Piezas definitivas cariadas + ausentes + obturadas
Índice CAO =−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−
Total de individuos reconocidos.
Su empleo está limitado a aquellos grupos de edad en los que la pérdida de las piezas dentales
se debe exclusivamente a la caries. Tiene el inconveniente de que no mide la intensidad de
afectación de la pieza, ya que tiene diferente pronóstico según el número de superficies
afectadas. Tampoco mide las necesidades de tratamiento.
Aún con estas limitaciones, el índice CAO está reconocido como el mejor y es el más utilizado de
los indicadores de la afectación de la población por la caries dental.
Para evaluar la afectación de la dentición temporal se utiliza el índice co.
Piezas temporales cariadas + obturadas
Índice co = −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−
Total de individuos reconocidos.
En el grupo etario de 6−14 años, que tienen dentición mixta, podemos utilizar el índice CAO−co,
que nos permite conocer la intensidad real de afectación por caries (promedio de piezas tanto
temporales como definitivas afectadas por individuo.
Pizas dfinitivas (cariadas + ausentes + obturadas + piezas temporales (cariadas +obturadas).
Índice CAO−co=
−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−
−−−−−−−
Total de individuos reconocidos.
Su importancia radica en que mide la intensidad real de afectación de la población.
La OMS utiliza el CAO (D), como el indicador de comparación del estado de salud dental entre
poblaciones distintas, definiendo el valor menor de 3 como meta a alcanzar en el año 2000 en el
grupo de 12 años de edad. El índice CAO, CAO−co y co en si no sirven para conocer las
necesidades de tratamiento, ni para valorar el tipo de tratamiento ya realizado. Así podemos
analizar las necesidades de tratamiento mediante la proporción de piezas cariadas del total de
piezas CAO, el grado de asistencia dental mediante la relación entre las piezas obturadas y el total
de piezas CAO y así mismo el grado de asistencia dental tardía mediante la proporción de piezas
ausentes divididas por piezas CAO.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 61
Piezas cariadas
Proporción de caries sin tratar =−−−−−−−−−−−−−−−−−−−−−−−−
Piezas C + A +
Podemos también valorar la afectación de determinados grupos de piezas.
Utilizando como unidad de medida la superficie dental, podemos hallar los índices CAO (S), co (S)
y
CAO−co (S), para lo que consideramos que cada pieza dental tiene 2 superficies proximales, 2
libres y , en las piezas posteriores, 1 oclusal (algunos autores consideran el borde incisal como
quinta superficie en los dientes anteriores).
N° de superficies de dientes permanentes cariadas + obturadas + ausentes
Índice Cao
(S)=−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−
−−−−−−−
N° de individuos reconocidos.
Su empleo ayuda a valorar el estado de afectación. Para estudios generales en los que queremos
conocer la afectación por caries dental, estos indicadores son suficientes.
También se puede conocer la afectación de las piezas dentales estudiando la proporción del total
de piezas presentes en la boca.
Piezas C + A + O
Proporción de afectación = −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−
Total de piezas revisadas
Para conocer la evolución de la caries, estudiaremos su incidencia, que mide el número de nuevas
piezas que se han cariao en un intervalo de tiempo.
Num. de nuevas piezas cariadas en un intervalo de tiempo.
Incidencia de caries =
−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−
Total de piezas o superficies revisadas.
• ISHO: Índice simplificado de higiene oral
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 62
En 1960. Greene y Vermillion crearon el índice de higiene bucal (OHI, por sus siglas en inglés oral
hygiene index); más tarde lo simplificaron para incluir sólo seis superficies dentales
representativas de todos los segmentos anteriores y posteriores de la boca. Esta modificación
recibió el nombre de OHI simplificado (OHI-S, por sus siglas en inglés oral hygiene index
simplifled). Mide la superficie del diente cubierta con desechos y cálculo. Se usó el impreciso
término desechos dado que no era práctico diferenciar entre la placa, los desechos y la materia
alba. Asimismo, lo práctico de establecer el peso y grosor de los depósitos blandos incitó a la
suposición de que en tanto más sucia se encontrase la boca, mayor sería el área cubierta por los
desechos. Esta inferencia también denota un factor relativo al tiempo, dado que mientras más
tiempo se abandonen las prácticas de higiene bucal, mayores son las probabilidades de que los
desechos cubran la superficie del diente.
El OHI-S consta de dos elementos: un índice de desechos simplificado (DI-S, por sus siglas en
inglés simplified debris index) un índice de cálculo simplificado (CI-S, por sus siglas en inglés
simplified calculus index). Cada uno se valora en una escala de O a 3. Sólo se emplean para el
examen un espejo bucal y un explorador dental tipo hoz o cayado de pastor ó una sonda
periodontal (OMS), y no se usan agentes reveladores. Las seis superficies dentales examinadas
en el OHI-S son las vestibulares del primer molar superior derecho, el incisivo central superior
derecho, el primer molar superior izquierdo y el incisivo central inferior izquierdo. Asimismo, las
linguales del primer molar inferior izquierdo y el primer molar inferior derecho.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 63
Cada superficie dental es dividida horizontalmente en tercios gingival, medio e incisal. Para el DI-S, se
coloca un explorador dental en el tercio incisal del diente y se desplaza hacia el tercio gingival, según los
criterios expuestos en el cuadro siguiente.
Criterio para calificar los componentes sobre los desechos bucales (DI-S) y el
cálculo (CI-S) en el índice de higiene oral simplificado (OHI-S)
Indice de desechos bucales (DI-S)
0 No hay presencia de residuos o manchas.
Desechos blandos que cubren no más de una tercera parte de la superficie dental
1 o hay presencia de pigmentación extrínseca sin otros residuos, sin importar la
superficie cubierta.
Decechos blandos que cubren más de una tercera parte, pero menos de la tercera
2
parte de la superficie dental expuesta
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 64
Residuos blandos que cubren más de la tercera parte de la superficie dental
3
expuesta
Indice del cálculo (CI-S)
0 No hay sarro presente
Cálculo supragingival que cubre no más de una tercera parte de la superficie
1
dental expuesta
Sarro supragingival que cubre más de un tercio, pero menos de dos terceras
2 partes de la superficie dental expuesta o hay presencia de vetas individuales de
cálculo subgingival alrededor de la porción cervical del diente, o ambos.
Sarro supragingival que cubre más de dos tercios de la superficie dental expuesta,
3 o hay una banda gruesa continua de cálculo subgingival alrededor de la parte
cervical del diente, o ambos
La calificación DI-S se obtiene por persona totalizando la puntuación de los desechos por
superficie dental y dividiendo el resultado entre la cantidad de superficies examinadas.
La valoración CI-S se practica colocando con cuidado un explorador dental en el surco gingival
distal y llevándolo en sentido subgingival desde el área de contacto distal hacia la mesial (una
mitad de la circunferencia dental es considerada como la unidad de calificación). El cuadro
anterior incluye los criterios para calificar el componente referente al sarro en el parámetro OHI-
S. La puntuación CI-S se obtiene por persona redondeando las calificaciones del cálculo por
superficie dentaria y dividiendo el resultado entre la cantidad de superficies examinadas. La
calificación OHI-S por perona es el total de las calificaciones DI-S y CI-S por sujeto.
A continuación se expresan los valores clínicos de la limpieza bucal respecto a los desechos que
es posible relacionar con las calificaciones DI-S agrupadas:
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 65
Adecuado 0.0 - 0.6
Aceptable 0.7 - 1.8
Deficiente 1.9 - 3.0
Los valores clínicos de la higiene bucal que pueden vincularse con las calificaciones OHI-S para
grupos son los siguientes:
decuado 0.0 - 1.2
Aceptable 1.3 - 3.0
Deficiente 3.1 - 6.0
La relevancia del parámetro 0HI-S es que, al igual que el índice de placa, es muy empleado en
todo el mundo y contribuye de manera considerable a la comprensión de la enfermedad
periodontal. También se empleó en los estudios Ten-State Nutrition Survey, NHS, NHANES y
HHANES. El alto grado de relación (r= 0.82)146 entre el 0HI-S y indice de placa permite, si se
conoce una de las dos calificaciones, calcular la otra mediante un análisis de regresión. La eficacia
principal del 0HI-S es su utilización en estudios epidemiológicos y en la valoración de los
programas de educación sobre la salud dental (ensayos longitudinales). También puede evaluar
el grado de aseo bucal de un individuo y puede, en grado más limitado, servir en estudios clínicos.
El índice es de fácil uso dado que los criterios son objetivos, el examen puede realizarse sin
demora y se puede alcanzar un nivel alto de capacidad de duplicación con un mínimo de sesiones
de capacitación.
• Control químico de la placa bacteriana
Los mecanismos de control de la placa bacteriana supragingival recomendados por Clínicas
Propdental incluyen los colutorios (de clorhedixina o lacer oros para mantenimiento), geles,
dentífricos, chicles, hilo dental e irrigadores de boca.
Colutorios
Es la forma más usada. La mayoría de agentes antiplaca se pueden hacer servir en forma de
colutorios. Eliminan poca placa proximal. Tienen un efecto limitado en bolsas periodontales
hondas.
Geles
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 66
Fase acuosa que tiene un humectante. No tiene agresivos ni agentes espumosos por lo que no
tiene interferencia en la biodisponibilidad del producto. La mayoría de agentes antiplaca son
compatibles con esta preparación.
Dentifrícos
Los dentifrícos contienen un gel que incluye agentes agresivos y antiespumosos.
Su función es dar gusto al producto y un efecto de limpieza con abrasivos para eliminar placa.
Se incorpora flúor para prevención de placa dental bacteriana. Esto es efectivo pero no siempre
hay una buena disponibilidad de los agentes antiplaca por ser una formulación compleja.
Clorhexidina
Digluconato de clorhexidina al 0.2% y 0.12%. Tiene una fuerte actividad antimicrobiana durante
7-12 horas.
Su Mecanismo de acción consiste en la reducción deposición película salivar y alteración de la
adherencia bacteriana a superficies dentales.
Es más eficaz sobre superficies limpias sin placa dental.
La clorhexidina es el más efectivo agente preventivo de la placa supragingival.
Los efectos secundarios del uso prolongado de clorhexidina es la tinción marrón de los dientes.
Antibioticos
Son inadecuados para el control de la placa dental supragingival.
Resultados poco convincentes debido a administración bajas durante cortos periodos de tiempo.
Desventajas: aparición de resistencias bacetrianas, reacciones de hipersensibilidad y
sobreinfecciones por hongos.
Listerine
Alteran la pared celular bacteriana con extracción de lipopolisacaridos y Ac. Lipoproteico,
reduciendo el potencial patogénico. Efectos secundarios: sensación quemazón y gusto amargo.
Tiene unos efectos moderados sobre la placa bacteriana (ligeramente superiores al triclosan pero
menores que los de la clorhexidina).
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 67
Triclosan
Es un agente antimicrobiano no iónico con propiedades antiinflamatorios. Solo tiene una
moderada acción inhibitoria de la placa dental. Los dentífricos con triclosan con copolímero han
mostrado que tiene efectos beneficiosos comparado con otros dentífricos sobre la placa y sobre
la gingivitis.
Compuestos de amonio cuaternario
Cloruro de benzalconio, cloruro de cetilpiridino y cloruro benzalmonio. Tienen una sustantividad
moderada: absorción inicial superior a la clorhexidina pero después disminuye.
Su actividad antimicrobiana igual o superior a la clorhexidina. Tiene un mecanismo de acción
cationica a pared celular con aumento de la permeabilidad y lisis, disminución del metabolismo
celular y disminución de la capacidad de la adherencia de las bacterias a las superficies dentales.
Fluoruros
Fluoruro de estaño 0.4%. actúan provocando una alteración del metabolismo y agregación
bacteriana.
Acción específica sobre calidad de placa. Actividad antimicrobiana relacionada con presencia del
estaño.
Oxigenantes con el bocarbonato
H2O2 solo o en combinación con bicarbonato sódico o sal. Sus efectos secundarios: Ulceraciones
orales, Hiperqueratosis, Candidiasis.
Biofilm dental
Se llama placa dental a una acumulación heterogénea de una comunidad microbiana variada,
aerobia y anaerobia, rodeada por una matriz intercelular de polímeros de origen salival y
microbiano. Estos microorganismos pueden adherirse o depositarse sobre las paredes de las
piezas dentarias. Su presencia puede estar asociada a la salud, pero si los microorganismos
consiguen los sustratos necesarios para sobrevivir y persisten mucho tiempo sobre la superficie
dental, pueden organizarse y causar caries, gingivitis (enfermedades de las encías) o enfermedad
periodontales.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 68
Las encías enrojecidas, inflamadas o que sangren pueden ser las primeras señales de una
gingivitis. Si la enfermedad es ignorada, los tejidos que mantienen a los dientes en su lugar
pueden comenzar a destruirse y eventualmente se pierden los dientes.
La placa dental se forma en la superficie de dientes, encía y restauraciones, y difícilmente puede
observarse, a menos que esté teñida. Su consistencia es blanda, mate, color blanco-amarillo. Se
forma en pocas horas y se elimina principalmente con el arrastre mecánico del cepillo dental.
Además, puede eliminarse con chorros de agua a presión como los que ofrecen los irrigadores
dentales. Lo más importante para su eliminación es el arrastre mecánico de la placa bacteriana.
Varía de un individuo a otro, y también varía su localización anatómica. Si la placa dental se
calcifica, puede dar lugar a la aparición de cálculos o sarro tártaro.
• Composición
La matriz intracelular + las bacterias + las células individuales.
Matriz intracelular
La matriz intracelular es un entramado orgánico con origen de bacterias, formado por restos de
la destrucción de bacterias y polisacáridos de cadena muy largas sintetizados por las propias
bacterias a partir de los azúcares de la dieta. Tiene tres funciones: sujeción, sostén y protección
de las bacterias de la placa.
Bacterias
Las bacterias de la placa dental son muy variadas: hay unos 200-300 tipos. Las características
bacterianas de cariogenicidad son las siguientes:
a) crecer y adherirse a la superficie dentaria.
b) sintetizar polisacáridos de los azúcares.
c) producir ácidos.
d) soportar bien en medios ácidos.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 69
Bacterias cariogénicas
a) Estreptococos: mutans, sobrinus, sanguis, salivalis. Son los que inician las caries. Tienen
propiedades acidúricas: desmineralizan el esmalte y la dentina.
b) Lactobacilus casei: Es acidófilo, continua las caries ya formadas, con proteolíticos:
desnaturalizan las proteínas de la dentina.
c) Actinomyces: viscosus, naeslundii. Tienen acción acidúrica y proteolítica.
La película adquirida
Se trata de un revestimiento insoluble que se forma de manera natural y espontánea en la
superficie dentaria. Es una película orgánica de origen salival, libre de elementos celulares, que
se forma por depósito selectivo de glucoproteínas salivales en la superficie de la hidroxiapatita
del esmalte dental.
Tiene dos funciones principales:
a) Protectora: se opone a la descalcificación dentaria, impidiendo la penetración de los ácidos
y el egreso de cationes desde la superficie del esmalte del diente hacia el medio.
b) Destructiva: permite la colonización bacteriana. Posee carga negativa y, gracias a puentes
de calcio, los microorganismos (primeramente los cocos) se adhieren a la misma.
Formación de la placa dental
Formada la película, es colonizada por microorganismos de la cavidad bucal (residentes); el
primer microorganismo que establece esta unión es el Streptococcus sanguis, posteriormente
seguirán coagregándose muchos más microorganismos, sobre todo del género Gram + y
aerobios.
Etapas de colonización
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 70
Deposición: fase en que los microorganismos incapaces de unirse químicamente o físicamente
a la película, se depositan en fosas y fisuras (defectos estructurales del esmalte) y estos defectos
los retienen. Esta fase es reversible porque no se unen, solo se depositan, es reversible porque
hay factores extrínsecos (cepillado) o intrínsecos (saliva) que impiden su unión. Sin embargo en
superficies lisas, como caras vestibulares si hay una adherencia y no una deposición. la adhesión
es dada por puentes iónicos que se forman entre la película adquirida y las bacterias cargadas
negativamente y que son unidas a través de iones cargados positivamente (calcio, hidrógeno,
magnesio) proporcionados por la saliva. Otro mecanismo que facilita esta adhesión son las
fimbrias y pilis que se unen a receptores específicos de la película. Una vez hay una adhesión
entre microorganismos y diente, se considera una unión irreversible para los factores intrínsecos,
sin embargo reversible para factores extrínsecos como el cepillado.
Coagregación: se refiere a los microorganismos que forman o formarán la segunda capa sobre
aquellos que están previamente adheridos a la película, puede ser homotípica (cuando se unen
2 microorganismos de la misma especie) o heterotípica (cuando se unen 2 especies distintas).
Crecimiento y maduración con la coagregación se siguen formando capas y más capas,
conforme aumentan las capas se darán una serie de cambios;
Cambios cuantitativos; se reproducen y aumentan en población los microorganismos
previamente adheridos o por coagregación de la misma o nuevas especies.
Cambios cualitativos; conforme se van agregando las capas, la placa se va volviendo más
gruesa, por lo tanto el ambiente o ecosistema de las capas más profundas cambiará
radicalmente, es decir pasará de un ambiente aerobio a uno anaerobio, esto entonces producirá
un cambio de la especie predominante en dichas áreas de la placa.
Diferencias entre placa supra y sub gingival
Placa supragingival
Es una placa que se ubica en las superficies de los dientes.
Placa organizada de manera oblicua y perpendicular al eje largo del diente.
Predominan bacterias Gram +.
En las capas más profundas predominan bacterias anaerobias estrictas y, en las más
superficiales, las bacterias anaerobias facultativas.
La actividad metabólica con que se relaciona, se basa en la fermentación láctica, o
producción de ácido láctico producto de la metabolización bacteriana de carbohidratos.
Se relaciona con la caries dental.
- Placa subgingival
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 71
Es una placa dental que por lo general se ubica en el surco gingival entre el diente y la encía.
Es una placa laxa, desorganizada, floja, no hay formación previa de película adquirida, ya que
la mayoría de las bacterias se depositan mas no se adhieren.
Predominan bacterias Gram -.
En un surco sano se encuentran más bacterias anaerobias facultativas y algunos Anaerobios
Estrictos, pero en un surco enfermo o con una periodontopatía se halla un predominio de
anaerobios estrictos.
La actividad metabólica de estas bacterias es por lo general proteolítica, hidrólisis de
proteínas, aminoácidos, lo que produce mal aliento (halitosis) y enfermedad periodontal.
• FUNCIONES DEL BIOFILM DENTAL
Tiene dos funciones principales:
1. PROTECTORA
se opone a la descalcificación dentaria, impidiendo la penetración de los ácidos y el
egreso de cationes (cargas positiva) desde la superficie del esmalte del diente hacia el
medio
2. DESTRUCTIVA
permite la colonización bacteriana. Posee carga negativa y, gracias a puentes de calcio,
los microorganismos (primeramente los cocos) se adhieren a la misma.
• Alteraciones provocadas por el biofilm
Las enfermedades más comunes de la boca producto del biofilm oral (placa bacteriana) son las
caries y las enfermedades gingivo-periodontales. Más del 90 % de la población argentina está
afectada por alguna de estas patologías.
Durante mucho tiempo la repercusión del estado de salud bucal en la salud general fue
desestimada como producto de la caída de la teoría de la “infección focal” que estuvo en boga
durante las décadas del 50 y 60, especialmente en los ámbitos profesionales y académicos. La
creencia popular de “focos séptico” que constituía un diente deteriorado nunca perdió vigencia
en el imaginario social.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 72
Hace ya unos treinta años, tanto la medicina como la odontología, comenzó a revisar esta idea
y con la ayuda de los progresos en microbiología, inmunología, biología molecular y los avances
tecnológicos de diagnóstico mejoraron el conocimiento del comportamiento de estas
enfermedades en diversos grupos poblacionales consolidándose el concepto de “factores de
riesgo”.
Un factor de riesgo implica un aumento de probabilidad de que una enfermedad ocurra. No es
precisamente la causa de la misma sino que comprende a los acontecimientos asociados a la
patología ya sea de carácter biológico, ambiental o sociocultural.
En este artículo se enfocará exclusivamente a la alteración de los tejidos bucales como posibles
factores de riesgo para la salud general. De las afecciones bucales producidas por el biofilm oral,
las enfermedades periodontales fueron las más estudiadas y publicadas por la literatura
odontológica como factores de riesgo asociadas a alteraciones sistémicas.(1) Entre ellas se citan:
a) Enfermedades cardiovasculares
b) Resultados adversos del embarazo (bajo peso al nacer, partos prematuros)
c) Enfermedades respiratorias
d) Evolución de la diabetes
La posibilidad biológica del pasaje de bacterias y productos inflamatorios al torrente sanguíneo
(bacteriemia) por maniobras odontológicas es bien sabido por la profesión médica que
recomienda cobertura antibiótica en pacientes con lesiones en las válvulas cardíacas o
portadores de prótesis valvulares. Pero actualmente existe suficiente evidencia científica de la
posibilidad de bacteriemias diarias asintomáticas durante la masticación y el cepillado de dientes
provenientes de las encías y tejidos de soporte dentario inflamados, como fuente importante de
patógenos y mediadores químicos que participarían en la iniciación o desarrollo de las
enfermedades anteriormente citadas.
La Enfermedad Periodontal como riesgo de enfermedades cardiovasculares
La periodontitis, una infección crónica muy común de los tejidos que rodean los dientes, se
asocia con niveles elevados de proteína C-reactiva (PCR) y otros biomarcadores de enfermedades
inflamatorias. Estudios de cohortes y casos y controles han demostrado que la periodontitis está
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 73
asociada con la disfunción endotelial de la aterosclerosis y un mayor riesgo de infarto de
miocardio.
En modelos experimentales, se ha demostrado que los patógenos periodontales pueden
promover la agregación plaquetaria y el desarrollo de ateromas. Hallazgos histológicos de
presencia de bacterias provenientes de bolsas periodontales infectadas en ateromas, parecen
demostrar el rol que tienen en la formación de los mismos y se constituyen como indicadores de
riesgo para el infarto de miocardio por obstrucción de las arterias coronarias.
De Steffano y col examinaron a 10.000 norteamericanos durante 17 años y observaron que los
pacientes con enfermedades periodontales tenían un 25% más probabilidades de riesgo de
cardiopatía coronaria. Como contrapartida, el tratamiento de las periodonciopatías en personas
con afecciones cardiovasculares, mostraron el mejoramiento de la función endotelial como una
protección endógena contra la ateroesclerosis.
La Enfermedad Periodontal como riesgo de partos prematuros y nacimiento de niños de bajo
peso
Hace unos años muchos trabajos de investigación observaron una fuerte asociación entre la
presencia de periodontitis avanzada en la madre y el aborto espontáneo, partos prematuros y
bebés de muy bajo peso al nacer. Además se ha reportado la presencia de anticuerpos fetales
contra los patógenos de bacterias asociadas a la enfermedad periodontal.
Entre los mecanismos postulados para explicar la influencia de la inflamación de las encías de la
madre en su organismo y el de su hijo estaría la acción de las toxinas bacterianas que llegarían a
la placenta y liberarían prostaglandinas o por la liberación desde la bolsa periodontal inflamada
de citoquinas que actuarían sobre la placenta participando en la iniciación del trabajo de parto.
Las mujeres con enfermedad periodontal puede experimentar más frecuente y grave bacteriemia
que las mujeres periodontalmente sanas. Como resultado, la cavidad uterina pueden llegar a ser
expuesto o colonizados por bacterias periodontales o sus productos derivados (por ejemplo,
lipopolisacáridos) provocando una cascada inflamatoria que conduce a un parto prematuro. Un
segundo supuesto mecanismo no requiere de las bacterias orales para colonizar la cavidad
uterina. Por el contrario, las citoquinas generado en el tejido periodontal enfermo puede entrar
en la circulación sistémica y precipitar una cascada similar, lo cual induciría al parto pretérmino
espontáneo.
Aunque hay investigaciones contradictorias sobre la asociación entre enfermedad periodontal y
los resultados adversos del embarazo, existe evidencia que el tratamiento periodontal puede
contribuir a la mejora de resultados del parto. La terapia periodontal no quirúrgica es segura
durante el embarazo, y, si está indicado, debe iniciarse tan pronto como sea posible para reducir
la inflamación. Es responsabilidad del odontólogo prevenir y tratar las enfermedades bucales con
la finalidad de mejorar la calidad de vida de la mamá y el futuro bebé.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 74
La Enfermedad Periodontal como riesgo de enfermedades respiratorias
La relación entre las enfermedades periodontales y afecciones respiratorias ha sido estudiada
ampliamente y básicamente los aspectos involucrados para que se dé esta asociación son:
pacientes de edad avanzada, respuesta inmune deprimida, pacientes con obstrucciones
pulmonares crónicos, pacientes hospitalizados. Las patologías más frecuentes reportadas son
neumonías bacterianas, bronquitis, EPOC y abscesos pulmonares. Se cita a la broncoaspiración
de bacterias periodontopáticas y a la colonización del tracto respiratorio, facilitado por enzimas
salivales, como probables mecanismos de llegada de estos patógenos al pulmón. Además la
liberación de citoquinas del proceso periodontal afectaría el endotelio vascular y el epitelio
respiratorio.
Existen recomendaciones de tratamientos periodontales simples para atenuar las consecuencias
de las enfermedades pulmonares que podrían ser graves en pacientes mayores.
Enfermedad Periodontal y Diabetes
Además de la conocida influencia de la diabetes como factor de riesgo para la patogénesis,
progresión y respuesta al tratamiento de la periodontitis, cada vez más se acumula evidencia
científica que da cuenta de una acción inversa : la periodontitis aumenta la severidad de la
diabetes mellitus al complicar el control metabólico y viceversa que explicaría la mayor
destrucción tisular observada en pacientes diabéticos periodontales, estableciendo que la
relación entre periodontitis y diabetes mellitus sea bidireccional.
El mecanismo biológico aceptado en la actualidad que intenta explicar el porqué los pacientes
diabéticos presenten periodontitis más severas, es la acumulación de producto finales de la
glicosilación que afectaría la migración y la fagocitosis tanto de polimorfonucleares como de
mononucleares, resultando en el establecimiento de una flora subgingival que por maduración
se transforma en anaerobia gramnegativa. Esto va a desencadenar la secreción de mediadores
solubles que promovería la destrucción del tejido conectivo y la reabsorción ósea, y el
establecimiento de un estado de resistencia de los tejidos frente a la insulina. Simultáneamente
por otro lado, la infección periodontal también inducirá a un estado de resistencia de los tejidos
frente a la insulina contribuyendo a la hiperglucemia. La relación que se establece entre diabetes
mellitus y periodontitis, resulta por lo tanto en una mayor severidad de la periodontitis y una
mayor dificultad para controlar los niveles de glucosa en sangre en pacientes diabéticos.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 75
El control glucémico es el componente más importante en el mantenimiento de la salud oral en
personas con diabetes y a su vez el mantenimiento de la salud bucal es un imperativo para los
pacientes diabéticos porque es considerable la reducción adicional de la carga inflamatoria que
resultaría positiva para una mejor salud general.
El impacto del estado de salud bucal en el bienestar integral de las personas, a la luz de las
investigaciones con alto grado de evidencia científica, está marcando una tendencia en la
comunidad médica-odontológica en el tratamiento y la prevención de las enfermedades orales
y, seguramente, contribuirá a la transformación de la perspectiva de las políticas sanitarias de
alcance comunitario.
Imagenología
• Diagnóstico radiográfico de alteraciones periodontales
Para una evaluación radiológica periodontal completa, debemos observar el estado de las
siguientes estructuras periodontales :
1. HUESO ALVEOLAR o TABIQUE INTERDENTAL:
La imagen radiográfica tiende a presentar pérdida ósea menor que la real. La diferencia entre
la altura real de la cresta alveolar y la altura que aparece en la radiografía varía de 0 a 1.6 mm.
a) Lámina Dura o Hueso Cortical:
Porción de hueso alveolar que cubre el alveolo que se presenta como un delgado borde
radiopaco junto al ligamento periodontal y la cresta. Radiograficamente aparece como una línea
blanca continua La lámina dura representa la superficie ósea que reviste el alveolo dentario, la
forma y la posición de la raíz, y los cambios en la angulación de los rayos X producen variaciones
considerables en su aspecto. Es por esto que para poder observarla adecuadamente, y con
fines de diagnóstico periodontal, se evalúa en la toma de radiografías interproximales y
periapicales con buena técnica de paralelismo. En la evaluación radiológica esta se describe
como:
a.1 Continua:
a.2 Discontinua:
b) Apófisis Alveolar, Hueso Esponjoso o Cresta Alveolar:
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 76
Porción del hueso alveolar que en la radiografía tiene un aspecto de red.
En condiciones normales, esta se localiza a 1.5 -2.0 mm apical a la unión cemento esmalte;
espacio conocido como GROSOR BIOLÓGICO, que permite la adhesión epitelial e
inserción de fibras de tejido conectivo. La magnitud de la pérdida ósea se estima como
la diferencia entre la altura del hueso fisiológico del paciente y la altura del hueso
residual. En la evaluación radiológica esta se describe como:
b.1 Altura de cresta ósea normal
b.2 Altura de cresta ósea disminuida
- En condiciones normales, tanto el ancho como la forma de la cresta varían según la
convexidad de las superficies dentales y la posición de las piezas con respecto a la altura de las
uniones cemento esmalte de los dientes contiguos. La angulación de la cresta suele ser paralela
a una línea imaginaria que se traza entre las uniones cemento-esmalte de las piezas dentarias
vecinas.
Cuando la altura de las cresta ósea se encuentra disminuida, el grado de pérdida ósea se
define en tres formas ; las cuales, junto con los aspectos clínicos e historia médica, contribuirán
a la formulación de un diagnóstico periodontal :
b.2.1 Patrón
b.2.2 Distribución
b.2.3 Gravedad o severidad
b.2.1 Patrón:
Utilizando como siempre, la unión cemento esmalte de los dientes adyacentes como plano de
referencia para determinar el patrón de pérdida ósea, la cual puede presentarse de dos formas:
Vertical, pérdida ósea angular:
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 77
Estos defectos son los que tienen dirección oblicua, para dejar en el hueso un surco socavado
a lo largo de la raíz;, por lo tanto, no se observan en un plano paralelo a la unión cemento
esmalte de los dientes adyacentes. Los defectos verticales interdentales se pueden reconocer
radiológicamente, aunque las tablas óseas gruesas los enmascaran algunas veces. Pueden
aparece defectos óseos en las tablas palatinas, bucales y linguales, pero éstos no son visibles en
las radiografías.
Horizontal o menoscabo óseo horizontal:
Es la forma más común de pérdida ósea en la enfermedad periodontal. La altura de hueso
se reduce pero su margen permanece paralelo a las uniones cemento esmalte de los
dientes adyacentes.
b.2.2 Distribución:
Signo diagnóstico importante. Señala dónde están los factores destructivos locales en
diferentes zonas de la boca y en superficies distintas del mismo diente. La distribución se
nombra de dos formas:
Localizada: si se presenta en área aisladas y afecta únicamente a un 30% de las piezas
presentes en boca.
Generalizada: si esta se presenta de manera uniforme en un porcentaje mayor al 30% de piezas
afectadas.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 78
b.2..3 Gravedad:
Esta mide el grado de severidad de la pérdida ósea con respecto a las raíces de las piezas
dentarias. Idealmente, se mide como el porcentaje de pérdida de la cantidad normal de hueso
en cada una de las piezas dentarias.
Ligera: Ligeros cambios en la cresta alveolar (discontinuidad de lámina, ligera o nula la
pérdida de altura ). Estos cambios pueden ir mayor de 0 a un 10%.
Moderada: Pérdida ósea del 10 al 33% (no va más allá del tercio cervical de la raíz.)
Grave o severa: pérdida ósea del mayor del 33% ( abarca los tercios medio y apical de la raíz)
c) Rarefacciones:
Cambio de densidad que muestra una imagen más roentgenoluscente en comparación con el
resto de la trabécula ósea. Tres tipos de rarefacciones a nivel periodontal:
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 79
Interproximal: la cual se evidencia en los cambios roentgenolscentes a nivel de la cresta
interproximal.
Area Periapical: lesiones que son resultado de la muerte pulpar. Muchas veces pueden
combinarse con lesiones de origen periodontal (lesiones endo-periodontales). Se observan
como una radiolucencia en el ápice de la raíz. En el caso de una lesión endo-periodontal, la
zona radiolúcida abarca desde la región apical hacia la parte más coronal de la cresta
interproximal.
Area de furcaciones : aunque su diagnóstico definitivo se
establece mediante el examen clínico, la radiografías son un auxiliar útil en su detección,
aunque muchas veces las lesiones furcales, en sus etapas iniciales, pueden no ser visibles
radiológicamente aunque sí pueden ser detectadas mediante el examen clínico por medio
del sondeo. El diagnóstico radiológico de la furcas, también puede verse alterado cuando
existen variaciones en la técnica radiográfica que muchas veces pueden ocultar la presencia
de las mismas.
Con el fin de facilitar la identificiación radiográfica de las lesiones de furcación, se sugiere aplicar
los siguientes criterios diagnósticos:
• En caso de encontrar pérdida ósea en las raíces vecinas a la zona de furcación, deberá
sospechar de cualquier cambio radiográfico mínimo y corroborar el mismo clínicamente.
• La menor radiolucencia que observe en el área de furcación, y donde observe los
contornos de las trabéculas, es indicio de lesión de furcación.
• Cuando exista el hallazgo de una pérdida ósea avanzada en una sola raíz molar, pude
suponerse que la furcación también está afectada.
Abcesos periodontales: Se observa como una zona radiolúcida discreta en el sector lateral de
la raíz, aunque muchas veces, esta lesiones pueden ser detectada clínicamente pero no ser
visibles en la radiografía, debido a la agudeza de la lesión.
2. LIGAMENTO:
a) Ensanchamiento del espacio del ligamento periodontal
(el valor normal es de 0.25 mm +/- 50% -- de 0. 13 a 0. 38 de mm).
El clínico debe ser muy observador en este aspecto, ya que la detección de un ensanchamiento
del espacio del ligamento periodontal suele depender también de la proyección de la película.
En caso de detectarlo, puede atribuirse la causa a Trauma oclusal de la pieza, lo cual deberá ser
evidenciado en el examen clínico periodontal junto con los signo clínicos propios de TO
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 80
(movilidad dentaria, presencia de facetas de desgaste., profundidad de la bolsa y análisis de
hábitos y contactos oclusales)
3. RAÍZ
a) Enanismo radicular:
El largo de la raíz guarda relación directa con la cantidad de inserción que sostiene al diente. Se
sobreentiende que mientras más larga sea la raíz, mejor soporte periodontal deberá tener, y
menor el riesgo de pérdida ante una enfermedad periodontal.
Se considera como normal la proporción mínima de 1 x 1.5;, es decir , que por una corona, la
pieza deberá tener la longitud de una corona y media en su raíz. Este dato puede no ser
relevante cuando el paciente no padece de alteraciones radiológicas a nivel de sus tejidos
periodontales, pero llega a ser de relevancia diagnóstica en el momento en que esta proporción
se ve disminuida y el soporte periodontal está siendo afectado. Por lo tanto, esto deberá ser
considerado para el pronóstico y tratamiento integral del paciente.
Radiológicamente, con la sonda periodontal, el clínico puede medir la longitud de la corona
desde su porción inciso-oclusal hacia la unión cemento esmalte, y luego comparar esta medición
con la longitud de la raíz en milímetros.
NOTA: Por lo tanto, es importante considerar que existe el mayor riesgo en un paciente con
pérdida ósea y bolsas periodontales de 5 mm n una pieza cuya raíz mida 10 mm, que en un
paciente con la misma pérdida pero cuya raíz llegue a medir 15 milímetros.
b) Reabsorción radicular externa :
Reabsorción en superficie :
La presencia de esta está relacionada con dientes reimplantados, fuerzas mecánicas anormales,
traumatismos, inflamación crónica, tumores y quistes, dientes impactados u otras causas
idiopáticas. Generalmente afecta la región apical de las piezas dentarias, por lo que en las
radiografías, esta región se ve roma y la longitud de la raíz se ve más corta. La lámina dura y el
hueso alrededor del ápice romo se ven normales. Este hallazgo radiológico es asintomático por
lo que clínicamente no es detectable.
b.1. Reabsorción inflamatoria Externa:
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 81
Así se le conoce a la presencia de una lesión inflamatoria en los tejidos
periodontales adyacentes a un proceso de reabsorción. Existen dos formas principales de
reabsorción, y ambas se deben a la destrucción de los cementosblastos y cementoide.:
• Reabsorción radicular inflamatoria periférica PIRR:
Los factores activadores de osteoclastos están provistos por una lesión inflamatoria en los
tejidos periodontales adyacentes.
Se puede atribuir esta lesión a falta de formación de epitelio de unión luego de un trauma o
detartraje y alisado excesivos, en donde el área dañada es repoblada por tejido conectivo, el
cual contiene células inflamatorias que, en presencia de alguna lesión, reconocerán a los
factores activadores de osteoclastos dela superficie radicular, iniciándose así la reabsorción.
La reabsorción suele estar situada cervicalmente y por ello también se le conoce como
“Reabsoción radicular cervical”. Sin embargo, en paciente con periodonto disminuído, suele
llamarse “ Reabsorción subósea” y “Reabsorción invasora supraósea canalicular”
Radiográficamente esta lesión sólo puede identificarse cuando ya ha alcanzado cierto tamaño,
a menudo es posible distinguir el contorno de la raíz dentro del área radiolúcida. Como
generalmente estas lesiones se localizan en el tercio cervical y proximal, pueden confudirse con
caries, pero la presencia de sangrado profuso y tejido de granulación, en combinación con un
fondo cavitario duro, confirmará el diagnóstico.
• Reabsorción radicular inflamatoria externa EIRR:
Aquí, el estímulo para la reabsorción proviene de una pulpa necrótica infectada, y muchas veces
es una complicación debida a traumatismo dentario. La reabsorción osteoclástica, avanzará en
la dirección del tejido pulpar infectado y dentina.
Los primeros signos radiográficos de reabsorción después del trauma no serán detectables,
hasta después de varias semanas.
c) Hipercementosis:
Es la deposición excesiva de cemento en las superficies radiculares, como resultado de una
supraerupción, inflamación o traumatismo o muchas veces sin causa aparente.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 82
Radiológicamente se observa como una cantidad excesiva de cemento, a lo largo de toda o parte
de la superficie radicular. El área afectada con mayor frecuencia es la apical que se observa
agrandada y bulbosa, y se ven separadas del hueso alveolar, por el espacio del ligamento
periodontal, que es de aspecto normal. No existen síntomas asociados y clínicamente no es
posible detectarla.
d) Anquilosis (Reabsorción sustitutiva)
Se conoce como anquilosis a la fusión que existe entre el hueso y el diente, es decir, ausencia
del ligamento periodontal. Según Andreasen (1981), se dice que la anquilosis es una forma de
curación de la reabsorción de la superficie radicular, que desde un punto de vista clínico, no es
deseable. Este tipo de reabsorción origina una sustitución de los tejidos dentarios duros por
hueso, de ahí su denominación.
Radiológicamente, la anquilosis se observa con una ausencia o desaparición del ligamento
periodontal, sin embargo, aún en los dientes no anquilosados. Andersson y cols. (1985)
demostraron que la percusión y la movilidad del diente son instrumentos diagnósticos más
sensibles que la radiografía, en las etapas iniciales de la anquilosis.
e) Fracturas radiculares:
Fractura radicular horizontal:
Son menos frecuentes que las de la corona, y son resultado de algún tipo de trauna. Las raíces
se pueden fracturar a cualquier nivel de su longitud.
Si el haz de rayos X es paralelo a la fractura, ésta se ve como una línea radiolúcida nítida en la
radiografía, sino está paralela, las áreas adyacentes de la estructura dental obstruyen el sitio de
la fractura. Con el tiempo, las fracturas radiculares por lo regular aumentan de tamaño, debido
al desplazamiento de fragmentos, hemorragia o edema; por lo tanto, aunque una fractura pase
inadvertida al principio, se le identificará en una radiografía que se le tome después.
Fractura radicular vertical:
Estas se definen comom fracturas longitudinales, más o menos oblicuas al eje mayor del diente.
Pueden atravesar el diente en distintas direcciones (mesiodistal o vestibulolingual), y pueden
afecta o no a la cámara pulpar. Como resultado de la proliferación microbiana en el espacio de
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 83
la fractura, el ligamento periodontal adyacente se convertirá en asiento de una lesión
inflamatoria que causará la destrucción de las fibras del tejido conectivo y del hueso alveolar.
Radiológicamente, la destrucción puede manifestarse de varias maneras. El defecto
radiográfico puede ser similar a los hallados en lesiones endodónticas y periodontales. En otros
casos, el aspecto es atípico. Un ensanchamiento del ligamento periodontal a lo largo de uno o
ambos lados de la superficie radicular puede indicar la presencia de una fractura radicular. Un
delicado halo de radiolucidéz apical es otro ejemplo de lesión radiográfica.
Esta lesión, como todas las anteriores deben ser confirmadas mediante el examen clínico,
presentándose síntomas marcados como: dolor, sensibilidad y formación de abcesos múltiples
(como racimos de uvas). El dato clínico relevante que confirma el diagnóstico de fractura
vertical es la profundización local y estrecha de una bolsa periodontal asociada a esta fractura.
El diagnóstico de las fracturas verticales es a menudo difícil porque no es fácil detectar la
fractura en el examen radiológico a menos que haya una clara separación de los fragmentos.
Muchas veces sólo la clínica y los síntomas pueden conducirnos a su diagnóstico, aunque
algunas veces el hallazgo debe confirmarse con la exposición quirúrgica de la raíz.
Restos radiculares:
Se tomará como resto radicular a toda pieza dental, que por caries o fractura se encuentre tan
destruida, que su rehabilitación no esté indicada y por lo tanto, deba ser extraída de la cavidad
oral.
5. FACTORES IRRITANTES O PREDISPONENTES:
a) Cálculos:
Calcificaciones petrificadas formadas en coronas y raíces que se forman debido al
endurecimiento de la placa bacteriana.
Radiograficamente, se observan como opacidades en formas diversas de punta aguda o
irregulares, que se extienden desde la superficie radicular proximal (como zonas anulares,
proyecciones nodulares o radiopacidades lisas).
La presencia radiológica de los cálculos, nos puede orientar en cuanto al grado de mineralización
de los mismos (según el grado de radiopacidad que éstos presenten), pero el número no es
indicativo del grado de severidad de la enfermedad periodontal.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 84
b) Restauraciones:
Se debe enfatizar en las restauraciones que tienen un compromiso con el periodonto, como lo
son las Restauraciones Clase II y la Prótesis Parcial fija específicamente. Estas se tipificarán en
base a dos situaciones:
b.1. Deficientes (empaques de comida)
b.2. Sobrecontorneadas
c) Posición de las piezas dentarias con respecto a las adyacentes:
Apiñamiento dentario:
Se observa como una sobreposición de los puntos de contacto de las coronas dentarias,
lo cual dificulta la detección de caries en esta región.
Diastemas
No hay existencia de puntos de contacto próximos, por lo que se observan espacios
interproximales que pueden ser de menos de un milímetro hasta de varios milímetros de
amplitud.
Espacios edéntulos
Son espacios en donde las piezas dentales están ausentes, por lo tanto no existe periodonto.
Estos espacios son considerados en la evaluación radiológica periodontal, únicamente para
evaluar el periodonto de las piezas que los limitan.
Saliva
La saliva es un fluido líquido de reacción alcalina complejo, algo viscoso producido por las
glándulas salivales en la cavidad bucal e involucrado en la primera fase de la digestión.
Producción
Se estima que la boca está humedecida por la producción de entre 1 y 1,5 litros de saliva al día,
si la persona está hidratada. Durante la vida de una persona se generan unos 43,800 litros. Esta
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 85
cantidad de saliva es variable, ya que va disminuyendo conforme aumenta la edad y debido a
diferentes tratamientos.
La producción de saliva está relacionada con el ciclo circadiano, de tal manera que por la noche
se segrega una mínima cantidad de saliva.
La saliva es segregada por las glándulas salivares mayores parótida y submaxilar (80-90 %) en
condiciones estimuladas, mientras que las glándulas sublinguales producen sólo el 5 % del total.
Las glándulas menores son responsables básicamente de la secreción en reposo y contribuyen al
5-10 % del total de saliva secretada.
La disminución patológica de saliva recibe el nombre de hiposalivación o hiposialia, mientras que
la sensación de sequedad bucal se denomina xerostomía, y la producción excesiva, sialorrea.
La medición de la producción de la saliva se llama sialometría.
• Características y composición de la saliva
La saliva es un líquido transparente y de viscosidad variable, lo que se atribuye al ácido siálico. Es
inodora como el agua.
La composición y pH de la saliva varían en función de los estímulos (como el olor o la visión de la
comida). El pH salival normal oscila entre 6,5 y 7.4
La composición de la saliva es similar a la del plasma y se caracteriza por los siguientes
componentes:
Agua: Representa más del 99 %.5 6 Permite que los alimentos se disuelvan y se pueda percibir su
sabor a través del sentido del gusto.
Iones cloruro: Activan la amilasa salival o ptialina.
Bicarbonato y fosfato: Neutralizan el pH de los alimentos ácidos y de la corrosión bacteriana.
Moco: El contenido de mucina, glicoproteína fundamental de la saliva, produce la viscosidad
necesaria para funciones lubricantes y de formación del bolo alimenticio que facilita la deglución
a lo largo del tubo digestivo, sin dañarlo.7
Lisozima: Es una sustancia antimicrobiana que destruye las bacterias contenidas en los alimentos,
protegiendo en parte los dientes de la caries y de las infecciones.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 86
Enzimas: Como la ptialina, que es una amilasa que hidroliza el almidón parcialmente en la boca,
comenzando la digestión de los hidratos de carbono. La lipasa lingual inicia también la digestión
de grasas.7
Estaterina: Con un extremo amino terminal muy ácido, que inhibe la precipitación de fosfato
cálcico al unirse a los cristales de hidroxiapatita. Además, también tiene función antibacteriana y
antifúngica.
Otras sustancias: La saliva contiene también inmunoglobulinas específicas, transferrina y
lactoferrina. En 2006 investigadores franceses del Instituto Pasteur identificaron una sustancia
en la saliva humana que llamaron Opiorfina, similar a la encontrada en ratas y vacas, que es hasta
seis veces más potente que la morfina para calmar el dolor.8 9
Calcio: La saliva está saturada de Ca2+, con lo que se evita que los dientes lo pierdan y ayuda a
digerir el alimento.
• Tipo de secrecion de saliva
1. Acinos serosos:
- Estos producen ptialina (inicia la digestión de almidones y azúcares)
- se localizan en las parótidas y en las glándulas submaxilares.
2. Acinos mucosos:
- Produce muscinas lubrica para proteger la mucosa y facilitar la deglución y ayudar a la
formación del bolo alimenticio.
Se localizan en las glándulas sublinguales y submaxilares predomina en las glándulas menores.
3. Acinos mixtos:
- Están compuestos de un acino mucoso y casquete seroso que drena en el mismo conducto.
- Pueden encontrarse en Las submaxilares, Sublinguales principalmente y algunas glándulas
menores.
• Funciones
En los humanos y mamíferos, así como en los reptiles la saliva es muy importante para:
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 87
Mantener el pH neutro, es decir a 7,4. Esta capacidad tamponadora del medio al neutralizar el
medio ácido producido tras las comidas evita la desmineralización del esmalte dental y la
acumulación de sarro que se produce con un pH básico.
Cicatrización: Además de favorecer la mineralización del esmalte de los dientes por su capacidad
tamponadora, la saliva contiene también un factor de crecimiento epidérmico que facilita la
cicatrización de la mucosa bucal lesionada.10
Función digestiva: Por el efecto de las enzimas que contiene, al mezclarse con el alimento junto
con la masticación lo transforma en bolo alimenticio, iniciando la digestión de carbohidratos y
grasas y facilitando la deglución.
Función gustativa: la saliva permite que las partículas sápidas (responsables del sabor) de los
alimentos, alcancen y estimulen químicamente los corpúsculos gustativos en la cavidad oral
especialmente en la lengua. Por eso la sensibilidad gustativa es menor cuando disminuye la
secreción salival por la edad avanzada, efectos de ciertos medicamentos o por trastornos
patológicos.
Lubricar la cavidad oral, además de facilitar la primera fase de la digestión y la deglución, en la
especie humana es importante en la expresión oral al facilitar la articulación de las palabras.
Mantener el equilibrio hídrico, al disminuir su producción por deshidratación envía un mensaje
de alarma al organismo produciendo la sensación de sed.
Protección: La saliva por su composición enzimática, especialmente por la lizosima, las
inmunoglobulinas y las proteínas como la muramidasa y la lactoferrina, defiende la cavidad oral
de la infección bacteriana. Asimismo, en especies como las serpientes venenosas y de cierto tipo
de musaraña, como el almiquí o solenodon, el veneno que las protege de depredadores y
enemigos es saliva modificada.
La saliva del dragón de Komodo tiene varios tipos diferentes de bacterias muy virulentas que
según la hipótesis de algunos estudiosos provocan una septicemia en su presa, que muere a las
pocas horas y permite al animal cazarla sin esfuerzo. En 2009 investigadores encontraron
sustancias tóxicas en la saliva de esta especie lo que pone en entredicho la hipótesis anterior y
plantea la del veneno como su arma depredadora principal.
CURSO CEAACES ODONTOLOGÍA – GRUPO CAPEI OMEGA 88
Vous aimerez peut-être aussi
- Atlas terapéutico de blanqueamiento dentalD'EverandAtlas terapéutico de blanqueamiento dentalÉvaluation : 2 sur 5 étoiles2/5 (1)
- Overbite OverjetDocument2 pagesOverbite OverjetFedericoQuishpe92% (60)
- Bioquimica de Laguna y Piña 8VA Edicion PRINTDocument1 446 pagesBioquimica de Laguna y Piña 8VA Edicion PRINTFreddy Edwin Quezada100% (1)
- Atlas de Detalles Constructivos Rehabilitacion - Peter BeinhauerDocument249 pagesAtlas de Detalles Constructivos Rehabilitacion - Peter BeinhauerFreddy Edwin Quezada92% (12)
- Reconstrucción de dientes endodonciados: Pautas de actuación clínicaD'EverandReconstrucción de dientes endodonciados: Pautas de actuación clínicaÉvaluation : 5 sur 5 étoiles5/5 (4)
- Odontología mínimamente invasiva y agentes remineralizantes: Prevención y reparación de la caries dentalD'EverandOdontología mínimamente invasiva y agentes remineralizantes: Prevención y reparación de la caries dentalPas encore d'évaluation
- Tratamiento de Bolsa Periodontal y FerulizaciónDocument40 pagesTratamiento de Bolsa Periodontal y FerulizaciónDAVID CUEVA JAUREGUIPas encore d'évaluation
- Ficha Clinica PeriodontalDocument49 pagesFicha Clinica PeriodontalDietrichHelsinkPas encore d'évaluation
- Guía de Práctica de Rehabilitación Oral PDFDocument64 pagesGuía de Práctica de Rehabilitación Oral PDFLuis DavilaPas encore d'évaluation
- Atlas de Detalles Contructivos Nueva Edcion CimentacionesDocument345 pagesAtlas de Detalles Contructivos Nueva Edcion CimentacionesFreddy Edwin Quezada100% (1)
- Rebeldes - Susan E. Hinton PDFDocument116 pagesRebeldes - Susan E. Hinton PDFNatalia67% (3)
- APARATOLOGIA 1 de Diciembre 2014Document36 pagesAPARATOLOGIA 1 de Diciembre 2014N CH Alex100% (3)
- Irrigantes locales en endodoncia de dientes primariosD'EverandIrrigantes locales en endodoncia de dientes primariosPas encore d'évaluation
- La calidad en el examen de maestría: Prótesis CompletasD'EverandLa calidad en el examen de maestría: Prótesis CompletasPas encore d'évaluation
- Labor Dental Técnica Vol.22 Ene-Feb 2019 nº5D'EverandLabor Dental Técnica Vol.22 Ene-Feb 2019 nº5Évaluation : 1 sur 5 étoiles1/5 (1)
- Cuidados en salud bucal para personas con discapacidad sensorialD'EverandCuidados en salud bucal para personas con discapacidad sensorialPas encore d'évaluation
- Labor Dental Técnica Vol.22 Octubre 2019 nº7D'EverandLabor Dental Técnica Vol.22 Octubre 2019 nº7Évaluation : 5 sur 5 étoiles5/5 (3)
- Geroprótesis: Técnica dental - Odontología - Atención odontológica en la vejezD'EverandGeroprótesis: Técnica dental - Odontología - Atención odontológica en la vejezPas encore d'évaluation
- Conocimientos de Odontología bien fundamentados y narrados de forma apasionante: ¡Pura locura!D'EverandConocimientos de Odontología bien fundamentados y narrados de forma apasionante: ¡Pura locura!Pas encore d'évaluation
- Disfunción Cráneo Cérvico MandibularD'EverandDisfunción Cráneo Cérvico MandibularÉvaluation : 3 sur 5 étoiles3/5 (3)
- ProstodonciaDocument101 pagesProstodonciaAlfredo Galicia Cuateco100% (1)
- Recesiones GingivalesDocument23 pagesRecesiones GingivalesMaria Jose ArrietaPas encore d'évaluation
- Factores de Riesgo de La Enfermedad PeriodontalDocument39 pagesFactores de Riesgo de La Enfermedad Periodontalodontoblogger100% (4)
- Preparacion Dental en Rehabilitacion OralDocument55 pagesPreparacion Dental en Rehabilitacion OralAlejandro Alfonso Gnecco GoenagaPas encore d'évaluation
- Complicaciones de ProtesisDocument29 pagesComplicaciones de ProtesisLizeth Merc100% (1)
- ABC PERIO Periodontologia Contemporanea PDFDocument273 pagesABC PERIO Periodontologia Contemporanea PDFAna Graciela Arestegui100% (1)
- ExodonciaDocument32 pagesExodonciaMarco Antonio Chompa100% (1)
- Int A La Rehabilitación OralDocument58 pagesInt A La Rehabilitación OralIrene Elizabeth Alcaraz100% (1)
- Guia de EndodonciaDocument30 pagesGuia de EndodonciaNelson BarakatPas encore d'évaluation
- Alargamiento CoronarioDocument14 pagesAlargamiento Coronariosebis9100% (1)
- Diagnostico y Plan de Tratamiento en Protesis FijaDocument100 pagesDiagnostico y Plan de Tratamiento en Protesis FijaIsis PagoagaPas encore d'évaluation
- Cirugia Bucal PreproteticaDocument33 pagesCirugia Bucal Preproteticamariajose chavezPas encore d'évaluation
- Dentadura UnimaxilarDocument42 pagesDentadura UnimaxilarLilian ValenciaPas encore d'évaluation
- DETARTRAJEDocument112 pagesDETARTRAJEJuan Carlos Pineda100% (1)
- Cirugia MucogingivalDocument66 pagesCirugia MucogingivalBlack Wolf Nuñez75% (4)
- Posición Inicial de TratamientoDocument13 pagesPosición Inicial de TratamientoFFDF0% (1)
- Blanqueamiento DentalDocument16 pagesBlanqueamiento DentalFanii Del AngelPas encore d'évaluation
- Como Disenar El Removible PerfectoDocument12 pagesComo Disenar El Removible Perfectokrikaesav50% (2)
- PPR Clasificacion de Kennedy PDFDocument13 pagesPPR Clasificacion de Kennedy PDFNAPOLEON LUIS BERGES GONZALEZ100% (1)
- Leiones Furca FinalDocument87 pagesLeiones Furca FinalParis Figueroa ZendejasPas encore d'évaluation
- e3axPR004UrU5Dlj MANUAL DE PROSTODONCIA TOTAL. AMIR GOMEZ PDFDocument98 pagese3axPR004UrU5Dlj MANUAL DE PROSTODONCIA TOTAL. AMIR GOMEZ PDFJesus LugoPas encore d'évaluation
- Guía de Práctica Clínica de PeriodonciaaaaDocument23 pagesGuía de Práctica Clínica de PeriodonciaaaaDiego EduardoPas encore d'évaluation
- DESENFRASCADODocument6 pagesDESENFRASCADOyeseniaarmijosPas encore d'évaluation
- Balance Oclusal en Protesis TotalesDocument9 pagesBalance Oclusal en Protesis Totalesesther pena33% (3)
- Bolsa PeriodontalDocument20 pagesBolsa PeriodontalYeffrey Pérez MPas encore d'évaluation
- Restauraciones IndirectasDocument6 pagesRestauraciones IndirectasCristhian Muñoz ManriquePas encore d'évaluation
- Aislamiento Del Campo OperatorioDocument77 pagesAislamiento Del Campo OperatorioLucy Pereyra CarruiteroPas encore d'évaluation
- GINGIVECTOMIADocument34 pagesGINGIVECTOMIAJuan Jose LeonPas encore d'évaluation
- Tratamiento de Las Lesiones Dentales TraumáticasDocument12 pagesTratamiento de Las Lesiones Dentales TraumáticasMildred Karina GonzálezPas encore d'évaluation
- Endocrown EspañolDocument17 pagesEndocrown EspañolLuis Fernando Guayllas PomaPas encore d'évaluation
- Recubrimiento Pulpar DirectoDocument20 pagesRecubrimiento Pulpar DirectoAlvaro Jose Horta Caicedo0% (1)
- Protesis TotalDocument9 pagesProtesis TotalDiego Mejia VélezPas encore d'évaluation
- Patologia Pulpar y PeriapicalDocument66 pagesPatologia Pulpar y Periapicalcristhian neiraPas encore d'évaluation
- Clase 1 - Principios Basicos de La Protesis FijaDocument43 pagesClase 1 - Principios Basicos de La Protesis FijaAna Cecilia Jaramillo GarciaPas encore d'évaluation
- Clasificación de KennedyDocument6 pagesClasificación de KennedyHugo OrtizPas encore d'évaluation
- 1 3 6-VitremerDocument1 page1 3 6-VitremerJhon Cristian Herrera CadenaPas encore d'évaluation
- Apexogénesis y ApexificaciónDocument20 pagesApexogénesis y ApexificaciónAna Cristina Moreno ZambranoPas encore d'évaluation
- Guia Acabado y PulidoDocument15 pagesGuia Acabado y PulidoMilas PerezPas encore d'évaluation
- ProvisionalesDocument33 pagesProvisionalesNini FrAnco100% (1)
- Avance de Seminario Recesiones GingivalesDocument20 pagesAvance de Seminario Recesiones Gingivalesangi paola puicon ruizPas encore d'évaluation
- VestibuloplastiaDocument6 pagesVestibuloplastiaCarlos AlfredoPas encore d'évaluation
- Cirugia Mucogingival Tema 12Document43 pagesCirugia Mucogingival Tema 12Nancy AlemánPas encore d'évaluation
- Protesis InmediataDocument6 pagesProtesis InmediataeduardobusPas encore d'évaluation
- Ña Ñe Ñi Ño Ñu: Fecha: NombreDocument5 pagesÑa Ñe Ñi Ño Ñu: Fecha: NombreFreddy Edwin QuezadaPas encore d'évaluation
- Modulo 8 Material de Estudio PatologiaDocument111 pagesModulo 8 Material de Estudio PatologiaFreddy Edwin QuezadaPas encore d'évaluation
- Compilacion Proyectos Ambientales 19 PDFDocument112 pagesCompilacion Proyectos Ambientales 19 PDFFreddy Edwin QuezadaPas encore d'évaluation
- Manual Tecnico de Primeros Auxilios UnlockedDocument233 pagesManual Tecnico de Primeros Auxilios UnlockedFreddy Edwin QuezadaPas encore d'évaluation
- Lengua 5Document129 pagesLengua 5Freddy Edwin Quezada100% (1)
- Capilla de ProyectosDocument16 pagesCapilla de ProyectosFreddy Edwin QuezadaPas encore d'évaluation
- Serial Visual Studio 2015 ProfessionalDocument1 pageSerial Visual Studio 2015 ProfessionalFreddy Edwin QuezadaPas encore d'évaluation
- Desgastes InterproximalesDocument35 pagesDesgastes InterproximalesAlma SanchezPas encore d'évaluation
- Diptico Niño Salud BucalDocument2 pagesDiptico Niño Salud BucalCarlos Galvez100% (1)
- ALINEADORESDocument7 pagesALINEADORESTOMAS DAVID CHICA LLAMASPas encore d'évaluation
- Llaves AndrewsDocument9 pagesLlaves AndrewsOmar Delgado0% (1)
- Arango Anatomia y Biomecanica Aplicada A Anclajes Esqueleticos en Ortodoncia CapituloDocument26 pagesArango Anatomia y Biomecanica Aplicada A Anclajes Esqueleticos en Ortodoncia CapituloOmar Nolberto Diaz Sanchez50% (2)
- Casi Clinico Corona Metal PorcelanaDocument5 pagesCasi Clinico Corona Metal PorcelanaANGEL ADALBERTO GALVAN GARCIAPas encore d'évaluation
- Operatoria Dental - Preparaciones CavitariasDocument23 pagesOperatoria Dental - Preparaciones CavitariasRenzo RoblesPas encore d'évaluation
- Informe EnceradoDocument7 pagesInforme EnceradoGiancarlo Escobar67% (3)
- Nuevo Eta Pa RadicularDocument87 pagesNuevo Eta Pa RadicularYessika Pumacajia SilvestrePas encore d'évaluation
- Lanzamiento Sensodyne Sensibilidad & EncíasDocument4 pagesLanzamiento Sensodyne Sensibilidad & EncíasCarlos A MuriesPas encore d'évaluation
- CEFALOMETRÍA - AnálisisDocument35 pagesCEFALOMETRÍA - AnálisisKarla MPPas encore d'évaluation
- Aranceles Albertengo LabDocument3 pagesAranceles Albertengo Labsandra324Pas encore d'évaluation
- Apuntes de Cefalometria de Ricketts y McNamaraDocument5 pagesApuntes de Cefalometria de Ricketts y McNamaraCESARPas encore d'évaluation
- GT 2023 Cuidado Personal (1) - 1Document19 pagesGT 2023 Cuidado Personal (1) - 1Samuel Brito BritoPas encore d'évaluation
- Portafolio de ServiciosDocument16 pagesPortafolio de ServiciosJulieth Rodriguez0% (1)
- Primer Premolar InferiorDocument7 pagesPrimer Premolar InferiorMiriam SanginezPas encore d'évaluation
- Enfermedades Orales en CaballosDocument19 pagesEnfermedades Orales en CaballosJavi CarrilloPas encore d'évaluation
- Enfermedad PeriodontalDocument21 pagesEnfermedad PeriodontalPaola JaquezPas encore d'évaluation
- Fusión DentalDocument2 pagesFusión DentalEDUARDO ANTONIO GIL BERREONDOPas encore d'évaluation
- Nueva Clasificacion PeriodontalDocument18 pagesNueva Clasificacion PeriodontalGerman Orozco OrtizPas encore d'évaluation
- Técnicas de InstrumentaciónDocument49 pagesTécnicas de InstrumentaciónoscarPas encore d'évaluation
- Triptico Cavidad VDocument4 pagesTriptico Cavidad VDiego IparraguirrePas encore d'évaluation
- Retenedores IndirectosDocument3 pagesRetenedores IndirectosEmilio Athael Flores AvilésPas encore d'évaluation
- Acceso Endodontico en Dientes Anteriores y PosterioresDocument19 pagesAcceso Endodontico en Dientes Anteriores y PosterioresWilliam La MadridPas encore d'évaluation
- Consentimiento Informado de Limpieza DentalDocument2 pagesConsentimiento Informado de Limpieza DentalODONTOLOGÍA ANGELICA OCAMPO100% (2)
- Conferencia Clase III .Document0 pageConferencia Clase III .Jess INPas encore d'évaluation
- Fisiología Dental 123Document63 pagesFisiología Dental 123Angie Vanessa Lerma PalominoPas encore d'évaluation
- Etapas Del Desarrollo DentalDocument7 pagesEtapas Del Desarrollo DentalAlejandra LeivaPas encore d'évaluation