Académique Documents
Professionnel Documents
Culture Documents
Reacciones Químicas
Transféré par
Alexander Revilla Mamani0 évaluation0% ont trouvé ce document utile (0 vote)
21 vues2 pagesTIPOS DE REACCIONES QUIMICAS
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentTIPOS DE REACCIONES QUIMICAS
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
21 vues2 pagesReacciones Químicas
Transféré par
Alexander Revilla MamaniTIPOS DE REACCIONES QUIMICAS
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
REACCIONES QUÍMICAS - TIPOS
1) Concepto:
Transformaciones en la cual una o más sustancias iniciales llamadas reactantes mediante
choques efectivos entre si originan la ruptura de enlaces; creando nuevos que darán lugar a
nuevas sustancias.
2) Ecuación química:
Expresa la reacción química usando símbolo y fórmulas:
1Ca(s )+2H 2 O( l ) →underbracealignl 1Ca ( OH )2 ( aC )+1 H 4 g ¿
⏟⏟
sentido ¿
⏟ de reaccion ¿
reactan tes productos
Coeficientes estequiométricos: 1,2,1 y 1
3) Clasificación
A) Por el mecanismo de la reacción por la forma como se originan los productos
A.1) De descomposición:
Una sustancia (compuesto) sufre una reacción para formar 2 ó mas sustancias (elementos o
compuesto).
Ejm.:
NaCl¿⃗
Corriente ¿ Eléctrica ¿→ Na + Cl 2 ¿
: electrólisis
H 2 O 2 L⃗
uz H 2 O + O 2
: fotólisis
NaHCO 3 ⃗Δ Na2 CO 3 + H2 O + CO 2 : Pirólisis
A.2) De combinación: (síntesis o adición)
Reaccionan 2 ó más sustancias (ya sean elementos o compuestos) para producir una sustancia.
Ejemplos:
Mg + O 2 ⃗Δ MgO: Calor necesario para iniciar la reacción
MgO + H2O Mg(OH)2
A.3) De simple desplazamiento (sustitución única).
Reacciona un elemento reemplazado a otro en un compuesto. Un metal sustituye a un catión
metálico en su sal o al hidrógeno en un ácido.
Li>K>Ba>Ca>Na>Mg>Al>Zn>Fe>Cd>N>Sn>Pb>(H)>Cu>Hg>Ag
Ejemplos:
Zn(s) + Ag NO3(ac) Zn(NO3)2(ac) + Ag(s)
Zn(s) + HNO3(ac) Zn(NO3)2(ac) + H2(s)
Un no metal sustituye a un anión no metálico en su sal o ácido. Para los halógenos la actividad
química: F2>Cl2>Br2>I2.
Ejemplo:
Cl2(g) + NaBr(ac) NaCl(ac) + Br2(ac)
A.II) De doble desplazamiento (metátesis)
Reaccionan 2 compuestos, el catión de un compuesto se intercambia con el catión de otro
compuesto, creando los compuesto; generalmente los reactantes están en solución acuosa.
Ejemplo:
Pb(NO3)2(ac) + KI(ac) PbI2(s) + KNO3(ac)
Precipitado Amarillo
HCl(ac) + NaOH(ac) NaCl(ac) + H2O(l)
Vous aimerez peut-être aussi
- Separata de Metales y No MetalesDocument2 pagesSeparata de Metales y No MetalesAlexander Revilla MamaniPas encore d'évaluation
- Sesion 07 - Planteam. Ecuac.Document6 pagesSesion 07 - Planteam. Ecuac.Alexander Revilla MamaniPas encore d'évaluation
- Problemas Propuestos de Caida LibreDocument3 pagesProblemas Propuestos de Caida LibreAlexander Revilla MamaniPas encore d'évaluation
- Problemas Propuestos de Caida LibreDocument2 pagesProblemas Propuestos de Caida LibreAlexander Revilla MamaniPas encore d'évaluation
- Separata Relaciones Bioticas - EcosistemaDocument3 pagesSeparata Relaciones Bioticas - EcosistemaAlexander Revilla MamaniPas encore d'évaluation
- Resumen Metales No Metales y Metaloides - 1 y 2doDocument2 pagesResumen Metales No Metales y Metaloides - 1 y 2doAlexander Revilla MamaniPas encore d'évaluation
- Plan de Trabajo Del Comite AmbientalDocument2 pagesPlan de Trabajo Del Comite AmbientalAlexander Revilla MamaniPas encore d'évaluation
- Practica Calificada N°02 - Num. Enteros - SolucionDocument1 pagePractica Calificada N°02 - Num. Enteros - SolucionAlexander Revilla Mamani100% (1)
- Intro CelulaDocument14 pagesIntro CelulaAlexander Revilla MamaniPas encore d'évaluation
- Sesión N - 04Document5 pagesSesión N - 04Alexander Revilla MamaniPas encore d'évaluation
- Practica Calificada N°01Document2 pagesPractica Calificada N°01Alexander Revilla MamaniPas encore d'évaluation
- Charla para El Dia de La MadreDocument1 pageCharla para El Dia de La MadreAlexander Revilla MamaniPas encore d'évaluation
- El Reino ProtistaDocument3 pagesEl Reino ProtistaAlexander Revilla MamaniPas encore d'évaluation
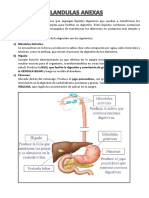
- Fisiologia DigestivaDocument3 pagesFisiologia DigestivaAlexander Revilla MamaniPas encore d'évaluation
- Ficha Feria CienciaDocument2 pagesFicha Feria CienciaAlexander Revilla MamaniPas encore d'évaluation
- Formulacion Nomenclatura y El Mol CPU OriginalDocument54 pagesFormulacion Nomenclatura y El Mol CPU OriginalYalitza Álvarez BarazartePas encore d'évaluation
- Tabla PeriodicaDocument15 pagesTabla Periodica011 TCPas encore d'évaluation
- AzufreDocument5 pagesAzufrepatogol1979Pas encore d'évaluation
- Lixiviacion en ColumnaDocument17 pagesLixiviacion en ColumnaNereida Yesica Olortigue HuamanPas encore d'évaluation
- Sopa de LetrasDocument6 pagesSopa de LetrasMax Wells100% (3)
- Valoración Por RetrocesoDocument8 pagesValoración Por RetrocesoJulieizziitha Ortega50% (2)
- Universidad Nacional Del AltiplanoDocument6 pagesUniversidad Nacional Del AltiplanoalexPas encore d'évaluation
- ENSAYO DE CORROSION Y OXIDACION - Odt 1Document6 pagesENSAYO DE CORROSION Y OXIDACION - Odt 1Karla BriceñoPas encore d'évaluation
- Sesión 6 - TM - Materiales No Ferrosos IIDocument31 pagesSesión 6 - TM - Materiales No Ferrosos IIYubert Edisson Huanca LimaPas encore d'évaluation
- Cesar - Torres Tarea 2Document4 pagesCesar - Torres Tarea 2César Torres67% (3)
- Fertilizantes - INTADocument2 pagesFertilizantes - INTAaylen paezPas encore d'évaluation
- Ejerciciios Sobre El Equilibrio de Solubilidad (Recopilación - 2014 - 2)Document6 pagesEjerciciios Sobre El Equilibrio de Solubilidad (Recopilación - 2014 - 2)James Cantillo BernalPas encore d'évaluation
- Línea Del TiempoDocument11 pagesLínea Del Tiempoiselanoemisanchez1846Pas encore d'évaluation
- Laboratorio 2Document27 pagesLaboratorio 2Mili Kath PCPas encore d'évaluation
- MetalesDocument5 pagesMetaleshugo floresPas encore d'évaluation
- Aceros, Soldadura y Uniones HV 2014Document55 pagesAceros, Soldadura y Uniones HV 2014Elian MorantPas encore d'évaluation
- Configuracion ElectronicaDocument6 pagesConfiguracion ElectronicaDougbenia MirabalPas encore d'évaluation
- Practica 11 Yodo y TiosulfatoDocument32 pagesPractica 11 Yodo y TiosulfatoEDDY100% (1)
- Cuestiones Tema 4 Química IndustrialDocument14 pagesCuestiones Tema 4 Química IndustrialFranciscoLopezMartinezPas encore d'évaluation
- Lista de Sustancias ControladasDocument5 pagesLista de Sustancias Controladasjorge villarpando mirandaPas encore d'évaluation
- Concentrados de ZNDocument34 pagesConcentrados de ZNJazFachinPas encore d'évaluation
- Suelos Practica CIC #7Document12 pagesSuelos Practica CIC #7Joha JácomePas encore d'évaluation
- Valencias de Elementos QuímicosDocument3 pagesValencias de Elementos QuímicosSantiago OrbeaPas encore d'évaluation
- Identificación de Un Compuesto Orgánico Solido Por Vía de Análisis Orgánico Clásico y EspectroscoDocument5 pagesIdentificación de Un Compuesto Orgánico Solido Por Vía de Análisis Orgánico Clásico y EspectroscoDiana HernándezPas encore d'évaluation
- Formulación InorgánicaDocument56 pagesFormulación Inorgánicaallan100% (1)
- Propiedades Periódicas de Los Elementos Químicos para Cuarto Grado de SecundariaDocument4 pagesPropiedades Periódicas de Los Elementos Químicos para Cuarto Grado de SecundariaAdriana Marisol Padrón LópezPas encore d'évaluation
- NOMENCLATURA12Document6 pagesNOMENCLATURA12DAYAN PILAR LEDESMA CHAVEZPas encore d'évaluation
- PRACTICA3Document4 pagesPRACTICA3Ana CarascoPas encore d'évaluation
- Cata EvaporadoresDocument32 pagesCata Evaporadoresfrio33Pas encore d'évaluation
- Minerales ClasesDocument20 pagesMinerales ClasesHector Guillén JuarezPas encore d'évaluation