Académique Documents
Professionnel Documents
Culture Documents
Révision N°1 Correction (MR KH Bessem) (Lycée Maknassy) PDF
Transféré par
Fakhri KlaiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Révision N°1 Correction (MR KH Bessem) (Lycée Maknassy) PDF
Transféré par
Fakhri KlaiDroits d'auteur :
Formats disponibles
Correction : Révision N° - 1 -
Lycée Maknassy 2012 - 2013 Prof: Kh.Bessem
Exercice N°– 1-
1) CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O
2) Les caractéristiques de cette réaction : athermique, limitée et lente.
3) Tableau descriptif d’évolution de l’avancement :
Eq. Réaction CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O
E.Système Avancement Quantités de matière (mol)
t=0 0 0,4 a 0 0
t≠ 𝟎 x 0,4 - x a-x x x
𝒕𝒇 𝐱𝒇 0,4 - 𝒙𝒇 a-𝒙𝒇 𝐱𝒇 𝐱𝒇
D’aprés le tableau 𝐱 𝒇 = 𝒏(𝒆𝒔𝒕𝒆𝒓: 𝐂𝐇𝟑 𝐂𝐎𝐎𝐂𝐇𝟐 𝐂𝐇𝟑 )𝒇𝒊𝒏𝒂𝒍
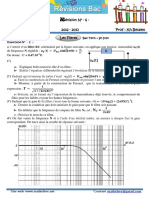
D’après la courbe 2, croissante, on aura: 𝐱 𝒇 = 𝟎, 𝟏𝟕 𝒎𝒐𝒍.
4)
𝒙𝒇 𝒙𝒇 𝟎,𝟏𝟕
a- On a : 𝝉𝒇 = ce qui donne: 𝒙𝒎𝒂𝒙 = = soit : 𝒙𝒎𝒂𝒙 = 𝟎, 𝟐 𝒎𝒐𝒍
𝒙𝒎𝒂𝒙 𝝉𝒇 𝟎,𝟖𝟓
Pour déterminer a il faut connaitre le réactif limitant (en défaut) :
On : dans ce cas les deux réactifs (alcool et acide) pris avec les mêmes coefficients stœchiométriques
(1), don le réactif limitant est celui qui lui correspond le minimum nombre de mole, or d’après
l’énoncé a < 0,4 moℓ, par conséquent l’alcool 𝐂𝐇𝟑 𝐂𝐎𝐎𝐂𝐇𝟐 𝐂𝐇𝟑 est le réactif limitant. Ce qui donne
a-𝒙𝒎𝒂𝒙 = 𝟎 d’ou: a = 0,4 mol.
b- Si la composition du système alcool, acide, ester et eau) reste inchangeable, alors on dit que le
système aboutit à un état d’équilibre.
Composition du mélange lorsque l’équilibre dynamique :
𝒏(𝒆𝒔𝒕𝒆𝒓)é𝒒𝒖𝒊 = 𝒏(𝒆𝒂𝒖)é𝒒𝒖𝒊 = 𝐱 𝒆𝒒 = 𝟎, 𝟏𝟕 𝒎𝒐𝒍
𝒏(𝒂𝒍𝒄𝒐𝒐𝒍)é𝒒𝒖𝒊 = 𝐚 − 𝒙𝒆𝒒 = 𝟎, 𝟐 − 𝟎, 𝟏𝟕 = 𝟎, 𝟎𝟑 𝒎𝒐𝒍
𝒏(𝒂𝒄𝒊𝒅𝒆)é𝒒𝒖𝒊 = 𝟎, 𝟒 − 𝒙𝒆𝒒 = 𝟎, 𝟒 − 𝟎, 𝟏𝟕 = 𝟎, 𝟎𝟐𝟑 𝒎𝒐𝒍
c- La constante d’équilibre K relative à la réaction d’estérification :
𝒆𝒔𝒕𝒆𝒓 é𝒒 𝒆𝒂𝒖 é𝒒 𝒏(𝒆𝒔𝒕𝒆𝒓)é𝒒 𝒏(𝒆𝒂𝒖)é𝒒 (𝟎,𝟏𝟕)𝟐
𝑲 = 𝝅é𝒒 = = = = 𝟒 , K= 4,18.
𝒂𝒍𝒄𝒐𝒐𝒍 é𝒒 𝒂𝒄𝒊𝒅𝒆 é𝒒 𝒏(𝒂𝒍𝒄𝒐𝒐𝒍)é𝒒 𝒏(𝒂𝒄𝒊𝒅𝒆)é𝒒 𝟎,𝟐𝟑×𝟎,𝟎𝟑
d- L’une des caractéristiques de la réaction d’éthérification est athermique, donc quelque soit la
variation de la température (augmentation ou bien diminution), la constante d’équilibre reste
égale à 4,18 (inchangeable).
5) On mélange 0,5 moℓ d’acide, 0,5 moℓ d’alcool, 1,2 moℓ d’ester et 1,2 moℓ d’eau.
Tout d’abord, il faut préciser le sens d’évolution spontané de la réaction, donc il faut calculer 𝝅
𝒏(𝒆𝒔𝒕𝒆𝒓)𝒏(𝒆𝒂𝒖) 𝟏,𝟐×𝟏,𝟐
𝝅= = = 𝟓, 𝟕𝟔 , remarquons que 𝝅 < 𝐾 on conclut que le sens inverse
𝒏(𝒂𝒍𝒄𝒐𝒐𝒍)𝒏(𝒂𝒄𝒊𝒅𝒆) 𝟎,𝟓×𝟎,𝟓
(hydrolyse) est possible spontanément.
Eq. Réaction CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O
E.Système Avancement Quantités de matière (mol)
t=0 0 0,5 0,5 1,2 1,2
t≠ 𝟎 x 0,5 + x 0,5 + x 1,2-x 1,2-x
𝒕é𝒒 𝐱𝒇 0,5 + 𝒙é𝒒 0,5 +𝒙é𝒒 1,2-𝒙é𝒒 𝐱𝒇
𝟏,𝟐−𝒙é𝒒 𝟐
La constante d’équilibre K reste égale à 4,18 (inchangeable), 𝟒, 𝟏𝟖 = ↔ 𝒙é𝒒 = 𝟎; 𝟎𝟔 𝒎𝒐𝒍
𝟎,𝟓 +𝒙é𝒒 𝟐
Site web: www.matheleve.net Contact: matheleve@gmail.com
Composition du système lorsque le nouvel état d’équilibre :
𝒏(𝒆𝒔𝒕𝒆𝒓)é𝒒𝒖𝒊 = 𝒏(𝒆𝒂𝒖)é𝒒𝒖𝒊 = 𝟏, 𝟏𝟒 𝒎𝒐𝒍
𝒏(𝒂𝒍𝒄𝒐𝒐𝒍)é𝒒𝒖𝒊 = 𝒏(𝒂𝒄𝒊𝒅𝒆)é𝒒𝒖𝒊 = 𝟎, 𝟓𝟔 𝒎𝒐𝒍
Exercice N°– 2-
1)
a- Tableau descriptif d’évolution de l’avancement :
Eq. Réaction 2 NO (g) + Br2 (g) 2 NOBr (g)
E.Système Avancement Quantités de matière (mol)
t=0 0 5 2 0
t≠ 𝟎 x 5 - 2x 2-x 2x
𝒕𝒇 𝐱𝒇 2 - 𝟐𝒙𝒇 2-𝒙𝒇 2 𝐱𝒇
b- Pour déterminer 𝐱 𝒇 il tout d’abord déterminer 𝐱 𝒎𝒂𝒙 et après on fait recours au taux
𝐱𝒇
d’avancement final 𝛕𝒇 = ↔ 𝐱 𝒇 = 𝛕𝒇 . 𝐱 𝒎𝒂𝒙
𝐱𝒎𝒂𝒙
Pour identifier le réactif limitant, on procède comme suit,
𝒏(𝑵𝑶)𝒊𝒏𝒊𝒕𝒊𝒂𝒍 𝒏(𝑩𝒓𝟐 )𝒊𝒏𝒊𝒕𝒊𝒂𝒍 𝒏(𝑵𝑶)𝒊𝒏𝒊𝒕𝒊𝒂𝒍 𝒏(𝑩𝒓𝟐 )𝒊𝒏𝒊𝒕𝒊𝒂𝒍
= 𝟎, 𝟐𝟓 𝒎𝒐𝒍 et = 𝟐 𝒎𝒐𝒍 on obtient : > par conséquent,
𝟐 𝟏 𝟐 𝟏
𝑩𝒓𝟐 est le réactif limitant ↔ 𝟐 − 𝒙𝒎𝒂𝒙 = 𝟎 ↔ 𝒙𝒎𝒂𝒙 = 𝟐 𝒎𝒐𝒍
Donc, 𝐱 𝒇 = 𝛕𝒇 . 𝐱 𝒎𝒂𝒙 = 𝟎, 𝟐𝟓 × 𝟐 soit : 𝐱 𝒇 = 𝟎, 𝟓 𝒎𝒐𝒍.
c- Composition du mélange lorsque l’équilibre dynamique :
𝒏(𝑵𝑶)é𝒒𝒖𝒊 = 𝟒 𝒎𝒐𝒍
𝒏(𝑵𝑶𝑩𝒓)é𝒒𝒖𝒊 = 𝟏 𝐦𝐨𝐥𝐞
𝒏(𝑩𝒓𝟐 )é𝒒𝒖𝒊 = 𝟏, 𝟓 𝒎𝒐𝒍
2)
a- Sens d’évolution spontanée du système :
On a augmenté 𝒏 𝑵𝑶 ce qui entraine une augmentation de sa concentration 𝑵𝑶 car le volume
reste constant, d’après la Loi de modération, le système évolue dans le sens qui tend à
diminuer 𝑵𝑶 , soit le sens direct est possible.
b-
Eq. Réaction 2 NO (g) + Br2 (g) 2 NOBr (g)
E.Système Avancement Quantités de matière (mol)
t=0 0 4 + 0,5 1,5 1
t≠ 𝟎 x 4,5 - 2x 1,5-x 1+x
𝒕𝒇 𝐱𝒇 4,5 - 𝟐𝒙𝒇 1,5-𝒙𝒇 1 + 𝐱𝒇
Or on a: 𝒏(𝑵𝑶)é𝒒𝒖𝒊 = 𝟑, 𝟓 𝒎𝒐𝒍 = 𝟒, 𝟓 − 𝟐𝒙𝒇 ↔ 𝒙𝒇 = 𝟎, 𝟓 𝒎𝒐𝒍
Par conséquent:
La composition du mélange lorsque le nouvel état d’équilibre est établi
𝒏(𝑵𝑶)é𝒒𝒖𝒊 = 𝟑, 𝟓 𝒎𝒐𝒍
𝒏(𝑵𝑶𝑩𝒓)é𝒒𝒖𝒊 = 𝟏, 𝟓 𝐦𝐨𝐥𝐞
𝒏(𝑩𝒓𝟐 )é𝒒𝒖𝒊 = 𝟏 𝒎𝒐𝒍
3) T2 > T1 : d’après la Loi de modération, l’augmentation de température, favorise la réaction
endothermique.
𝝉𝒇𝟐 >𝝉𝒇𝟐 : C’est – à – dire le système est déplacé dans le sens direct.
𝒔𝒆𝒏𝒔 𝒅𝒊𝒓𝒆𝒄𝒕: 𝒆𝒏𝒅𝒐𝒕𝒉𝒆𝒓𝒎𝒊𝒒𝒖𝒆
D’où on aura,
𝒔𝒆𝒏𝒔 𝒊𝒏𝒗𝒆𝒓𝒔𝒆: 𝒆𝒙𝒐𝒕𝒉𝒆𝒓𝒎𝒊𝒒𝒖𝒆
4) D’après la Loi de modération, toute augmentation de pression déplace le système dans le sens
qui tend à diminuer le nombre de mole total des gaz.
Avec 𝒏𝑻 (𝟐 𝐍𝐎 (𝐠) + 𝐁𝐫𝟐 (𝐠))𝒈 = 𝟑 𝒎𝒐𝒍
𝒏𝑻 (𝟐 𝐍𝐎𝐁𝐫 (𝐠))𝒈 = 𝟐 𝒎𝒐𝒍 , d’où le système évolue dans le sens direct (3 vers 2)
Site web: www.matheleve.net Contact: matheleve@gmail.com
Vous aimerez peut-être aussi
- Suivi D Une Transformation Chimique Cours 2 2Document9 pagesSuivi D Une Transformation Chimique Cours 2 2Smove OnerPas encore d'évaluation
- Correction Examen 2016-2020Document68 pagesCorrection Examen 2016-2020Mohamed SaidiPas encore d'évaluation
- Examen National Physique Chimie 2 Bac SVT 2017 Normale CorrigeDocument10 pagesExamen National Physique Chimie 2 Bac SVT 2017 Normale CorrigeMohamed SaidiPas encore d'évaluation
- 2 Suivi Temporel D'une Transformation Chimique - Vitesse de RéactionDocument40 pages2 Suivi Temporel D'une Transformation Chimique - Vitesse de Réactionyunuabou3Pas encore d'évaluation
- Correction de la composition du 1er semestre IA Pikine GuédiawayeDocument6 pagesCorrection de la composition du 1er semestre IA Pikine Guédiawayemaimounacisse784Pas encore d'évaluation
- Equilibre D'un Système ChimiqueDocument8 pagesEquilibre D'un Système ChimiqueNouhad KaisPas encore d'évaluation
- Cours 1 - Suivi Temporel D'une TransformationDocument7 pagesCours 1 - Suivi Temporel D'une TransformationsalhiPas encore d'évaluation
- Le Suivi Temporel D Une Transformation Chimique La Vitesse de Reaction Cours 1Document7 pagesLe Suivi Temporel D Une Transformation Chimique La Vitesse de Reaction Cours 1Boualem Talbi100% (1)
- 2DDL 7Document2 pages2DDL 7Abdennour Aimene AmraniPas encore d'évaluation
- Série 1 - Transformation ChimiqueDocument14 pagesSérie 1 - Transformation ChimiquemedPas encore d'évaluation
- 9 - État D'équilibre D'un Système 2Document8 pages9 - État D'équilibre D'un Système 2pro alixPas encore d'évaluation
- Compte Rendu TP6 - Osvaldo-CamaraDocument13 pagesCompte Rendu TP6 - Osvaldo-CamaraDéborah LuiraPas encore d'évaluation
- Chapitre 4 Corrigé-Exos-Modèle Gaz ParfaitDocument3 pagesChapitre 4 Corrigé-Exos-Modèle Gaz Parfaitlecallo.jessiePas encore d'évaluation
- Cours-Les Réactions chimiques-FR PDFDocument6 pagesCours-Les Réactions chimiques-FR PDFhakima032100% (1)
- 7 Réactions Acido-BasiquesDocument8 pages7 Réactions Acido-BasiquesMed yahyaPas encore d'évaluation
- Suivi Temporel Et Vitesse de Reaction Cours Corrige Et CompleteDocument7 pagesSuivi Temporel Et Vitesse de Reaction Cours Corrige Et CompleteYassine RabikPas encore d'évaluation
- Cinétique 1Document21 pagesCinétique 1Closed WayPas encore d'évaluation
- Chapitre IIDocument4 pagesChapitre IIdihia didaPas encore d'évaluation
- CC-Exos1 1011Document11 pagesCC-Exos1 1011Dabo100% (1)
- Reactions Equilibrees 2022Document33 pagesReactions Equilibrees 2022Mira MslPas encore d'évaluation
- Elements de Thermodynamique StatistiqueDocument16 pagesElements de Thermodynamique StatistiqueFATIMA HADDANIPas encore d'évaluation
- Solution Contrôle TD Section ADocument4 pagesSolution Contrôle TD Section AAbdel OihabPas encore d'évaluation
- Correction DC Nov 2023Document4 pagesCorrection DC Nov 2023tamersamira80Pas encore d'évaluation
- Les Reactions D Oxydo Reduction Exercices Corriges 1 3Document8 pagesLes Reactions D Oxydo Reduction Exercices Corriges 1 3chayma rebai100% (1)
- TD1 - Physique Des Vibrations - CorrectionDocument7 pagesTD1 - Physique Des Vibrations - CorrectionMdzayd EL FahimePas encore d'évaluation
- T1 S5 Correction ExercicesDocument37 pagesT1 S5 Correction ExerciceskandedianissyPas encore d'évaluation
- Corrigé 05 PDFDocument2 pagesCorrigé 05 PDFEl Kamoun AminePas encore d'évaluation
- Cours Thermodynamique-ConvertiDocument45 pagesCours Thermodynamique-ConvertiRedOne DerrouazinPas encore d'évaluation
- Fiche Sur Loi Daction de Masse Conditions Dévolution Spontanée 1Document4 pagesFiche Sur Loi Daction de Masse Conditions Dévolution Spontanée 1chadaPas encore d'évaluation
- A ImprimerDocument34 pagesA Imprimerfounè diassanaPas encore d'évaluation
- Controle 2 1s Avec Corr (WWW - Pc1.ma)Document9 pagesControle 2 1s Avec Corr (WWW - Pc1.ma)Mohamed ElouakilPas encore d'évaluation
- Chapitre 3Document6 pagesChapitre 3Boù ChràPas encore d'évaluation
- Semaine 8Document8 pagesSemaine 8Kpabou KpabouPas encore d'évaluation
- Chapitre III Les Reactions FormellesDocument6 pagesChapitre III Les Reactions FormellesMidi SthPas encore d'évaluation
- Chimie 3Document5 pagesChimie 3LAILA ASLOUZIPas encore d'évaluation
- Les Oscillateurs MecaniquesDocument74 pagesLes Oscillateurs Mecaniquesahmed kitariPas encore d'évaluation
- Cour Complet Oscillations Forcées 1DDLDocument5 pagesCour Complet Oscillations Forcées 1DDLAnya Hernafi100% (1)
- ST 2an19 s3 Emd Physique2013Document8 pagesST 2an19 s3 Emd Physique2013ibtihal RNPas encore d'évaluation
- Examene Physique 03 VF 2022Document5 pagesExamene Physique 03 VF 2022Omar LANGEURPas encore d'évaluation
- Cours Mecanique Fluides - Chapitres 6 Et 7Document16 pagesCours Mecanique Fluides - Chapitres 6 Et 7chadiPas encore d'évaluation
- Corrigé - TD 0 + TD 1Document3 pagesCorrigé - TD 0 + TD 1amiira bouzouadaPas encore d'évaluation
- Suite Cours ConductionDocument10 pagesSuite Cours Conductioniheb trabelsi TGPas encore d'évaluation
- Correction TD1 Génie Des Procédés Alimentaires LP IA (EST) 2020-2021Document10 pagesCorrection TD1 Génie Des Procédés Alimentaires LP IA (EST) 2020-2021Hassan lachgarPas encore d'évaluation
- Modélisation Mathématique CoursDocument17 pagesModélisation Mathématique CoursSaif Eddine Majdoub100% (1)
- Corrigé Serie 3Document4 pagesCorrigé Serie 3Imane Bsr100% (1)
- Bac STL Physique Chimie Et MathematiquesDocument8 pagesBac STL Physique Chimie Et MathematiquesHeidy Jackson VoidPas encore d'évaluation
- SN°4 MFluidesDocument7 pagesSN°4 MFluidesrachida lakaazPas encore d'évaluation
- Réaction OpposéDocument6 pagesRéaction OpposéhasnaechougraniPas encore d'évaluation
- Correction de Td2 de Dynamique Du Point 1TSIDocument4 pagesCorrection de Td2 de Dynamique Du Point 1TSIOussama SahnounPas encore d'évaluation
- Sujet D CMDDocument29 pagesSujet D CMDgasmi chaimaPas encore d'évaluation
- 4 Suivi D'une Transrormation ChimiqueDocument19 pages4 Suivi D'une Transrormation ChimiqueMfO HaCkEr ViPPas encore d'évaluation
- TAF 2 Calcul Dynamique - Watsop Piankeu Noel - 16G03301Document9 pagesTAF 2 Calcul Dynamique - Watsop Piankeu Noel - 16G03301watsopPas encore d'évaluation
- Chapitre 2 - SupersymetrieDocument30 pagesChapitre 2 - SupersymetriehessoulPas encore d'évaluation
- Correction QCM Renforcement Physique Quantique 2021Document33 pagesCorrection QCM Renforcement Physique Quantique 2021Angelblacks Du95Pas encore d'évaluation
- Série de TD N Math 5Document6 pagesSérie de TD N Math 5The Algerianman100% (1)
- Révision N°2 (MR KH Bessem) (Lycée Maknassy) PDFDocument3 pagesRévision N°2 (MR KH Bessem) (Lycée Maknassy) PDFFakhri KlaiPas encore d'évaluation
- Révision N°1 (MR KH Bessem) (Lycée Maknassy) PDFDocument4 pagesRévision N°1 (MR KH Bessem) (Lycée Maknassy) PDFFakhri KlaiPas encore d'évaluation
- Révision N°1 (MR KH Bessem) (Lycée Maknassy) PDFDocument4 pagesRévision N°1 (MR KH Bessem) (Lycée Maknassy) PDFFakhri KlaiPas encore d'évaluation
- Révision N°6 Correction (MR KH Bessem) (Lycée Maknassy) PDFDocument2 pagesRévision N°6 Correction (MR KH Bessem) (Lycée Maknassy) PDFFakhri KlaiPas encore d'évaluation
- Résumé Graissage Et LubrificationDocument20 pagesRésumé Graissage Et LubrificationOliver Twiste50% (2)
- ABHBC Etat de Qualite 2010-2011Document21 pagesABHBC Etat de Qualite 2010-2011Nahli Abdel MottalibPas encore d'évaluation
- CHACHOU Argumentaire Sociomag Juillet17 2Document5 pagesCHACHOU Argumentaire Sociomag Juillet17 2Eric MvogPas encore d'évaluation
- NL StabDocument18 pagesNL StabHAIPas encore d'évaluation
- Iso 4618 2014 en PDFDocument19 pagesIso 4618 2014 en PDFyassinPas encore d'évaluation
- Droit de La Propriete Intellectuelle DavidDocument38 pagesDroit de La Propriete Intellectuelle DavidNathanael AbandaPas encore d'évaluation
- Chapitre 2 Avec Exercices-Systèmes Non-LinéairesDocument13 pagesChapitre 2 Avec Exercices-Systèmes Non-LinéairesmohamedPas encore d'évaluation
- CV TEBI Modif-1Document3 pagesCV TEBI Modif-1Eba Jean aymardPas encore d'évaluation
- Cours Marketing DirectDocument45 pagesCours Marketing DirectMeryem IdbellaPas encore d'évaluation
- 1ére Année OrganisationDocument72 pages1ére Année OrganisationTaha CanPas encore d'évaluation
- Laghouasli Azrif 2019Document58 pagesLaghouasli Azrif 2019mohamedPas encore d'évaluation
- Chapitre 02Document15 pagesChapitre 02OumaimaPas encore d'évaluation
- Mémoire AZIAN Sourou Florent - CompressedDocument220 pagesMémoire AZIAN Sourou Florent - CompressedIbrahim DanielPas encore d'évaluation
- Raffaella TEDESCHI: La Critique Artistique D'octave Mirbeau, Lieu D'explorations Et de RéfractionsDocument6 pagesRaffaella TEDESCHI: La Critique Artistique D'octave Mirbeau, Lieu D'explorations Et de RéfractionsPierre MICHELPas encore d'évaluation
- Aspects Réglementaire BPF Et Organisationnel D'un Laboratoire de Contrôle de Qualité 1Document48 pagesAspects Réglementaire BPF Et Organisationnel D'un Laboratoire de Contrôle de Qualité 1lola benrPas encore d'évaluation
- LINERDocument9 pagesLINERFa TehPas encore d'évaluation
- Repertoire Milieux Septembre 2023Document162 pagesRepertoire Milieux Septembre 2023brandonssh91Pas encore d'évaluation
- REVENUS 2021: Investissements Outre-MerDocument8 pagesREVENUS 2021: Investissements Outre-Mer6edgeePas encore d'évaluation
- Les Equations Algebriques - Aborder Les Inconnues-Par - (-WWW - Heights-Book - Blogspot.com-)Document164 pagesLes Equations Algebriques - Aborder Les Inconnues-Par - (-WWW - Heights-Book - Blogspot.com-)Houcinebeladjat BeladjatPas encore d'évaluation
- A I1108f PDFDocument79 pagesA I1108f PDFWafa AjiliPas encore d'évaluation
- IPT MPSI DS4 CorrigeDocument12 pagesIPT MPSI DS4 CorrigeSwayziiPas encore d'évaluation
- Devoir & Corrigé 1 Lycée de Moukoundzi NgouakaDocument4 pagesDevoir & Corrigé 1 Lycée de Moukoundzi NgouakagimeymouandaPas encore d'évaluation
- Organisation Des ChantiersDocument46 pagesOrganisation Des ChantiersIchaou Illya haladou danja100% (1)
- Santé Et Sécurité Au TravailDocument122 pagesSanté Et Sécurité Au TravailPierre Henri EPOUPas encore d'évaluation
- Formuler Objectif PedagogiqueDocument6 pagesFormuler Objectif PedagogiqueSbee100% (1)
- Rapport Stage Version Finale - Mohamed HamdiDocument47 pagesRapport Stage Version Finale - Mohamed HamdiMohamed HAMDIPas encore d'évaluation
- Plaquette CMC Conception Métallique ChaudronnerieDocument2 pagesPlaquette CMC Conception Métallique Chaudronneriendobra-1Pas encore d'évaluation
- Dérivation Et FonctionDocument201 pagesDérivation Et FonctionThe Best Channel100% (1)
- Support n1 Apercu GeneralDocument33 pagesSupport n1 Apercu GeneralYAWOPas encore d'évaluation
- 2as Ge MTDocument3 pages2as Ge MTMamoun BelkacemPas encore d'évaluation