Académique Documents
Professionnel Documents
Culture Documents
ACIDEZ E BASICIDADE: RADICAIS E AMINAS
Transféré par
Dioc4Description originale:
Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
ACIDEZ E BASICIDADE: RADICAIS E AMINAS
Transféré par
Dioc4Droits d'auteur :
Formats disponibles
ACIDEZ E BASICIDADE
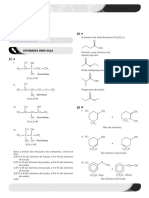
PROFº: PAULO LOPES Frente: 04 Aula: 15 ITA: 02/10/07
(AC)
O
//
II. H3C - CH2 - C
I. Considerações Gerais: \
Quanto maior a facilidade de ácido ionizar o O • •H
hidrogênio em solução aquosa, mais ácido ele será (maior
será o seu Ka). O
//
II. Efeito indutivo (IS): lII. H3C - CH2 – CH2 - C
Corresponde ao deslocamento de elétrons de \
uma ligação sigma. O • • H
III. Tipos de Radicais: O
//
a) Eletroatraentes: São aqueles que atraem para si o par lV. H3C - CH2 – CH2 – CH2 – CH - C H+
de elétrons, causando na cadeia um IS-, ou seja, aumenta l \
a acidez. Br O• • H
IS- → ÁCIDO FORTE
EX:
CARÁTER ÁCIDO: FENOL e ÁLCOOL
F > C l > Br > I > OH > > NO2
H+ com facilidade
b) Eletrorepelentes: São aqueles que “empurram” o par
de elétrons em sentido contrário, causando na cadeia um Fenol I. O• • H
IS+, ou seja, diminui a acidez. H+ com dificuldade
EX: Álcool II. H3C – CH2 – O • • H
H3C – CH2 - •CH2 > H3C - •CH2 > •CH3 > H
CARÁTER ÁCIDO: ÁCIDO > FENOL > ÁLCOOL
EX: Ácido Forte
O BASICIDADE (Aminas):
//
I. H2C - C H+ ioniza com facilidade (IS-) I. Considerações gerais:
l \ Quanto maior a facilidade de doar um par de
Cl O• • H elétrons na forma de ligação DATIVA, maior será a
BASICIDADE.
EX: Ácido Fraco
EX:
O H
// l
lI. H3C - C H+ ioniza com dificuldade (IS+) N - H
\ ••
O• • H H
Base de Lewis
Obs: Quanto maior a cadeia carbônica; menor será a
acidez. II. TIPOS DE AMINAS:
EX:
a) Primárias: R- NH2
O ••
// H
I. H3C - C l > II > III b) Secundárias: R– N - R
\ ACIDEZ ••
O• •H R
l
c) Terciárias: R – N - R
••
Fale conosco www.portalimpacto.com.br
04. (cesgranrio-RJ) Considere a tabela de valores de Ka
R das substâncias abaixo:
H l
R – N – R > R – NH2 > R N R
•• •• ••
Amina Amina Amina
SEC PRI TEC → Impedimento Espacial
Obs; Quanto maior o número de repelentes presente nas
aminas maior será a sua basicidade. Assim sendo as
aminas secundárias são bases mais fortes que as aminas
primárias, seguindo está linha de raciocínio, as aminas
terciárias deveriam ser as mais fortes, no entanto, são as
mais fracas devido o impedimento espacial.
H C H
N H
H
H C C H
H H
Impedimento Espacial
EXERCÍCIOS
01. (FESP-SP) Seja um ácido orgânico de fórmula geral
XCH2COOH, onde X poderá ser substituído por H, F, Cl,
Br ou . Pergunta-se: em qual dos casos o ácido será mais
fortemente dissociado em solução aquosa?
a) X = H
b) X = F
c) X = C l
d) X = Br
e) X = I
02. (PUC-MG) Considerando os ácidos CH2ClCOOH,
CHCl2COOH, CCl3COOH, CH3COOH, CF3COOH, o mais
fraco e o mais forte são respectivamente:
a) CH2ClCOOH e CH3COOH
b) CH3COOH e CCl3COOH
c) CCl3COOH e CHCl2COOH
d) CH3COOH e CF3COOH
e) CCl3COOH e CF3COOH
03. (FCMSSP-SP) “O ortonitrofenol, cuja fórmula
estrutural é apresentada abaixo, é um ácido mais forte do
que o fenol”. Com base nessa informação, conclui-se que
a introdução do agrupamento nitro facilita a ruptura da
ligação. (I)
O H
(II) (III)
NH2
(IV) (V)
a) l b) ll c) lll
d) IV e) V.
Fale conosco www.portalimpacto.com.br
Vous aimerez peut-être aussi
- ACIDEZ E BASICIDADE: OS PRINCÍPIOS DO EFEITO INDUTIVO E DOS GRUPOS ELETROATRAENTES E REPELENTESDocument2 pagesACIDEZ E BASICIDADE: OS PRINCÍPIOS DO EFEITO INDUTIVO E DOS GRUPOS ELETROATRAENTES E REPELENTESkassiojfPas encore d'évaluation
- Química - Fascículo 02 - Ligação CovalenteDocument11 pagesQuímica - Fascículo 02 - Ligação CovalenteConcurso Vestibular100% (6)
- Aula 3 Ligações Covalentes e IônicasDocument5 pagesAula 3 Ligações Covalentes e IônicasPaloma Ana MarquesPas encore d'évaluation
- Nox PDFDocument6 pagesNox PDFGuilhermeFreitasPas encore d'évaluation
- Ed Reacoes de Alcenos 2021 - 2 ApnpsDocument2 pagesEd Reacoes de Alcenos 2021 - 2 ApnpsVictor Damasceno mine Áurea IIPas encore d'évaluation
- Fenóis, éteres, aldeídos e cetonasDocument24 pagesFenóis, éteres, aldeídos e cetonasEdson FernandesPas encore d'évaluation
- Chap12c Reactions of Alcoois, Eteres e SulfetosDocument96 pagesChap12c Reactions of Alcoois, Eteres e Sulfetosrodrigo_0909Pas encore d'évaluation
- Chap18a Substâncias Carboniladas IIDocument116 pagesChap18a Substâncias Carboniladas IIrodrigo_0909Pas encore d'évaluation
- Reacoes OrganicasDocument27 pagesReacoes Organicascarbony_carbonilaPas encore d'évaluation
- Acidez e Basicidade em Compostos OrgânicosDocument8 pagesAcidez e Basicidade em Compostos OrgânicosRayanne Silva100% (1)
- GUIÃO DE CORREÇÃO - Teste 2Document4 pagesGUIÃO DE CORREÇÃO - Teste 2Carmen PaulinoPas encore d'évaluation
- Acidez e Basicidade Dos Compostos Orgânicos PDFDocument5 pagesAcidez e Basicidade Dos Compostos Orgânicos PDFPedro DonolaPas encore d'évaluation
- Síntese IodofórmioDocument8 pagesSíntese IodofórmioGabriella GabyPas encore d'évaluation
- Quimica 20062Document3 pagesQuimica 20062Gabriel AbouPas encore d'évaluation
- Aula 5 Volumetria de Complexacao PDFDocument40 pagesAula 5 Volumetria de Complexacao PDFElaine FerreiraPas encore d'évaluation
- ÁcidosDocument31 pagesÁcidosKeila DiasPas encore d'évaluation
- Resumo de Química para AC2 e AC3Document30 pagesResumo de Química para AC2 e AC3lucas 60fpsPas encore d'évaluation
- Conceitos de Ácidos e Bases - Prof° Agamenon RobertoDocument6 pagesConceitos de Ácidos e Bases - Prof° Agamenon Robertocb_penatrujilloPas encore d'évaluation
- Química Orgânica: Cadeias Carbônicas e Ligação QuímicaDocument18 pagesQuímica Orgânica: Cadeias Carbônicas e Ligação QuímicaThalles RannierePas encore d'évaluation
- Respostas Dos Exercicios PropostosDocument19 pagesRespostas Dos Exercicios Propostoskenkoz573Pas encore d'évaluation
- Quimica Cap9Document3 pagesQuimica Cap9pedroteixeirasales01Pas encore d'évaluation
- Carbonilas Adição Nuc 2022Document70 pagesCarbonilas Adição Nuc 2022darthcaedusPas encore d'évaluation
- Ficha Acidos CarboxilicosDocument3 pagesFicha Acidos Carboxilicosarnold romanPas encore d'évaluation
- Fundamentos de Química Orgânica - Lista de Exercícios 2Document2 pagesFundamentos de Química Orgânica - Lista de Exercícios 2Milton BastoPas encore d'évaluation
- Aula 10 - Síntese Do Cloreto de T-ButilaDocument7 pagesAula 10 - Síntese Do Cloreto de T-ButilaIlenil SantosPas encore d'évaluation
- RadioliseDocument19 pagesRadiolisenorbertokvPas encore d'évaluation
- Movimento circular uniforme e suas grandezasDocument10 pagesMovimento circular uniforme e suas grandezasLarissa Manielly morais limaPas encore d'évaluation
- Química geral e inorgânicaDocument5 pagesQuímica geral e inorgânicaRogger RochaPas encore d'évaluation
- Exercícios Ácido BaseDocument6 pagesExercícios Ácido BaseHenrique Cesar RodriguesPas encore d'évaluation
- Ad Nucleofilica CarbonilasDocument48 pagesAd Nucleofilica CarbonilasdarthcaedusPas encore d'évaluation
- Álcoois e ÉteresDocument70 pagesÁlcoois e ÉtereskatarinafukuharaPas encore d'évaluation
- Sebenta de Exercicios QA2012 - JPNDocument43 pagesSebenta de Exercicios QA2012 - JPNiudhasoidjoiasdPas encore d'évaluation
- Funções InorgânicasDocument5 pagesFunções Inorgânicasjonatas.limaPas encore d'évaluation
- Aula Prof Anibal Ácido Básico e HidroEletroliticoDocument15 pagesAula Prof Anibal Ácido Básico e HidroEletroliticoKarina CostaPas encore d'évaluation
- Lista Exerccio OrgDocument4 pagesLista Exerccio Orgyasmin silva0% (1)
- Compostos CarboniladosDocument63 pagesCompostos CarboniladosMercês MendesPas encore d'évaluation
- Quimica1 Cap15Document4 pagesQuimica1 Cap15FRANCISCO TARCIOPas encore d'évaluation
- Alcinos - 1Document5 pagesAlcinos - 1José Everton SilvaPas encore d'évaluation
- Lista de Exercícios - PolímerosDocument5 pagesLista de Exercícios - Polímerosalexchacal100% (1)
- ALUNO Folheto4 OLIMPIADA QUIMICA 28 4 TONY 2021Document10 pagesALUNO Folheto4 OLIMPIADA QUIMICA 28 4 TONY 2021Emily ReisPas encore d'évaluation
- 05-Fun Es Inorg NicasDocument7 pages05-Fun Es Inorg NicasAna AlvesPas encore d'évaluation
- Aromáticos: Regra de Huckel e Provas de Estrutura do BenzenoDocument76 pagesAromáticos: Regra de Huckel e Provas de Estrutura do BenzenoCaioPas encore d'évaluation
- Acidoses e Alcaloses MetabolicasDocument99 pagesAcidoses e Alcaloses MetabolicasRodrigo Werner ToccoliPas encore d'évaluation
- Tabela 20das 20principais 20fun C3 A7 C3 B5es 20org C3 A2nicasDocument2 pagesTabela 20das 20principais 20fun C3 A7 C3 B5es 20org C3 A2nicasedmmss MssPas encore d'évaluation
- Quimica1 Cap15 1Document4 pagesQuimica1 Cap15 1Yasmin Galliza AguiarPas encore d'évaluation
- ICT 016 - Reações de Esterificação, Transesterificação, Hidrólise e SaponificaçãoDocument15 pagesICT 016 - Reações de Esterificação, Transesterificação, Hidrólise e SaponificaçãoLAYDETCPas encore d'évaluation
- Capítulo 12 (essencial)Document38 pagesCapítulo 12 (essencial)samuelnascimento323Pas encore d'évaluation
- Condensações Aldólicas (Impressão) (Modo de Compatibilidade)Document20 pagesCondensações Aldólicas (Impressão) (Modo de Compatibilidade)andreiampwPas encore d'évaluation
- 3-Álcoois e FenóisDocument47 pages3-Álcoois e Fenóisapi-3704406100% (2)
- Conferencia 2 Port Equilibrio IónicoDocument43 pagesConferencia 2 Port Equilibrio IónicoMango lavoPas encore d'évaluation
- Apostila Química Orgânica: Terpenos E Rotas De SínteseD'EverandApostila Química Orgânica: Terpenos E Rotas De SíntesePas encore d'évaluation
- Final Fantasy VIII CompletinhoDocument33 pagesFinal Fantasy VIII CompletinhoDioc450% (2)
- SolubilidadeDocument9 pagesSolubilidadeDioc4Pas encore d'évaluation
- As Partículas FundamentaisDocument7 pagesAs Partículas FundamentaisDioc4Pas encore d'évaluation
- Introducao A Fisica Quantica 02Document5 pagesIntroducao A Fisica Quantica 02Carlos Veras100% (1)
- Dispositivos Simples de Energía Libre - Es.ptDocument4 pagesDispositivos Simples de Energía Libre - Es.ptAdriano SouzaPas encore d'évaluation
- Características PP reprocessado peças automotivasDocument53 pagesCaracterísticas PP reprocessado peças automotivasAntônio César da SilvaPas encore d'évaluation
- Calculo de PassarelaDocument93 pagesCalculo de Passarelamola65100% (2)
- Diagramas de cargas em vigas principais de concretoDocument16 pagesDiagramas de cargas em vigas principais de concretoCesar AugustoPas encore d'évaluation
- Nanocompósitos automotivosDocument45 pagesNanocompósitos automotivosRafael HenriquePas encore d'évaluation
- Pilha de LatinhaDocument2 pagesPilha de LatinhaGabriel AraújoPas encore d'évaluation
- IMI Interativa Concentric Butterfly Valves PTDocument12 pagesIMI Interativa Concentric Butterfly Valves PTLeandro Fagundes de PaulaPas encore d'évaluation
- Lista Exercícios Intro Química OrgânicaDocument6 pagesLista Exercícios Intro Química OrgânicaCarlos WestrupPas encore d'évaluation
- Galvanoplastia protege peças contra corrosãoDocument2 pagesGalvanoplastia protege peças contra corrosãoELLEN CRYSTINA LESTENSKY PEREIRAPas encore d'évaluation
- Geomechanical behavior and alterability of Simplício dam gneissDocument206 pagesGeomechanical behavior and alterability of Simplício dam gneissVeronica MaynardPas encore d'évaluation
- Guia de incompatibilidade de produtos químicosDocument8 pagesGuia de incompatibilidade de produtos químicosAlexandre BelarminoPas encore d'évaluation
- Slides - Pedras NaturaisDocument43 pagesSlides - Pedras NaturaisIdieni Amélia MöllerPas encore d'évaluation
- Rochas e minerais na escola EB 2,3 FERNANDO TÁVORADocument4 pagesRochas e minerais na escola EB 2,3 FERNANDO TÁVORAFernando Jorge Teixeira100% (3)
- Adpol 777 DF - Rev4Document3 pagesAdpol 777 DF - Rev4Cleber RodrigoPas encore d'évaluation
- Prova - SepDocument9 pagesProva - Sepbruno26041998Pas encore d'évaluation
- Corrosão de armaduras em concretoDocument36 pagesCorrosão de armaduras em concretolucas5nilhaPas encore d'évaluation
- Artigo-Geo RS 2009Document10 pagesArtigo-Geo RS 2009JúniorLopesPas encore d'évaluation
- Aula3 PTR0115NDocument69 pagesAula3 PTR0115NJoão Pedro BragaPas encore d'évaluation
- Prova Ciências 5º Ano 1º BimestreDocument4 pagesProva Ciências 5º Ano 1º BimestreSilvia HelenaPas encore d'évaluation
- Cilindro de PaintballDocument5 pagesCilindro de PaintballVinicius Matos da SilvaPas encore d'évaluation
- Dimensionamento de perfis para compressãoDocument5 pagesDimensionamento de perfis para compressãoRodrigo DuartePas encore d'évaluation
- 02 05 2014-15-30densidade Energetica de Residuos VegetaisDocument11 pages02 05 2014-15-30densidade Energetica de Residuos VegetaisLucas Faria de MedeirosPas encore d'évaluation
- Estacas Pranchas LaminadasDocument23 pagesEstacas Pranchas LaminadasFrederico DonagemmaPas encore d'évaluation
- Cabos @certielDocument6 pagesCabos @certielRui Rego100% (1)
- Principais áreas de pesquisa e províncias do Cráton AmazônicoDocument51 pagesPrincipais áreas de pesquisa e províncias do Cráton AmazônicoAlex RamiresPas encore d'évaluation
- Propriedades Físicas dos MateriaisDocument4 pagesPropriedades Físicas dos MateriaisFILOMENO GONÇALVES Santos100% (1)
- Araldite Ly1316 2br Hy951Document4 pagesAraldite Ly1316 2br Hy951Adriano OliveiraPas encore d'évaluation
- Ensaios de materiaisDocument2 pagesEnsaios de materiaisAnderson Ferraz67% (3)
- Ficha Tecnica MT Marcos TH EspDocument2 pagesFicha Tecnica MT Marcos TH EspZeryan GuerraPas encore d'évaluation
- Materiais Móveis DetalhamentoDocument98 pagesMateriais Móveis DetalhamentoDeborah Diniz100% (2)