Académique Documents
Professionnel Documents
Culture Documents
GUIA 5 MICOLOGIA-Dermatofitos
Transféré par
cistian david gaona mateusTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
GUIA 5 MICOLOGIA-Dermatofitos
Transféré par
cistian david gaona mateusDroits d'auteur :
Formats disponibles
Código FLA-23 v.
00
Guía Unificada de Laboratorios
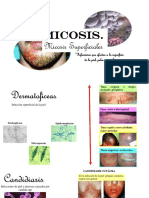
MICOLOGIA CLINICA
Página 1 de 6
1. Titulo:
Guía No 5
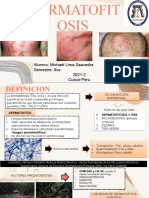
DERMATOFITOSIS
2. Objetivo General
Correlacionar datos clínicos y epidemiológicos con los hallazgos en el examen directo y el cultivo para el correcto
diagnóstico de las dermatofitosis.
2.1 Objetivos Específicos
1. Aplicar una toma de muestra adecuada.
2. Identificar mediante el examen directo, las estructuras correspondientes a dermatofitosis.
3. Realizar diagnóstico de dermatofitosis, por medio del examen directo de muestras clínicas.
4. Informar correctamente el resultado de los exámenes directos.
5. Identificar género y especie de los agentes etiológicos
6. Correlacionar los datos clínicos y epidemiológicos de esta micosis.
3. Marco Teórico
Definición
Las dermatofitosis o tineas, son micosis de la piel y sus anexos, uñas y cabellos, producidas por hongos dermatofitos
que se encargan de colonizar la capa cornificada de la piel y sus anexos produciendo una variedad de manifestaciones
clínicas cuya intensidad está asociada con el nicho ecológico del hongo, con el tipo de respuesta inmune inducida, con
factores ambientales y posiblemente con factores genéticos por parte del hospedero.
Los hongos dermatofitos hacen parte en su estado perfecto del Phyllum Ascomycota; este estado se asocia con la
capacidad de reproducirse sexualmente por ascosporas; cuando a algunos de estos hongos se le encuentra este tipo
de reproducción usualmente el nombre del género y la especie cambian, localizándose todos ellos en un sólo género
que se conoce con el nombre de Arthroderma.
La forma imperfecta del hongo (anamorfa), está relacionada con la reproducción sexual, es el estado en el que con
mayor frecuencia se encuentra este grupo de hongos; debido a sus características macroscópicas y microscópicas
ellos se clasifican en tres géneros que son: Trichophyton, Microsporum y Epidermophyton.
Hasta el momento se han descrito aproximadamente 40 especies de dermatofitos, los cuales además, por su nicho
ecológico se han clasificado en tres grupos: los antropofílicos, los zoofílicos y los geofílicos. Los antropofílicos viven en
la piel del hombre ,los zoofílicos en la piel de animales, los geofílicos permanecen en restos de queratina que caen en
la tierra y que están en proceso de descomposición.
Las lesiones características de las tineas son el resultado de la invasión del estrato córneo por el hongo, la liberación
de sus productos metabólicos (algunos con propiedades enzimáticas y antigénicas), así como de la respuesta
inflamatoria del hospedero, expresada a nivel de la epidermis y la dermis. En las dermatofitosis es también frecuente
observar reacciones alérgicas que se manifiestan a distancia, las llamadas dermatofitides; estas lesiones son estériles
y suelen presentarse como vesículas pruriginosas o áreas de descamación fina, semejantes a otras afecciones
dermatológicas (dishidrosis) o a una tinea. Las infecciones por hongos antropofílicos son usualmente crónicas y poco
inflamatorias, mientras que las causadas por especies zoofílicas y geofílicas suelen ser agudas y producir marcada
reacción inflamatoria.
Las lesiones se presentan en la piel glabra (tinea corporis), en el ángulo interno del muslo (tinea cruris), en las uñas
(tinea unguium), en los pies y en las manos (tinea pedis y tinea manuum), en el cabello (tinea capitis) y en la barba
(tinea barbae).
Elaborado por: Revisado y Aprobado por:
Daisy Janeth Carvajal B Versión 2 de 2
MSc - Microbiología.
Fecha: Septiembre de 2009 Fecha: Fecha: Septiembre de 2009
Código FLA-23 v. 00
Guía Unificada de Laboratorios
MICOLOGIA CLINICA
Página 2 de 6
Agentes etiológicos
Especies de los géneros Microsporum, Trichophyton y Epidermophyton.
En nuestro medio, las especies más comunes son, en orden de importancia:
Trichophyton rubrum
Trichophyton mentagrophytes
Epidermophyton floccosum
Microsporum canis
Microsporum gypseum
Trichophyton tonsurans
Diagnóstico
El examen directo junto con el cultivo son los métodos de elección para el diagnóstico de las dermatofitosis, ambos
métodos se deben usar de manera conjunta pues se ha encontrado que cada uno de ellos por separado tiene una
sensibilidad y especificidad moderadas
Muestra
Escamas de piel: deben recolectarse de los bordes activos de la lesión con hoja de bisturí.
Detrito subungueal y fragmentos de uñas: se toman con pinzas y cortaúñas estériles
Vellos y Cabellos, aquellos opacos, quebradizos y cortos o los que se fracturan al alcanzar la superficie y los que dan
el aspecto de puntos negros: se deben arrancar con pinzas estériles
Examen directo
KOH al 10 ó 20% adicionado con tinta china azul
Negro de clorazol E
Calcofluor
Hallazgos
En la tinea corporis, cruris, pedis, unguium, manuum y barbae se observan hifas hialinas de 3 -15um de diámetro,
septadas y ramificadas, con o sin artroconidias, en algunos casos se ven clamidoconidias.
En la tinea capitis tipo endothrix se ve intacto el límite del pelo y en su interior se observan hifas con algunas
artroconidias. En la forma endo-ectotrix, se encuentran hifas y algunas veces artroconidias en el interior del cabello;
pero lo más distintivo es que se encuentran fragmentos de hifas y abundantes artroconidias formando una vaina o
cubierta en su parte externa. Las estructuras micóticas son de diferente tamaño según el agente etiológico. En la
tinea barbae se describen hallazgos similares en el vello.
Significado
En las lesiones que comprimen el cabello se llega al diagnóstico clínico de tinea capitis, variedad endo o ectotrix.
En la piel glabra, excluyendo los pies, se puede llegar al diagnóstico de tinea corporis.
En el área inguino-crural las lesiones pueden ser producidas por dermatofitos o por levaduras del género Candida , por
tanto, es difícil la diferenciación entre hifas (dermatofitos) cuando las blastoconidias no están presentes.
En las lesiones de uñas y pies usualmente las estructuras micóticas observadas al mic roscopio no permiten una
diferenciación neta correspondientes a los mohos moniliáceos y aún dematiáceos poco pigmentados. Además en
muchos casos es difícil diferenciar las hifas de las pseudohifas. En conclusión en las lesiones de uñas y pies muchas
veces solo se puede afirmar que la lesión es de origen micótico.
En todos los casos de tineas se requiere el cultivo para establecer el género y la especie del agente etiológico.
Informe de resultados
Piel glabra: Se observan fragmentos de micelio compatibles con dermatofitos
Piel del área inguino-crural: Se observan fragmentos de micelio /estructuras micóticas
Uñas y pies: Se observan fragmentos de micelio / estructuras micóticas
Cabello: invasión tipo endotrix; invasión tipo endo-ectotrix-
Elaborado por: Revisado y Aprobado por:
Daisy Janeth Carvajal B Versión 2 de 2
MSc - Microbiología.
Fecha: Septiembre de 2009 Fecha: Fecha: Septiembre de 2009
Código FLA-23 v. 00
Guía Unificada de Laboratorios
MICOLOGIA CLINICA
Página 3 de 6
Cultivo
La identificación de especie de los dermatofitos se hace a partir de los cultivos. Las muestras se siembran en agar
sabouraud modificado, se incuban entre 22 y 27C, y se mantienen en oscuridad por 2 a 3 semanas.
Cuando crece las colonias se analiza la morfología macroscópica y microscópica de ella así:
Macroscópicamente:
Consistencia: puede ser algodonosa, pulverulenta o granulosa
Topografía: puede ser rugosa, crateriforme o cerebriforme.
Color en el anverso
Color en el reverso
Microscópicamente
Microconidias: tamaño, forma y organización sobre la hifa
Macroconidias: forma, tamaño, tipo de pared y número de septos.
Otras estructuras, como hifas en espiral, clamidosporas, hifas en forma de candelabro.
Características de género
El género Microsporum presenta abundante cantidad de macroconidias de pared gruesa, rugosas, fusiformes, a
veces con pequeñas prolongaciones en forma de espina (equinuladas); producen también microconidias que son
sésiles, pedunculadas surgen solas o en racimos. Especies: M. canis, M. gypseum. Figuras 1,2, 3 y 4.
Figura 1 Colonias de Microsporum canis Figura 2 Microsporum canis en azul de lactofenol
Figura 3 Colonias de Microsporum gypseum Figura 4 Microsporum gypseum en azul de lactofenol
Elaborado por: Revisado y Aprobado por:
Daisy Janeth Carvajal B Versión 2 de 2
MSc - Microbiología.
Fecha: Septiembre de 2009 Fecha: Fecha: Septiembre de 2009
Código FLA-23 v. 00
Guía Unificada de Laboratorios
MICOLOGIA CLINICA
Página 4 de 6
El género Trichophyton se caracteriza por presentar con mayor frecuencia microconidias globosas, piriformes, sésiles
o pedunculadas, pueden salir solas o formando racimos a partir de la hifa. Las macroconidias son raras y cuando
aparecen son de pared delgada, lisas y elongadas en forma de lápiz, fusiformes o cilíndricas con una longitud entre 8 a
86 μm y un diámetro de 4 a 14 μm . Especies: T. mentagrophytes, T. rubrum, T. tonsurans, T. schöenleinii. Figura 5 a
12
Figura 5 Colonia de Trichophyton mentagrophytes Figura 6 Trichophyton mentagrophytes en azul de
lactofenol
Figura 7Colonia de Trichophyton rubrum Figura 8 Trichophyton rubrum en azul de lactofenol
Figura 9 Colonia de Trichophyton tonsurans Figura 10 Trichophyton tonsurans en azul de lactofenol
Elaborado por: Revisado y Aprobado por:
Daisy Janeth Carvajal B Versión 2 de 2
MSc - Microbiología.
Fecha: Septiembre de 2009 Fecha: Fecha: Septiembre de 2009
Código FLA-23 v. 00
Guía Unificada de Laboratorios
MICOLOGIA CLINICA
Página 5 de 6
Figura. 11 Colonia de Trichophyton schöenleinii Figura. 12 Trichophyton schöenleinii en azul de lactofenol
El género Epidermophyton presenta macroconidias en forma de raqueta con paredes que pueden ser delgadas o
gruesas y con 1 a 9 septos, éstas son abundantes y salen de las hifas de manera individual o en racimos; también
presenta abundante cantidad de clamiconidias. Sólo presenta una sola especie que es E. floccosum . Figura 13 y 14
Figura 13 Colonia de Epidermophyton floccosum Figura 14 Epidermophyton floccosum en azul de
lactofenol
4. Materiales, Equipos e Insumos
4.1 Materiales:
Elementos de bioseguridad: Bata manga larga, guantes, gorro, careta.
Láminas portaobjeto
Laminillas cubreobjeto
KOH 10%
Fósforos
Toalla de papel
Hojas de bisturí
Lancetas
Tijeras
4.2 Medios
Agar sabouraud modificado (Mycosel, Dermasel, Micobioctic)
Cultivos en Agar sabouraud modificado de los agentes etiológicos de dermatofitomicosis.
Elaborado por: Revisado y Aprobado por:
Daisy Janeth Carvajal B Versión 2 de 2
MSc - Microbiología.
Fecha: Septiembre de 2009 Fecha: Fecha: Septiembre de 2009
Código FLA-23 v. 00
Guía Unificada de Laboratorios
MICOLOGIA CLINICA
Página 6 de 6
5. Procedimiento
PRIMERA SEMANA.
Observar las placas de colección.
Reconocer las diferentes formas de esporulación de los hongos dermatofitos.
Observar las características de las colonias de estos hongos
Realizar la técnica de microcultivo para lograr la esporulación de estos hongos.
SEGUNDA SEMANA
Diligenciar la historia clínica.
Toma de muestras: Cultivo y examen directo de lesiones de pacientes con lesiones producidas por dermatofitos a nivel
de piel, pelo y uñas.
Leer y reportar los exámenes directos.
Incubar los cultivos
6. Nivel de Riesgo:
Nivel 2 (Medio)
7. Bibliografía
ARANGO M., CASTAÑEDA E., Micosis humanas, Procedimientos diagnósticos. Exámenes directos. Edición CIB,
INS. 1.995
ESCOBAR M, y otros. Micología. Manual de Laboratorio. Departamento de Microbiología y Parasitología, Facultad
de Medicina, Universidad de Antioquia. 1.995
PEREZ J. Aspectos actuales sobre las dermatofitosis y sus agentes etiológicos. Biosalud Vol 14. Enero –Dic 2005
págs. 105-121.
Fotografías tomadas de:
http://www.nlm.nih.gov/medlineplus/spanish/ency/article/000877.htm
http://bilbo.edu.uy/~microbio/hongos.html
http://timm.main.teikyo-u.ac.jp/pfdb/cover/alphabetical_list.html
8. Anexos
CONSULTA
1. De acuerdo a cada uno de los agentes etiológicos mencionados describa, su hábitat, los tejidos que afecta,
las características de sus colonias, y sus características microscópicas que le permiten identificarlo y dibújelos.
2. En qué consiste el fenómeno de Mosaico y cómo se observa al microscopio?
3. Qué requisitos debe cumplir un paciente para tomarle una buena muestra para el diagnóstico de
dermatofitomicosis.
4. De qué sitio de la lesión debe tomarse la muestra para el diagnóstico de tiña corporis y porqué razón?
5. Cuánto tiempo debe dejarse en incubación un cultivo de dermatofitos antes de ser descartado como negativo?
6. Qué técnica de Laboratorio se utiliza para la toma de muestras, cuando se quiere estudiar la presencia de
dermatofitos en superficies de suelos, baños, saunas, piscinas, ropa y otros ambientes húmedos?.
7. Explique porqué razón se utiliza la lámpara de Wood en el diagnóstico de dermatofitosis.
8. Explique para qué se utiliza la técnica del anzuelo.
Elaborado por: Revisado y Aprobado por:
Daisy Janeth Carvajal B Versión 2 de 2
MSc - Microbiología.
Fecha: Septiembre de 2009 Fecha: Fecha: Septiembre de 2009
Vous aimerez peut-être aussi
- Dermatofitos TiñaDocument20 pagesDermatofitos TiñaMichael Lima SaavedraPas encore d'évaluation
- CLASE 12. Clasificación de Los Leucocitos. Interpretación Clínica.Document67 pagesCLASE 12. Clasificación de Los Leucocitos. Interpretación Clínica.Juan SandovalPas encore d'évaluation
- Cuadro de ParasitosDocument31 pagesCuadro de ParasitosMaria Belen VillagranPas encore d'évaluation
- Tiña CorporisDocument8 pagesTiña CorporisFabian JaraPas encore d'évaluation
- MicologíaDocument74 pagesMicologíaMiguel Avalos50% (2)
- Marcadores Tumorales Su Diagnostico en El LaboratorioDocument30 pagesMarcadores Tumorales Su Diagnostico en El LaboratorioJano GarciaPas encore d'évaluation
- Dermatofitos: Características macro y microscópicasDocument9 pagesDermatofitos: Características macro y microscópicasAnel BernabePas encore d'évaluation
- Diagnostico de DermatofitosDocument53 pagesDiagnostico de DermatofitosRobert L. CaballeroPas encore d'évaluation
- Leucemias (FAB)Document17 pagesLeucemias (FAB)Denisse RdzPas encore d'évaluation
- Cuaderno de CampoDocument7 pagesCuaderno de CampoMaritzaPas encore d'évaluation
- Medios_de_cultivo_selectivos_y_diferencialesDocument3 pagesMedios_de_cultivo_selectivos_y_diferencialesGeovani DiazPas encore d'évaluation
- Practicas de Laboratorio de Microbiologia PDFDocument211 pagesPracticas de Laboratorio de Microbiologia PDFoscarin123456789Pas encore d'évaluation
- Sindrome MielodisplasicoDocument46 pagesSindrome MielodisplasicoWALTERPas encore d'évaluation
- Hymenolepis nana: parásito intestinal de 25-40mm que infecta al hombreDocument1 pageHymenolepis nana: parásito intestinal de 25-40mm que infecta al hombreZarialmlPas encore d'évaluation
- Anemia ferropénica: causas, diagnóstico y tratamientoDocument277 pagesAnemia ferropénica: causas, diagnóstico y tratamientoVictor Santiago100% (1)
- Conociendo El Banco de Sangre 07marzo2020 PDFDocument98 pagesConociendo El Banco de Sangre 07marzo2020 PDFCandy MendiolaPas encore d'évaluation
- Leucemias LinfoblasticasDocument43 pagesLeucemias LinfoblasticasRyan Ken IlookatyouPas encore d'évaluation
- 4 - EctoparasitosisDocument69 pages4 - EctoparasitosisFélix AlemánPas encore d'évaluation
- Medios de Cultivo, Reactivos y Tecnicas de Montaje Utilizados en MicologiaDocument5 pagesMedios de Cultivo, Reactivos y Tecnicas de Montaje Utilizados en Micologiacistian david gaona mateusPas encore d'évaluation
- Metodos de Diagnostico CoproparasitologicoDocument17 pagesMetodos de Diagnostico CoproparasitologicoRobert Caballero BardalesPas encore d'évaluation
- MICOSIS (Superficiales-Cutaneos)Document11 pagesMICOSIS (Superficiales-Cutaneos)LidallyPas encore d'évaluation
- Trabj Diphyllobothrium LatumDocument7 pagesTrabj Diphyllobothrium LatumDiegoPas encore d'évaluation
- GUIA - 2 - LABORATORIO Estructuras Somaticas-MicologiaDocument7 pagesGUIA - 2 - LABORATORIO Estructuras Somaticas-Micologiacistian david gaona mateusPas encore d'évaluation
- Clereance de CreatininaDocument1 pageClereance de CreatininaluaplazPas encore d'évaluation
- Factores de VirulenciaDocument17 pagesFactores de VirulenciaEnrique Alfonso Cabeza HerreraPas encore d'évaluation
- Leucemia 1Document54 pagesLeucemia 1antoniapepita77Pas encore d'évaluation
- Coloración PasDocument21 pagesColoración PasVicttoryaPas encore d'évaluation
- Clave Pictorica de TriatominosDocument16 pagesClave Pictorica de TriatominosyesseniaPas encore d'évaluation
- Las 10 Plagas de Egipto y Su SignificadoDocument10 pagesLas 10 Plagas de Egipto y Su SignificadoMarceloMarianiPas encore d'évaluation
- Sílabo Bioquímica Clínica II 2021 PARALELO ADocument23 pagesSílabo Bioquímica Clínica II 2021 PARALELO AVERONICA PAZPas encore d'évaluation
- Sesión 11 Prueba CATA - SpectrumDocument28 pagesSesión 11 Prueba CATA - SpectrumGabriela Pasion BazanPas encore d'évaluation
- Norma Técnica de Salud de Atención Integral de BrucelosisDocument34 pagesNorma Técnica de Salud de Atención Integral de BrucelosisJaneth Roxana Aldazábal AlarcónPas encore d'évaluation
- Difilobotriosis: Parásito intestinal causante de anemiaDocument27 pagesDifilobotriosis: Parásito intestinal causante de anemiaJose Nelson DepablosPas encore d'évaluation
- Inmunología Frente A HongosDocument25 pagesInmunología Frente A HongosMonserrat OpitzPas encore d'évaluation
- LeucopoyesisDocument29 pagesLeucopoyesisAnabel CamachoPas encore d'évaluation
- TEORÍA ESTUDIO DE LOS LEUCOCITOS. LEUCOPOYESIS Semana 7Document37 pagesTEORÍA ESTUDIO DE LOS LEUCOCITOS. LEUCOPOYESIS Semana 7KelletCadilloBarruetoPas encore d'évaluation
- Leucemias AgudasDocument87 pagesLeucemias AgudasJuan Lopez100% (1)
- Enfermedad de Chagas Final FinalDocument19 pagesEnfermedad de Chagas Final FinalBrigitte MonjaPas encore d'évaluation
- Guia #5 Levaduras y DermatofitosDocument7 pagesGuia #5 Levaduras y DermatofitosAlejandra CastilloPas encore d'évaluation
- Plan de Gobierno CARACOTODocument9 pagesPlan de Gobierno CARACOTOJefferson ParraPas encore d'évaluation
- Formulario de Balanza PDFDocument8 pagesFormulario de Balanza PDFLuden Javier Dávila AcuñaPas encore d'évaluation
- Martes - Hugo Fuentes Cruz. Practica Noxas - Semana 11Document7 pagesMartes - Hugo Fuentes Cruz. Practica Noxas - Semana 11hugo f.cPas encore d'évaluation
- Dermatofitos (Recuperado)Document18 pagesDermatofitos (Recuperado)Dairo Luis Avila MendezPas encore d'évaluation
- Observación Microscópica de HongosDocument9 pagesObservación Microscópica de HongosKarlos Alayo BardalesPas encore d'évaluation
- ANTICUERPOSDocument25 pagesANTICUERPOSCristian Saavedra DíazPas encore d'évaluation
- Aeromonas PresentaciónDocument22 pagesAeromonas Presentacióntaniamariaguzman_353100% (1)
- Preparacion de Un Medio de CultivoDocument12 pagesPreparacion de Un Medio de CultivoSuanie PatiñoPas encore d'évaluation
- Prevalencia de dermatofitos en niños escolares de PunoDocument29 pagesPrevalencia de dermatofitos en niños escolares de PunoR Warner QuispePas encore d'évaluation
- Diphyllobothrium peruanoDocument18 pagesDiphyllobothrium peruanoAnonymous me3HTbZbhPas encore d'évaluation
- Guia Cultivo de Linfocitos para Obtencion de MetafasesDocument5 pagesGuia Cultivo de Linfocitos para Obtencion de MetafasesMarta Isabel Lindo ValdesPas encore d'évaluation
- Trichosporon BeigeliiDocument11 pagesTrichosporon BeigeliiADRIAN0% (1)
- Micologia Tarea 4Document9 pagesMicologia Tarea 4Nathaly Jovana Contreras HerreraPas encore d'évaluation
- Edward Lawrie Tatum y George Wells BeadleDocument8 pagesEdward Lawrie Tatum y George Wells BeadleBioquimicaPas encore d'évaluation
- c6 Metabolismo de Las BacteriasDocument30 pagesc6 Metabolismo de Las BacteriasMyle SaaPas encore d'évaluation
- Toxoplasma GondiiDocument46 pagesToxoplasma GondiiEmma Segura Solis100% (1)
- Guia Parasitologia v.2 - 2018-2Document100 pagesGuia Parasitologia v.2 - 2018-2Milagros Daniela Gonzales SalazarPas encore d'évaluation
- StreptococcusDocument41 pagesStreptococcusJuan R. AntunezPas encore d'évaluation
- Pruebas de Susceptibilidad A AntimicrobianosDocument22 pagesPruebas de Susceptibilidad A AntimicrobianosJuan CarlosPas encore d'évaluation
- PseudomonasDocument24 pagesPseudomonashepatompPas encore d'évaluation
- Niveles de BioseguridadDocument32 pagesNiveles de BioseguridadWal RamosPas encore d'évaluation
- Identificacion de Bacterias en OrinaDocument25 pagesIdentificacion de Bacterias en OrinaEdgar Ruiz Rojas0% (1)
- PROTOZOOS Y NEMATELMINTOSpptxDocument47 pagesPROTOZOOS Y NEMATELMINTOSpptxremy samir ramos causaPas encore d'évaluation
- Práctica 1. MicologíaDocument1 pagePráctica 1. Micologíapao ricaldiPas encore d'évaluation
- Chlamydia TrachomatisDocument16 pagesChlamydia TrachomatisJAIR ADRIAN FLORES AGUAYOPas encore d'évaluation
- Guia 8 LaboratorioDocument5 pagesGuia 8 Laboratoriocistian david gaona mateusPas encore d'évaluation
- Actividad 1 (4431)Document2 pagesActividad 1 (4431)cistian david gaona mateusPas encore d'évaluation
- Taller Laboratorio Parasitologia Clinica I (4432)Document2 pagesTaller Laboratorio Parasitologia Clinica I (4432)cistian david gaona mateusPas encore d'évaluation
- Guia 6 LaboratorioDocument7 pagesGuia 6 Laboratoriocistian david gaona mateusPas encore d'évaluation
- Guia 8 LaboratorioDocument5 pagesGuia 8 Laboratoriocistian david gaona mateusPas encore d'évaluation
- Micrometría Parasitaria CristianDocument3 pagesMicrometría Parasitaria Cristiancistian david gaona mateusPas encore d'évaluation
- Enzimas bacterianasDocument11 pagesEnzimas bacterianasMiguel MorenoPas encore d'évaluation
- Flagelados Comensales y Patogenos3Document120 pagesFlagelados Comensales y Patogenos3cistian david gaona mateusPas encore d'évaluation
- Guia 7 LaboratorioDocument7 pagesGuia 7 Laboratoriocistian david gaona mateusPas encore d'évaluation
- Guia 9 LaboratorioDocument9 pagesGuia 9 Laboratoriocistian david gaona mateusPas encore d'évaluation
- Guia 6 Tinciones 2016 PDFDocument11 pagesGuia 6 Tinciones 2016 PDFMiguel MorenoPas encore d'évaluation
- BioseguridadDocument7 pagesBioseguridadJhanpiere Castro GonzalezPas encore d'évaluation
- Guia 7 Medios Selectivos y Diferenciales 2016Document5 pagesGuia 7 Medios Selectivos y Diferenciales 2016Camilo QuinteroPas encore d'évaluation
- Técnica de MicrocultivoDocument3 pagesTécnica de Microcultivocistian david gaona mateusPas encore d'évaluation
- GUIA - 3 - MICOLOGIA - Hongos AmbientalesDocument12 pagesGUIA - 3 - MICOLOGIA - Hongos Ambientalescistian david gaona mateusPas encore d'évaluation
- Micosis Cutaneas # 2Document11 pagesMicosis Cutaneas # 2Jeniffer Gabriela Solorzano GarzonPas encore d'évaluation
- Microsporum CanisDocument8 pagesMicrosporum CanisDj6693316Pas encore d'évaluation
- Micosis SuperficialesDocument8 pagesMicosis SuperficialesFrida OlivaresPas encore d'évaluation
- Dermatomicosis FarmaciaDocument23 pagesDermatomicosis FarmaciaFranco Coco SartoriPas encore d'évaluation
- Presentación Introducción A La Microbiología Vintage Colores PastelDocument4 pagesPresentación Introducción A La Microbiología Vintage Colores Pastelanggy vergelPas encore d'évaluation
- Micosis superficiales: pitiriasis versicolor y dermatofitosisDocument13 pagesMicosis superficiales: pitiriasis versicolor y dermatofitosisKatherine Apaza LlantoyPas encore d'évaluation
- ANTIFUNGICOSDocument22 pagesANTIFUNGICOSjoseph_uni100% (1)
- 17 - DermatofitosisDocument25 pages17 - DermatofitosisShirley Marcela Cayo Sulla100% (2)
- Ficha 1 - Agentes Causales Mocosis Supeficiales 2Document6 pagesFicha 1 - Agentes Causales Mocosis Supeficiales 2Yosna cameroPas encore d'évaluation
- Clase 4 Hongos PDFDocument69 pagesClase 4 Hongos PDFFrancisca AlarcónPas encore d'évaluation
- Dermatofitosis o TiñasDocument32 pagesDermatofitosis o TiñasMaría Goretti Castilla PérezPas encore d'évaluation
- Micosis superficialesDocument107 pagesMicosis superficialesEdson Mozo MirandaPas encore d'évaluation
- Diapositivas Tema 26. Micologia MédicaDocument32 pagesDiapositivas Tema 26. Micologia MédicaJack Douglas EfronPas encore d'évaluation
- Micosis Cutáneas 2023Document96 pagesMicosis Cutáneas 2023andrew616Pas encore d'évaluation
- Cuestionario MicrobiologíaDocument3 pagesCuestionario MicrobiologíaGlOriia LópezPas encore d'évaluation
- DERMATOMICOSISDocument61 pagesDERMATOMICOSISIván HinostrozaPas encore d'évaluation
- Infecciones Piel HongosDocument58 pagesInfecciones Piel HongosAndrés Felipe PérezPas encore d'évaluation
- OnicomicosisDocument2 pagesOnicomicosisSebastian Novoa BenavidesPas encore d'évaluation
- Prevención de la tiña: formas de evitar su contagioDocument15 pagesPrevención de la tiña: formas de evitar su contagiojudederrycash555Pas encore d'évaluation
- Infecciones por dermatofitos: guía de diagnóstico y tratamientoDocument21 pagesInfecciones por dermatofitos: guía de diagnóstico y tratamientoNuriaXimenaVásquezSáenzPas encore d'évaluation
- Guia Practica Micologia PDFDocument18 pagesGuia Practica Micologia PDFbicPas encore d'évaluation
- Tiñas y PitiriasisDocument8 pagesTiñas y PitiriasisLex amellPas encore d'évaluation
- ANTIFÚNGICOSDocument3 pagesANTIFÚNGICOSValentina AriasPas encore d'évaluation
- Terbix Inserto WEBDocument1 pageTerbix Inserto WEBElvis LimaPas encore d'évaluation
- TIÑASDocument71 pagesTIÑASkarenPas encore d'évaluation
- Micosis DermatologiaDocument12 pagesMicosis DermatologiaSelena Delgadillo VasquezPas encore d'évaluation