Académique Documents
Professionnel Documents
Culture Documents
TS - BAC Blanc N°1 Corrigé - Obligatoire
Transféré par
phytanjaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TS - BAC Blanc N°1 Corrigé - Obligatoire
Transféré par
phytanjaDroits d'auteur :
Formats disponibles
Lycée Jean d’Alembert Jeudi 21 juin 2012
Correction du BAC BLANC n°1 - Obligatoire
EXERCICE 1 : ESPÈCES ACIDES EN SOLUTION (8 points) Antilles 2003 (rattrapage)
1. Mesure par pH-métrie
1.1.
1.1.1. Un acide selon Brönsted est une espèce chimique capable de céder un proton H+.
1.1.2. HA(aq) + H2O(ℓ) = A–(aq) + H3O+(aq)
Les couples mis en jeu sont : HA(aq) / A–(aq) et H3O+(aq) / H2O(ℓ).
1.1.3. D’après l’équation chimique, on a n(H3O+(aq)) = n(A-(aq))
1.2.
1.2.1. n(H3O+) = [H3O+] × V donc : n(H3O+)1 = 1,3.10–3 × 0,200 = 2,6.10–4 mol
n(H3O+)2 = 1,0.10–2 × 0,200 = 2,0.10–3 mol
1.2.2. n(HA)0 = c0.V donc : n(HA1)0 = n(HA2)0 = 1,0.10–2 × 0,200 = 2,0.10–3 mol
1.2.3. L’avancement maximal xmax de la réaction correspond à la consommation de tout l’acide présent
initialement : n(HA)0 – xmax = 0 donc xmax = c0 × V = 2,010–3 mol
Avancement final est : xf = n(H3O+) = n(A-), donc xf1 = 2,610–4 mol
xf2 = 2,010–3 mol
+ +
xf H3 O éq ∙V H3 O éq
Taux d’avancement final : = = = . Le taux d’avancement final indique le
xmax c0 ∙V c0
pourcentage de l’acide initial qui se trouve dissocié dans l’état final.
Si < 100%, alors la transformation est limitée : tout l’acide introduit initialement n’est pas consommé
(bien qu’il soit le réactif limitant).
1,3.10-3 1,0.10-2
Pour la solution S1 : 1 = = 0,13 = 13 % et pour la solution S2 : 2 = = 1,0 = 100 %
1,0.10-2 1,0.10-2
2. Suivi spectrophotométrique
2.1.
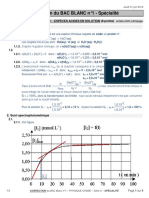
2.1.1. Voir figure.
t1/2
TS CORRECTION du BAC Blanc n°1 – PHYSIQUE-CHIMIE – Série S – OBLIGATOIRE Page 1 sur 4
Lycée Jean d’Alembert Jeudi 21 juin 2012
1 dx 1 d I (aq) ∙V d I2 (aq)
2.1.2. La vitesse volumique de réaction est définie par v = ∙ , donc v = ∙ 2 = .
V dt V dt dt
Le coefficient directeur de la tangente à la courbe en un point est égal à la vitesse à cette date. Or les
coefficients directeurs des tangentes tracées diminuent au cours du temps, la vitesse de réaction
diminue au cours du temps.
Cette évolution est liée à la diminution des concentrations en réactifs au cours du temps.
d I2 (aq) d I2 (aq)
2.1.3. > donc la vitesse est maximale à la date t = 0 min.
dt t=0 dt t
2.1.4. Le temps de demi-réaction t1/2 est la durée au bout de laquelle l’avancement atteint la moitié de sa
valeur finale. x(t1/2) = xfinal /2.
xmax
xmax 2 I2 (aq) max
2.1.5. [I2(aq)]max = [I2](t1/2) = ainsi [I2](t1/2) =
V V 2
Voir figure : t1/2 = 9 min.
2.2.
2.2.1. Les couples mis en jeu sont : H2O2(aq) / H2O(ℓ) et I2(aq) / I–(aq)
2.2.2. réduction : H2O2(aq) + 2 H+(aq) + 2e– = 2 H2O(ℓ) ou H2O2(aq) + 2 H3O+(aq) + 2e– = 4 H2O(ℓ)
oxydation : 2 I–(aq) = I2(aq) + 2e–
2.2.3. L’espèce I– subit une oxydation, en effet le produit de la réaction est l’oxydant I2.
2.2.4. L’acide recherché est entièrement dissocié dans l’eau et donne des ions iodure, c’est donc HI (acide
iodhydrique).
3. Mesure conductimétrique
3.1. = (A-)·[A-(aq)] + (H3O+)·[H3O+(aq)].
3.2. D’après la question 1.1.3. : [A-(aq)] = [H3O+(aq)], il vient : = (A-)·[H3O+(aq)] + (H3O+)·[H3O+(aq)]
σ
Soit (A-) = - (H3O+) avec [H3O+]1 = 1,3.10–3 mol.L-1 = 1,3 mol.m-3
H3 O+ (aq)
53,4
(A-) = – 35,0 = 6,1 mS.m².mol-1
1,3
3.3. Dans le tableau la valeur de la conductivité molaire ionique la plus proche correspond à l’ion méthanoate
HCOO–, il s’agit donc de l’acide méthanoïque HCOOH.
TS CORRECTION du BAC Blanc n°1 – PHYSIQUE-CHIMIE – Série S – OBLIGATOIRE Page 2 sur 4
Lycée Jean d’Alembert Jeudi 21 juin 2012
EXERCICE 2 : RADIOACTIVITÉ DANS LA FAMILLE DE L’URANIUM (7 points) Antilles2003
1. Désintégration du radium
1.1. Cette désintégration est du type alpha. En effet, elle s'accompagne de l'émission d'un noyau d'hélium
également appelé particule .
1.2.
1.2.1. Défaut de masse : m = (Z·mP + (A-Z)·mn ) – mX
1.2.2. Défaut de masse du noyau de radium :
m(Ra) = (Z·mP + (A-Z)·mn ) – mRa = (88x1,007) + (226–88)x1,009) – 225,977 = 227,858 – 225,977
m(Ra) = 1,881 u
1.3. La relation d'équivalence masse-énergie est : E = m·c²
avec : E énergie de masse en joule, m masse de la particule en kg, c célérité de la lumière dans le vide.
1.4.
1.4.1. L’énergie de liaison El d'un noyau correspond à l'énergie qu’il faut fournir à un noyau, pris au repos,
pour le séparer en ses nucléons isolés et pris au repos.
1.4.2. Pour le noyau de radon on a : El(Rn) = ∆m·c² = 3,04.10–27 x (3,00.108)² = 2,74.10–10 J
2,74.10-10
1.4.3. Ce qui fait en MeV : El(Rn) = = 1,71.103 MeV
-19 6
1,60.10 ×10
El El (Rn) 1,71.103
1.4.4. L'énergie de liaison par nucléon du noyau de radon est : = = = 7,70 MeV.nucléon-1.
A 222 222
1.5.
1.5.1. ∆E = [(mRn + mHe) – mRa]·c²
1.5.2. ∆E = [(221,970 + 4,001) – 225,977] x 1,66054.10–27 x (3,00.108)² = – 8,97.10–13 J
∆E est négative car cette réaction nucléaire s'accompagne d'une perte de masse. Le noyau de
radium cède de l'énergie au milieu extérieur.
2. Fission de l'uranium 235.
2.1. Deux noyaux sont isotopes s'ils possèdent le même numéro atomique Z mais des nombre de nucléons A
différents. En fait seul le nombre de neutrons les distingue.
2.2.
2.2.1. Lors d'une fission, un gros noyau instable, sous l'effet d'un neutron, se casse en deux noyaux plus
petits. Cette réaction nucléaire provoquée s'accompagne d'un dégagement d'énergie.
235 1 99 134
2.2.2. 92U + 0n 40Zr + 52Te + 3 10n
2.2.3. Cette réaction s'accompagne d'un dégagement d'énergie :
El El El
Elibérée = 235 x (U) – [99 x (Zr) + 134 x (Te)] < 0 car l’énergie est cédée vers le milieu extérieur
A A A
Sur la courbe d'Aston on lit :
El El El
(U) = 7,2 MeV.nucléon–1 (Zr) = 8,7 MeV.nucléon–1 (Te) = 8,5 MeV.nucléon–1
A A A
Donc Elibérée = 235 x 7,2 – [99 x 8,7 + 134 x 8,5] = – 3,1.102 MeV
3. Désintégration du noyau Zr.
3.1. La radioactivité β– correspond à un noyau instable qui se désintègre spontanément pour former un nouveau
noyau fils avec émission d'un électron.
3.2. Pour écrire cette équation, on a appliqué les lois de conservation du nombre de charges et du nombre de
99 99 0
nucléons : 40Zr 41Nb + -1
e
TS CORRECTION du BAC Blanc n°1 – PHYSIQUE-CHIMIE – Série S – OBLIGATOIRE Page 3 sur 4
Lycée Jean d’Alembert Jeudi 21 juin 2012
EXERCICE 3 : TAUX D’ALCOOLÉMIE (5 POINTS) Réunion 2008
1. Choix de la méthode de suivi.
1.1. L’ion dichromate ainsi que l’ion chrome (III) colorent la solution. Cette coloration de la solution va donc
changer en fonction de l’apparition des ions chrome (III) et/ou la disparition des ions chromate. La réaction
pourra donc être suivie par spectrophotométrie.
1.2. La spectrophotométrie est une méthode de mesure non-destructive car le système chimique n'est pas
modifié par le passage de la lumière au cours de la mesure.
2. Suivi temporel.
2.1. On sélectionne la longueur d’onde qui correspond au maximum d’absorption de l’espèce chimique étudiée.
2.2. Équation 3 CH3CH2OH(aq) + 2 Cr2O72-(aq) + 16 H+(aq) = 3 CH3COOH(aq) + 4 Cr3+(aq) + 11 H2O(l)
État initial n0 n1 Excès 0 0 Excès
État intermédiaire n0 – 3 x n1 – 2 x Excès 3x 4x Excès
État final n0 – 3 xf n1 – 2 xf Excès 3 xf 4 xf Excès
2-
n Cr2 O7 n1 - 2 x 1
2.3. On a [Cr2O72-] = = donc [Cr2O72-]·V = n1 – 2x donc x = (n1 – [Cr2O72-]·V)
V V 2
A
2.4. On a : A = 150·[Cr2O72-] donc [Cr2O72-] =
150
1 A 1 A
Donc x = ·(n1 – ·V) = ·(c·V’ – ·V) avec V’ = 10 mL = 10.10–3 L
2 150 2 150
1 –2 –3
A 1
Donc x = ·(2,0.10 x 10.10 – x 12.10–3) = ·(20.10–5 – 8,0.10–5 x A) = (10 – 4.A).10–5 mol
2 150 2
2.5. Lorsque l’absorbance n’évolue plus c’est que [Cr2O72–] n’évolue plus. L’avancement est alors maximal, car
la transformation est totale.
Graphiquement pour x = xmax, on a Af = 2,39.
Comme xmax = (10 – 4. Af).10–5
alors xmax = (10 – 4 x 2,39).10–5 = 4,4.10–6 mol.
Si l’éthanol est le réactif limitant, cela signifie que les ions
dichromate sont en excès. Donc en fin de réaction, il
resterait des Cr2O72–.
Vérifions cette hypothèse :
n(Cr2O72–)finale = n1 – 2 xmax = c.V’ – 2 xmax
n(Cr2O72–)finale = 2,0.10–2 x 10.10–3 – 2 x 4,4.10–6 = 1,9.10-4
Amax
donc comme n(Cr2O72–)finale ≠ 0, l’ion dichromate est en
excès alors l’éthanol est limitant.
2.6. L’éthanol est totalement consommé, soit n 0 – 3 xmax = 0.
Donc n0 = 3 xmax, quantité de matière contenue dans 2,0 mL de sang.
1,0
Dans 1,0 L de sang la quantité de matière d’éthanol est n = n0 · = 3 xmax x 500 = 1500 xmax
2,0.10-3
Alors la masse d’éthanol est m = n·M = 1500 x 4,4.10–6 x 46 = 0,30 g pour un litre de sang.
Le conducteur n’est pas en infraction puisque cette alcoolémie est inférieure à 0,5 g/L.
TS CORRECTION du BAC Blanc n°1 – PHYSIQUE-CHIMIE – Série S – OBLIGATOIRE Page 4 sur 4
Vous aimerez peut-être aussi
- Corrigé Du Devoir de Synthèse N°1: Chimie Exercice 1Document4 pagesCorrigé Du Devoir de Synthèse N°1: Chimie Exercice 1Riadh MarouaniPas encore d'évaluation
- Série Corrigéenotion Déquilibre Chimique Loi Daction de Masse La Loi de Modération 1Document8 pagesSérie Corrigéenotion Déquilibre Chimique Loi Daction de Masse La Loi de Modération 1chadaPas encore d'évaluation
- Ensa 2016Document5 pagesEnsa 2016khalid el yacoubiPas encore d'évaluation
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2015-2016) MR Maalej Med HabibDocument6 pagesDevoir de Synthèse N°1 - Sciences Physiques - Bac Mathématiques (2015-2016) MR Maalej Med HabibMustapha ElhafiPas encore d'évaluation
- Bac Blanc 2 SM (21-22)Document9 pagesBac Blanc 2 SM (21-22)Salma BendaoudPas encore d'évaluation
- Electro Lys eDocument4 pagesElectro Lys eالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Bac - Sujets de Physique-Chimie, Term SDocument169 pagesBac - Sujets de Physique-Chimie, Term SandoPas encore d'évaluation
- Exercices 5 Dipole RC PDFDocument1 pageExercices 5 Dipole RC PDFBilel WerghemmiPas encore d'évaluation
- Devoir Corrigé de Synthèse N°1 - Sciences Physiques - Bac Math (2015-2016) MR Benjeddou Rachid PDFDocument10 pagesDevoir Corrigé de Synthèse N°1 - Sciences Physiques - Bac Math (2015-2016) MR Benjeddou Rachid PDFMustapha ElhafiPas encore d'évaluation
- Mo, N Control Controle 1 - 1 S1 2 Bac FRDocument3 pagesMo, N Control Controle 1 - 1 S1 2 Bac FRMed Brini0% (1)
- Correction Exo1 Ageterre 4ptsDocument2 pagesCorrection Exo1 Ageterre 4ptsrihabPas encore d'évaluation
- Bac Nucléaire PDFDocument13 pagesBac Nucléaire PDFAyoub Ben Mlah100% (1)
- Décroissance Radioactive CoursDocument21 pagesDécroissance Radioactive CoursÅnþôņīo Məđ100% (1)
- Devoir de Synthèse N°1 - Sciences Physiques - Bac Technique (2020-2021) MR Foued BahlousDocument4 pagesDevoir de Synthèse N°1 - Sciences Physiques - Bac Technique (2020-2021) MR Foued BahlousKhalil BkekriPas encore d'évaluation
- Acide BaseDocument10 pagesAcide BaseAmeni Slimen100% (1)
- Cours PilesDocument5 pagesCours PilesLotfi Ben MalekPas encore d'évaluation
- Examens Nationaux de 2008 À 2021 - PCTIZNIT PDFDocument194 pagesExamens Nationaux de 2008 À 2021 - PCTIZNIT PDFMaroua SekkoutPas encore d'évaluation
- Concours Blanc ENSA Juillet 2015 Physique ChimieDocument6 pagesConcours Blanc ENSA Juillet 2015 Physique ChimieMoPas encore d'évaluation
- Exercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumDocument9 pagesExercice 1 (7 Points) Étude Cinétique de La Réaction de L'éthanoate D'éthyle Avec L'hydroxyde de SodiumAli A RammalPas encore d'évaluation
- Série D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriDocument5 pagesSérie D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriTawfiq Weld EL Arbi0% (1)
- 1 - Cinétique ProfDocument16 pages1 - Cinétique Profyahya chbaniPas encore d'évaluation
- Devoir de Synthèse N°1 1er Semestre - Sciences Physiques - Bac Sciences Exp (2018-2019) MR Foued Bahlous PDFDocument7 pagesDevoir de Synthèse N°1 1er Semestre - Sciences Physiques - Bac Sciences Exp (2018-2019) MR Foued Bahlous PDFMohamed SaidiPas encore d'évaluation
- Masse Et Énergie, Reactions Nucleaires PDFDocument7 pagesMasse Et Énergie, Reactions Nucleaires PDFAzizElheniPas encore d'évaluation
- Devoir de Synthèse N°2 Avec Correction 2012 2013 (Sidi Zikri)Document11 pagesDevoir de Synthèse N°2 Avec Correction 2012 2013 (Sidi Zikri)fayePas encore d'évaluation
- C9Chim Transformations Forcees PDFDocument2 pagesC9Chim Transformations Forcees PDFAzizElheni100% (1)
- Series N°9 Piles Electrochimiques Bac SC ExpertDocument3 pagesSeries N°9 Piles Electrochimiques Bac SC ExpertMahmoud Essahbi Sahbi DaghsniPas encore d'évaluation
- C8Chim Les Piles PDFDocument3 pagesC8Chim Les Piles PDFAzizElheniPas encore d'évaluation
- Devoir Corrigé de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR TRAYIA NABILDocument9 pagesDevoir Corrigé de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR TRAYIA NABILwalidPas encore d'évaluation
- Dipôles RL - RC - RLC - 2012 - LSLL PDFDocument7 pagesDipôles RL - RC - RLC - 2012 - LSLL PDFAnis DahnenPas encore d'évaluation
- Devoir 1 BiofDocument3 pagesDevoir 1 BiofImane Eddoha100% (1)
- Corrige ENI GEIPI Physique 2009Document8 pagesCorrige ENI GEIPI Physique 2009la physique selon le programme FrançaisPas encore d'évaluation
- Ex Chap3 CorrectionDocument13 pagesEx Chap3 CorrectionAmina BelarouciPas encore d'évaluation
- Technique de Suivi Temporel D'une TransformationDocument8 pagesTechnique de Suivi Temporel D'une TransformationJosé Ahanda NguiniPas encore d'évaluation
- Révision Et Coltrol 2Document5 pagesRévision Et Coltrol 2Arfa Bouchta67% (3)
- Devoir 1 pc2 PDFDocument6 pagesDevoir 1 pc2 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exercices 5 Suivi TemporelDocument1 pageExercices 5 Suivi TemporelMajed GharibPas encore d'évaluation
- Série D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFDocument2 pagesSérie D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFAzizElheni100% (1)
- Ondes Et Transformations NucléairesDocument73 pagesOndes Et Transformations NucléairesM U S I C100% (2)
- C9Phy Mecanique de Newton PDFDocument2 pagesC9Phy Mecanique de Newton PDFAzizElheniPas encore d'évaluation
- Ondes Mecaniques ProgressivesDocument2 pagesOndes Mecaniques ProgressivesSofyan MziziPas encore d'évaluation
- Suivi CinetiqueDocument7 pagesSuivi CinetiqueMed BriniPas encore d'évaluation
- Sciences Physiques - Cinetique Chimique-Gazzah MahmoudDocument3 pagesSciences Physiques - Cinetique Chimique-Gazzah MahmoudMahmoud GazzahPas encore d'évaluation
- Devoir 1Document1 pageDevoir 1Noureddine ElkouayPas encore d'évaluation
- Devoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR ABDAOUI HAMMADI PDFDocument4 pagesDevoir de Contrôle N°1 - Sciences Physiques - Bac Sciences Exp (2015-2016) MR ABDAOUI HAMMADI PDFMohamed SaidiPas encore d'évaluation
- Série Pile Math 1 SCDocument3 pagesSérie Pile Math 1 SCScriblouPas encore d'évaluation
- Acide Base TakiDocument4 pagesAcide Base Takiaziz bensaid2Pas encore d'évaluation
- ÀndeDocument8 pagesÀndeImen Ben GharbiaPas encore d'évaluation
- 10038734Document36 pages10038734dam 12100% (1)
- Chute Libre Verticale D Un Solide Exercices Non Corriges 4Document5 pagesChute Libre Verticale D Un Solide Exercices Non Corriges 4S Bouhmid100% (1)
- Série Dipôle RCDocument2 pagesSérie Dipôle RCacademie archimedePas encore d'évaluation
- Série D'exercices - Physique - Dipole RLC Libre - Bac Mathématiques (2016-2017) MR Afdal AliDocument9 pagesSérie D'exercices - Physique - Dipole RLC Libre - Bac Mathématiques (2016-2017) MR Afdal AliChili 1111Pas encore d'évaluation
- Microsoft Word Les Piles 2 4m S PDFDocument3 pagesMicrosoft Word Les Piles 2 4m S PDFAmal Rezgui100% (1)
- Noyau Masse Energie PDFDocument4 pagesNoyau Masse Energie PDFHadjer Jojo100% (1)
- Cinétique Chimique App PDFDocument6 pagesCinétique Chimique App PDFAzizElheni100% (1)
- TS - BAC Blanc N°1 Corrigé - Spécialité PDFDocument4 pagesTS - BAC Blanc N°1 Corrigé - Spécialité PDFphytanjaPas encore d'évaluation
- MA Moire de ThA Se A. Blondel 200214 - Corrections4Document255 pagesMA Moire de ThA Se A. Blondel 200214 - Corrections4phytanjaPas encore d'évaluation
- Cours Complet 1ere Chap13Document28 pagesCours Complet 1ere Chap13phytanjaPas encore d'évaluation
- Ed 697Document0 pageEd 697casaouis02Pas encore d'évaluation
- EX1C1 L'eau de Javel, Précaution D'emploi, StabilitéDocument1 pageEX1C1 L'eau de Javel, Précaution D'emploi, StabilitéphytanjaPas encore d'évaluation
- Suivi TemporelDocument8 pagesSuivi TemporelphytanjaPas encore d'évaluation
- TS - DM1 - Phys 1-Chim 2Document2 pagesTS - DM1 - Phys 1-Chim 2phytanjaPas encore d'évaluation
- 98bb How To Mix A Bleach Solution - 2019 - FR - Dec 2019Document1 page98bb How To Mix A Bleach Solution - 2019 - FR - Dec 2019MIKE KOUNOUPas encore d'évaluation
- devoirsurvTS n1Document5 pagesdevoirsurvTS n1phytanjaPas encore d'évaluation
- DS1 Ondes Chap 1Document2 pagesDS1 Ondes Chap 1phytanja100% (1)
- 2005 USA Correction Exo2 Ondes 5ptsDocument2 pages2005 USA Correction Exo2 Ondes 5ptsphytanjaPas encore d'évaluation
- Correc Devoir Ts 1Document4 pagesCorrec Devoir Ts 1phytanjaPas encore d'évaluation
- 2-Activite - Theoreme EcDocument2 pages2-Activite - Theoreme EcphytanjaPas encore d'évaluation
- Physique Chapitre2 Mouvement SolideDocument5 pagesPhysique Chapitre2 Mouvement SolidephytanjaPas encore d'évaluation
- Exercice (Type Bac) Suivi Temporel D - Une Transformation ChimiqueDocument2 pagesExercice (Type Bac) Suivi Temporel D - Une Transformation ChimiquephytanjaPas encore d'évaluation
- Sujetchimie Ensa 06Document6 pagesSujetchimie Ensa 06phytanjaPas encore d'évaluation
- Sujet Metropole Septembre 2003Document3 pagesSujet Metropole Septembre 2003phytanjaPas encore d'évaluation
- Preprint Cinetique ACXIXmeDocument14 pagesPreprint Cinetique ACXIXmephytanjaPas encore d'évaluation
- Devoir Surveillé No 2Document2 pagesDevoir Surveillé No 2phytanjaPas encore d'évaluation
- Les Ondes Mécaniques ProgressivesDocument16 pagesLes Ondes Mécaniques ProgressivesphytanjaPas encore d'évaluation
- Activités 3 Rotation Dun Solide Indéfor...Document5 pagesActivités 3 Rotation Dun Solide Indéfor...phytanjaPas encore d'évaluation
- Cours VitesseDocument4 pagesCours VitessephytanjaPas encore d'évaluation
- Activités 3 Rotation Dun Solide Indéformable Autour D'un Axe FixeDocument5 pagesActivités 3 Rotation Dun Solide Indéformable Autour D'un Axe FixephytanjaPas encore d'évaluation
- Rotation D Un Solide Indeformable Autour D Un Axe Fixe CoursDocument10 pagesRotation D Un Solide Indeformable Autour D Un Axe Fixe Coursphytanja100% (1)
- 1 Cours Rotation D'un Solide Autour D'un Axe Fixe PDFDocument2 pages1 Cours Rotation D'un Solide Autour D'un Axe Fixe PDFAzizElheni100% (7)
- TP13-4 Mouvement de RotationDocument1 pageTP13-4 Mouvement de RotationphytanjaPas encore d'évaluation
- Analyser Le Suivi Conductimetrique D Un DosageDocument3 pagesAnalyser Le Suivi Conductimetrique D Un DosagephytanjaPas encore d'évaluation
- 7 Cours Du Moment de ForceDocument5 pages7 Cours Du Moment de Forcephytanja100% (1)
- TS - BAC Blanc N°1 Corrigé - Spécialité PDFDocument4 pagesTS - BAC Blanc N°1 Corrigé - Spécialité PDFphytanjaPas encore d'évaluation
- Etude Cinetique Par Suivi ConductimetriqueDocument4 pagesEtude Cinetique Par Suivi ConductimetriquephytanjaPas encore d'évaluation
- TS - BAC Blanc N°1 - ObligatoireDocument9 pagesTS - BAC Blanc N°1 - ObligatoirephytanjaPas encore d'évaluation
- Entites Chimiques StablesDocument2 pagesEntites Chimiques StablestitPas encore d'évaluation
- Chapitre 2Document31 pagesChapitre 2Ailton muhanchePas encore d'évaluation
- Structure de L'atomeDocument2 pagesStructure de L'atomeKeryl CrawfordPas encore d'évaluation
- Epfl TH1955Document144 pagesEpfl TH1955Verica VulovicPas encore d'évaluation
- Raie SpectraleDocument4 pagesRaie SpectraleAramis MousquetayrePas encore d'évaluation
- 2de Physique-Chimie Enseignement Commun 1022524Document16 pages2de Physique-Chimie Enseignement Commun 1022524Hamdini KamelPas encore d'évaluation
- 47565456217Document3 pages47565456217Bangaly Mohamed mamayimbe cissé CisséPas encore d'évaluation
- Cours LeonardDocument100 pagesCours Leonardelie mij kisalePas encore d'évaluation
- Mécanique: II. de La Terre À La LuneDocument2 pagesMécanique: II. de La Terre À La LuneAIMAD ESSAKHIPas encore d'évaluation
- 1 H M LEGRAND Sujet Uniquement Pour Les Classes de 1 4 Et 1 6Document7 pages1 H M LEGRAND Sujet Uniquement Pour Les Classes de 1 4 Et 1 6Aymen Ben BrahimPas encore d'évaluation
- A 1 3 Mecanisme sn2Document5 pagesA 1 3 Mecanisme sn2Yc YacinePas encore d'évaluation
- Exercices Décroissance RadioactiveDocument3 pagesExercices Décroissance RadioactiveFouzi RafliPas encore d'évaluation
- Livre Physique 7D 7cDocument164 pagesLivre Physique 7D 7csj4y55bd4xPas encore d'évaluation
- ÉléctromagnitismDocument13 pagesÉléctromagnitismjamalPas encore d'évaluation
- P M1 Physique Semi ConducteursDocument127 pagesP M1 Physique Semi ConducteursChebli AbdoPas encore d'évaluation
- TD-Serie 1 FPL AtomistiqueDocument2 pagesTD-Serie 1 FPL Atomistiquelea lamPas encore d'évaluation
- Corrigé Exercices BiophysiqueDocument6 pagesCorrigé Exercices BiophysiqueatcholeessossolamPas encore d'évaluation
- Cours Et Travaux Dirigés Atomistique Et Chimie OrganiqueDocument89 pagesCours Et Travaux Dirigés Atomistique Et Chimie OrganiqueJihane BraichePas encore d'évaluation
- Stéréochimie Isomérie Conformationnelle-1Document17 pagesStéréochimie Isomérie Conformationnelle-1adnan aitlahcPas encore d'évaluation
- Ondes Et Transformations NucléairesDocument73 pagesOndes Et Transformations NucléairesM U S I C100% (2)
- Chpaitre 2 HT NouveauDocument32 pagesChpaitre 2 HT Nouveauleharani soheibPas encore d'évaluation
- Généralités ASP US TDM IRMDocument12 pagesGénéralités ASP US TDM IRMMaamar BenmokhtarPas encore d'évaluation
- Cours - Sciences Physiques - Modele de L'atome - 2ème Sciences (2016-2017) MR Ghouili MondherDocument2 pagesCours - Sciences Physiques - Modele de L'atome - 2ème Sciences (2016-2017) MR Ghouili MondherRAY EVOLUTION100% (3)
- Chimie1an2017 td3Document4 pagesChimie1an2017 td3Walid AzzamPas encore d'évaluation
- Support de Cours RADIOACTITE - Première PartieDocument18 pagesSupport de Cours RADIOACTITE - Première PartieRex DerekPas encore d'évaluation
- Devoir de Contrôle N°1 - Physique - 2ème Informatique (2010-2011) MR Yousfi HmidaDocument2 pagesDevoir de Contrôle N°1 - Physique - 2ème Informatique (2010-2011) MR Yousfi Hmidadhouha100% (3)
- Polarité Des Molécules (Physique Spé Première)Document2 pagesPolarité Des Molécules (Physique Spé Première)BesmaPas encore d'évaluation
- N2 Contrôle Radiographique Ou GammagraphiqueDocument9 pagesN2 Contrôle Radiographique Ou Gammagraphiquemed chabanePas encore d'évaluation
- الفيزياء والكيمياء - شعبة العلوم التجريبية مسلك علوم الحياة والأرض (خيار فرنسية) المكيف - الموضوع-1Document20 pagesالفيزياء والكيمياء - شعبة العلوم التجريبية مسلك علوم الحياة والأرض (خيار فرنسية) المكيف - الموضوع-1ennassikiPas encore d'évaluation
- Liaison CovalenteDocument17 pagesLiaison CovalenteHaytem bossPas encore d'évaluation