Académique Documents
Professionnel Documents
Culture Documents
TP Dosage Redox Diiode Correction
Transféré par
Sk CisseTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TP Dosage Redox Diiode Correction
Transféré par
Sk CisseDroits d'auteur :
Formats disponibles
1ere STL-SPCL Module chimie TP
Dosage redox iodométrie
But : Dosage d’une solution d’iode par une solution de thiosulfate de sodium.
I. Etalonnage de la solution de thiosulfate de sodium.
On étalonne d'abord le thiosulfate de sodium dont la concentration est d'environ 0,1
mol/L avec une solution de diiode préparée par action des ions iodate IO3- sur les
ions I- en excès.
1. préparation de la solution d'iodate de potassium.
Question :
a. Calculer la masse à peser pour préparer 100 mL de KIO3 à 0,030 mol/L.
Nombre de mole : nKIO3 = Vsol x CKIO3 = 0,100 x 0,030 = 3.10-3 mol.
Masse à peser : mKIO3 = nKIO3 x MKIO3 = 3.10-3 x 214 = 6,42.10-1 g.
Manipulation : Préparer cette solution.
Masse réellement pesée : mpesée = 6,429.10-1g.
Question :
b. A l'aide de la masse réellement pesée calculer précisément la concentration de votre
solution d'iodate de potassium.
Calcul du nombre de mole pesée : n’KIO3 = mpesée /MKIO3 = 6,429.10-1/214 = 3,0.10-3 mol.
Concentration : C’KIO3 = n’KIO3 /Vsol = 3,0.10-3 / 0,1 = 3,0.10-2 mol.
2. préparation de la solution de diiode.
c. Ecrire l'équation de la réaction d’oxydo-réduction entre les couples IO3- / l2 et l2/I- (en
milieu acide)
Demi-équation : 2IO3- + 12H+ + 10e- = l2 + 6H2O
(2I- = l2 + 2e-) x 5
2IO3- + 12H+ + 10I- 6 I2 + 6H2O
d. Faire un tableau d'avancement (avec des valeurs chiffrées pour les réactifs) illustrant le
mélange de 10,0 mL de solution d'iodate de potassium (K++IO3-) à 3,0.10-2 mol.L-1, 10 mL de
iodure de potassium (K+ +l-) à 1 mol.L-1 et 5 gouttes d'acide sulfurique.
2IO3- + 10I- + 12H+ 6 I2 + 6H2O
EI x=0 3.10-4 10-2 excès 0 0
-4 -2
E inter x 3.10 -2x 10 – 10x excès 6x solvant
EF x=xmax 3.10-4 -2xmax 10-2 – 10xmax excès 6xmax solvant
-4 -3 -4
EF x=5.10 0 8,5.10 excès 9.10 solvant
Les valeurs dans le tableau sont en mole.
Nombre de mole d’ions iodates dans l’état initial : n°IO3 = 3,0.10-2 x 0,01 = 3.10-4 mol.
Nombre de mole d’ions iodures dans l’état initial : n°I- = 0,01 x 1 = 10-2 mol.
e. Justifier la présence d'acide sulfurique.
L’acide sulfurique permet à la réaction d’oxydoréduction de se produire, en effet les ions H + font
partis de la réaction, on les retrouve dans l’équation.
f. Quel est le réactif limitant ? Pourquoi celui-ci ?
Pour déterminer le réactif limitant il faut calculer l’avancement maximum.
Cas 1 (les ions iodates) : 3.10-4 -2xmax ≥0 ; on déduit xmax ≤3.10-4/2 = 1,5.10-4 mol.
Cas 2 (les ions iodures) : 10-2 – 10xmax ≥0 ; on déduit xmax ≤10-2/10 = 10-3 mol.
On retient la valeur la plus petite, qui est correspond au domaine commun des deux inéquations.
Donc xmax = 1,5.10-4 mol. Le réactif limitant est donc l’ion iodate.
g. Terminer alors de compléter le tableau d'avancement pour connaître la valeur de n i2
(nombre de moles de l 2 formée)
Donc d’après le tableau nI2 = 9.10-4mol.
Manipulation :
- Préparer cette solution de diiode. Boucher, agiter, attendre 2 minutes. Ajouter 50 mL d’eau
distillée.
1ere STL-SPCL Module chimie TP
Dosage redox iodométrie
3. Etalonnage de la solution de thiosulfate de sodium (2Na+ + S2032-)
h. Ecrire l’équation de la réaction entre (l2/I- et S4O62-/ S2032-)
S4O62-/ S2032-)
l2 + 2e- = 2I-
2S2032- = S4O62- +2e-
2 S203 + l2 S4O62- + l2
2-
i. En déduire la relation de l’équivalence entre n!2, Vt et Ct (t : thiosulfate)
A l’équivalence les réactifs ont été introduits dans les proportions stœchiométriques.
𝑛𝑆203 𝑛
On a donc : = 𝐼2 (les chiffres au dénominateur correspondent au coefficient
2 1
stœchiométrique).
Le nombre de mole de thiosulfate est n S2O3 = Ct x Vt (Vt étant le volume à l’équivalence).
𝐶𝑡 ×𝑉𝑡
Donc 𝑛𝐼2 =
2
Manipulation :
- ajouter à la burette la solution de thiosulfate de sodium
- ajouter juste avant l’équivalence un peu d’empois d’amidon (ou thiodéne, ou iodex)
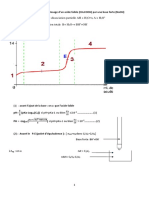
j. Préciser et expliquer le changement de couleur à ’équivalence.
Le changement de couleur correspond au virage du iodex, qui donne une coloration noire à la
solution le temps qu’elle contient du diiode, lorsque l’équivalence est atteinte, la totalité du diiode
a réagi, le iodex devient incolore.
k. Exprimer Cthiosulfate.
𝑛 ×2
𝐶𝑡 = 𝐼2 Avec nI2 = 9.10-4 mol.
𝑣𝑡
l. Faire deux essais concordants à 1%. Calculer C, dans les deux cas puis calculer la moyenne.
9.10−4 ×2
Premier essai : V1t = 17,8 mL 𝐶1𝑡 = −3 = 1,0112. 10−1 𝑚𝑜𝑙. 𝐿−1
17,8.10
9.10−4 ×2
Deuxième essai : V2t = 17,9 mL. 𝐶2𝑡 = = 1,0056. 10−1 𝑚𝑜𝑙. 𝐿−1
17,9.10−3
𝐶 +𝐶 (1,0112+1,0056).10−1
Valeur moyenne : 𝐶𝑡 𝑚𝑜𝑦 = 1𝑡 2 2𝑡 = = 1,008. 10−1 𝑠𝑜𝑖𝑡 1,01. 10−1 𝑚𝑜𝑙. 𝐿−1
2
Il - Dosage de la solution de diiode inconnue par le thiosulfate de sodium
m. Indiquer la relation à l’équivalence. On appelle C I2 la concentration inconnue de la solution
d’iode. Exprimer CI2 en fonction de Vl2,Ct,Vt.
Manipulation : On dose 20 mL de la solution de l 2 à doser, en ajoutant 50 mL d’eau distillée par
le thiosulfate en utilisant du thiodéne en fin de dosage.
n. Exprimer CI2
𝑪𝒕 ×𝑽𝒕 𝑪𝒕 ×𝑽𝒕
En reprenant l’expression 𝒏𝑰𝟐 = et avec nI2 =CI2 xVI2 on obtient : 𝐶𝑰𝟐 = , Vt
𝟐 𝟐×𝑉𝐼2
correspond au volume équivalent.
O. Faire deux essais concordants à 1 %. Calculer CI2 dans les deux cas puis calculer la
moyenne.
1,01.10−1 ×8,1
Premier essai : V1t = 8,1 mL 𝐶1𝐼2 = = 2,05. 10−1 𝑚𝑜𝑙. 𝐿−1
2×20
1,01.10−1 ×8,2
Deuxième essai : V2t = 8,2 mL. 𝐶2𝐼2 = = 2,07. 10−1 𝑚𝑜𝑙. 𝐿−1
2×20
𝐶1𝐼2 +𝐶2𝐼2 2,05+2,07 −1 −1
Valeur moyenne : 𝐶𝐼2 𝑚𝑜𝑦 = = = 2,06. 10 𝑚𝑜𝑙. 𝐿
2 2
1ere STL-SPCL Module chimie TP
Dosage redox iodométrie
p. Cette solution de diiode a au préalable été diluée en versant 10,0 mL à l'aide d'une pipette
jaugée dans une fiole jaugée de 50,0 mL. Quelle est la concentration Ci 2 initiale de la solution
initiale ?
Cette solution de diiode a été diluée par 50/10 =5.
La concentration initiale est donc 5 fois plus importante. Ci 2 = 5xCI2 moy = 1,03 mol.L-1.
Vous aimerez peut-être aussi
- Correction TP4 de CinétiqueDocument5 pagesCorrection TP4 de CinétiqueDjaafeurMenouar80% (5)
- tp13 Dosage Sel de Mohr Corrige 2010-2011Document3 pagestp13 Dosage Sel de Mohr Corrige 2010-2011Abdelkrim AB100% (3)
- TP Dosage Par Conductimetrie Du Destop Correction Du TPDocument5 pagesTP Dosage Par Conductimetrie Du Destop Correction Du TPhhedfi100% (1)
- Chapitre5 Mobilite-Nombres de TransportDocument25 pagesChapitre5 Mobilite-Nombres de TransportRoland Agasro100% (1)
- Cine Tique 2Document22 pagesCine Tique 2momos55Pas encore d'évaluation
- Corrigés Des Travaux Dirigés Chimie en Solution - Pr. Nabil SaffajDocument40 pagesCorrigés Des Travaux Dirigés Chimie en Solution - Pr. Nabil Saffajnabil saffajPas encore d'évaluation
- TP Chimie AnalytiqueDocument13 pagesTP Chimie AnalytiqueFedoua Benamer100% (1)
- TP Dosage Redox Potentiometrique CorrectionDocument5 pagesTP Dosage Redox Potentiometrique Correctiondina 05100% (1)
- Décomposition Du Thiosulfate de SodiumDocument2 pagesDécomposition Du Thiosulfate de SodiumDana Capbun67% (3)
- Dosage en Retour de La Vitamine CDocument2 pagesDosage en Retour de La Vitamine CFatima BenPas encore d'évaluation
- TP Dosage Redox Diiode CorrectionDocument3 pagesTP Dosage Redox Diiode CorrectionSk CissePas encore d'évaluation
- Bilan Thermique D'une Ligne de CuissonDocument37 pagesBilan Thermique D'une Ligne de CuissonDalila Ammar80% (10)
- BiophysiqueDocument29 pagesBiophysiqueRimo Khan50% (2)
- Correction Du TP - Suivi Temporel D'une Transformation Chimique Par ...Document3 pagesCorrection Du TP - Suivi Temporel D'une Transformation Chimique Par ...WaliD MerabeT0% (1)
- TP Cinétique Chimique reaction-1-ORDRE-1Document10 pagesTP Cinétique Chimique reaction-1-ORDRE-1kiritosunny30Pas encore d'évaluation
- Vitesse 2Document5 pagesVitesse 2lemiaPas encore d'évaluation
- TP - Dosage D'une Solution de Diiode Par Une Solution de Thiosulfate de SodiumDocument1 pageTP - Dosage D'une Solution de Diiode Par Une Solution de Thiosulfate de SodiumKonan Richard Kouassi100% (3)
- C03 Cinetique ReactionDocument2 pagesC03 Cinetique ReactionmohPas encore d'évaluation
- TP .Avancement .4sc - Exp.2022Document6 pagesTP .Avancement .4sc - Exp.2022Med Brini100% (1)
- Cinetique Chimique PDFDocument21 pagesCinetique Chimique PDFياسين السعدانيPas encore d'évaluation
- Série Dexercices Corrigés N°2Document7 pagesSérie Dexercices Corrigés N°2chada100% (1)
- Cinetique Tpn°1 2020 GP 2eme Annee LicenceDocument4 pagesCinetique Tpn°1 2020 GP 2eme Annee LicenceChouYa OsPas encore d'évaluation
- Compte Rendu 2 RésolutionDocument5 pagesCompte Rendu 2 Résolutionchouchou baPas encore d'évaluation
- Etude Cryoscopique D'une Solution DilueeDocument4 pagesEtude Cryoscopique D'une Solution DilueeRidha issaoui80% (5)
- TP 2Document6 pagesTP 2fashionista louli100% (4)
- TP ConductimetrieDocument5 pagesTP ConductimetriePedro Assassi100% (1)
- Exercices PDFDocument4 pagesExercices PDFالغزيزال الحسن EL GHZIZAL Hassane100% (3)
- TP 5 STDocument2 pagesTP 5 STABDelpari SeraichePas encore d'évaluation
- DosageDocument6 pagesDosageriadh01net90% (10)
- TP N°2 ChimieDocument5 pagesTP N°2 ChimieDenilson Josemir100% (1)
- Dosage H3PO4 NaOHDocument11 pagesDosage H3PO4 NaOHcxccwPas encore d'évaluation
- CHP 2 TD - Chimie - SolutionDocument8 pagesCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- Polycopié Exercices Corrigés Chimie Des Solutions Aqueuses Chimie 03 - 2ème Année - CompressedDocument84 pagesPolycopié Exercices Corrigés Chimie Des Solutions Aqueuses Chimie 03 - 2ème Année - CompressedAbdoul SawadogoPas encore d'évaluation
- Série D'exercices Vitesse de RéactionDocument4 pagesSérie D'exercices Vitesse de Réactionothmane GbPas encore d'évaluation
- TPN°4.Etude de La Cinetique Chimique Groupe LGP 17 (A.D) DocxDocument6 pagesTPN°4.Etude de La Cinetique Chimique Groupe LGP 17 (A.D) DocxSöû SøùSøú Mîã100% (1)
- TP 5: Cinétique D'oxydation Des Ions Iodure Par Le Peroxyde D'hydrogèneDocument8 pagesTP 5: Cinétique D'oxydation Des Ions Iodure Par Le Peroxyde D'hydrogènesfvsfv100% (1)
- Dosage D'oxydo Reduction Complement Du CoursDocument16 pagesDosage D'oxydo Reduction Complement Du CoursAnonymous 83IGhG100% (1)
- Srie Dexos Cintique L3-GPDocument6 pagesSrie Dexos Cintique L3-GPFatima YahiaPas encore d'évaluation
- TP 4 Dosage Des Ions ChlorureDocument6 pagesTP 4 Dosage Des Ions ChlorureSali0% (2)
- TP N°°°05 ManganimétrieDocument6 pagesTP N°°°05 Manganimétrieroumaissa bhPas encore d'évaluation
- Cryoscopie AlmemaDocument9 pagesCryoscopie AlmemaCheikh Ismaïla BA0% (1)
- TP Chimie N°7 Dosage OxydoreductionDocument1 pageTP Chimie N°7 Dosage OxydoreductionSerge.Omisos367767% (3)
- TP Dosage Par Étalonnage, Par Titrage Conductimétrique CORRECTIONDocument2 pagesTP Dosage Par Étalonnage, Par Titrage Conductimétrique CORRECTIONjdbyv cehcbeuPas encore d'évaluation
- 01 Équilibre de SolubilitéDocument7 pages01 Équilibre de SolubilitéTsiory Ranaivoson100% (1)
- Exercices N 5 Et 6Document7 pagesExercices N 5 Et 6ahlemmPas encore d'évaluation
- TP5 Analytique 3émé AnnéeDocument10 pagesTP5 Analytique 3émé AnnéeLïnâ ExØtîc DõlĽPas encore d'évaluation
- Solution TP2-TITRAGE-D - UNE-BASE-FORTE-PAR-UN-ACIDE-FORT-univ-annabaDocument8 pagesSolution TP2-TITRAGE-D - UNE-BASE-FORTE-PAR-UN-ACIDE-FORT-univ-annabaKhalil Oukebdane100% (1)
- TP s5 2018 2019 PR Abdelaaziz El Gadi Et Pr. Kholtei AbdelilahDocument34 pagesTP s5 2018 2019 PR Abdelaaziz El Gadi Et Pr. Kholtei AbdelilahMounir DABOUZPas encore d'évaluation
- A. Etude Cinétique de La Transformation Des Ions Peroxodisulfate Et Des Ions IoduresDocument5 pagesA. Etude Cinétique de La Transformation Des Ions Peroxodisulfate Et Des Ions IoduresZahra Zahra50% (2)
- TP 3 Chimie 1Document4 pagesTP 3 Chimie 1Marouane Taibini100% (2)
- TP Eau de Javel CorrectionDocument3 pagesTP Eau de Javel CorrectionLou BalonPas encore d'évaluation
- Serie 3 EquilibreDocument8 pagesSerie 3 EquilibreBadre OuzougarPas encore d'évaluation
- Dosage Acido BasiqueDocument33 pagesDosage Acido Basiquemed100% (1)
- Imp PDFDocument13 pagesImp PDFChimiste ChimistePas encore d'évaluation
- TP2 de ChimieDocument2 pagesTP2 de Chimiemohammed el aminePas encore d'évaluation
- Ae 18 Dosage Par Etalonnage Conductimetrie Avec CorrectionDocument6 pagesAe 18 Dosage Par Etalonnage Conductimetrie Avec Correctionsanterre100% (1)
- TP N°1 Cinétique de La Réaction Persulfate-Iodure - Section BDocument2 pagesTP N°1 Cinétique de La Réaction Persulfate-Iodure - Section BBoudjaoui0% (1)
- Examen de TP Dosage de HCL Par NaOHDocument2 pagesExamen de TP Dosage de HCL Par NaOHKHALIFA EL HARFI100% (1)
- Corrigé Série 1Document5 pagesCorrigé Série 1Mohamed ECHAMAI100% (2)
- Kinetics - CinetiqueDocument8 pagesKinetics - CinetiqueRalphNkdPas encore d'évaluation
- TP Chimie Cinétique LGP-18 2020Document14 pagesTP Chimie Cinétique LGP-18 2020Amina BadaouiPas encore d'évaluation
- 1 Ere S Eval Decembre 2014Document4 pages1 Ere S Eval Decembre 2014Hadri MohamedPas encore d'évaluation
- Correction Epreuve de Chimie Au Probatoire C D Et E 2022Document3 pagesCorrection Epreuve de Chimie Au Probatoire C D Et E 2022possibradyPas encore d'évaluation
- Guide RefDocument56 pagesGuide RefMardoch GedeonPas encore d'évaluation
- 2012enmp0054 PDFDocument242 pages2012enmp0054 PDFAbed Med MedPas encore d'évaluation
- BiblioDocument11 pagesBiblioSk CissePas encore d'évaluation
- Badiaga 2011CLF22187Document184 pagesBadiaga 2011CLF22187Sk CissePas encore d'évaluation
- Photon 201789 P 26Document3 pagesPhoton 201789 P 26Sk CissePas encore d'évaluation
- RegimeVariable Partie2Document10 pagesRegimeVariable Partie2Sk CissePas encore d'évaluation
- Exo14 CorDocument4 pagesExo14 CorSk CissePas encore d'évaluation
- Citer Une Référence Et Creer Une Bibliographie 2011Document5 pagesCiter Une Référence Et Creer Une Bibliographie 2011Sk CissePas encore d'évaluation
- RegimeVariable Partie3Document24 pagesRegimeVariable Partie3Sk CissePas encore d'évaluation
- RegimeVariable Partie2Document10 pagesRegimeVariable Partie2Sk CissePas encore d'évaluation
- Exo15-17 CorDocument6 pagesExo15-17 CorSk CissePas encore d'évaluation
- Polar NaDocument8 pagesPolar NaSk CissePas encore d'évaluation
- RegimeVariable Partie1Document18 pagesRegimeVariable Partie1Sk CissePas encore d'évaluation
- Electrocinetique RTDocument4 pagesElectrocinetique RTSk CissePas encore d'évaluation
- tp05 MaiverDocument14 pagestp05 MaiverSk CissePas encore d'évaluation
- BR Polarimeter FR 2.0Document28 pagesBR Polarimeter FR 2.0Sk CissePas encore d'évaluation
- TP 01 TSTLDocument2 pagesTP 01 TSTLSk CissePas encore d'évaluation
- Cracowski DESC 2016 1.3Document38 pagesCracowski DESC 2016 1.3Sk CissePas encore d'évaluation
- 2014LIL2E027Document178 pages2014LIL2E027Sk CissePas encore d'évaluation
- Polar NaDocument8 pagesPolar NaSk CissePas encore d'évaluation
- ManuscritDocument244 pagesManuscritSk CissePas encore d'évaluation
- Polar NaDocument8 pagesPolar NaSk CissePas encore d'évaluation
- SC CH TP Preparation D Une Solution de NaOHDocument4 pagesSC CH TP Preparation D Une Solution de NaOHRä MøunPas encore d'évaluation
- 95043-Article Text-245053-2-10-20210722Document9 pages95043-Article Text-245053-2-10-20210722Sk CissePas encore d'évaluation
- Chap - II Application de La Spectroscopie UV-VisibleDocument1 pageChap - II Application de La Spectroscopie UV-VisibleRija RasolomananaPas encore d'évaluation
- tp05 MaiverDocument14 pagestp05 MaiverSk CissePas encore d'évaluation
- 20967950Document24 pages20967950Sk CissePas encore d'évaluation
- TP N° 3 - Préparation Dune Solution - PDFDocument7 pagesTP N° 3 - Préparation Dune Solution - PDF지미라kim miraPas encore d'évaluation
- 2007GRE17053 Plante Capucine (1) (D) MP Version DiffusionDocument119 pages2007GRE17053 Plante Capucine (1) (D) MP Version DiffusionselmaPas encore d'évaluation
- Chapitre1 FluageDocument16 pagesChapitre1 FluageFatimaZahraeEnasseriPas encore d'évaluation
- Catalogue IMANORDocument1 323 pagesCatalogue IMANORAli OUKHBACH100% (1)
- Chap1 - Transformateur MonophaseDocument29 pagesChap1 - Transformateur MonophaseMaxence Kouessi100% (1)
- ZZZ Suppexos th7 Thermochimie PDFDocument9 pagesZZZ Suppexos th7 Thermochimie PDFsouPas encore d'évaluation
- 1 ChapitreDocument43 pages1 ChapitreJhee raaPas encore d'évaluation
- Activités Pour Le Cycle Terminal STI2D: Analyse Fonctionnelle de La Cafetière P. 3Document25 pagesActivités Pour Le Cycle Terminal STI2D: Analyse Fonctionnelle de La Cafetière P. 3ELFPas encore d'évaluation
- Devoir Maison-2Document2 pagesDevoir Maison-2Mohamed MaimounyPas encore d'évaluation
- A3522 PDFDocument26 pagesA3522 PDFAnis SouissiPas encore d'évaluation
- Planning Contrôles Parcours BBDocument4 pagesPlanning Contrôles Parcours BBKhadijaPas encore d'évaluation
- Activité N°12 Molécules Configuration AbsolueDocument6 pagesActivité N°12 Molécules Configuration AbsoluehaddadPas encore d'évaluation
- Grusson 1Document213 pagesGrusson 1mourad cholliPas encore d'évaluation
- Appareillages Et Schémas ÉlectriquesDocument63 pagesAppareillages Et Schémas ÉlectriquesMhamed Larbaoui100% (24)
- TD MetDocument4 pagesTD MetMohammed El azhariPas encore d'évaluation
- C61 Circuits Linéaires Du Premier OrdreDocument16 pagesC61 Circuits Linéaires Du Premier OrdreAdam ChPas encore d'évaluation
- Tableau ChimieDocument38 pagesTableau Chimieemilie cyrPas encore d'évaluation
- TP1 AbaqusDocument8 pagesTP1 AbaqusAhmed RACHDIPas encore d'évaluation
- PCM FS02d ConcentrationDocument3 pagesPCM FS02d ConcentrationNACIR OULHAJPas encore d'évaluation
- DILUTION CoursDocument3 pagesDILUTION Coursbafoa.ifmPas encore d'évaluation
- Thermodynamique. DR AMIOTDocument176 pagesThermodynamique. DR AMIOTSAIFdjoombadjoomba100% (1)
- 1AC Série Des Exercices N1Document2 pages1AC Série Des Exercices N1saidPas encore d'évaluation
- Chapitre I: Généralité Sur Le ForageDocument8 pagesChapitre I: Généralité Sur Le Foragekoki041996Pas encore d'évaluation
- LDocument4 pagesLMouhi MouhaPas encore d'évaluation
- 3e PCTDocument11 pages3e PCTeucludePas encore d'évaluation
- Série 1 BiophysiqueDocument2 pagesSérie 1 BiophysiqueLina AmiraPas encore d'évaluation
- Dossier2 Pose D'un Tableau ModulaireDocument12 pagesDossier2 Pose D'un Tableau ModulairePascal ArmagnacPas encore d'évaluation
- TD N°4 em 2 18-19Document3 pagesTD N°4 em 2 18-19Shekina Évangile MABIALAPas encore d'évaluation
- Elimination Des Polluants Organiques Par Des Argiles Naturelles Et Modifiees PDFDocument143 pagesElimination Des Polluants Organiques Par Des Argiles Naturelles Et Modifiees PDFKamel TouatiPas encore d'évaluation
- Le Voyant LiquideDocument1 pageLe Voyant LiquidemakikouPas encore d'évaluation