Académique Documents
Professionnel Documents
Culture Documents
RSBelkadyetal
Transféré par
sokaina elgasmiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
RSBelkadyetal
Transféré par
sokaina elgasmiDroits d'auteur :
Formats disponibles
See discussions, stats, and author profiles for this publication at: https://www.researchgate.
net/publication/341914635
La démarche Qualité au sein d'un laboratoire de biologie médicale au Maroc
Article in Biologie Médicale · January 2018
CITATIONS READS
3 14,211
3 authors, including:
Abdelhamid Barakat
151 PUBLICATIONS 1,728 CITATIONS
SEE PROFILE
Some of the authors of this publication are also working on these related projects:
ACIP 2016 View project
COVID-19 View project
All content following this page was uploaded by Boutaina Belkady on 04 June 2020.
The user has requested enhancement of the downloaded file.
REVUE DE SYNTHESE
La démarche qualité au sein d’un laboratoire d’analyses de biologie
médicale au Maroc
Quality approach in laboratory of medical biology in Morocco
B. Belkady1,2, Z. Elkarhat1,2, H. Rouba², A. Barakat², S. Nassereddine¹
1
Service de Cytogénétique Médicale, Institut Pasteur du Maroc, Casablanca
2
Laboratoire de Génomique et Génétique humaine, Institut Pasteur du Maroc, Casablanca
Résumé
Afin d’implanter un système de management de la qualité et engager un laboratoire
d’analyses de biologie médicale dans une dynamique d’amélioration continue, il
est essentiel d’instaurer une bonne démarche qualité. Cette démarche repose sur
l’engagement des responsables et l’implication de tous les acteurs du laboratoire dans
la définition d’actions, dont l’objectif est d’améliorer tous les éléments non conformes
aux objectifs qualité que le laboratoire de biologie médicale s’est fixé. Dans cet
article, le référentiel choisi est la norme ISO 15189-Version 2012 qui fournit les
exigences de compétence et de qualité dans un laboratoire de biologie médicale.
Elle se distingue du guide de bonne exécution des analyses entre autres par la mise
en place d’un système de management de la qualité. Nous avons résumé dans cet
article les éléments à prendre en compte, en vue du processus d’accréditation d’un
laboratoire d’analyses de biologie médicale.
Mots clés : Démarche qualité ; management de la qualité ; LABM ; GBEA ;
Norme ISO 15189
*Auteur correspondant :
Boutaïna BELKADY
E-mail : boutaina.belkady@gmail.com
Journal de Biologie Médicale / Volume 7-Numéro 25 / Avr-Juin 2018 51
ARTICLES SCIENTIFIQUES
REVUE DE SYNTHESE
Abstract
In order to implement a quality management system and to engage a laboratory of medical
biology in a dynamic of continuous improvement, it is essential to establish a good quality
approach. This approach is based on the commitment and the involvement of all the actors
of the laboratory in the determination of actions whose objective is to improve all the
non-conforming elements to the objectives that the laboratory has fixed. The standard ISO
15189V2012 has been chosen for this purpose, which provides the requirements of competence
and quality in a laboratory of medical biology. It differs from the GBEA by the implementation
of a quality management system. We have summarized in this article the elements to be
considered for the process of accreditation of a medical biology laboratory.
Key words : Quality approach ; quality management ; LMB ; GBEA ; standard ISO 15189
Introduction
L’approche historique de la qualité se confond avec celle possibles d’erreurs, d’anomalies ou d’écarts à la norme et
de la production industrielle. Du contrôle de certaines la mise en place d’actions préventives. Le système est donc
caractéristiques d’un produit en vue d’adopter des actions défini et suivi.
correctives lors de sa fabrication, l’industrie est assez Management de la qualité (années 2000) : qui introduit
vite passée à la prévention, en prenant des dispositions une conception globale du management, centrée sur la
systématiques dès la conception d’un produit afin de lui qualité comme objectif dans laquelle le rôle des hommes
conférer une qualité à la fois plus régulière et économique. est essentiel. Cette démarche cherche à impliquer tous
La qualité est ensuite devenue un enjeu économique en soi. les acteurs pour qu’ils participent de leur propre initiative,
Elle s’est insérée au cœur de la stratégie de l’entreprise, à l’amélioration continue des résultats dans l’intérêt
confrontée à une clientèle de plus en plus exigeante du laboratoire, des employés et de la société dans son
en terme de produits et services [1]. La multiplicité ensemble. Le système est maîtrisé et son efficacité
des acceptations de la notion de qualité est source de s’améliore en continu [1].
malentendus et de réticences associés à cette démarche.
L’assurance qualité a été définie selon l’ISO comme
Cependant, la norme ISO 900 version 2015 a donné une
"une partie du management de la qualité visant à donner
définition de la qualité comme étant "L’ aptitude d’un
confiance par la conformité aux exigences pour la qualité.
ensemble de caractéristiques intrinsèques d’un produit L’ensemble des activités préétablies et systématiques
ou d’un service à satisfaire des exigences". Schématiquement, nécessaires pour donner la confiance appropriée qu’un
trois étapes principales peuvent être distinguées dans
produit ou un service satisfera aux exigences données
l’évolution de cette notion durant le siècle dernier :
relatives à la qualité" (ISO900V2015). Cette définition fait
Contrôle qualité (jusqu’aux années 80) : qui correspond à apparaître la notion de confiance : le client doit avoir la
un ensemble de pratiques et de contrôles statistiques. preuve que l’entreprise s’est dotée des moyens nécessaires
Assurance qualité (années 90) : qui vise, par des pour maîtriser les risques de dysfonctionnement et qu’elle
procédures appropriées, à fournir au client l’assurance que les utilise effectivement. Pour créer cette confiance, on
la qualité attendue est obtenue. Il s’agit essentiellement prend appui sur un nombre de textes écrits, précisant
d’une démarche d’anticipation pour la maîtrise des risques les règles et les procédures qui constituent le système
fondés sur l’analyse et la rationalisation des processus documentaire de l’assurance de la qualité (Figure 1).
en jeu, la détermination des points critiques et sources
52 Journal de Biologie Médicale / Volume 7-Numéro 25 / Avr-Juin 2018
REVUE DE SYNTHESE
des entreprises engagées dans un processus de
certification se distingue de celui de leurs homologues
hors démarche" et que "les entreprises engagées dans
un processus de certification sont caractérisées par une
plus forte formalisation". La certification a donc un effet
sur l’organisation interne avec des changements sur la
formalisation des procédures, la maîtrise des documents,
le contrôle et le traitement des produits non conformes.
De ce fait, l’optimisation du système documentaire de
procédures et d’archivage est devenue une stratégie
pour réduire les problèmes de communication en interne
comme en externe [2, 3].
En résumé, de l’assurance qualité qui visait à garantir la
réponse aux besoins exprimés par le client, nous sommes
passés aujourd’hui à un SMQ. De plus, cet SMQ peut
s’appliquer à n’importe quel type d’organisation ; C’est ainsi
Figure 1 : Représentation schématique d’un système
documentaire qualité
que la démarche qualité concerne des domaines aussi
diversifiés que l’industrie, le commerce, les professions
libérales, l’enseignement, l’économie sociale et le domaine
Le management de la qualité selon la norme ISO 9000V2005 de la santé.
est "un mode de management d’un organisme, centré sur
la qualité, impliquant la participation de tous ses membres Le but de cet article est de décrire et traiter les étapes
et visant au succès à long terme par la satisfaction du client à suivre pour instaurer un SMQ au sein d’un LABM au
et bénéfique pour tous les membres de l’organisme et pour Maroc, et en faire un point de départ et un document
la société en général". Cette définition a été modifiée dans qui présente les préalables pour réussir la mise en œuvre
la dernière version ISO 9000V2015 en "activités relatives à d’une démarche qualité qui vise à une accréditation
la qualité, coordonnées pour orienter et diriger un ISO 15189.
organisme".
Le système de management de la qualité (SMQ) est donc
l’ensemble des moyens humains, matériels, documentaires Notion de "démarche qualité"
et organisationnels qui permettent au biologiste responsable
de faire fonctionner la démarche qualité au sein du dans un LABM
laboratoire d’analyse de biologie médicale (LABM). Il
doit être constamment revu comme le précise la norme Le terme "démarche qualité" n’est pas toujours bien
ISO 15189V2012 "La direction du laboratoire doit, à compris, comme en témoigne la mauvaise interprétation qui
intervalles planifiés, revoir le SMQ pour assurer qu’il consiste à assimiler de façon systématique la démarche
demeure pertinent, adéquat et efficace et qu’il concourt qualité à une démarche de certification. La démarche
aux soins prodigués aux patients". Les exigences relatives qualité vise avant tout à instaurer un SMQ basé sur la
au management des LABM concernant les aspects participation de tous ses membres, et visant au succès
documentaires et organisationnels sont les suivants : à long terme.
Pour un LABM et en fonction de son domaine d’activité,
Etablissement d’un manuel qualité. chaque responsable peut s’appuyer sur des référentiels
Politique qualité et objectifs déclinés à partir de ses axes qui fournissent des directives plus spécifiques pour
(responsabilité de la direction). organiser une démarche qualité.
Maîtrise organisationnelle des documents et des L’ISO 9001 est la norme "mère" décrivant les mesures
enregistrements. et précautions à prendre pour pérenniser l’activité des
Maîtrise des travaux non conformes (actions correctives entreprises dans les domaines de la production de services
et préventives). et de biens. La reconnaissance par une tierce partie de la
Maîtrise des services extérieurs et des travaux sous- bonne application de l’ISO 9001 s’appelle la certification,
traités. et précise le domaine d’activité concerné. Les normes
Revue du système qualité à intervalle planifié. métier dérivées de l’ISO 9001 vont plus dans le détail
Plusieurs études ont constaté que "le système documentaire des risques spécifiques et des exigences pour couvrir
Journal de Biologie Médicale / Volume 7-Numéro 25 / Avr-Juin 2018 53
ARTICLES SCIENTIFIQUES
REVUE DE SYNTHESE
ces risques. C’est le cas des normes ISO 17025 (exigences
générales concernant la compétence des laboratoires
d’étalonnages et d’essais), ISO 15189 (Laboratoires de
biologie médicale - exigences concernant la qualité et la
compétence - Laboratoires d’analyses de biologie médicale),
et ISO 17020 (évaluation de la conformité : exigences
pour le fonctionnement de différents types d’organismes
procédant à l’inspection). La reconnaissance par une
tierce partie s’appelle l’accréditation et se présente sous
forme d’une portée décrivant par domaine les méthodes
ou les secteurs réglementés sur lesquels l’organisme est Figure 2 : Schéma réunissant les référentiels Qualité d’un
reconnu compétent. laboratoire de biologie médicale.
Dans ce qui suit nous allons évoquer deux référentiels
qui règlent aujourd’hui la vie des laboratoires de biologie
médicale : Activités d’un LABM
Le guide de bonne exécution des analyses (GBEA) Un laboratoire de biologie médicale est un lieu où sont
marocain, bien que rédigé initialement pour les laboratoires prélevés et analysés divers fluides biologiques d’origine
privés, il s’applique aussi à tous les laboratoires des humaine sous la responsabilité des biologistes médicaux,
établissements publics de santé. Il est centré sur l’acte de qui en interprètent les résultats dans le but de participer au
biologie médicale. diagnostic et au suivi de certaines maladies. Cette analyse
La norme ISO 15189 qui complète le GBEA, est destinée médicale se fait en trois phases ( Figure 3)
spécifiquement aux LABM et précise comment peut se
faire leur accréditation.
A l’échelle du laboratoire et au quotidien, la démarche
qualité s’avère bénéfique tant en interne qu’en externe, car
elle permet de :
Soutenir la qualité intrinsèque des analyses et des
recherches en améliorant l’organisation et la cohésion
de l’équipe, la traçabilité et la fiabilité des résultats
d’analyse.
Contribuer à pérenniser le savoir faire du laboratoire Figure 3 : Organisation des activités d’un laboratoire d’analyses
notamment dans une période où le personnel (vacataires, de biologie médicale
stagiaires, doctorants) change souvent.
Les laboratoires produisent des résultats d’analyses qui sont
La mise en place d’un SMQ est un investissement pour largement utilisés à des fins cliniques ou de santé publique.
le LABM, qui nécessite l’effort humain de la réflexion Les erreurs dans les laboratoires cliniques ont donc un
sur sa propre organisation, sur la mise en place des grand impact sur la sécurité et les soins des patients.
pratiques et leur documentation, et qui rapporte une Si des résultats inexacts sont rendus, les conséquences
clarification des mécanismes, leur traçabilité, leur peuvent être très graves. Ces erreurs peuvent conduire à
fiabilité, ainsi qu’une meilleure implication de toute une augmentation des coûts pour le patient à cause des
l’équipe. autres enquêtes inappropriées, ou aboutir à un mauvais
Dès lors que le LABM a décidé d’implanter un SMQ, soin ou une modification de thérapie [4].
le choix du référentiel et du périmètre de la démarche Ces conséquences entraînent une augmentation en coût,
qualité doit être fixé. Puisqu’il s’agit d’un LABM, en temps, et en ressources humaines et n’apportent aucun
l’application des exigences de la norme internationale bénéfice au patient. C’est pourquoi, la recherche de la qualité
ISO 15189 diffusée par le système d’accréditation de doit être une préoccupation essentielle et constante [4].
l’Institut Marocain de Normalisation (IMANOR), accompagnée L’objectif de l’accréditation en biologie médicale est de
(réglementairement) du GBEA marocain est une bonne garantir la fiabilité des examens de biologie médicale
option afin de satisfaire les parties intéressées réalisés et la qualité de la prestation médicale offerte par
(Figure 2). le laboratoire en question.
54 Journal de Biologie Médicale / Volume 7-Numéro 25 / Avr-Juin 2018
REVUE DE SYNTHESE
Les référentiels qualité L’exécution des analyses
- Prélèvement et identification de l’échantillon.
Le GBEA - Transmission et conservation des échantillons.
- Transmission des résultats (confidentialité, serveur de
Présentation du GBEA
résultats, traçabilité des transmissions).
Publié le 27 Ramadan 1431 (7 Septembre 2010), l’arrêté de - Contrôle de qualité. Interne : pour chaque constituant
la Ministre de la Santé Mme Yasmina BADDOU n°2598-10 biologique quantifiable, il faut clairement établir la fréquence
exige formellement à tous les LABM, quel que soit leur de passage des contrôles ; externe : peut être effectué par
statut (publique ou privé), d’appliquer les dispositions du un organisme spécialisé public ou privé à but non lucratif
GBEA, qui sont réparties en quatre chapitres. Il est donc accrédité par l’état ou par les services du ministère de la santé.
nécessaire de décomposer ce guide et de s’assurer que Le stockage et la conservation des archives
le laboratoire applique ses analyses conformément aux - Les résultats des analyses effectuées dans LABM
dispositions du GBEA. doivent être archivés pendant une période de 3 ans.
Il faut savoir que le GBEA est un texte réglementaire, - Les résultats des analyses exécutées dans le cadre d’un
son application est du domaine de l’agrément. Il introduit contrôle de qualité doivent être conservés pendant 2 ans.
quelques bases d’une démarche d’assurance qualité et cite - Les supports informatiques doivent garantir la pérennité
les conditions de déroulement des analyses propres aux et l’intégrité des données.
laboratoires de biologie médicale. L’hygiène et la sécurité
- Toutes les précautions doivent être prises pour respecter
But du GBEA
les obligations réglementaires contre les risques d’incendie.
"Son but est d’aider à rationaliser le fonctionnement - Par mesure d’hygiène, il est indiqué de disposer entre
des laboratoires d’analyses de biologie médicale, et de autres de lavabos à pédale et de distributeurs de savon.
rappeler un certain nombre de règles et de recommandations - L’élimination des déchets doit être conforme à la législation
dont le but n’est ni d’imposer les contraintes, ni d’empiéter et à la réglementation en vigueur en la matière.
sur la compétence propre du biologiste. Le choix de la
méthode utilisée pour l’exécution d’une analyse particulière La norme ISO 15189
relève de sa seule compétence. Toutefois, il est important Présentation de la norme
que cette méthode soit adaptée aux connaissances
La norme ISO 15189, publiée dans sa première version en
théoriques et pratiques du moment et qu’elle suive les
2003 est dérivée de l’ISO 17025, a fondé son système de
recommandations des sociétés savantes nationales ou
management qualité des LABM sur la norme ISO 9001.
internationales afin d’assurer la qualité exigée".
Cette norme internationale a été publiée en trois
Ce guide fait apparaître une responsabilité accrue des versions (15189V2003/ 15189V2007/ 15189V2012). C’est la
biologistes dans les activités pré-analytiques, analytiques version la plus récente qui est utilisée, les deux autres
et post-analytiques. Les thèmes qu’il aborde concernent : étant devenues obsolètes et dépassées. Nous évoquerons
L’organisation du laboratoire donc uniquement la version 2012.
La mise en place de l’ISO 15189 est devenue obligatoire
- Le système d’assurance qualité : positionnement afin d’en
pour les LABM dans de nombreux pays notamment en
faire un élément essentiel.
France. Au Maroc, c’est une démarche volontaire qui
- Obligation de la direction et des responsables : rôle des
vient en complément du domaine réglementaire. Elle
professionnels, adéquation entre qualifications et fonctions,
demande la participation de tout le personnel de la
formation du personnel.
structure, beaucoup de temps et une grande implication
Le fonctionnement du laboratoire financière. En effet, l’accréditation à cette norme permet de :
- Installations et équipement : systèmes analytiques choisis Démontrer la compétence du LABM quant aux
en fonction des performances souhaitées. prestations qu’il offre et améliorer en continu la qualité de
- Entretien des locaux et équipements : procédures écrites ses services.
et personnes qualifiées Donner confiance aux patients quant à la qualité des
- Matériels et réactifs : traçabilité (stockage, utilisation, prestations et de la prise en charge de ce dernier.
péremption, …). Impliquer tout le personnel à tous les stades de la
- Informatique : sécurisation de tout système informatique démarche qu’importe leur hiérarchie.
(données, confidentialité, transmission électronique, Améliorer la réputation du LABM et atteindre une
traçabilité). reconnaissance de la qualité des soins fournis.
Journal de Biologie Médicale / Volume 7-Numéro 25 / Avr-Juin 2018 55
ARTICLES SCIENTIFIQUES
REVUE DE SYNTHESE
Exigences de la norme Tableau I : Comparaison entre le GBEA marocain et la norme
ISO 15189
Elles sont réparties en deux chapitres principaux, le
premier portant sur les exigences relatives au management GBEA marocain ISO 15189
(Chapitre 4), le second sur les exigences techniques Niveau National International
(Chapitre 5) ; sans oublier les mesures d’hygiène et de Diagnostic par Inspection Audit
sécurité au laboratoire.
Type de système Système d’assurance Système de management
Exigences relatives au management : traitent tout qualité qualité
ce qui a un rapport au SMQ du laboratoire, dont les Responsabilité de la Non Abordée Engagement de la
responsabilités en matière d’organisation (maitrise des direction direction
documents) et de management qui vise les responsabilités Responsable qualité Biologiste Personne désignée
de la direction du laboratoire. Le chapitre 4.3 de la norme
Gestion du personnel Qualification/Diplôme Politique globale des
ISO 15189 concerne les exigences en termes de maîtrise et formation continue Ressources Humaines
des documents (création, état de diffusion, revue, révision)
et leur connaissance par le personnel. Elles traitent aussi Validation des Non Abordée Régulièrement
méthodes analytiques
le contrôle de la qualité, l’identification et la maitrise des
non-conformités, les actions correctives et préventives, Amélioration Statique Dynamique
d’amélioration continue
sans oublier les audits internes et externes et l’amélioration
continue.
Exigences techniques : traitent le côté technique du
laboratoire, dont les processus pré-analytique, analytique et Mise en place d’un SMQ au sein
post-analytique, la gestion du personnel, l’environnement, d’un LABM
le matériel ; la garantie de la qualité des résultats, leur
compte rendu et leur diffusion. La politique qualité
Hygiène et sécurité : Au vu des exigences de la norme On appelle "démarche qualité" l’approche organisationnelle
ISO 15189 sont décrites les actions de prévention à adoptée par un organisme en vue d’accroitre ses
l’environnement que du poste de travail lui-même, vis-à- performances. Il s’agit d’une démarche participative
vis des risques biologiques, chimiques, liés aux gaz, aux qui doit être portée au plus haut niveau hiérarchique.
radiations ionisantes ou non et incendie, afin de ne pas L’engagement de la direction est donc capital, et se
compromettre à la fois la sécurité des patients, celle du traduit par une politique globale de la qualité.
personnel et la qualité des résultats. En plus de décrire pourquoi le laboratoire existe, ses
Et bien que la norme ISO 15189 prescrit uniquement buts et ses objectifs globaux, la politique qualité est une
des exigences en terme de prévention, les actions déclaration qui témoigne de l’engagement de la direction
curatives face à des accidents d’exposition au sang pour développer et soutenir la démarche qualité. Elle
(mesures dites AES) et/ou aux produits chimiques sont contient toujours une orientation pour la satisfaction
définies [5]. des clients et l’amélioration continue, et le plus souvent
une volonté de progrès interne telle que l’amélioration
Comparaison entre la norme ISO 15189 et le GBEA des processus, la maîtrise ou réduction des coûts, le
développement des compétences, ...
La norme ISO 15189 et le GBEA marocain présentent des Cette déclaration est signée par le directeur du
points communs qui sont la maîtrise des documents, laboratoire et fait partie de la documentation qualité. Sa
la gestion des ressources et le respect des conditions rédaction est libre et dépend du style de chacun, mais elle
d’hygiène et de sécurité. Cependant, la norme ISO 15189 doit aborder les points suivants : l’engagement de la direction,
vient en quelque sorte combler les lacunes du GBEA l’affirmation de sa volonté, les moyens prévus, les moyens
avec des exigences supplémentaires techniques humains (qui sera impliqué ? qui fera quoi ?) et les objectifs
et d’autres en matière de qualité, notamment la mise en à atteindre qui seront déclinés en objectifs quantifiables
place d’un SMQ, d’objectifs et d’indicateurs qualité, dont découleront des indicateurs.
d’actions correctives et préventives, de communication Le plus important est que les indicateurs choisis soient tous
interne et d’amélioration continue du SMQ. En revanche, directement liés aux objectifs, simples, mesurables et pertinents.
le GBEA est très précis en règles pratiques et spécifiques Au cours de l’évolution du SMQ, certains indicateurs
à la biologie (Tableau I). peuvent se révéler moins pertinents ou difficiles à relever et
56 Journal de Biologie Médicale / Volume 7-Numéro 25 / Avr-Juin 2018
REVUE DE SYNTHESE
nécessiteront d’être remplacés : les indicateurs évoluent dans Tableau III : Tableau des 7M
le temps. De plus, les objectifs étant appelés à évoluer,
les indicateurs évolueront en conséquence [6]. Milieu Environnement matériel ou immatériel : conditions de travail...
La politique qualité est destinée à être communiquée Matière Matières premières traitées, informations, marchandises...
en interne, mais peut l’être aussi en externe, auprès des
Matériel Equipements, machines utilisées, pièces de rechange...
clients et autres partenaires.
Main-d’œuvre Ressources humaines, qualifications du personnel...
Outils de la démarche qualité
Méthode Procédures utilisées, processus d’échange d’informations...
La mise en place d’un système de gestion de la qualité Management Méthodes d’encadrement, style de commandement, délégation...
dans une organisation telle qu’un LABM ne peut être
réalisée qu’avec l’utilisation des outils de la qualité. Moyens Budget alloué, coûts...
financiers
Ces outils ne sont pas restrictifs et il est judicieux de
jongler entre eux selon le contexte. Il existe des outils
elle grippe sur la diagonale en passant sur chaque étape
pour analyser des effets (diagramme d’Ishikawa, QQOQCP,
AMDEC, SWOT,...) et d’autres pour l’optimisation et jusqu’à la fin du cycle. L’idée est de répéter les 4 phases
tant que le niveau attendu n’est pas atteint [7] (Figure 4).
l’amélioration continue (approche des 5S, modèle PDCA, ...).
Parmi les outils qualité les plus connus :
Le Brainstorming (méthode permettant de produire un
maximum d’idées en un minimum de temps).
Le QQOQCP (technique de structuration d’un sujet sur la
base des questions Qui, Quoi, Où, Quand, Comment et Pourquoi).
L’analyse SWOT (analyse des forces et faiblesses de
l’organisme, ainsi que des menaces et des opportunités, en
interne comme en externe).
L’approche des 5S (approche pour la maitrise de la
traçabilité et l’amélioration de l’environnement de travail).
A l’époque de la production de masse, l’encombrement
d’une usine était considéré comme un signe d’activité.
A l’heure de la qualité c’est l’inverse (Tableau II).
Tableau II : Tableau des 5S
Seiri Ne garder dans l’espace de travail que ce qui est utile pour
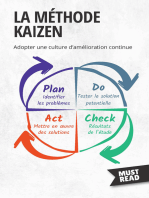
réaliser les tâches Figure 4 : Illustration schématique de la roue de Deming [7]
Seiton Définir où doit se trouver chaque chose pour que les tâches
soient faciles à réaliser - La première étape du cycle (Plan) "Planifier", consiste à préparer et
planifier ce que l’on va réaliser.
Seiso Nettoyer pour s’assurer que chaque élément est prêt à servir - La seconde étape du cycle (Do) "faire" est la construction, la
en état
réalisation, de l’œuvre.
Seiketsu Standardiser les tâches et formaliser le niveau d’exigence pour - La troisième étape (Check) "vérifier" consiste à contrôler que les
que la zone de travail soit toujours rangée et propre ressources mises en œuvre dans l’étape précédente (Do) et les
résultats obtenus correspondent bien à ce qui a été prévu (Plan).
Shitsuke Continuer à améliorer dans la rigueur du respect des standards
Divers moyens de contrôle sont alors déployés.
- Enfin la dernière étape du cycle (Act) "agir", consiste à ajuster les
Le diagramme d’Ishikawa (ou diagramme des 7M) est écarts, rechercher des points d’améliorations. Ce qui amènera un
nouveau projet à réaliser, donc une nouvelle planification à établir,
une arborescence visualisant toutes les causes et effets ce sera le début d’un nouveau cycle.
potentiels d’un problème (Tableau III). Selon l’illustration de Deming, on représente une cale sous la roue
Pour un "effet" particulier (panne, défaillance technique, pour éviter de revenir en arrière. Cette dernière symbolise l’entretien
d’un système de management intégré formel avec des procédures
accident, retard, …), la méthode d’Ishikawa permet de claires, écrites et accessibles, des audits internes réguliers, …
rechercher l’ensemble des causes possibles. En partant
d’un brainstorming, les causes identifiées sont notées et La cartographie des processus dans un LABM
classées selon les 7M sur un diagramme en arêtes de poisson.
La roue de Deming (ou modèle PDCA). C’est un cercle La cartographie des processus permet de répartir les activités
vertueux divisé en quatre portions et présenté sur la diagonale du laboratoire en trois catégories conformément à la norme
d’un triangle. Lorsqu’on tourne la roue dans le même sens, ISO 15189 de telle manière à préparer une étude de l’état
Journal de Biologie Médicale / Volume 7-Numéro 25 / Avr-Juin 2018 57
ARTICLES SCIENTIFIQUES
REVUE DE SYNTHESE
des lieux du service. Cette répartition consiste à fonctionner de permettre à l’équipe de mesurer les écarts entre ce
selon 3 catégories de processus (Figure 5) : qui est fait et ce qui devrait être fait. Les résultats de cet
état des lieux vont donc permettre la mise en place
Processus management ou de pilotage. Ce processus
d’un plan d’actions dont le but est de définir les actions
correspondent à la détermination d’une politique et d’une
correctives, les moyens nécessaires, les responsabilités
stratégie pour le laboratoire et ainsi au pilotage des
et les échéances.
actions mises en œuvre pour atteindre les objectifs fixés.
Pour le traitement des écarts constatés lors du diagnostic,
Processus de réalisation. Il correspond à la réalisation du
il est judicieux de suivre un outil de mise en place tel que
service (des analyses) et au "métier" du laboratoire, qu’on
le QQOQCP, afin de faciliter l’implantation de la démarche
peut subdiviser en trois parties (pré-analytique, analytique
qualité :
et post-analytique)
Processus support ou de soutien. Il représente les activités Quoi ? Que voulons-nous faire ?
internes permettant le bon fonctionnement du laboratoire Qui ? Qui est concerné par la mise en œuvre de la
(achats et gestion du matériel, locaux et infrastructure, solution ? Qui va subir le changement ? Qui va faire quoi
ressources humaines, ...). dans le projet ?
Chacun de ces processus englobe un nombre de Où ? En quel lieu, sur quelle machine ou dans quel secteur
procédures qui permettent la transformation d’une donnée l’action va-t-elle être menée ?
d’entrée en donnée de sortie. La norme ISO 15189 exige que Quand ? A quel moment le plan sera mis en œuvre ?
ces procédures, en plus d’être apparentées au processus Après quelle autorisation peut-on commencer ?
adéquat, doivent être codifiées de telle sorte à ce que Comment ? De quelle façon allons-nous procéder pour
chaque procédure ait un identifiant unique permettant la être le plus efficace?
traçabilité de ce dernier.
Evaluation
Etat des lieux et plan d’actions
La mise en œuvre d’une démarche qualité dans un LABM
Après avoir lu et assimilé tous les éléments et exigences a pour but principal de satisfaire les besoins de ses
de la norme, il est nécessaire de réaliser une étude de clients, que le laboratoire a traduit en objectifs à atteindre
l’état des lieux (ou diagnostic) afin d’estimer l’écart entre dans le cadre de son système de management qualité.
"là où se trouve le laboratoire" et "là où il devrait être", La question est de savoir si les actions entreprises, les
en fixant des objectifs réalistes afin de diminuer les écarts. processus mis en œuvre ou les améliorations réalisées
En effet, ces écarts ne seront pas supprimés d’un seul font évoluer le LABM vers le but fixé.
coup, les objectifs doivent donc être réalisables, peu Il y a donc lieu de le vérifier et pour cela d’évaluer le niveau
importe si l’amélioration est minime. Ceci définit l’essence de qualité atteint par rapport à celui qui était prévu. Pour
même d’une démarche qualité : l’amélioration continue. ce faire, le LABM doit mettre en œuvre une démarche
L’étude de l’état des lieux se fait en créant des grilles d’évaluation, définir un processus d’évaluation et utiliser
d’autodiagnostic inspirées de la norme d’accréditation des outils tels que des indicateurs et des tableaux de
internationale ISO 15189 version 2012 et du GBEA. Les bord qui permettent de suivre l’évolution d’une activité
données sont ensuite transcrites en diagrammes afin et des audits internes dont le but est de constater dans
Figure 5 : Exemple de cartographie des processus d’un laboratoire d’analyses de biologie médicale
58 Journal de Biologie Médicale / Volume 7-Numéro 25 / Avr-Juin 2018
REVUE DE SYNTHESE
quelle mesure le LBM répond aux exigences et aux précisée dans la norme amenant à des actions préventives
objectifs qu’il s’est proposé d’atteindre. ou des révisions de documents ; elle doit aussi amener à
redéfinir les objectifs qualité pour l’année suivante.
Indicateurs
Tableau de bord
C’est un outil qui produit une information recueillie
régulièrement sur la situation d’une action, sur le Il a pour but de présenter aux responsables du LABM les
fonctionnement d’un processus, plus généralement sur informations qu’ils attendent pour décider des actions
l’évolution d’un phénomène. Cette information, mesurable, à mener pour améliorer la qualité des informations sur
issue d’un fait observé, comparée à une valeur cible la situation actuelle et l’évolution de la qualité, sur les
déterminée pour un objectif, permet d’évaluer de façon écarts et les dérives par rapport aux objectifs, et sur
quantitative ou qualitative l’écart éventuel entre ce l’efficacité ou non des mesures antérieures prises et
qui est prévu et ce qui est réalisé. Différents types mises en œuvre pour améliorer la qualité.
d’indicateurs peuvent être utilisés selon ce que l’on veut Il regroupe les informations issues de l’analyse des
évaluer : données fournies par les indicateurs, que l’on pourra
regrouper par domaine d’activité. Il convient que ces
Indicateurs de résultat, encore appelés indicateurs
informations soient fidèles, concises, précises et
de surveillance, qui indiquent une valeur à un moment
facilement compréhensibles et qu’elles soient présentées
donné et qui permettent de vérifier un résultat atteint ou
de façon synthétique sur un support qui en facilite la
l’évolution progressive vers le résultat et qui peuvent
lecture et la communication.
entraîner une action rapide ou immédiate.
Indicateurs de processus ou indicateurs d’amélioration Audit interne
ou encore indicateurs de pilotage, qui mettent en évidence L’audit interne, parfois appelé audit de première partie,
un ensemble d’actions à réaliser pour atteindre l’objectif est un processus d’auto-évaluation qui est réalisé en
fixé sur une période déterminée et qui constituent une interne ou par un tiers pour le compte du laboratoire par
base de réflexion sur les actions à mener pour améliorer la accord prévu. Le choix entre effectuer des audits avec le
qualité. personnel en interne ou via un prestataire externe nécessite
Indicateurs de satisfaction, indispensables pour mesurer l’étude de différents critères [8] tels que les ressources
l’efficacité des mesures prises pour évaluer la qualité des disponibles (humaines, compétences, ...), le coût interne
soins prodigués aux patients. (formation du personnel, mobilisation des effectifs pour
La norme ISO 15189V2012 (Chapitre 4.14.7) apporte des effectuer les audits) / externe (coût de l’auditeur) et la
précisions complémentaires : politique interne du laboratoire.
"Le laboratoire doit définir des indicateurs qualité pour L’audit interne peut être :
surveiller et évaluer la performance au travers des aspects Un audit de processus (données d’entrée, données de
critiques des processus pré-analytiques, analytiques sortie) avec définition des 7M du processus, qui évalue
et post-analytiques. [...] Le processus de surveillance l’enchaînement des activités d’un processus. Cet audit
des indicateurs qualité doit être planifié, ce qui inclut permet d’évaluer la maturité du processus.
l’établissement des objectifs, de la méthodologie, de Un audit système qui s’intéresse à la cohérence de la
l’interprétation, des limites, du plan d’action et de la durée politique et des objectifs qualité et à la cohérence de
de mesure. Les indicateurs doivent être périodiquement l’ensemble du SMQ mis en place par le LBM par rapport
revus pour garantir leur adéquation continue. Il convient au référentiel choisi. Dans ce cas, on a recours à la
que le laboratoire définisse des indicateurs qualité démarche PDCA de Deming [7].
permettant de surveiller et d’évaluer systématiquement la
contribution du laboratoire aux soins du patient". Amélioration continue
Différents indicateurs peuvent ainsi être proposés : Il convient que l’amélioration continue de la performance
indicateurs de production, de coût et/ou de consommation globale d’un organisme soit un objectif permanent de ce
en réactifs, de non conformités de prélèvement, de délais dernier. Le LABM est dans une logique de compétitivité.
de réalisation, de temps de transport des prélèvements, Il souhaite l’amélioration durable de ses processus et pour se
de satisfaction des utilisateurs du laboratoire, du contrôle faire exploite des activités de veille concurrentielle,
de qualité des analyses, des incertitudes de mesures,… d’analyse de l’évolution du marché et anticipe les
[6] L’ensemble de ces éléments d’évaluation du système besoins des clients par une revue pertinente et régulière
qualité doit faire l’objet d’une revue de direction annuelle du fonctionnement de ses processus.
Journal de Biologie Médicale / Volume 7-Numéro 25 / Avr-Juin 2018 59
ARTICLES SCIENTIFIQUES
REVUE DE SYNTHESE
Le LABM doit améliorer en continu l’efficacité du SMQ, jour sur toutes les opérations du laboratoire, et est
y compris les processus pré-analytiques, analytiques et avantageuse pour le personnel du laboratoire car tous les
post-analytiques, au moyen de revues effectuées par aspects du travail sont documentés et les responsabilités
la direction pour comparer la performance actuelle du sont assignées.
laboratoire dans ses activités d’évaluation, actions
correctives et actions préventives avec ses intentions,
comme indiqué dans la politique qualité et les objectifs Conflit d’intérêt
qualité [9].
La démarche d’amélioration continue vise à pérenniser Les auteurs déclarent n’avoir aucun lien d’intérêt.
l’assurance qualité, principe souvent représenté par la
roue de Deming ou cycle PDCA. Après sa planification,
toute action d’amélioration mise en œuvre, qu’elle soit
corrective ou préventive, doit être suivie d’une vérification
Références
de son efficacité puis d’une phase d’ajustement [7]. 1- Cheilan A, Lachet B, Minoux J et al. Guide expérimental pour
Tout dysfonctionnement, toute anomalie, tout incident la qualité en recherche - Groupe de Travail Français "Qualité en
doit être considéré comme une source d’amélioration Recherche" Décembre 1997.
potentielle de l’efficience du LABM. 2- Messeghen. Implications organisationnelles des normes ISO
Le principe de l’amélioration continue se caractérise 9000 pour les petites et moyennes entreprises. Finance Contrôle
Stratégie. 2001;4(3):183-213.
par une attitude positive vis-à-vis des défauts et des
3- Mongour A. Les Impacts organisationnels de la norme ISO 9000 :
dysfonctionnements qui consiste pour chacun d’eux à : une revue systématique de littérature. Mémoire of Business
En rechercher les causes et identifier toutes les Administration. Université de Laval (Canada), Faculté des Sciences
de l’Administration, 2007, 130 p.
conséquences (administratives, juridiques et financières).
4- Kalra J, Kalra N, Baniak N. Medical error, disclosure and
Préciser les actions correctives envisagées. patient safety: a global view of quality care. Clinical Biochemistry.
Mettre en œuvre les solutions retenues. 2013;46(13-14):1161-9.
Suivre l’efficience des actions correctives mises en place. 5- Vinner E, Odou MF, Fovet B et al. Hygiène et sécurité au laboratoire
Prévenir la récidive en intégrant au système qualité les de biologie médicale. Ann Biol Clin. 2013;71 (Hors série no 1):325-50.
mesures correctives jugées pertinentes. 6- Szymanowicz A, Neyron MJ, Champagnon N et al. Proposition
de tableaux d’indicateurs utiles à la bonne marche d’un service
De plus, il est nécessaire, à travers des divers audits et de biochimie hospitalier. Immuno-analyse & Biologie Spécialisée.
enquêtes de satisfaction, de mettre en place des mesures 2008;23:159-78.
prévenant des dysfonctionnements potentiels. [9] 7- Deming WE. Out of the crisis. Cambridge, MA (USA) : MIT press,
2000.(book)
8- Barr-Pulliam D. Recours aux services de tiers pour les
Conclusion activitésd’audit interne, The IIA-Chicago Research Foundation,
Common Body of Knowledge, 2015.
9- Annaix V, Rogowski J, Joyau M et al. Gestion des non-
La démarche qualité d’un LABM est le reflet de conformités au laboratoire de biologie médicale : application aux
l’organisation et de la réactivité de l’ensemble de son non-conformités des prélèvements pour l’année 2009. Ann Biol Clin.
équipe et sa capacité à réagir efficacement devant tout 2011;69(3):363-72.
événement. Néanmoins, l’investissement dans cette - NF EN ISO 9000 : "Systèmes de management de la qualité –
démarche exige l’implication de toute personne faisant Principes essentiels et vocabulaire". Saint-Denis. AFNOR, 2005.
partie de l’organisme qu’importe leur hiérarchie, mais - NF EN ISO 9000 : "Systèmes de management de la qualité –
aussi l’ouverture d’esprit quant à l’amélioration continue Principes essentiels et vocabulaire". Saint-Denis. AFNOR, 2015.
et le changement et l’abolissement de l’idée que la qualité - NF EN ISO 9001 : "Systèmes de management de la qualité –
Exigences". Saint-Denis : AFNOR, 2015.
n’a pour rôle que de blâmer et juger les compétences et - NF EN ISO 15189 : "Laboratoires d’analyses de biologie médicale
salir la réputation de l’organisme. - Exigences particulières concernant la qualité et la compétence".
Une fois mise en place, cette démarche simplifie la vie au Saint-Denis : AFNOR, 2012.
laboratoire de plusieurs façons. Elle est autant bénéfique - GBEA : Guide de bonne exécution des analyses : texte
pour les patients que pour les médecins car toutes les réglementaire, dont la loi 12-01 l’avait annoncé dans son article
55, a été publié dans le journal officiel N°5892 - 11 Hija 1431 ,
informations liées à l’analyse des échantillons peuvent 2010.
être retrouvées facilement. Elle est aussi bénéfique pour
la direction car les informations sont fournies au jour le
60 Journal de Biologie Médicale / Volume 7-Numéro 25 / Avr-Juin 2018
View publication stats
Vous aimerez peut-être aussi
- Les inducteurs de l'amélioration continue: Plus de 365 pistes de progrès au service de la performance durable de votre entrepriseD'EverandLes inducteurs de l'amélioration continue: Plus de 365 pistes de progrès au service de la performance durable de votre entreprisePas encore d'évaluation
- RSBelkadyetalDocument10 pagesRSBelkadyetalDelondon AlasckoPas encore d'évaluation
- La Méthode Kaizen: Adopter une culture d'amélioration continueD'EverandLa Méthode Kaizen: Adopter une culture d'amélioration continuePas encore d'évaluation
- RSBelkadyetalDocument11 pagesRSBelkadyetalELIASSE khadiriPas encore d'évaluation
- La Méthode SCORE: Mesurer et améliorer les performances opérationnellesD'EverandLa Méthode SCORE: Mesurer et améliorer les performances opérationnellesPas encore d'évaluation
- La Démarche Qualité Au Sein D'un Laboratoire D'analysesDocument11 pagesLa Démarche Qualité Au Sein D'un Laboratoire D'analysesHassnae AznagPas encore d'évaluation
- Klein 2014Document17 pagesKlein 2014ImanePas encore d'évaluation
- Gbea PDFDocument34 pagesGbea PDFayb100% (2)
- Manuel v2010 Nouvelle MaquetteDocument100 pagesManuel v2010 Nouvelle MaquetteAnonymous 529Z5GW8YPas encore d'évaluation
- Prise de Position Audit Interne Qualite Mai 2004 1Document8 pagesPrise de Position Audit Interne Qualite Mai 2004 1Azalea De l'AtlasPas encore d'évaluation
- 2 - Les Systèmes de Management de La Qualité18Document12 pages2 - Les Systèmes de Management de La Qualité18Jimmy JimPas encore d'évaluation
- La Contribution Du Système Management Qualité À L'amélioration Des Performances Des Entreprises Agroalimentaires AlgériennesDocument7 pagesLa Contribution Du Système Management Qualité À L'amélioration Des Performances Des Entreprises Agroalimentaires AlgériennesSaddik BenbouzaPas encore d'évaluation
- Résumé de La Norme ISO 901 Version 2008Document27 pagesRésumé de La Norme ISO 901 Version 2008ahmedPas encore d'évaluation
- Management de La Qualité Dans Les Établissement de L'enseignement Supérieur - Cas Des Écoles Supérieures de TechnologieDocument22 pagesManagement de La Qualité Dans Les Établissement de L'enseignement Supérieur - Cas Des Écoles Supérieures de TechnologieNouerddine OuldkhouiaPas encore d'évaluation
- Grilles D'auto-Évaluation: Self Assessment ToolsDocument5 pagesGrilles D'auto-Évaluation: Self Assessment ToolsnadjahPas encore d'évaluation
- Aq 1Document13 pagesAq 1Lidvina FirquetPas encore d'évaluation
- Management de La Qualité Dans Les Établissements de L'enseignement Supérieur: Cas Des Ecoles Supérieures de TechnologieDocument23 pagesManagement de La Qualité Dans Les Établissements de L'enseignement Supérieur: Cas Des Ecoles Supérieures de TechnologieSerge KewouPas encore d'évaluation
- Managment of Clinical Lab - Version 2 Feb. 2022Document38 pagesManagment of Clinical Lab - Version 2 Feb. 2022Landry TengaPas encore d'évaluation
- Management de La QualiteDocument37 pagesManagement de La QualiteokyPas encore d'évaluation
- ISO 9001 Version 2008Document66 pagesISO 9001 Version 2008sélem AzPas encore d'évaluation
- Procédés de NettoyageDocument5 pagesProcédés de Nettoyagesouheilbenazouz2Pas encore d'évaluation
- Système de Management de La Qualité (SMQ)Document6 pagesSystème de Management de La Qualité (SMQ)danhahounde eudes rolland sodomePas encore d'évaluation
- Audit QualitéDocument28 pagesAudit QualitéKAWTAR TABOUTPas encore d'évaluation
- Iso 9001 V 2008 Cours DétailléDocument36 pagesIso 9001 V 2008 Cours DétailléHIMOUDIPas encore d'évaluation
- Formation À La Norme ISO 9001 Version 2008Document91 pagesFormation À La Norme ISO 9001 Version 2008Tarek FennichePas encore d'évaluation
- Audit EfficacitéDocument1 pageAudit EfficacitéNabil OggadiPas encore d'évaluation
- DEMARCHEDocument3 pagesDEMARCHEMaelys BressonPas encore d'évaluation
- A QualitéDocument4 pagesA QualitégholamiPas encore d'évaluation
- Cours de Management de La Qualité ESI-INPHBDocument21 pagesCours de Management de La Qualité ESI-INPHBMouhamed KRAPas encore d'évaluation
- Le Management de La QualitéDocument23 pagesLe Management de La QualitéRassitni AgrauolebPas encore d'évaluation
- Les Principes de L'assurance QualiteDocument8 pagesLes Principes de L'assurance Qualiteabir azamiPas encore d'évaluation
- Norme IsoDocument9 pagesNorme IsostevensegalsPas encore d'évaluation
- Fiche Processus Management de La Qualité Et Amélioration ContinueDocument4 pagesFiche Processus Management de La Qualité Et Amélioration Continuedcmdpgs.net100% (1)
- Laboratoire Manuel Qualité - Exemplaire Internet (3728)Document52 pagesLaboratoire Manuel Qualité - Exemplaire Internet (3728)dabc spoterPas encore d'évaluation
- FSSCDocument2 pagesFSSCCycy HmPas encore d'évaluation
- Contribution À L'optimisation D'un Processus de Production Par Le Diagramme D'ishikawa.Document14 pagesContribution À L'optimisation D'un Processus de Production Par Le Diagramme D'ishikawa.s cherguiPas encore d'évaluation
- Ich q10Document43 pagesIch q10soumayaPas encore d'évaluation
- Iso 22000 VFDocument3 pagesIso 22000 VFZouhour HannachiPas encore d'évaluation
- Management Qualité en Industrie PharmaceutiqueDocument49 pagesManagement Qualité en Industrie PharmaceutiqueWalid Masmoudi100% (1)
- Chap 1Document27 pagesChap 1Wàlid LàkehalPas encore d'évaluation
- Mise en Œuvre de La Gestion Environnementale Système en Système de Gestion de La QualitéDocument7 pagesMise en Œuvre de La Gestion Environnementale Système en Système de Gestion de La QualitéFrajPas encore d'évaluation
- Iso 9001Document7 pagesIso 9001Fatima Zahra KarfalPas encore d'évaluation
- Telecharger Le Plan Qualite Du Mali Globe Network - 5a35fc281723dd159ad44d8dDocument27 pagesTelecharger Le Plan Qualite Du Mali Globe Network - 5a35fc281723dd159ad44d8dToure ahmedPas encore d'évaluation
- Approche ProcessusDocument48 pagesApproche ProcessusIroukoura AlexPas encore d'évaluation
- Amelioration de Performance Dun ProcessuDocument13 pagesAmelioration de Performance Dun ProcessuPIDPas encore d'évaluation
- Cours ISO 9001 Version 2015 Partie 1Document45 pagesCours ISO 9001 Version 2015 Partie 1smailPas encore d'évaluation
- FR Whitepaper Iso 9001Document30 pagesFR Whitepaper Iso 9001Paco SonamoPas encore d'évaluation
- Norme ISO 9000Document20 pagesNorme ISO 9000ghilesPas encore d'évaluation
- REVISIONDocument23 pagesREVISIONJaafar ChirigPas encore d'évaluation
- Certification Système de Management de La Sécurité Des Denrées AlimentairesDocument2 pagesCertification Système de Management de La Sécurité Des Denrées AlimentairesProsper Jean AmoikonPas encore d'évaluation
- Qual-02 - Approches Gestion QualitéDocument12 pagesQual-02 - Approches Gestion QualitéismailovePas encore d'évaluation
- FSSC 22000Document86 pagesFSSC 22000eboule lisa100% (2)
- Management de La Qualité Et Le Processus de CertificationDocument4 pagesManagement de La Qualité Et Le Processus de CertificationSafae NadiPas encore d'évaluation
- Démarche Qualite 2013 PDFDocument4 pagesDémarche Qualite 2013 PDFenterprises_60487137Pas encore d'évaluation
- Maîtrisez Toutes Les Exigences de La Norme ISO 9001Document37 pagesMaîtrisez Toutes Les Exigences de La Norme ISO 9001Adnane Remila100% (2)
- CFA Descartes - IsO 9001 Version 2008Document71 pagesCFA Descartes - IsO 9001 Version 2008metoui62Pas encore d'évaluation
- Guide SMQDocument20 pagesGuide SMQMiraPas encore d'évaluation
- Certification ISO 9001 D'un Système de Management Qualité Dans Un Centre D'investigation CliniqueDocument7 pagesCertification ISO 9001 D'un Système de Management Qualité Dans Un Centre D'investigation CliniquenadjahPas encore d'évaluation
- Certification QualitéDocument2 pagesCertification Qualitékarim100% (1)
- Ad 353637Document2 pagesAd 353637silinalina adamPas encore d'évaluation
- Delta-Product - Diamond5upDocument3 pagesDelta-Product - Diamond5upsokaina elgasmiPas encore d'évaluation
- Rapport 1666Document334 pagesRapport 1666sokaina elgasmiPas encore d'évaluation
- CH10 CompressedDocument44 pagesCH10 Compressedsokaina elgasmiPas encore d'évaluation
- Cours Audit Normes Etudiants 2020-2021Document71 pagesCours Audit Normes Etudiants 2020-2021sokaina elgasmiPas encore d'évaluation
- Statistique Et Pratique D'excel en TraitementDocument38 pagesStatistique Et Pratique D'excel en Traitementsokaina elgasmiPas encore d'évaluation
- Série 2 PR NohairDocument2 pagesSérie 2 PR Nohairsokaina elgasmiPas encore d'évaluation
- Custum Pan C1210Document1 pageCustum Pan C1210sokaina elgasmiPas encore d'évaluation
- Custum Ves C1200Document1 pageCustum Ves C1200sokaina elgasmiPas encore d'évaluation
- 04.synthese Enquete de Satisfaction ClientDocument6 pages04.synthese Enquete de Satisfaction Clientsokaina elgasmiPas encore d'évaluation
- Idl 13920Document340 pagesIdl 13920sokaina elgasmiPas encore d'évaluation
- Série PR NohairDocument5 pagesSérie PR Nohairsokaina elgasmiPas encore d'évaluation
- Le Secteur Marocain AgroalimentaireDocument412 pagesLe Secteur Marocain AgroalimentairejamalPas encore d'évaluation
- ACFrOgD23wGd0XUa2x 2yz5k3ah2PGrsXEiqfrwFClZUqQDt4kH9u5iLq7jL0EkAf0rm52YcUa BxcznJnLStkWXzg2FcVYUwdyDoggzbJJa4NIbM6GQNmrKTo8zuWTcjqGd7 Zq6 mBUvGe - XsDocument30 pagesACFrOgD23wGd0XUa2x 2yz5k3ah2PGrsXEiqfrwFClZUqQDt4kH9u5iLq7jL0EkAf0rm52YcUa BxcznJnLStkWXzg2FcVYUwdyDoggzbJJa4NIbM6GQNmrKTo8zuWTcjqGd7 Zq6 mBUvGe - Xssokaina elgasmiPas encore d'évaluation
- SMQ LEONI MPQT Groupe 5Document41 pagesSMQ LEONI MPQT Groupe 5sokaina elgasmiPas encore d'évaluation
- Revision Decision STQTDocument2 pagesRevision Decision STQTsokaina elgasmiPas encore d'évaluation
- Dris RokhDocument3 pagesDris Rokhsokaina elgasmiPas encore d'évaluation
- Le LaitDocument1 pageLe Laitsokaina elgasmiPas encore d'évaluation
- RSBelkadyetalDocument11 pagesRSBelkadyetalsokaina elgasmiPas encore d'évaluation
- PM 2 Dynamique de La CroissanceDocument21 pagesPM 2 Dynamique de La Croissancesokaina elgasmiPas encore d'évaluation
- Iso 14688 1 2017Document12 pagesIso 14688 1 2017Franckeml H2ALPas encore d'évaluation
- Examen Rabi 2Document4 pagesExamen Rabi 2Øthmane HđPas encore d'évaluation
- Filiere Legumes SecsDocument3 pagesFiliere Legumes SecsrafikPas encore d'évaluation
- Mesures PistonspistonDocument17 pagesMesures PistonspistonAyou HamPas encore d'évaluation
- Les Limites Du Bilan Standard D'hémostase RVLDocument8 pagesLes Limites Du Bilan Standard D'hémostase RVLLAMA LAMAPas encore d'évaluation
- Formes PharmaceutiquesDocument7 pagesFormes Pharmaceutiqueshadjsadok100% (1)
- Recrutez Avec Pôle EmploiDocument1 pageRecrutez Avec Pôle Emploiangelique.corso13Pas encore d'évaluation
- Chapitr05 EnergieDocument3 pagesChapitr05 EnergieKahina DahmaniPas encore d'évaluation
- 07BDocument3 pages07BPatról150100% (1)
- Sujet Linux - SRI 2018 CorrigéDocument6 pagesSujet Linux - SRI 2018 Corrigéoussama remliPas encore d'évaluation
- Repertoire Des Salons 2020Document31 pagesRepertoire Des Salons 2020montsesanviPas encore d'évaluation
- 6472Document21 pages6472tidjani73Pas encore d'évaluation
- Quels Moyens Pour Prévenir Le Risque InondationDocument5 pagesQuels Moyens Pour Prévenir Le Risque Inondationrachidmokhtari15Pas encore d'évaluation
- Augmentation de Capital Par Apports NouveauxDocument8 pagesAugmentation de Capital Par Apports NouveauxSalmaElPas encore d'évaluation
- Décodeur 1Document5 pagesDécodeur 1Hanane TrgPas encore d'évaluation
- Bulletin Sept-Oct 10 v2Document20 pagesBulletin Sept-Oct 10 v2fbourdeix2293Pas encore d'évaluation
- Evaluations Externes Internationales - PISA - Mathématiques - Questionnaire (Ressource 10416)Document12 pagesEvaluations Externes Internationales - PISA - Mathématiques - Questionnaire (Ressource 10416)Ogion123Pas encore d'évaluation
- Regles de Dessin en Charpente Metallique PDFDocument77 pagesRegles de Dessin en Charpente Metallique PDFkouangoua100% (1)
- Copie de Paie SNCFDocument4 pagesCopie de Paie SNCFRiad Le RePas encore d'évaluation
- DOMAINE D'application DES SIDocument9 pagesDOMAINE D'application DES SIsantie ethamPas encore d'évaluation
- PROCEDURE D ImmatriculationDocument2 pagesPROCEDURE D ImmatriculationManuellaPas encore d'évaluation
- Rapport de Stage Pour EntrepriseDocument30 pagesRapport de Stage Pour EntrepriseSAWADOGOPas encore d'évaluation
- Bac BlancDocument2 pagesBac BlancOuedraogo Harouna100% (1)
- Côte D'ivoire - Tata Motors Livre À La SOTRA Les Premiers 117 Bus D'une Commande Total de 500Document3 pagesCôte D'ivoire - Tata Motors Livre À La SOTRA Les Premiers 117 Bus D'une Commande Total de 500Laurenne YaoPas encore d'évaluation
- Les Différentes Techniques D'irrigation Et Les Éléments de ChoixDocument43 pagesLes Différentes Techniques D'irrigation Et Les Éléments de ChoixHichem Hajlaoui100% (2)
- Les CapteursDocument6 pagesLes Capteursclair ricePas encore d'évaluation
- Endroits en VilleDocument54 pagesEndroits en VilleМедина ГусейноваPas encore d'évaluation
- Exposé Cahier Des ChargesDocument9 pagesExposé Cahier Des ChargesAlfred EbrottiePas encore d'évaluation
- Electrotechnique s2 2018 Final PDFDocument15 pagesElectrotechnique s2 2018 Final PDFAYAD AHMEDPas encore d'évaluation
- VRDDocument25 pagesVRDfouad abdelhamidPas encore d'évaluation
- Gestion de projet : outils pour la vie quotidienneD'EverandGestion de projet : outils pour la vie quotidienneÉvaluation : 5 sur 5 étoiles5/5 (2)
- 7 Techniques Pour Augmenter Vos Revenus: Rentabilisez vos passions, Testez vos idées et Lancez votre business sans risqueD'Everand7 Techniques Pour Augmenter Vos Revenus: Rentabilisez vos passions, Testez vos idées et Lancez votre business sans risqueÉvaluation : 2.5 sur 5 étoiles2.5/5 (3)
- L'analyse fondamentale facile à apprendre: Le guide d'introduction aux techniques et stratégies d'analyse fondamentale pour anticiper les événements qui font bouger les marchésD'EverandL'analyse fondamentale facile à apprendre: Le guide d'introduction aux techniques et stratégies d'analyse fondamentale pour anticiper les événements qui font bouger les marchésÉvaluation : 3.5 sur 5 étoiles3.5/5 (4)
- Comment entreprendre en partant de zéro - Le guide de poche pour créer son entrepriseD'EverandComment entreprendre en partant de zéro - Le guide de poche pour créer son entreprisePas encore d'évaluation
- La communication professionnelle facile à apprendre: Le guide pratique de la communication professionnelle et des meilleures stratégies de communication d'entrepriseD'EverandLa communication professionnelle facile à apprendre: Le guide pratique de la communication professionnelle et des meilleures stratégies de communication d'entrepriseÉvaluation : 5 sur 5 étoiles5/5 (1)
- La comptabilité facile et ludique: Il n'a jamais été aussi simple de l'apprendreD'EverandLa comptabilité facile et ludique: Il n'a jamais été aussi simple de l'apprendreÉvaluation : 2 sur 5 étoiles2/5 (1)
- Direction, Alignment, Commitment: Achieving Better Results Through Leadership, First Edition (French)D'EverandDirection, Alignment, Commitment: Achieving Better Results Through Leadership, First Edition (French)Pas encore d'évaluation
- Marketing: Guide Pour Gagner De L'argent En Ligne Avec Les Réseaux SociauxD'EverandMarketing: Guide Pour Gagner De L'argent En Ligne Avec Les Réseaux SociauxPas encore d'évaluation
- Le trading en ligne facile à apprendre: Comment devenir un trader en ligne et apprendre à investir avec succèsD'EverandLe trading en ligne facile à apprendre: Comment devenir un trader en ligne et apprendre à investir avec succèsÉvaluation : 3.5 sur 5 étoiles3.5/5 (19)
- Investir pour les débutants - Démarrer en 10 étapes facilesD'EverandInvestir pour les débutants - Démarrer en 10 étapes facilesÉvaluation : 3.5 sur 5 étoiles3.5/5 (2)
- Le Scalping est Amusant!: Partie 1: Le trading rapide avec Heikin AshiD'EverandLe Scalping est Amusant!: Partie 1: Le trading rapide avec Heikin AshiÉvaluation : 5 sur 5 étoiles5/5 (1)
- Sortez de la galère ! [Sortez de l'endettement et reprenez le contrôle de votre vie rapidement]D'EverandSortez de la galère ! [Sortez de l'endettement et reprenez le contrôle de votre vie rapidement]Évaluation : 5 sur 5 étoiles5/5 (1)
- Création d'une start-up à succès de A à Z: Réussir votre Start-up 2.0 Web et MobileD'EverandCréation d'une start-up à succès de A à Z: Réussir votre Start-up 2.0 Web et MobileÉvaluation : 3.5 sur 5 étoiles3.5/5 (4)
- Mieux s'organiser au travail: Le guide pratique pour gérer son temps et atteindre ses objectifsD'EverandMieux s'organiser au travail: Le guide pratique pour gérer son temps et atteindre ses objectifsÉvaluation : 4 sur 5 étoiles4/5 (7)
- Le jardin des vertueux: Riyad al-SalihinD'EverandLe jardin des vertueux: Riyad al-SalihinÉvaluation : 5 sur 5 étoiles5/5 (1)
- Le plan marketing en 4 étapes: Stratégies et étapes clés pour créer des plans de marketing qui fonctionnentD'EverandLe plan marketing en 4 étapes: Stratégies et étapes clés pour créer des plans de marketing qui fonctionnentPas encore d'évaluation
- La stratégie commerciale en boulangerie pâtisserieD'EverandLa stratégie commerciale en boulangerie pâtisserieÉvaluation : 3.5 sur 5 étoiles3.5/5 (2)
- Comment Développer Votre Entreprise de Marketing de Réseau en 15 Minutes Par Jour : Rapide ! Efficace ! Fantastique !D'EverandComment Développer Votre Entreprise de Marketing de Réseau en 15 Minutes Par Jour : Rapide ! Efficace ! Fantastique !Évaluation : 4 sur 5 étoiles4/5 (8)
- Le Bon Accord avec le Bon Fournisseur: Comment Mobiliser Toute la Puissance de vos Partenaires Commerciaux pour Réaliser vos ObjectifsD'EverandLe Bon Accord avec le Bon Fournisseur: Comment Mobiliser Toute la Puissance de vos Partenaires Commerciaux pour Réaliser vos ObjectifsÉvaluation : 4 sur 5 étoiles4/5 (2)
- La Sous-Traitance Accessible à Tous: Boostez votre Business en Faisant Travailler les Autres pour Vous !D'EverandLa Sous-Traitance Accessible à Tous: Boostez votre Business en Faisant Travailler les Autres pour Vous !Évaluation : 1 sur 5 étoiles1/5 (1)
- La psychologie du trading facile à apprendre: Comment appliquer les stratégies et les attitudes psychologiques des traders gagnants pour réussir dans le trading.D'EverandLa psychologie du trading facile à apprendre: Comment appliquer les stratégies et les attitudes psychologiques des traders gagnants pour réussir dans le trading.Évaluation : 4 sur 5 étoiles4/5 (2)
- Le money management facile à apprendre: Comment tirer profit des techniques et stratégies de gestion de l'argent pour améliorer l'activité de trading en ligneD'EverandLe money management facile à apprendre: Comment tirer profit des techniques et stratégies de gestion de l'argent pour améliorer l'activité de trading en ligneÉvaluation : 3 sur 5 étoiles3/5 (3)
- Le marketing d'affiliation en 4 étapes: Comment gagner de l'argent avec des affiliés en créant des systèmes commerciaux qui fonctionnentD'EverandLe marketing d'affiliation en 4 étapes: Comment gagner de l'argent avec des affiliés en créant des systèmes commerciaux qui fonctionnentPas encore d'évaluation






















































































































![Sortez de la galère ! [Sortez de l'endettement et reprenez le contrôle de votre vie rapidement]](https://imgv2-1-f.scribdassets.com/img/word_document/239848355/149x198/394cfbb7c6/1677054544?v=1)













