Académique Documents
Professionnel Documents
Culture Documents
Thermo DS1 3a 2021
Transféré par
Quentin MoalTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Thermo DS1 3a 2021
Transféré par
Quentin MoalDroits d'auteur :
Formats disponibles
ECAM3a Devoir surveillé de thermodynamique n°1 15 novembre 2021
Documents autorisés : calculatrice collège, fiche de synthèse A4 manuscrite.
La qualité de la rédaction et des commentaires sera prise en compte.
Barème prévisionnel : Ex 1 / 6 pts ; Ex 2 / 8 pts ; Ex 3 / 6 pts.
Exercice 1 – Analyse thermique d’une canalisation
Une conduite cylindrique en acier (R0 = 30 mm, R1 = 32 mm, λ1 = 45 W.m-1.K-1) transportant de la vapeur est
calorifugée par une épaisseur e2 = 28 mm de revêtement isolant de conductivité thermique λ2 = 0,02 W.m-1.K-1.
La température de la face interne de la canalisation est supposée égale à celle de la vapeur (100°C). Cet ensemble
est placé dans une atmosphère à 25°C. On mesure un flux de chaleur échangé de 14,7 W par unité de longueur
de la canalisation.
1. Déterminer la résistance thermique totale, incluant la convection en surface, par unité de longueur.
2. En déduire la valeur du coefficient de convection h.
3. Déterminer la température à l’interface acier- isolant et la température de surface de l’isolant.
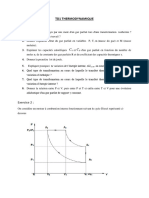
Exercice 2 - Cycle moteur à gaz parfait
Un moteur thermique fonctionne en appliquant à une mole de gaz parfait diatomique ( = 1,4, constante des gaz
parfaits R = 8,314 J.mol-1.K-1) le cycle réversible suivant :
- Le gaz, initialement dans un état A (pression P A = 105 Pa, température TA = 300 K) est comprimé de manière
adiabatique jusqu’à l’état B (PB = 4.105 Pa, TB)
- Il est ensuite chauffé à pression constante jusqu’à l’état C. Au cours de ce chauffage le gaz reçoit une quantité
de chaleur QBC = 13,22 kJ.
- Il subit ensuite une détente adiabatique jusqu’à retrouver sa pression initiale (état D, P D = PA, TD)
- Il est enfin refroidi de manière isobare pour revenir à son état A initial.
1. Tracer ce cycle dans un diagramme de Clapeyron. Vérifier qu’il est bien moteur.
2. À partir de la relation de Mayer CP – CV = R, retrouver les expressions des capacités calorifiques molaires à
volume constant CV et à pression constante CP de ce gaz en fonction de R et .
3. Calculer puis reporter dans un tableau les valeurs de pression, volume et température pour chacun des états
du cycle.
4. Calculer les quantités de chaleur échangées sur chacune des transformations.
5. En déduire le travail total produit par la machine au cours d’un cycle. Quelle proportion de la chaleur reçue a
été transformée en travail ?
Exercice 3 - Caractérisation d’un mélange
Un mélange de gaz est préparé à partir d’un volume V 1 = 30 L de dioxygène, sous une pression P1 = 1,9 bars et à
une température T1 = 20°C, et d’un volume V2 = 12 L d’un gaz diatomique inconnu, sous une pression P2 = 1,3 bar
et à une température T2 = 45°C, de masse m2 = 22,4 g. Ces gaz sont mélangés dans une enceinte de volume V 3 =
1 m3, maintenue à une température T3 = 0°C. On supposera que ces gaz se comportent comme des gaz parfaits.
1. Déterminer le nombre de moles de chaque constituant.
2. En déduire la pression finale P3 dans l’enceinte.
3. Déterminer la nature du gaz inconnu parmi les possibilités suivantes : F2, NO, C2H6, HBr, I2, CO.
4. Déterminer les fractions molaires et massiques de chaque constituant.
5. Déterminer la masse molaire moyenne M du mélange.
Numéro atomique
Élément
Z
Masse molaire
X
M
Vous aimerez peut-être aussi
- TD N°3 de PHYSIQUE IIIDocument3 pagesTD N°3 de PHYSIQUE IIIfjosephfabricePas encore d'évaluation
- TD Thermo 21-22Document3 pagesTD Thermo 21-22Junior ALLODJIPas encore d'évaluation
- Exercices D'application - CopieDocument3 pagesExercices D'application - CopieAbbé Marc LESSAMBA100% (2)
- Ex Thermo 1Document10 pagesEx Thermo 1Rom RomPas encore d'évaluation
- TD Serie 1 PDFDocument4 pagesTD Serie 1 PDFmohamed saadiPas encore d'évaluation
- ThermoDocument13 pagesThermoYoussef Ben omarPas encore d'évaluation
- Fiche de Travaux Diriges de ThermodynamiqueDocument3 pagesFiche de Travaux Diriges de ThermodynamiqueSerge KewouPas encore d'évaluation
- Travaux Dirigés ThermodynamiqueDocument4 pagesTravaux Dirigés ThermodynamiqueRodolphe Sounou100% (1)
- Introduction Generale de ThermosDocument2 pagesIntroduction Generale de ThermoskakeraPas encore d'évaluation
- TD Thermo en LigneDocument16 pagesTD Thermo en LigneDavi Nordel NgondzaPas encore d'évaluation
- TD 1 2 3 PDFDocument9 pagesTD 1 2 3 PDFBenouna Rajae AminaPas encore d'évaluation
- Série N°1Document2 pagesSérie N°1Mohamed Ben-HmamePas encore d'évaluation
- Examens Thermo 21 22Document2 pagesExamens Thermo 21 22Rawnek AkremiPas encore d'évaluation
- Exercices de ThermodynamiqueDocument18 pagesExercices de ThermodynamiqueBadre-ezzamen KaddourPas encore d'évaluation
- TD 1 ThermoDocument2 pagesTD 1 Thermomoney makerPas encore d'évaluation
- Exercie L1 EAD Energie InterneDocument1 pageExercie L1 EAD Energie Internefiacre mpouonguiPas encore d'évaluation
- ThermoDocument3 pagesThermoOumixa BenPas encore d'évaluation
- Machet PDFDocument19 pagesMachet PDFTaoufikAghrisPas encore d'évaluation
- TD 1thermoDocument2 pagesTD 1thermoGhassen BoussaaPas encore d'évaluation
- TD Thermodynamique-2Document48 pagesTD Thermodynamique-2kawtar azzouziPas encore d'évaluation
- ET4Document4 pagesET4ABDOXX1aPas encore d'évaluation
- TD1-b PTD 012Document3 pagesTD1-b PTD 012Sif eddinePas encore d'évaluation
- Epreuve de Thermodynamique 2006Document9 pagesEpreuve de Thermodynamique 2006LilliputienPas encore d'évaluation
- TD N2Document3 pagesTD N2Esperance TchibindaPas encore d'évaluation
- Exercice N1Document3 pagesExercice N1Harry Mongo100% (2)
- TD Thermo L1chi 23 24 022637Document6 pagesTD Thermo L1chi 23 24 022637milandcalebPas encore d'évaluation
- Fiche TD Machines Thermiques: Exercice 01Document3 pagesFiche TD Machines Thermiques: Exercice 01sino spagoPas encore d'évaluation
- Correction Du TD3Document19 pagesCorrection Du TD3Sa Nae NacerPas encore d'évaluation
- TD2 Thermo 2017-2018-1Document3 pagesTD2 Thermo 2017-2018-1Joseph AmondPas encore d'évaluation
- TD 4Document2 pagesTD 4Oumaima FakhrPas encore d'évaluation
- Thermo TD2 2024Document4 pagesThermo TD2 2024Lodvert T. POATYPas encore d'évaluation
- Second Principe: EX 1 - Création D'entropie Dans Une Expérience de CalorimétrieDocument2 pagesSecond Principe: EX 1 - Création D'entropie Dans Une Expérience de Calorimétriezakaria amirPas encore d'évaluation
- Série #2 - S4 2021Document2 pagesSérie #2 - S4 2021Abar YoucefPas encore d'évaluation
- Fiche TD 2Document2 pagesFiche TD 2Bouchiba leilaPas encore d'évaluation
- 106 Thermo TDDocument16 pages106 Thermo TDEmmanuel KetPas encore d'évaluation
- T5 TD PDFDocument2 pagesT5 TD PDFMario StiflerPas encore d'évaluation
- Machines ThermiquesDocument19 pagesMachines ThermiquesAnouar BhPas encore d'évaluation
- TD1Document3 pagesTD1Randa BelaidiPas encore d'évaluation
- Tutorials Thermodynamics NTSOUKPOEDocument6 pagesTutorials Thermodynamics NTSOUKPOESangaré OumarPas encore d'évaluation
- Cours Exercices Thermo4Document9 pagesCours Exercices Thermo4Fatou SECKPas encore d'évaluation
- TD Premier Deuxieme PrincipesDocument5 pagesTD Premier Deuxieme Principessamim1971Pas encore d'évaluation
- S Rie 2 ThermodynamiqueDocument3 pagesS Rie 2 Thermodynamiquechakib abPas encore d'évaluation
- Serie 2 Termo Pm1Document2 pagesSerie 2 Termo Pm1aydi abdelhediPas encore d'évaluation
- Fiche de TD Valopro ThermoDocument5 pagesFiche de TD Valopro Thermomarcelina24Pas encore d'évaluation
- SérieN3 2020-2021Document2 pagesSérieN3 2020-2021MounirPas encore d'évaluation
- TD ThermodynamiqueDocument4 pagesTD ThermodynamiqueamenmhedhbiiPas encore d'évaluation
- Série de TD N1 2020Document2 pagesSérie de TD N1 2020Sara AkliPas encore d'évaluation
- Exercice D Application MSE - 2Document2 pagesExercice D Application MSE - 2Abdelkhalek SaidiPas encore d'évaluation
- Exam en 1Document2 pagesExam en 1minhtuanbk202Pas encore d'évaluation
- Thermodynamique TD, Tests, Exam CorrigeeDocument55 pagesThermodynamique TD, Tests, Exam CorrigeeAwatif BePas encore d'évaluation
- E 2ME PRINCIPE TD62emeprincipethermo PDFDocument6 pagesE 2ME PRINCIPE TD62emeprincipethermo PDFMosaab Echabane100% (1)
- TD4 ThermoDocument3 pagesTD4 ThermoYoussef BensaidPas encore d'évaluation
- Exercices Et Devoir-Thermodynamique IDocument4 pagesExercices Et Devoir-Thermodynamique Iapi-291918152Pas encore d'évaluation
- Fiche de TD N°1Thermodynamique Version Finale 2019-2020Document2 pagesFiche de TD N°1Thermodynamique Version Finale 2019-2020Ñar ĎjesPas encore d'évaluation
- Chap13 Bilans Energie 1er Ppe TDDocument4 pagesChap13 Bilans Energie 1er Ppe TDdhoubzainabPas encore d'évaluation
- Examen 2021Document4 pagesExamen 2021Mohammed AmliehPas encore d'évaluation
- RéfrigérationTD1 PDFDocument5 pagesRéfrigérationTD1 PDFAmine100% (1)
- 04 Quadripôles, Fonctions de Transfert, FiltresDocument12 pages04 Quadripôles, Fonctions de Transfert, FiltresHalima Aataf100% (1)
- chapitreII de TdsDocument117 pageschapitreII de Tdsmalika elorfPas encore d'évaluation
- Carte DspaceDocument54 pagesCarte DspaceMeriamChadram100% (3)
- Fondations Prof SyntheseDocument29 pagesFondations Prof SynthesehzoualidPas encore d'évaluation
- l1.1 Varedia Livret TechnologiesDocument46 pagesl1.1 Varedia Livret TechnologiesJàMàl MejorPas encore d'évaluation
- BAC-S1-S3-2010-corrige-1er GroupeDocument15 pagesBAC-S1-S3-2010-corrige-1er GroupeMonsieur RonePas encore d'évaluation
- Panne CouranteDocument37 pagesPanne CouranteISsråe BåHhärPas encore d'évaluation
- 2007 Reunion Exo2 Correction Meca - Trebuchet 5 5ptsDocument3 pages2007 Reunion Exo2 Correction Meca - Trebuchet 5 5ptsLhoussaineOuaouichaPas encore d'évaluation
- ElectromagnétismeDocument37 pagesElectromagnétismePFEPas encore d'évaluation
- Complexes PDFDocument64 pagesComplexes PDFbechirPas encore d'évaluation
- coursIRM PDFDocument82 pagescoursIRM PDFNoureddine BenarifaPas encore d'évaluation
- AlcalinitéDocument2 pagesAlcalinitéAlkatel Al HanounePas encore d'évaluation
- TD1 Electronique Des ImpulsionsDocument2 pagesTD1 Electronique Des Impulsionsaymenlake9Pas encore d'évaluation
- GroupesDocument5 pagesGroupesMoha BaihiPas encore d'évaluation
- ChmTheo S5 Chap1Document12 pagesChmTheo S5 Chap1Abdelhakim Bailal100% (2)
- FICHEDocument132 pagesFICHEHamzaMajid100% (2)
- Pfe Mixte Pont Iso Ferroviaire 1Document81 pagesPfe Mixte Pont Iso Ferroviaire 1titililimimi100% (1)
- Cours TDM Physique Appliquée Et Technologie Cours M SOUALMIDocument17 pagesCours TDM Physique Appliquée Et Technologie Cours M SOUALMINoureddine Benarifa100% (5)
- TD Capteurs Et ActionneursDocument13 pagesTD Capteurs Et ActionneursKarim HanzazPas encore d'évaluation
- Chapitre 2 Utilisation de La Diode A Jonction en Redressement PDFDocument21 pagesChapitre 2 Utilisation de La Diode A Jonction en Redressement PDFRajhiHoussemPas encore d'évaluation
- Devoir de Contrôle N°1 2011 2012 (Omar Elkalchani)Document2 pagesDevoir de Contrôle N°1 2011 2012 (Omar Elkalchani)Monji SaiemPas encore d'évaluation
- 3-Up Right SprinklerDocument10 pages3-Up Right SprinklerSara KHEIRIPas encore d'évaluation
- Mémoire Fin D'etude Master 2 Génie CivilDocument142 pagesMémoire Fin D'etude Master 2 Génie Civilnebile100% (3)
- TT2 Chap1-Transmission en Bande de Base (Modifi+®)Document41 pagesTT2 Chap1-Transmission en Bande de Base (Modifi+®)Rasta Kais92% (12)
- Chapitre 1Document31 pagesChapitre 1mahdi hadhri100% (1)
- Compte RenduDocument10 pagesCompte RenduSofiane HAMCHAOUIPas encore d'évaluation
- 6 Chapitre1Document19 pages6 Chapitre1Abd El Basset BeNmansourPas encore d'évaluation
- NC01 Indice A-Grue-Potain H3023 PA663 ScelléeDocument5 pagesNC01 Indice A-Grue-Potain H3023 PA663 ScelléeSami OurariPas encore d'évaluation
- E Capteur2Document1 pageE Capteur2satrwPas encore d'évaluation
- 2 Examen MDCDocument3 pages2 Examen MDCkadaPas encore d'évaluation