Académique Documents
Professionnel Documents
Culture Documents
Controle 19 (PR Y. EL FATIMY) Partie Chimie
Transféré par
cheikhna lemrabettTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Controle 19 (PR Y. EL FATIMY) Partie Chimie
Transféré par
cheikhna lemrabettDroits d'auteur :
Formats disponibles
Année scolaire : 2019/2020 Contrôle 1
WWW.PCTIZNIT.COM Nom :…………………….………..
Pr. Y. EL FATIMY Partie de chimie (7,5 pts) Prénom :…………………………..
La note : .......................... 20
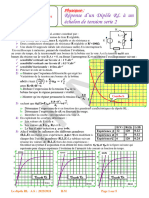
Cette exercice a pour objectif de suivi l’évolution de
la réaction de l’acide chlorhydrique avec le
magnésium. A une date t=0, on introduit une masse
m = 300 mg de magnésium en poudre dans un ballon
contenant d’une solution aqueuse d’acide
chlorhydrique de concentration molaire CA. La figure
ci-contre représente les variations de la quantité de
matière en ions H3O+ dans le mélange réactionnel au
cours du temps.
Données :
-Toutes les mesure ont été prises à 20°C .
- La masse molaire du Magnésium : M(Mg) = 24,3 g.mol-1.
-Les couples interviennent sont : H3O+/H2; Mg2+/Mg - Le volume du mélange est : VA = V= 50 mL
1- Ecrire l’équation bilan de la réaction étudié.
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………...........................…
2- Citer d’autres techniques qui peuvent utiliser pour suivre l’évolution de cette réaction étudie.
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………..
3- Calculer la concentration [ ] et la quantité de matière (Mg).
……………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
4- Complétez le tableau d’avancement suivant.
Equation de la réaction …………………………………………………………………………………
Etat du système avancement Quantité de matière (mol)
Etat initial ………….... …………… …………… …………… …………
Etat intermédiaire …………… …………… …………… …………… …………
Etat final …………… …………… …………… …………… …………
5- Déterminer l’avancement maximal xmax de la réaction et déduire le réactif limitant.
……………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………….…
6- A partir de tableau d’avancement montrer que : ( ) ( )
...............................................................................................................................................................
...............................................................................................................................................................
...............................................................................................................................................................
WWW.PCTIZNIT.COM
WWW.PCTIZNIT.COM
7- Vérifier que la valeur de l‘avancement final de la réaction est
……………………………………………………………………………………………………………………………….…
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
8- Définir le temps de demi-réaction t1/2 et déterminer sa valeur.
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………….…
……………………………………………………………………………………………………………………………...
9- Quelle est la durée nécessaire à l’achèvement de la réaction ?
……………………………………………………………………………………………………………………………
( )
10- Montrer que la vitesse volumique de cette réaction est : ( ) . Puis calculer sa
valeur à t = 200s
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………….…
…………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………
11-Sachant que la vitesse volumique à l’instant t0 = 0 s, est : ;
D’apres les résultats obtenus, Expliquer pourquoi la vitesse diminue au cours de la réaction.
……………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………
12- Calculer la masse de magnésium qui a disparu à l’instant t = 350 s.
……………………………………………………………………………………………………………………………….……
……………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………….……………
13- En gardant les concentrations initiales des réactifs, et on augmente la température de mélange
réactionnel à 40°C, Tracer sur la figure ci-dessus la nouvelle évolution ( ) ( ).
Expliquer l’effet de la température sur la vitesse de la réaction au niveau microscopique.
…………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………...
Bonne chance
WWW.PCTIZNIT.COM
Vous aimerez peut-être aussi
- Cours PC Elèves 2bac BiofDocument217 pagesCours PC Elèves 2bac BiofLahcenEs-samlaliPas encore d'évaluation
- Devoir 1 Modele 3 Physique Chimie 2 Bac SPC Semestre 2Document4 pagesDevoir 1 Modele 3 Physique Chimie 2 Bac SPC Semestre 2Hamza ZaïmPas encore d'évaluation
- Serie 1 Avancement D'une Reaction 2021Document6 pagesSerie 1 Avancement D'une Reaction 2021ja3bek ma9rounaPas encore d'évaluation
- Proposition 1Document8 pagesProposition 1Testeur MohammediaPas encore d'évaluation
- 17-Oscillateur+charge Et Decharg+ Courant Sinus+ Pendule PesantDocument5 pages17-Oscillateur+charge Et Decharg+ Courant Sinus+ Pendule PesantAnonymous hbpCoy4Pas encore d'évaluation
- 4e dc1 2010 2011 Doo PDFDocument3 pages4e dc1 2010 2011 Doo PDFKhairedine LatamnaPas encore d'évaluation
- Ob S2-Cin-ChimiqueDocument3 pagesOb S2-Cin-ChimiqueManar Bahi100% (2)
- Condensate UrDocument3 pagesCondensate Urdhouib imenPas encore d'évaluation
- Filtre Passe Haut PassifDocument3 pagesFiltre Passe Haut PassifYossri HmaiedPas encore d'évaluation
- Devoir de Synthèse N°1 - Sciences Physiques - 2ème Informatique (2016-2017) MR Amari AbdelkrimDocument3 pagesDevoir de Synthèse N°1 - Sciences Physiques - 2ème Informatique (2016-2017) MR Amari AbdelkrimZouari IsmailPas encore d'évaluation
- Dev Synthese N°14scDocument6 pagesDev Synthese N°14scSahbi Mabrouki YamenPas encore d'évaluation
- Devoir de Synthese N - 1-2Document5 pagesDevoir de Synthese N - 1-2Med BriniPas encore d'évaluation
- Devoir de Synthèse N°1 - Physique - Bac SC Exp Math (2009-2010) MR BLaaroussi MR L.Akkari.DDocument5 pagesDevoir de Synthèse N°1 - Physique - Bac SC Exp Math (2009-2010) MR BLaaroussi MR L.Akkari.DhammouazizPas encore d'évaluation
- MatièreDocument2 pagesMatièreMatadour Salman100% (1)
- Cours Physique Nature Ondulatoire de La Lumiere (Sciences2016) (Eleve1)Document4 pagesCours Physique Nature Ondulatoire de La Lumiere (Sciences2016) (Eleve1)Daghsni Said100% (1)
- Série D'exercice 3 Electricite Et Acide Base-1Document11 pagesSérie D'exercice 3 Electricite Et Acide Base-1Mohamed MéknPas encore d'évaluation
- 8 LC PDFDocument3 pages8 LC PDFAzizElheniPas encore d'évaluation
- Dc3 Sadiki 2014 MathsDocument3 pagesDc3 Sadiki 2014 Mathslemia100% (1)
- TD Terminale D Mai N°1Document3 pagesTD Terminale D Mai N°1Essohanam AwatePas encore d'évaluation
- Gabarit 1 2021 Cours Bac CondensateurDocument4 pagesGabarit 1 2021 Cours Bac CondensateurjurassiqueparkPas encore d'évaluation
- Devoir de Synthèse N°1Document3 pagesDevoir de Synthèse N°1academie archimedePas encore d'évaluation
- DS2 S1 2SMBF 2020-2021 S1 TYPE A Prof - Izaran (WWW - Pc1.ma)Document4 pagesDS2 S1 2SMBF 2020-2021 S1 TYPE A Prof - Izaran (WWW - Pc1.ma)allach mohamedPas encore d'évaluation
- 2046044série N3Document2 pages2046044série N3Nassim ChraitiPas encore d'évaluation
- 01 Bac Physchimie D Ci PDFDocument3 pages01 Bac Physchimie D Ci PDFSarah Amah AdomPas encore d'évaluation
- 1.les Oscillations Libres Amorties - 1Document4 pages1.les Oscillations Libres Amorties - 1Abderahmen Haj DahmenPas encore d'évaluation
- Devoir de Contrôle N°1 Avec Correction - Sciences Physiques - Bac Mathématiques (2013-2014) MR Sadki EzzeddineDocument3 pagesDevoir de Contrôle N°1 Avec Correction - Sciences Physiques - Bac Mathématiques (2013-2014) MR Sadki EzzeddinerihabPas encore d'évaluation
- 2ème Devoir Du 1er Trimestre PCT Tle D 2019-2020 Cs Le PharaonDocument4 pages2ème Devoir Du 1er Trimestre PCT Tle D 2019-2020 Cs Le PharaonHAPPYPas encore d'évaluation
- Série D'exercices - Physique Cinématique 2 - 4éme Mathématiques (2013-2014) MR Affi Fethi 2 PDFDocument8 pagesSérie D'exercices - Physique Cinématique 2 - 4éme Mathématiques (2013-2014) MR Affi Fethi 2 PDFAzizElheniPas encore d'évaluation
- Devoir de Contrôle N°1 Avec Correction Physiques - 3ème - Docx Version 1Document9 pagesDevoir de Contrôle N°1 Avec Correction Physiques - 3ème - Docx Version 1Mouhamed Ali SahbaniPas encore d'évaluation
- Série Ec - RFD PlateformeDocument2 pagesSérie Ec - RFD PlateformeBakari AnisPas encore d'évaluation
- MVT D'un Projectile Dans Un Champ UniformeDocument2 pagesMVT D'un Projectile Dans Un Champ UniformeYasmine InePas encore d'évaluation
- Concours Blanc 2 MedecineDocument3 pagesConcours Blanc 2 MedecinePaul Eric EkoaPas encore d'évaluation
- Devoir À Maison Svt2022 PCDocument4 pagesDevoir À Maison Svt2022 PCKhalid Awtm0% (1)
- Cours Physique - ChimieDocument106 pagesCours Physique - ChimieHind EssamlaliPas encore d'évaluation
- Evaluation Des AcquisDocument2 pagesEvaluation Des AcquisGOUNOUPas encore d'évaluation
- Serie Onde Uploaded by Sofieno JobranDocument4 pagesSerie Onde Uploaded by Sofieno JobranSofieno JobranPas encore d'évaluation
- 2bac-Sm FR Examens Nationaux Physique-Chimie 2015 A 2020Document196 pages2bac-Sm FR Examens Nationaux Physique-Chimie 2015 A 2020Soufiane AzikiPas encore d'évaluation
- Devoir de Contrôle N°1 - Sciences Physiques - 1ère AS (2011-2012) MR Trimech Abdelhakim PDFDocument2 pagesDevoir de Contrôle N°1 - Sciences Physiques - 1ère AS (2011-2012) MR Trimech Abdelhakim PDFDadati SouPas encore d'évaluation
- Devoir de Controle Siences PDFDocument3 pagesDevoir de Controle Siences PDFSmaali Faouzi Smaali100% (1)
- Devoir 1 TC2023Document4 pagesDevoir 1 TC2023moustapha00Pas encore d'évaluation
- LC Libre Non AmortieDocument2 pagesLC Libre Non AmortieAhmed Ben RomdhanePas encore d'évaluation
- Dc3 Sadiki 2012 MathsDocument5 pagesDc3 Sadiki 2012 MathsAnis DahnenPas encore d'évaluation
- Gsa 2bac 1819 S1 C3 PCF PCDocument4 pagesGsa 2bac 1819 S1 C3 PCF PCAmine AlaoUii AlaouiPas encore d'évaluation
- 5 RL PDFDocument3 pages5 RL PDFAzizElheni100% (1)
- Devoir c1 4scDocument6 pagesDevoir c1 4scHammadi RekikPas encore d'évaluation
- DC N°1 Final PDFDocument6 pagesDC N°1 Final PDFLina AkroutePas encore d'évaluation
- Bac Blanc 2019Document6 pagesBac Blanc 2019khalid el yacoubi100% (1)
- Dipole RL 2023 Serie 2 A FaireDocument5 pagesDipole RL 2023 Serie 2 A Faireourabitayssir756100% (1)
- Correction Examen Régional Tanger - Tetouan - Al Houceima 2019Document5 pagesCorrection Examen Régional Tanger - Tetouan - Al Houceima 2019Souad ZeriouhPas encore d'évaluation
- Examen Blanc N°2 Du Baccalauréat Année: 2020Document8 pagesExamen Blanc N°2 Du Baccalauréat Année: 2020Mehdi AgPas encore d'évaluation
- Devoir de Synthèse N°2 Avec Correction 2012 2013 (Sidi Zikri)Document11 pagesDevoir de Synthèse N°2 Avec Correction 2012 2013 (Sidi Zikri)fayePas encore d'évaluation
- Suite Chute LibreDocument9 pagesSuite Chute Libretamersamira80Pas encore d'évaluation
- DC 1Document2 pagesDC 1Мохамед Ель ФахімPas encore d'évaluation
- Révision Et Coltrol 2Document5 pagesRévision Et Coltrol 2Arfa Bouchta67% (3)
- DEVOIR Synthese1 Bac M 2013Document5 pagesDEVOIR Synthese1 Bac M 2013Yassine Riahi100% (1)
- Série D'exercices N°1 - Sciences Physiques Cinétique Chmique, Dosage Acide-Base, Dipôle RL, Oscillations Mécaniques Forcées - Bac Sciences Exp (2010-2011) MR Abdmouleh NabilDocument5 pagesSérie D'exercices N°1 - Sciences Physiques Cinétique Chmique, Dosage Acide-Base, Dipôle RL, Oscillations Mécaniques Forcées - Bac Sciences Exp (2010-2011) MR Abdmouleh NabilhammouazizPas encore d'évaluation
- Controle 1 2BAC BIOF PC Partie Chimie (2) - 2Document2 pagesControle 1 2BAC BIOF PC Partie Chimie (2) - 2said youssfiPas encore d'évaluation
- Devoir 3Document4 pagesDevoir 3Majed GharibPas encore d'évaluation
- SC Phys S1 S1a S3 GP1 2019Document4 pagesSC Phys S1 S1a S3 GP1 2019cheikhna lemrabettPas encore d'évaluation
- Capture D'écran . 2023-11-21 À 20.00.04Document7 pagesCapture D'écran . 2023-11-21 À 20.00.04cheikhna lemrabettPas encore d'évaluation
- Capture D'écran . 2023-11-21 À 20.00.04Document7 pagesCapture D'écran . 2023-11-21 À 20.00.04cheikhna lemrabettPas encore d'évaluation
- Capture D'écran . 2023-04-05 À 11.49.07 PMDocument9 pagesCapture D'écran . 2023-04-05 À 11.49.07 PMcheikhna lemrabettPas encore d'évaluation
- La ProcreationDocument2 pagesLa ProcreationRihane FarahPas encore d'évaluation
- Imo 3APIC 2019 KhénifraDocument1 pageImo 3APIC 2019 Khénifracheikhna lemrabettPas encore d'évaluation
- Série Dexercice Courant ElactriqueDocument1 pageSérie Dexercice Courant Elactriquecheikhna lemrabettPas encore d'évaluation
- QcmcorDocument2 pagesQcmcorkalifa ben cheick konatePas encore d'évaluation
- Pubquest 01Document6 pagesPubquest 01cheikhna lemrabettPas encore d'évaluation
- Serie Energie Potentielle Et MecaniqueDocument2 pagesSerie Energie Potentielle Et Mecaniquecheikhna lemrabettPas encore d'évaluation
- QCM Worms CorrecDocument16 pagesQCM Worms CorrecMohamed HmamouchPas encore d'évaluation
- 1092 Quelle Place Pour Les Ingenieurs Dans Lindustrie Ana Cardoso de MatosDocument22 pages1092 Quelle Place Pour Les Ingenieurs Dans Lindustrie Ana Cardoso de MatostestPas encore d'évaluation
- 2nde Travail Sur La Competence Realiser Effectuer Des Calculs Cedric MARANGONIDocument30 pages2nde Travail Sur La Competence Realiser Effectuer Des Calculs Cedric MARANGONIIbrahima DiopPas encore d'évaluation
- Catalogue GTEO 2019Document29 pagesCatalogue GTEO 2019Cyril Thomas GinglingerPas encore d'évaluation
- Projet Tutoré Rihab AhlemDocument37 pagesProjet Tutoré Rihab AhlemGhileb RihabPas encore d'évaluation
- Design Et Différents BioréacteursDocument5 pagesDesign Et Différents BioréacteursAPas encore d'évaluation
- 057.063.x - MAN - FR - Braumeister 10L-20L-50L PDFDocument32 pages057.063.x - MAN - FR - Braumeister 10L-20L-50L PDFjaimes13Pas encore d'évaluation
- Essai de PliageDocument1 pageEssai de Pliageguillome14100% (1)
- Le Vrai Livre (Abbe Sinesius)Document6 pagesLe Vrai Livre (Abbe Sinesius)ubuntulinux1984Pas encore d'évaluation
- Déterminer Le Débit CDocument8 pagesDéterminer Le Débit Ckawter100% (1)
- HydrauliqueDocument81 pagesHydrauliqueadox100% (1)
- PSA Méthode Séssai MatériauxDocument22 pagesPSA Méthode Séssai MatériauxMiguel Queiros100% (1)
- ds2 3eme SC Exp 2010 PDFDocument4 pagesds2 3eme SC Exp 2010 PDFBarhoumi MouradPas encore d'évaluation
- Exe Rev Phys 3 Vib Chap 5Document9 pagesExe Rev Phys 3 Vib Chap 5ZakariaPas encore d'évaluation
- DESAGREGATIONDocument3 pagesDESAGREGATIONkhenguiPas encore d'évaluation
- Granulites Et Fusion PartielleDocument5 pagesGranulites Et Fusion PartiellejfmujmPas encore d'évaluation
- STATIQUEDocument3 pagesSTATIQUEFaustin KouassiPas encore d'évaluation
- SMPC s1 Série3 Thermochimie 2021Document11 pagesSMPC s1 Série3 Thermochimie 2021yassineredone4Pas encore d'évaluation
- 2nde A - APC - Solutions Aqueuses IoniquesDocument12 pages2nde A - APC - Solutions Aqueuses Ioniquesmassamba AwoussiPas encore d'évaluation
- Dosagedela GSTDocument3 pagesDosagedela GSTRubyPas encore d'évaluation
- CorrosionDocument10 pagesCorrosionLe Bacha BachaPas encore d'évaluation
- A Program For Solving Heat and Mass Transfer Problems On A PCDocument198 pagesA Program For Solving Heat and Mass Transfer Problems On A PCsaeidianPas encore d'évaluation
- Bilan ThermiqueDocument36 pagesBilan ThermiqueKhaledKouaissa100% (3)
- Transfert de MasseDocument15 pagesTransfert de MasseZakaria BstPas encore d'évaluation
- Opération Des Sept Esprits Des Planètes - Manuscrit de L'arsenalDocument10 pagesOpération Des Sept Esprits Des Planètes - Manuscrit de L'arsenalSpartakus FreeMann100% (3)
- TP Chroma PDFDocument4 pagesTP Chroma PDFaziza elhamzaoui.Pas encore d'évaluation
- Contrôle de Qualité Et Sources D'erreurs en Antibiogramme (MDocument5 pagesContrôle de Qualité Et Sources D'erreurs en Antibiogramme (MJ-Paul Déto100% (4)
- 2004 275 Mai Bouchonnet p.7Document8 pages2004 275 Mai Bouchonnet p.7Rami KettouchePas encore d'évaluation
- Guide Technique Aep 3mDocument48 pagesGuide Technique Aep 3mAziz Ait Amrane100% (1)
- Chimie AnalytiqueDocument41 pagesChimie AnalytiqueKhalil OukebdanePas encore d'évaluation