Académique Documents
Professionnel Documents
Culture Documents
Chapitre V
Transféré par
Khouloud TriaCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chapitre V
Transféré par
Khouloud TriaDroits d'auteur :
Formats disponibles
1
اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
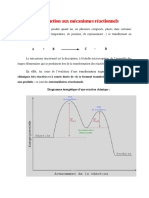
Chapitre V : Mécanismes réactionnels
I-Introduction : écriture d’une réaction en chimie organique, effet du solvant,
intermédiaires réactionnels, types de réactifs.
II- Substitution nucléophile d’ordre 1 (SN1)
III-Elimination d’ordre 1 (E1)
IV-Substitution nucléophile d’ordre 2 (SN2)
V-Elimination d’ordre 2 (E2)
VI-Substitution radicalaire (SR)
VII-Substitution électrophile (SE)
VIII-Addition électrophile (AE)
IX-Addition nucléophile (AN)
X-Addition radicalaire (AR)
Un mécanisme réactionnel correspond à l'enchaînement d'étapes, de réactions élémentaires,
par lequel un changement chimique peut avoir lieu.
IV.1. Introduction : écriture d’une réaction en chimie organique, effet du
solvant, intermédiaires réactionnels, types de réactifs
Soit la réaction suivante :
Selon cette représentation de la réaction bilan, on peut facilement noter que la réaction
passe par deux étapes :
Une rupture (scission) de la liaison A–B
suivie de la formation de la nouvelle liaison A–C
Le mécanisme réactionnel de la réaction mis en jeu une étude mécanistique complète qui
fait appel à une description d’un certain nombre d’aspect : électronique, cinétique,
énergétique et stéréochimique.
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 1
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
1-1 Aspect électronique
Au cours de la rupture et de la formation d’une liaison, une liaison covalente peut se
rompre de deux façons soit :
une rupture symétrique (homolytique)
Exemple : alcane, Cl2, O2, H2,….
une rupture disymétrique (hétérolytique)
Exemple : CH3–O–Na CH3O- + Na+
Si A–B est une molécule organique, alors A+ est appelé carbocation et B- est appelé
carbanion
Quant à la formation de la liaison, elle peut être obtenue soit par :
une combinaison des radicaux en mettant les électrons célibataires en commun.
Exemple :
une combinaison entre nucléophile et électrophile, à retenir qu’un nucléophile
attaque toujours un électrophile.
Exemple:
1-2 Aspect cinétique
1-3 Aspect énergitique
1-4 Aspect stéréochimique.
Remarque : Pour ces trois aspects, nous sommes limités par le temps.
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 2
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
2. Stabilité des intermédiaires réactionnels :
les radicaux sont d’autant plus stables, c'est-à-dire plus grande sera leur durée de
vie, lorsqu’ils sont substitués.
les carbocations (hybridation sp2, structure plane) étant pauvre en électrons, sont
plus stables avec la présence de substituants à effet inductif +I (donneurs
d’électrons). De même avec la présence de groupement à effet mésomère +M.
les carbanions (hybridation sp3, structure pyramidale) étant riches en électrons, sont
d’autant moins stables lorsqu’ils sont porteurs de substituants à effet inductif
électrodonneur +I.
3- Principales réactions en chimie organique
Avant toute chose il est important de souligner qu’une réaction chimique peut être facilitée
par l’usage des solvants. Ces derniers sont répartis en trois classes en fonction de la nature
des interactions qu’ils peuvent donner avec le soluté :
Solvants protiques : ils sont donneurs de liaisons hydrogène (ex : H2O, CH3OH,
CH3CO2H,…)
Solvants polaires aprotiques : ils sont juste accepteurs de liaisons hydrogène (ex :
acétone (CH3COCH3), chloroforme (CCl3),….)
Solvants apolaires : pas de moments dipolaires permanents (ou très faibles) (ex : hexane,
cyclohexane, benzène,…).
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 3
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
Sous certaines conditions de travail, une classification des réactions organiques à été
donnée en quatre grandes catégories : l’addition, l’élimination, la substitution et la
transposition.
3-1 Réaction d’addition (A)
Dans ce type de réaction on a l’addition d’un réactif sur une molécule présentant des
insaturations. On distingue deux sortes de réactions d’additions : une addition électrophile
(AE) et une addition nucléophile (AN).
a) Addition électrophile (AE)
Elle est généralement rencontrée lors d’une addition classique en milieu ionique d’une
entité électrophile (E) sur une molécule à doubles ou triples liaisons (C=C ou C≡C) qui
jouent le rôle de nucléophiles. La réaction débute par l’attaque électrophile (d’où le nom
AE) suivie d’une compensation nucléophile.
Dans le cas des composés éthyléniques ou acétyléniques simples, la partie électrophile du
réactif se fixe sur le carbone de la liaison multiple le moins substitué. On dit que la réaction
est régiosélective et qu’elle obéit à la règle de MARKOVNIKOV.
Exemple : addition de HBr sur le 2-méthylbutène
le réactif HBr présente l’entité électrophile H+ et l’entité nucléophile Br-
la réaction débute par l’attaque électrophile de H+ et la formation d’un carbocation plan
le plus stable qui suit la règle de Markovnikov (carbocation le plus substitué).
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 4
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
suivie par une compensation nucléophile de Br -
Il est important de noter, que selon les conditions réactionnelles utilisées on peut assister à
une addition radicalaire de façon anti-Markovnikov dite effet Karash.
Exemple : addition de HBr sur le 3-chloropropène en présence du peroxyde. Le mécanisme
se déroule en trois étapes :
la première étape est l’étape d’initiation lors de laquelle les radicaux libres se forment.
Suivie de l’étape de propagation. Cette étape débute par l’attaque du radical Br ● sur la
double liaison qui suit la règle anti-Markovnikov. De sorte que l’attaque de Br● s’effectue
préférentiellement sur le carbone le moins substitué (porte le plus d’hydrogène) afin que le
radical libre soit porté sur le carbone le plus substitué.
En suite, l’hydrogène portant un radical va former une liaison avec le carbone lui même
portant un radical. Ainsi, le produit majoritaire est celui dans lequel le H se fixe sur le
carbone central.
En dernière, l’étape de terminaison qui consiste à la recombinaison des radicaux.
Lorsque tout le brome ou tous les alcènes sont consommés la réaction s’arrête (réaction en
chaine).
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 5
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
b) Addition nucléophile (AN)
Ce type d’addition est le plus souvent rencontré dans le cas de l’addition sur les carbones
oxygénés (cétone, aldéhyde, acide, ester,…) et aussi sur les imines (C=N) ou les nitriles
(C N). Cette réaction commence par l’addition de la partie nucléophile (d’où le nom
AN) suivie de la compensation électrophile (le plus souvent H+).
Exemple : addition de H2O sur le butan-2-one
la molécule H2O présente l’entité nucléophile OH- et l’entité électrophile H+
la réaction débute par l’attaque nucléophile de OH-
suivie par une compensation électrophile de H+
3-2 Réaction d’élimination (E)
C’est la réaction inverse de l’addition. Il s’agit le plus souvent de l’élimination d’une
molécule HX du squelette carboné au moyen d’une base (ou nucléophile) pour obtenir un
alcène. On distingue une élimination d’ordre 1 notée E1 (étape cinétiquement
monomoléculaire) et d’ordre 2 notée E2 (étape cinétiquement bimoléculaire).
Indépendamment du mécanisme, le schéma général est le suivant :
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 6
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
a) Elimination d’ordre 1 (E1)
Les réactions E1 s’effectue en deux étapes, la première lente (étape limitante = étape
déterminante de la vitesse) qui consiste à la formation d’un carbocation par rupture
hétérolytique de la liaison C–X suivie d’une étape rapide au cours de laquelle la base
attaque le proton porté par le carbone voisin (position β) du carbocation formé, et ainsi
l’alcène est formé. Il est important de retenir, que lorsque plusieurs alcènes peuvent être
formés par élimination, l’alcène majoritaire donc le plus stable est celui le plus substitué.
Le mécanisme réaction E1 obéit ainsi à la règle établie par SAYTZEFF
Exemple : déshydrobromation du 3-bromo-3,4-diméthylhexane
la réaction commence par la formation du carbocation au sein du substrat par le
départ de Br- (nucléophile), une étape lente qui favorise la formation du carbocation
le plus stable.
suivie par le départ du proton H+ en position β du carbocation sous l’action de la
base B- (ou du nucléophile) (dans cet exemple les positions β sont en (1), (2) et (3)).
b) Elimination d’ordre 2 (E2)
La réaction d’élimination E2 est obtenue quant la stabilité du carbocation est faible
(présence d’un carbone peu substitué : primaire plutôt que secondaire ou tertiaire).
Dans cette réaction le nucléophile agit comme une base, il arrache un proton situé en
position β du nucléofuge avec lequel il forme une liaison covalente. Le mécanisme
réactionnel E2 s’effectue en une seule étape : attaque du nucléophile (base) et départ du
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 7
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
nucléofuge concerté c'est-à-dire qu’ils se produisent simultanément. La règle de
SAYTSEFF régit également le mécanisme E2.
Exemple : déshydrobromation du 2-bromo-3-méthyl-2-phenylpentane
3-3 Réaction de substitution (S)
Il s’agit d’une réaction dans laquelle un atome ou groupe d’atomes d’un composé chimique
est remplacé par un autre atome ou groupe d’atomes. La réaction de substitution se classe
en premier lieu selon la nature du substituant qui attaque le substrat, et se qualifie selon
cette nature soit de substitution nucléophile (SN), de substitution électrophile (SE) et
même de substitution radicalaire (SR).
a) Substitution nucléophile (SN)
Dans cette réaction le substituant, un nucléophile (atome ou molécule riche en électrons)
est attiré par des composés en déficit électroniques (alcane, composé aromatique
substitué,...). D’un point de vue cinétique la substitution nucléophile peut être d’ordre 1
(SN1) ou d’ordre 2 (SN2).
a-1) Substitution nucléophile d’ordre 1 (SN1)
Le mécanisme de cette réaction SN1, tout comme celui de l’élimination E1, se déroule en
deux étapes : la première lente, cinétiquement limitante, étant le départ du groupe partant et
la seconde est l’attaque du substituant nucléophile sur le reste du substrat (le carbocation).
Généralement, ce type de réaction est rencontré lorsque le substrat présente un carbone
tertiaire en application de la règle de SAYTSEFF.
Exemple : hydrolyse du (R)-1-iodo-1-méthyl-1-phenylpropane
1ére étape essentielle, cinétiquement lente, monomélculaire, consiste à la formation
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 8
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
du carbocation le plus stable par la rupture hétérolytique de la liaison C–I.
suivie de la deuxième étape, très rapide, qui se résume à l’attaque du nucléophile
(ici H2O) sur le carbocation. Il faut remarquer, que l’attaque du nucléophile peut
s’effectuer de part et d’autre du plan du carbocation trigonal. Ceci engendre, dans le cas
d’un carbone asymétrique de départ, la formation d’énantiomère (mélange racémique). La
réaction SN1 est donc non stéréospécifique.
a-2) Substitution nucléophile d’ordre 2 (SN2)
Ce type de réaction, identique au mécanisme de la réaction E2, est fréquemment rencontré
lorsque le carbone réactionnel est le moins substitué à savoir carbone primaire plutôt que
secondaire ou tertiaire. La réaction se déroule par l’attaque du nucléophile et le départ
nucléofuge synchroné Il faut retenir que pour des raisons stérique, le nucléophile opère par
une attaque arrière par rapport au nucléofuge, ce qui entraine une inversion de
configuration dite inversion de WALDEN (inversion comparable à celle du retournement
de parapluie). De plus, une réaction SN2 est d’autant plus facile que le nucléophile est plus
fort et que le nucléofuge est plus faible et plus stable sous forme libre.
Exemple : méthanolyse du (R)-2-chlorobutane
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 9
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
Le tableau ci-après résume, en fonction du substrat et du nucléophile, l’orientation
privilégiée du mécanisme réactionnel.
Récapitulatif
b) Substitution électrophile aromatique (SEa)
La substitution électrophile est une réaction organique dans laquelle une entité électrophile
remplace un autre groupe, le plus souvent un atome d’hydrogène, porté sur un composé
riche en électrons en particulier les composés aromatiques. Ainsi, la principale réaction de
ce type est la substitution électrophile aromatique noté SEa. Dans ces composés
aromatiques, la présence des électrons π confère au cycle aromatique un caractère
nucléophile qui favorise une substitution d’un atome sous l’action d’un électrophile.
Il faut retenir que la réaction d’addition est défavorisée sur composé aromatique car le
produit d’addition détruit son aromaticité. De plus, l’élimination d’un proton qui permet de
rétablir l’aromaticité est plus rapide devant l’addition de l’entité nucléophile sur le
carbocation.
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 10
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
Le mécanisme réactionnel de la SEa se déroule en deux étapes : la première étape est lente
(cinétiquement déterminante), ou l’état de transition est appelé complexe de Wheland, et la
seconde étape est rapide. Lors de cette seconde étape le cycle regagne sont aromaticité
Divers réactions de substitutions électrophiles aromatiques (SEa) sont rencontrées et ne
différent l’une de l’autre qu’en fonction de la nature de l’électrophile. Le schéma donné ci-
dessous rassemble les principales réactions de la SEa.
Les différentes réactions de substitutions électrophiles aromatiques
b-1) Halogénation
Pour réaliser cette réaction, il est nécessaire de rajouter dans le milieu réactionnel un acide
de Lewis (AlCl3, FeCl3,…) dans le but de rendre l’halogène plus électrophile par
polarisation de la liaison halogène-halogène
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 11
1 اﻟﻜﯿﻤﯿﺎء اﻟﻌﻀﻮﯾﺔ اﻟﻔﺼﻞ اﻟﺨﺎﻣﺲ
Exemple : Chloration du benzène en présence du catalyseur FeCl3 (acide de Lewis)
Dans un premier temps il faut former le réactif électrophile Cl+ :
Dans un second temps, on décrit le mécanisme de la SEa :
- 1ére étape lente : formation de l’intermédiaire de Wheland
- 2nd étape rapide : élimination rapide d’un proton avec formation du produit
En dernier, régénération du catalyseur :
اﻟﻤﺼﺪر׃ ﻣﻨﻘﻮل
Université du 20 Aout 1955-SKIKDA - 2020/2021- Licence 2 - Z.HOUIENE 12
Vous aimerez peut-être aussi
- Photosynthèse: Les Grands Articles d'UniversalisD'EverandPhotosynthèse: Les Grands Articles d'UniversalisPas encore d'évaluation
- Chapitre1 Chimie Organique 2Document8 pagesChapitre1 Chimie Organique 2jean luc abdias konanPas encore d'évaluation
- Cours7 Les Reactions Chimie Organique Part4Document39 pagesCours7 Les Reactions Chimie Organique Part4HamzaPas encore d'évaluation
- UE1-chimie-7-Chaîne HydrocarbonnéesDocument26 pagesUE1-chimie-7-Chaîne Hydrocarbonnéessun-nee-chan9Pas encore d'évaluation
- 5.4 Addition (A)Document12 pages5.4 Addition (A)taki djPas encore d'évaluation
- Cours Réactions HYDROCARBURES ALIPHATIQUES LCE2Document41 pagesCours Réactions HYDROCARBURES ALIPHATIQUES LCE2Wissal ChammakhiPas encore d'évaluation
- 5 Substitution Electrophile 2Document11 pages5 Substitution Electrophile 2Bibi BibaPas encore d'évaluation
- Cours de Chimie Organique Descriptive-BCGS4-C245Document95 pagesCours de Chimie Organique Descriptive-BCGS4-C245Najimou Alade Tidjani100% (2)
- Gpis2chorga Part 2etud 2122Document35 pagesGpis2chorga Part 2etud 2122belkacemPas encore d'évaluation
- Effets Électroniques Et Mécanismes RéactionnelsDocument11 pagesEffets Électroniques Et Mécanismes Réactionnelsdaniel.bignoumbaPas encore d'évaluation
- Chim 306 - Notes de CoursDocument43 pagesChim 306 - Notes de Coursnatural recipePas encore d'évaluation
- Mécanisme Réactionnels - S.BOUSSAHA VPDocument23 pagesMécanisme Réactionnels - S.BOUSSAHA VPFeryal BhPas encore d'évaluation
- REACTIONS D'addition ÉléctrophileDocument7 pagesREACTIONS D'addition Éléctrophilewarda MaPas encore d'évaluation
- Chapitre5 1Document9 pagesChapitre5 1Karim Radi100% (1)
- Additions Électrophiles Sur La Double-Liaison C C (1710)Document6 pagesAdditions Électrophiles Sur La Double-Liaison C C (1710)AxellePas encore d'évaluation
- 1 Intermediaires Reactionnels 1Document12 pages1 Intermediaires Reactionnels 1Rachid Guend100% (1)
- Mecanismes PDFDocument11 pagesMecanismes PDFAbdoulaye Diallo0% (1)
- UE1 Chimie 8 Fonctions MonovalentesDocument36 pagesUE1 Chimie 8 Fonctions Monovalentessun-nee-chan9Pas encore d'évaluation
- Cours Chimie Organique 2 (S4) TC BCG-convertiDocument126 pagesCours Chimie Organique 2 (S4) TC BCG-convertiRim ElmoutaoukkilPas encore d'évaluation
- UE1 - Chimie Organique - 24/08/2017Document64 pagesUE1 - Chimie Organique - 24/08/2017John BasicPas encore d'évaluation
- Mecanismes Des ReactionsDocument5 pagesMecanismes Des ReactionsRock In BandPas encore d'évaluation
- Cours Chimie Organique 2Document18 pagesCours Chimie Organique 2nail mcaPas encore d'évaluation
- Réactions de Substitution ÉlectrophileDocument5 pagesRéactions de Substitution Électrophilewarda MaPas encore d'évaluation
- Chapitres 3 4 Et 5Document57 pagesChapitres 3 4 Et 5agbegnidomawoukoPas encore d'évaluation
- Cours4 Les Reactions Chimie Organique Part1Document29 pagesCours4 Les Reactions Chimie Organique Part1Kalosoiretrotchgmail.com KalosoPas encore d'évaluation
- Chimie Organique Cours Sur Les AlcènesDocument25 pagesChimie Organique Cours Sur Les AlcènesKone KouweltonPas encore d'évaluation
- Fom-Mr L2 PCDocument56 pagesFom-Mr L2 PCBaroka julien YANEPas encore d'évaluation
- Alcenès Planchage FinalDocument22 pagesAlcenès Planchage FinalRima LettreuchPas encore d'évaluation
- Cours de Chimie OrganiqueDocument114 pagesCours de Chimie Organiqueosefresistance100% (1)
- Cours Chimie Organique 3Document8 pagesCours Chimie Organique 3raly13Pas encore d'évaluation
- Cours de Chimie Orga DESC I-1Document45 pagesCours de Chimie Orga DESC I-1emmanuel cerda adonaïPas encore d'évaluation
- 40-105 Mécanismes RéactionnelsDocument8 pages40-105 Mécanismes RéactionnelsKhalil LasferPas encore d'évaluation
- Les AlcèneDocument11 pagesLes AlcèneŚặł Ặĥ ßŏukĥíặřPas encore d'évaluation
- Chapitre I-ÉlectrochimieDocument9 pagesChapitre I-Électrochimieعبد الرحيم بشيرPas encore d'évaluation
- Alcene 1Document13 pagesAlcene 1williammerlindonfackPas encore d'évaluation
- Cours Electrochimie Appliquée M1 CHIMIE ANALYTIQUE - SMDocument18 pagesCours Electrochimie Appliquée M1 CHIMIE ANALYTIQUE - SMSamar ZedamPas encore d'évaluation
- Mecanisme Reactionnel SN1 SN2 OuziDocument33 pagesMecanisme Reactionnel SN1 SN2 Ouzisafae ziyatiPas encore d'évaluation
- Chapitre V - Introduction RéactivitéDocument63 pagesChapitre V - Introduction Réactivitéالدعم الجامعيPas encore d'évaluation
- Hydrocarbures Insatures MedDocument12 pagesHydrocarbures Insatures MedousmaneditbakoresyllaPas encore d'évaluation
- Belhammou SeifeddineDocument35 pagesBelhammou SeifeddineAnissa Villa100% (3)
- Cinetique Chapitre2Document26 pagesCinetique Chapitre2sii hemPas encore d'évaluation
- TP Electrochimie 11Document12 pagesTP Electrochimie 11charte nyembaPas encore d'évaluation
- Chimie OrganiqueDocument16 pagesChimie OrganiqueNour Allah tabibPas encore d'évaluation
- Chapitre I.2 Electrophysiologie 2022Document24 pagesChapitre I.2 Electrophysiologie 2022Adam ChehouaniPas encore d'évaluation
- chimie_sn1 sn2Document11 pageschimie_sn1 sn2meyemarion99Pas encore d'évaluation
- Cours ElectrochimieDocument10 pagesCours ElectrochimieSousou YosraPas encore d'évaluation
- Chap5 AromatiquesDocument6 pagesChap5 AromatiquesChimie ChimiePas encore d'évaluation
- Orbitales Moléculaires Frontières en Chimie OrganiqueDocument33 pagesOrbitales Moléculaires Frontières en Chimie OrganiqueMathieu Péborde80% (5)
- Chimie 8 - Chimie OrganiqueDocument14 pagesChimie 8 - Chimie OrganiqueNathan CohenPas encore d'évaluation
- Mecanismes Reactionnels Cours LeconteDocument16 pagesMecanismes Reactionnels Cours LeconteNajimou Alade Tidjani100% (1)
- Chapitre IVDocument11 pagesChapitre IVbousnane3bousnanePas encore d'évaluation
- Orbitales Et Réactivité ChimiqueDocument17 pagesOrbitales Et Réactivité ChimiqueCharles CostesPas encore d'évaluation
- MP CHIMIE CCP 1 2005.extrait PDFDocument4 pagesMP CHIMIE CCP 1 2005.extrait PDFkmeriemPas encore d'évaluation
- Chapitre 4 Cinétiques Des Réactions ÉlectrochimiquesDocument21 pagesChapitre 4 Cinétiques Des Réactions ÉlectrochimiquesridhaPas encore d'évaluation
- Cours COII - SN PDFDocument65 pagesCours COII - SN PDFYoussef FihriPas encore d'évaluation
- Conversion Electrochimique FDocument34 pagesConversion Electrochimique FMichael AllessiPas encore d'évaluation
- ChimieDocument9 pagesChimiebchaimaa747Pas encore d'évaluation
- Introduction à la physique de la matièreD'EverandIntroduction à la physique de la matièreÉvaluation : 3 sur 5 étoiles3/5 (1)
- Fermions: Les Grands Articles d'UniversalisD'EverandFermions: Les Grands Articles d'UniversalisPas encore d'évaluation
- Liste D'affectations Médecine Générale-Stages Ambulatoires Été 2022Document58 pagesListe D'affectations Médecine Générale-Stages Ambulatoires Été 2022Pascal SambrePas encore d'évaluation
- TD Substitution Nucleophile Corrige 4Document6 pagesTD Substitution Nucleophile Corrige 4Daniel Nd100% (1)
- Chapitre 5 c245 Chimie Org2 Les Composes AromatiquesDocument21 pagesChapitre 5 c245 Chimie Org2 Les Composes AromatiquesAbderrahmane BoughabaPas encore d'évaluation
- Cours Série Aromatique SEA 1Document66 pagesCours Série Aromatique SEA 1Sahouin Claude MedardPas encore d'évaluation
- 2009 Lyon Walchshofer Carbonyles CoursDocument30 pages2009 Lyon Walchshofer Carbonyles CoursPride Algerian ツPas encore d'évaluation
- Chapitre 15-Substitutions Nucleophiles Et EliminationsDocument14 pagesChapitre 15-Substitutions Nucleophiles Et EliminationsdarmalPas encore d'évaluation
- TD Intermediaires Reactionnels 2 SolutionDocument2 pagesTD Intermediaires Reactionnels 2 SolutionIssa SINDEPas encore d'évaluation
- Chapitre VDocument12 pagesChapitre VKhouloud TriaPas encore d'évaluation
- Substitution ElectrophileDocument36 pagesSubstitution Electrophileadelino13Pas encore d'évaluation
- Chimie Organique MécanismesDocument17 pagesChimie Organique MécanismesMLAN HesnaPas encore d'évaluation
- Chapitre 7 Chimie OrganiqueDocument46 pagesChapitre 7 Chimie OrganiqueleloPas encore d'évaluation
- TD Substitution Nucleophile Corrige 3Document5 pagesTD Substitution Nucleophile Corrige 3زيد بخليفةPas encore d'évaluation
- Chimie Organique Fonctionnelle TD Corr 08Document3 pagesChimie Organique Fonctionnelle TD Corr 08Kouadio Franck Tomasino KouamePas encore d'évaluation
- TD Substitution Electrophile 512goodprepaDocument1 pageTD Substitution Electrophile 512goodprepaZabeirou Aminou Kaptina100% (1)
- Boumendjel Ahcene p06Document36 pagesBoumendjel Ahcene p06Chimiste ChimistePas encore d'évaluation
- Synthese Chimie OrganiqueDocument13 pagesSynthese Chimie Organiqueelpis100% (2)
- TD Substitution Nucleophile 4Document4 pagesTD Substitution Nucleophile 4ANONYME179Pas encore d'évaluation
- TD Substitution NucleophileDocument3 pagesTD Substitution NucleophileJohns AtsacwounPas encore d'évaluation
- Exercices 2Document2 pagesExercices 2SARAHPas encore d'évaluation
- Corrige TD1Document7 pagesCorrige TD1Mariam Ben AbdelouahabPas encore d'évaluation
- Réactions Et Mécanismes PDFDocument44 pagesRéactions Et Mécanismes PDFfatima ArabPas encore d'évaluation