Académique Documents
Professionnel Documents
Culture Documents
Propiedades
Transféré par
Wendy Julieth LosadaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Propiedades
Transféré par
Wendy Julieth LosadaDroits d'auteur :
Formats disponibles
PROPIEDADES FUNCIONALES DE LAS PROTENAS Las propiedades funcionales de las protenas se definen como cualquier propiedad fisicoqumica de los
polmeros que afecta y modifica algunas caractersticas de un alimento y que contribuyen a la calidad final del producto Las propiedades funcionales dependen de factores intrnsecos propios de las molculas y de factores extrnsecos del medio que los rodea y que se pueden o no modificar (pH, temperatura, Aw, y otros.) Las propiedades funcionales de las protenas pueden ser clasificadas en tres grupos segn el tipo de interaccin que predominen:
PROPIEDADES DE HIDRATACIN DEPENDIENTES DE LAS INTERACCIONES PROTENA AGUA: - Solubilidad La conformacin de una protena en solucin depende fundamentalmente de sus interacciones con el agua. El agua es el solvente biolgico por excelencia. En solucin acuosa, los residuos hidrofbicos de las protenas se acumulan en el interior de la estructura, mientras que en la superficie aparecen diversos grupos con carga elctrica, en funcin del pH del medio. En torno a los grupos cargados, los dipolos del agua se orientan conforme a la carga elctrica de cada grupo, de tal manera que la protena presenta una capa de solvatacin formada por el agua de hidratacin, que es
el agua retenida por las cargas elctricas de la superficie de las protenas, donde interaccionan con el agua mediante puentes de hidrgeno. La solubilidad depende fundamentalmente de: - pH: Al variarlo se modifica el estado de ionizacin y la carga neta de la molcula proteica. Esta variacin trae como consecuencia una alteracin de las fuerzas atractivas y repulsivas entre las cadenas laterales de los aminocidos de las protenas. Esta prdida de fuerzas conduce a una prdida de la capacidad de asociarse con las molculas de agua. - Temperatura: Como regla general, la solubilidad de las protenas aumenta, cuando la temperatura se eleva de 0 a 40 50C. Por encima de 40 50C el movimiento de las molculas es suficiente para romper los enlaces implicados en la estabilizacin de las estructuras secundaria y terciaria. Esta desnaturalizacin va seguida, frecuentemente, de una agregacin y la solubilidad de la protena desnaturalizada llega ser inferior a la de la protena natural. - Influencia de la fuerza inica: Los iones con sales neutras, con molaridades comprendidas entre 0.5 y 1.0 M, pueden aumentar la solubilidad de las protenas, efecto que se conoce como Salting in o salazn, los iones de las sales reaccionan con las cargas de las protenas y rebajan la atraccin electrosttica entre las cargas opuestas de grupos prximos de la misma protena. Si la concentracin de las sales neutras es superior a 1.0 M, la solubilidad de las protenas decrece y puede conducir a una precipitacin. Este efecto se conoce como Saltin out, desalado; este efecto resulta de la competencia entre la protena y los iones salinos por las molculas de agua necesarias para su solvatacion respectiva. Con una fuerte concentracin salina, no hay bastantes molculas de agua disponibles para la solvatacion de la protena porque la mayor parte del agua esta fuertemente ligada a las sales. En estas condiciones, las interacciones protena protena resultan mas importantes que las interacciones protena agua y esto puede conducir a una agregacin seguida de una precipitacin de las molculas proteicas. - Capacidad de absorcin de agua y retencin de agua. Cuando la protena absorbe agua liquida, el sistema alcanza un equilibrio. Es una propiedad muy importante en el estudio de protenas crnicas y en los procesos de panadera porque afecta directamente la textura y viscosidad del producto. El pH afecta la capacidad de absorcin de agua (CAA) de una protena. Cerca al punto isoelectrico (pI), la CAA disminuye y la velocidad de absorcin. Industrialmente es importante tener en cuenta este punto, ya que primero se debe hacer los procesos de hidratacin y luego agregar el azcar o las sales de formulacin.
PROPIEDADES DEPENDIENTES DE LAS INTERACCIONES PROTEINA PROTEINA. - Gelificacin La protena gracias al calor se convierten en un excelente agente gelificante. Un gel es un material formado por una red slida tridimensional continua que embebe agua (solvente) y los otros componentes y los inmoviliza. Durante esta especie de polimerizacin de las protenas en la red tridimensional el lquido viscoso se transforma en una matriz viscoelstica. Los geles exhiben propiedades microestructurales y mecnicas diversas: pueden ser muy blandos (slido soft) que se rompen y fluyen fcilmente por aplicacin de fuerzas pequeas y los geles strong. La gelificacin se ve influida, entre otras circunstancias, por el calentamiento, pH, la fuerza inica y la concentracin proteica. En la mayora de los casos es indispensable el tratamiento trmico para conseguir la gelificacin el calentamiento desnaturaliza y despliega las molculas proteicas y facilita el intercambio disulfuro, formndose as nuevos enlaces cruzados de este tipo. Algunas protenas no presentan poder gelificante, pero pueden cogelificar con aquellas que si lo hacen, por ejemplo, con la gelatina o la casena. El agua presente en el gel es, retenida fsicamente, lo cual significa que no est unida fuertemente a la molcula proteica y por lo tanto puede ser eliminada fcilmente del gel, aunque no fluye libremente de l. El poder o capacidad gelificante de las protenas es una de las propiedades funcionales que determinan su empleo en la preparacin de variados alimentos. Las protenas con capacidad gelificante son usadas para mejorar la absorcin de agua, la adhesin de partculas y contribuyen a estabilizar las emulsiones y espumas.
PROPIEDADES DE SUPERFICIE - Propiedades emulsionantes Son dispersiones en dos lquidos no miscibles, de los cuales uno se encuentra bajo la forma de pequeas gotitas dispersas y el otro bajo la forma de una fase continua dispersante:
En la formacin de espumas y emulsiones el agente de interfase disminuye la tensin que se establece entre lquidos no miscibles. Es necesario que este agente tenga porciones hidrofbicos e hidroflicas (anfiflica) en su estructura. Los agentes ms utilizados son las protenas, los monoglicridos y steres de cidos grasos. Numerosos productos alimenticios son emulsiones (leche, cremas, helados, mantequilla, queso fundido, mayonesa, carnes finamente picadas para salchichas, etc.). Donde los constituyentes proteicos tienen, frecuentemente, un papel preponderante en la estabilizacin de estos sistemas coloidales. Las protenas se adsorben en la interfase entre las gotitas de aceite disperso y la fase acuosa continua y aportan propiedades fsicas y reolgicas (espesamiento, viscosidad, elasticidad- rigidez) que determinan la resistencia a las gotitas a la coalescencia. Las emulsiones son inestables y se separan en dos fases como resultado de:
Para incrementar la estabilidad de las emulsiones se emplean agentes emulsionantes como las protenas que debido a su carcter anfiflico pueden formar pelculas sobre las gotas de aceite. Las protenas que presentan propiedades emulsionantes se utilizan para estabilizar emulsiones de aceite en agua.
- Propiedades espumantes
Las espumas son sistemas bifsicos que involucra una interaccin agua-aire. Al incorporarse el aire por batido, agitacin manual o inyeccin de aire se crea una interfase debido a la no disminucin de los componentes de la espuma.
En la mayora de las espumas alimentarias, la fase gaseosa es el aire y la fase lquida es una suspensin acuosa que contiene la protena. Las espumas o batidos pueden obtenerse por batido o agitacin de una solucin acuosa de protena en presencia de una gran masa gaseosa. En la mayora de los casos, para los productos alimenticios se prefiere el batido para hacer espumas. Una diferencia significativa entre las emulsiones y las espumas est en el hecho que en stas la fraccin de volumen ocupada por la fase dispersa (gas), vara en una escala mucho mayor que con las emulsiones y son ms inestables porque contienen una mayor superficie en la interfase.
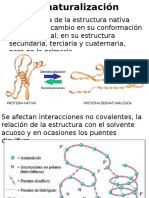
Desnaturalizacin de protenas La desnaturalizacin proteica puede definirse como cualquier modificaron de su conformacin (a nivel de su estructura secundaria, terciaria y cuaternaria) que no vaya acompaada la ruptura de los enlaces peptidicos implicados en la estructura primaria. Los efectos de la naturalizacin no es solamente la prdida de estructuras, de propiedades funcionales sino tambin:
- La alteracin de la capacidad de la alteracin de agua - La perdida de actividad biolgica - El aumento de la sensibilidad al ataque de las proteasas, debido al desbloqueo de enlaces peptdicos correspondientes a los sitios de accin especificas de las proteasas. - Aumento de la viscosidad. Los agentes que causan desnaturalizacin se clasifican: - Agentes Fsicos: Calor, fro, tratamiento mecnico, presin hidrosttica, irradiacin. - Agentes Qumicos: cidos y bases, metales, disolventes orgnicos y soluciones acuosas de compuestos orgnicos.
Vous aimerez peut-être aussi
- La Vida Útil de los Alimentos y sus Principales Reacciones: ¿Qué pasa en los alimentos con el tiempo?D'EverandLa Vida Útil de los Alimentos y sus Principales Reacciones: ¿Qué pasa en los alimentos con el tiempo?Évaluation : 2 sur 5 étoiles2/5 (1)
- Propiedades Funcionales de Las ProteínasDocument7 pagesPropiedades Funcionales de Las ProteínasEdgar RomeroPas encore d'évaluation
- GELESDocument18 pagesGELESAmayrani Figueroa Diaz100% (2)
- Propiedades FuncionalesDocument48 pagesPropiedades FuncionalesGise Ochandorena100% (1)
- Propiedades Funcionales de Las Proteinas 2016Document67 pagesPropiedades Funcionales de Las Proteinas 2016yoselin100% (1)
- EQUIPO 7 - Propiedades Funcionales de Las ProteinasDocument33 pagesEQUIPO 7 - Propiedades Funcionales de Las ProteinasFidel Bladiomar LópezPas encore d'évaluation
- Clase 7 y 8 Propiedades FuncionalesDocument81 pagesClase 7 y 8 Propiedades FuncionalesAbraham YehezkelPas encore d'évaluation
- Unidad 2. Modificación Enzimática de Las Propiedades Funcionales y Nutricionales de Las ProteinasDocument36 pagesUnidad 2. Modificación Enzimática de Las Propiedades Funcionales y Nutricionales de Las ProteinasCesar Carrillo MayPas encore d'évaluation
- Desnaturalización de Las ProteinasDocument25 pagesDesnaturalización de Las ProteinasLuis Sosa100% (1)
- Propiedades Funcionales de Las ProteinasDocument14 pagesPropiedades Funcionales de Las ProteinasVictor Santa Cruz QuirozPas encore d'évaluation
- Propiedades Funcionale de Las Proteinas PDFDocument7 pagesPropiedades Funcionale de Las Proteinas PDFBrian Guillermo Bustamante86% (7)
- Planilha de Cálculo de Trocador de Calor 1Document34 pagesPlanilha de Cálculo de Trocador de Calor 1João VictorPas encore d'évaluation
- INTRODUCCIÓN ProteínasDocument5 pagesINTRODUCCIÓN ProteínasjatuesPas encore d'évaluation
- 701 Rodriguez 2021 11 29 Proteínas IIDocument10 pages701 Rodriguez 2021 11 29 Proteínas IIMariel RodriguezPas encore d'évaluation
- Macro NutrientesDocument52 pagesMacro NutrientesRodrigo Luis Rodriguez AlvinoPas encore d'évaluation
- Tema 4-ProteinasDocument8 pagesTema 4-ProteinasAna Angulo VillaPas encore d'évaluation
- Propiedades Funcionales de Las Proteínas en La SojaDocument21 pagesPropiedades Funcionales de Las Proteínas en La SojaGisela RodríguezPas encore d'évaluation
- Conversion QuimicaDocument23 pagesConversion Quimicaisel galuePas encore d'évaluation
- Proteinas 2Document75 pagesProteinas 2Juan CamiloPas encore d'évaluation
- Propiedades Funcionales de Las Proteías - PrecipitaciónDocument3 pagesPropiedades Funcionales de Las Proteías - PrecipitaciónJOSE LUIS AGUIRREPas encore d'évaluation
- U1l4 TD Grupo 13-AprobadoDocument9 pagesU1l4 TD Grupo 13-AprobadoTiniHryshchenkoPas encore d'évaluation
- Alteraciones o Modificaciones en Las Propiedades FuncionalesDocument13 pagesAlteraciones o Modificaciones en Las Propiedades FuncionalesDiana Laura Trasviña GonzalezPas encore d'évaluation
- Gelificacion de ProteinasDocument4 pagesGelificacion de ProteinasIsrael Paez Sanchez100% (2)
- Seminario Propiedades de HidratacionDocument8 pagesSeminario Propiedades de HidratacionNatalia Carabajal LangePas encore d'évaluation
- Proteínas en Los AlimentosDocument7 pagesProteínas en Los Alimentosdiego franco alvaPas encore d'évaluation
- Propiedades Funcionales de Las ProteínasDocument5 pagesPropiedades Funcionales de Las ProteínasJesus Antonio Verdugo ChavezPas encore d'évaluation
- ProteinasDocument16 pagesProteinasBania VP100% (1)
- Desnaturalizacion de ProteinasDocument7 pagesDesnaturalizacion de ProteinasDario JayaPas encore d'évaluation
- DesnaturalizacionDocument3 pagesDesnaturalizacionJose Eliseo Rubalcava ChávezPas encore d'évaluation
- Propiedades Funcionales de Las ProteínasDocument8 pagesPropiedades Funcionales de Las ProteínasAline liraPas encore d'évaluation
- Componentes de La LecheDocument24 pagesComponentes de La LecheLeonela SA100% (1)
- Formacion de GelesDocument16 pagesFormacion de GelesVictor Cardiel RodeloPas encore d'évaluation
- Informe de DesnaturalizaciónDocument16 pagesInforme de DesnaturalizaciónDiana Sevillano AscatePas encore d'évaluation
- Presentación Bioquímica ProteínasDocument17 pagesPresentación Bioquímica ProteínasBrisa VázquezPas encore d'évaluation
- DesnaturalizaciónDocument2 pagesDesnaturalizaciónMelaniie OrtiizPas encore d'évaluation
- DESDOBLAMIENTODocument3 pagesDESDOBLAMIENTOWendy HueblaPas encore d'évaluation
- Desnaturalizacion de ProteinasDocument4 pagesDesnaturalizacion de ProteinasLesly Caja TantaPas encore d'évaluation
- Prop Funcionales 2Document39 pagesProp Funcionales 2p4k1t099Pas encore d'évaluation
- Solubilidad y EspumadoDocument4 pagesSolubilidad y EspumadoAndy EscalantePas encore d'évaluation
- 4.2 Propiedades de ProteínasDocument14 pages4.2 Propiedades de ProteínasAlondra LeonPas encore d'évaluation
- Expo Proteinas 2Document30 pagesExpo Proteinas 2Jose Guadalupe Rodriguez FosilPas encore d'évaluation
- INFORME FINAL CRA (Malma-Velasquez)Document13 pagesINFORME FINAL CRA (Malma-Velasquez)Andrea VelásquezPas encore d'évaluation
- Propiedades de Las ProteínasDocument6 pagesPropiedades de Las ProteínasJoicy AlejandroPas encore d'évaluation
- Qa Informe 2 FinalDocument21 pagesQa Informe 2 FinalJoselinOrePas encore d'évaluation
- Gelificacion de ProteinasDocument5 pagesGelificacion de ProteinasAlejandro Giraldo Echeverri100% (1)
- Union de SaboresDocument7 pagesUnion de SaboresJoselynGonzález♥100% (1)
- ViscocidadDocument3 pagesViscocidadpablo ortizPas encore d'évaluation
- Anti Nutrient EsDocument12 pagesAnti Nutrient Esdora yanetPas encore d'évaluation
- Wuolah-Free-Recopilacion-Preguntas-Primer-Parcial TECNODocument21 pagesWuolah-Free-Recopilacion-Preguntas-Primer-Parcial TECNOCelia SalmeronPas encore d'évaluation
- TEMA 5. Alteraciones de Las ProteínasDocument16 pagesTEMA 5. Alteraciones de Las ProteínasNicole MastrogiorgioPas encore d'évaluation
- Informe AlimentosDocument9 pagesInforme AlimentosJorgePedrozoCalderonPas encore d'évaluation
- ProteínasDocument11 pagesProteínasEmmanuel CasteloPas encore d'évaluation
- PorteinasDocument8 pagesPorteinasCesia Lucero Morocco LinoPas encore d'évaluation
- Análisis de Modificaciones de Las ProteínasDocument6 pagesAnálisis de Modificaciones de Las ProteínasEdwin CabascangoPas encore d'évaluation
- Cuestionarios 1er Parcial - Tema 5Document6 pagesCuestionarios 1er Parcial - Tema 5Sauceda ReyesPas encore d'évaluation
- Propiedades EspumantesDocument7 pagesPropiedades EspumantesJuan Pablo León100% (1)
- Estabilidad Beta GalaDocument18 pagesEstabilidad Beta GalaFelipe MuñosPas encore d'évaluation
- Proteinas IIDocument4 pagesProteinas IIALee RObles TOrresPas encore d'évaluation
- DesnaturalizaciónDocument28 pagesDesnaturalizaciónErnesto GallegoPas encore d'évaluation
- Química de macrocomponentes de alimentosD'EverandQuímica de macrocomponentes de alimentosPas encore d'évaluation
- Texto Informativo-Formulación y Nomenclatura QuímicaDocument1 pageTexto Informativo-Formulación y Nomenclatura QuímicaJeferson Paul Rivera la RosaPas encore d'évaluation
- Soluciones y Rubricas Evaluación Del CPQG I 2011.02.09Document10 pagesSoluciones y Rubricas Evaluación Del CPQG I 2011.02.09Luis VacaPas encore d'évaluation
- Informe de EspectrofotómetroDocument9 pagesInforme de EspectrofotómetroMaria Ticlla IrigoinPas encore d'évaluation
- Lab7 - Guía Preparación de BufferDocument11 pagesLab7 - Guía Preparación de BufferSantiago Ahumada TobarPas encore d'évaluation
- Practica 6 FisicaDocument7 pagesPractica 6 Fisicajennifer alva mPas encore d'évaluation
- Tarea Primer ParcialDocument9 pagesTarea Primer ParcialMartin CabreraPas encore d'évaluation
- Examen 1ra UnidadDocument4 pagesExamen 1ra Unidadkate Amairani Coronel VegaPas encore d'évaluation
- Propiedades Intensivas y Extensivas de La MateriaDocument3 pagesPropiedades Intensivas y Extensivas de La MateriaRonell StuartPas encore d'évaluation
- El Aire y Sus CaracterísticasDocument2 pagesEl Aire y Sus CaracterísticasFanny Uceda Castillo100% (2)
- Caucho, Vulcanizado o Termoplástico Determinación Del Efecto de Los LíquidosDocument4 pagesCaucho, Vulcanizado o Termoplástico Determinación Del Efecto de Los LíquidosNorma PazPas encore d'évaluation
- Analisis 1234Document4 pagesAnalisis 1234Yenny Rojas ShuanPas encore d'évaluation
- Codigo Del ModeloDocument3 pagesCodigo Del ModeloAndrey f Solano tPas encore d'évaluation
- AdsorciónDocument21 pagesAdsorciónLuis Felipe Pool YamPas encore d'évaluation
- Quimica Temario-Reacciones QuimicasDocument3 pagesQuimica Temario-Reacciones QuimicasCecilia DelgadoPas encore d'évaluation
- Indice de Productividad GASDocument3 pagesIndice de Productividad GASmayraPas encore d'évaluation
- ChillersDocument10 pagesChillersMoisesPas encore d'évaluation
- Ejercicios de EsteqDocument6 pagesEjercicios de EsteqJosePas encore d'évaluation
- TermoDocument12 pagesTermoMarisol Chuyma VargasPas encore d'évaluation
- Diapositiva Fundamentos y Usos Del PQS Tipo ABCDocument14 pagesDiapositiva Fundamentos y Usos Del PQS Tipo ABCAndrea VillalobosPas encore d'évaluation
- Lab - 01 - Toma de Muestras Común (3 Puestos)Document2 pagesLab - 01 - Toma de Muestras Común (3 Puestos)Stefan NiedbalskiPas encore d'évaluation
- Tema I Electroquímica 2018-IIDocument62 pagesTema I Electroquímica 2018-IIDenisse Alcarraz LoaPas encore d'évaluation
- 3.14 BalanceMasaDocument7 pages3.14 BalanceMasaKPPas encore d'évaluation
- Conceptos Basicos de ElectroquimicaDocument3 pagesConceptos Basicos de ElectroquimicaNatasha Ramirez LunaPas encore d'évaluation
- Tratar Suelos AlcalinosDocument5 pagesTratar Suelos AlcalinosCarlos SanchezPas encore d'évaluation
- Informe GelificacionDocument4 pagesInforme GelificacionJhon William MejiaPas encore d'évaluation
- Monografia Mn374 Lazo Timana KevinDocument29 pagesMonografia Mn374 Lazo Timana KevinkevinPas encore d'évaluation
- Método de La Efectividad - NtuDocument16 pagesMétodo de La Efectividad - NtuMilo Andrade TapiaPas encore d'évaluation
- 4-Combustion 2021 A 2022Document28 pages4-Combustion 2021 A 2022jhon jairo perdomo portillaPas encore d'évaluation
- Plutonio - Wikipedia, La Enciclopedia LibreDocument120 pagesPlutonio - Wikipedia, La Enciclopedia LibreEdgardo MoraezPas encore d'évaluation