Académique Documents
Professionnel Documents
Culture Documents
Seminario Del Hierro
Transféré par
Juan Carlos Tenecora QuitoCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Seminario Del Hierro
Transféré par
Juan Carlos Tenecora QuitoDroits d'auteur :
Formats disponibles
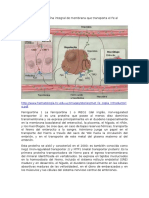
METABOLISMO DEL HIERRO
El hierro es un elemento esencial para todos los organismos vivientes. En la primera etapa de la evolucin de la vida, los seres primitivos lo utilizaban como parte de su sistema de generacin de energa, existiendo en su estado ferroso debido al escaso oxgeno ambiental. Cuando la concentracin de oxgeno aument, predominaron las formas oxidadas, poco solubles y los organismos tuvieron que sintetizar molculas que tuvieran capacidad de unir hierro para poder as aprovechar mejor su presencia. En los animales vertebrados esta funcin es realizada por las protenas transferrina (Tf) y ferritina, quienes son, respectivamente, las responsables del transporte y almacenamiento de hierro. Estas protenas unen el metal muy estrechamente para evitar la formacin de productos hidrolticos insolubles, pero como el proceso es reversible, el elemento se encuentra disponible ante la demanda celular. La combinacin del hierro con una protena evita, adems, su prdida va filtracin glomerular. En soluciones acuosas, el hierro puede encontrarse en dos estados de oxidacin estables: Fe2+ (ferroso) y Fe3+ (frrico). Esta propiedad lo hace capaz de participar en reacciones que abarcan gran parte de la bioqumica, incluyendo aqullas que controlan el flujo de electrones a travs de rutas bioenergticas, la sntesis de ADN y el aporte de oxgeno a los tejidos. Entre las hemoprotenas que utilizan hierro como cofactor se encuentran las que participan en el metabolismo del oxgeno (oxidasas, peroxidasas, catalasas e hidroxilasas), en la transferencia de electrones (citocromos) y en el transporte de oxgeno (hemoglobina). El hierro en el organismo se encuentra formando parte de dos compartimientos: uno funcional, que incluye los diversos compuestos celulares que contienen o requieren hierro, y otro de depsito, el cual constituye la reserva corporal del metal. El transporte de hierro unido a la Tf plasmtica facilita el intercambio del metal entre ambos compartimientos. El exceso de hierro se deposita intracelularmente asociado a ferritina y hemosiderina, fundamentalmente en el sistema monocito- macrfago del bazo, el hgado y la mdula sea. En condiciones fisiolgicas el hierro est unido a una protena ya que su presencia aislada, como en los casos de intoxicacin por el metal, produce daos graves en los tejidos. Esta toxicidad se debe a la habilidad del hierro
libre de generar, en conjuncin con el oxgeno, radicales hidroxilos que pueden causar peroxidacin de las membranas lipdicas y otros constituyentes celulares. Por esta razn, la absorcin, concentracin y estado redox de este metal, deben ser regulados cuidadosamente: si la cantidad de hierro presente es escasa, se produce anemia y si se encuentra en exceso, causa dao en los rganos por siderosis. METABOLISMO DEL ERITROCITO
DEPSITO DE FE El exceso de hierro se deposita intracelularmente como ferritina y hemosiderina, fundamentalmente en el SER del bazo, el hgado y la mdula sea. Cada molcula de ferritina puede contener hasta 4 500 tomos de hierro, aunque normalmente tiene alrededor de 2 500, almacenados como cristales de hidrxido fosfato frrico [(FeOOH8). FeO. PO3H2]. La molcula de apoferritina es un heteropolmero de 24 subunidades de 2 tipos diferentes: L y H, con un peso molecular de 20 kDa cada una, formadas por 4 cadenas helicoidales. Las variaciones en el contenido de subunidades que componen la molcula determinan la existencia de diferentes isoferritinas, las que se dividen en 2 grandes grupos: isoferritinas cidas (ricas en cadenas H) localizadas en el corazn, los glbulos rojos, los linfocitos y los monocitos, y las isoferritinas bsicas (ricas en cadenas L) predominantes en el hgado, el bazo, la placenta y los granulocitos. Las subunidades se organizan entre s de manera tal que forman una estructura esfrica que rodea a los cristales de hierro. Esta cubierta proteica posee en su entramado 6 poros de carcter hidroflico y tamao suficiente para permitir el paso de monosacridos, flavinmononucletidos, cido ascrbico o desferroxamina. Se plantea que estos poros tienen una funcin catalizadora para la sntesis de los cristales de hierro y su incorporacin al interior de la molcula de ferritina.
La funcin fundamental de la ferritina es garantizar el depsito intracelular de hierro para su posterior utilizacin en la sntesis de las protenas y enzimas. Este proceso implica la unin del hierro dentro de los canales de la cubierta proteica, seguido por la entrada y formacin de un ncleo de hierro en el centro de la molcula. Una vez formado un pequeo ncleo de hierro sobre su superficie, puede ocurrir la oxidacin de los restantes tomos del metal a medida que se incorporan. Se han observado diferencias entre la velocidad de captacin de hierro por las diferentes isoferritinas; as las isoferritinas ricas en cadenas H tienen una mayor velocidad de captacin y se ha demostrado que sta es precisamente la funcin de este tipo de subunidad. No obstante, las cadenas H y L cooperan en la captacin del hierro, las subunidades H promueven la oxidacin del hierro y las L, la formacin del ncleo. Tanto el depsito de hierro como su liberacin a la circulacin son muy rpidos, e interviene en este ltimo proceso el flavinmononucletido. El hierro es liberado en forma ferrosa y convertido en frrico por la ceruloplasmina plasmtica, para que sea captado por la transferrina que lo transporta y distribuye al resto del organismo. La hemosiderina est qumicamente emparentada con la ferritina, de la que se diferencia por su insolubilidad en agua. Aunque ambas protenas son inmunolgicamente idnticas, la hemosiderina contiene un por ciento mayor de hierro (30 %) y en la microscopia se observa como agregados de molculas de ferritina con una conformacin diferente de los cristales de hierro. El volumen de las reservas de hierro es muy variable, pero generalmente se considera que un hombre adulto normal tiene entre 500 y 1 500 mg y una mujer entre 300 y 1 000 mg, aunque estos valores dependen grandemente del estado nutricional del individuo. REGULACIN DEL BALANCE CELULAR DEL FE El balance del Fe ocurre por regulacin en diferentes niveles. El nivel ms importante es a travs de regulacin de expresin de protenas fundamentales en el metabolismo del hierro (apoferritina, RTF, etc.); es un proceso complejo de transcripcin de ARNm realizado en los ribosomas, el cual depender inicialmente de la cantidad total de Fe en el organismo, y
por lo tanto de la necesidad del equilibrio de protenas importadoras, de depsito o exportadoras de Fe. La regulacin es llevada a cabo por protenas reguladoras del Hierro (IRP1 y 2) que se unen al ARNm en relacin con los elementos reguladores del Hierro (IRE) que segn su localizacin en posicin 3o 5codificarn genes especficos (ferritina, RTF, DMT1, ferroportina, etc...).
REGULACIN DEL METABOLISMO DEL FE Hay 3 niveles: importacin, depsito y exportacin celular de Fe. El Fe normalmente ingresa al organismo a travs del intestino. Esta absorcin aumenta en caso de dficit de Fe, aumento de demanda por eritropoyesis o hipoxia. Y disminuye en caso de exceso de Fe o inflamacin. Se reconocen 4 reguladores: 1) del depsito, que modulan la absorcin (disminuyndola en caso de sobrecarga y aumentndola en caso de dficit de Fe), 2) eritroide, el ms potente, aumentando la absorcin de Fe en caso restriccin de la eritropoyesis, por dficit de Fe o por eritropoyesis acelerada. 3) la hipoxia, de forma an no bien conocida, con aumento de la absorcin de Fe y de la produccin de transportadores y 4) la inflamacin. Todos estos reguladores actan a travs de factores humorales que en definitiva regulan la absorcin intestinal del Fe. La Hepcidina polipptido de 25 AA (tambin conocido como LEAP: pptido antimicrobiano sintetizado en el hgado), con un rol fundamental en el metabolismo del Fe. Inhibe la absorcin del Fe desde el enterocito y la liberacin desde los macrfagos (Fgura 4). En relacin con la Hepcidina est el gen HFE (gen de la hemocromatosis), el cual tambin tendra un rol en la regulacin de los depsitos, aparentemente regulando la expresin de la Hepcidina. La protena hemojuvelin (HJV) co-receptor de BMP (protenas morfogenticas seas) es reguladora de la Hepcidina, mutaciones en HJV producen la forma juvenil de hemocromatosis. Recientes trabajos reportan el rol de una serin-proteasa de membrana conocida como TMPRSS6 o Matriptasa 2 en la regulacin de la Hepcidina, sta actuara clivando el receptor HJV. A su vez la Hepcidina tambin est en relacin con los reguladores eritroides, con la hipoxia e inflamacin. En el caso de la inflamacin la IL6 sera la citoquina ms importante, ya que sta estimulara la sntesis
heptica de Hepcidina. Esto explicara lo ocurrido con el metabolismo del Fe en las anemias inflamatorias. Por lo que la medida de niveles de Hepcidina en plasma puede ser de utilidad en la prctica clnica para comprender mejor la fisiopatologa de estos procesos y lograr diferenciar la anemia de los procesos inflamatorios crnicos de la anemia por dficit de Fe. La Hepcidina acta sobre el exportador de Fe (Ferroportina) ya que sta induce la fosforilacin de AA intracelular gatillando la internalizacin del complejo Hepcidina-Ferroportina y posterior degradacin del exportador. En caso de dficit de Hepcidina habra una persistencia de Ferroportina en la membrana con el consiguiente aumento en la absorcin de Fe y en caso contrario se producira una hipoferremia. TRANSPORTE DEL HIERRO El Fe circula unido a la transferrina (TF), sta en situaciones normales est presente a una concentracin de 2 a 3 g/l. Se mide en plasma como capacidad total de unir Fe. La unin con Fe+3 es de alta afinidad; el Fe precipitara de circular libre. De sntesis heptica, aumenta en caso de dficit de Fe, por mecanismos poco conocidos. La TF est saturada normalmente en 1/3, el % de saturacin de TF disminuye en caso de deficiencia de Fe, AEIC (anemia de enfermedades inflamatorias crnicas). Y aumenta en caso de suplemento de Fe o por aumento de demanda. Cada molcula de TF transporta 1 a 2 tomos de Fe, unidos a su receptor de membrana (RTF: receptor de TF). Estos receptores se expresan sobre todo en aquellas clulas que necesitan Fe (precursores eritroides, clulas tumorales y linfocitos activados). Los RTF son hallados en la sangre en proporcin a la masa eritroide. Los niveles de RTFs (solubles) aumentados son indicativos de deficiencia de hierro o eritropoyesis ineficaz. El complejo TF-Fe-RTF entra a la clula por endocitosis (Figura 3), estas vesculas poseen un pH cido donde se libera el Fe y pasa al citoplasma. Luego la TF y RTF vuelven a la membrana celular para liberar la apoTf (TF sin Fe) al plasma y de esta forma poder participar de un nuevo ciclo del transporte de Fe. En el interior de la clula el Fe es captado por protenas y pequeas molculas para su utilizacin o depsito. En los precursores eritroides la mayora del Fe va a la mitocondria para incorporarse al grupo hemo. El transporte del Fe en otras clulas como por ejemplo los hepatocitos es muy importante ya que al mayor depsito de Fe ocurre en estas clulas. Estas expresan RTF1 y RTF2 (con iguales funciones que RTF1 pero menos eficiente y de funcin incierta). Por otro lado y a diferencia con RTF1, RTF2 no formara complejo con la protena HFE. Se ha relacionado a mutaciones
en RTF2 con Hemocromatosis, por lo cual este sera importante en el metabolismo del Fe. Al parecer la Ferroportina jugara un rol en el transporte de Fe desde el hepatocito. Los macrfagos del SRE obtienen el Fe al fagocitar los eritrocitos, pero tambin por el ciclo de la TF. En estas clulas la Ferroportina sera la protena exportadora de Fe. Al parecer la Ceruloplasmina (ferroxidasa con cobre) tendra un papel importante ya que catalizara la oxidacin de Fe+2 en Fe+3. La concentracin del Fe en plasma y por lo tanto la saturacin de TF est regulada por la entrega celular (hepatocitos y macrfagos) de Fe (oferta de Fe) y de la demanda (eritropoyesis). En caso de eritropoyesis constante la saturacin de Tf depende del recambio de Fe de depsito. Aumentando en caso de entrega mayor de Fe y disminuyendo en caso contrario (por retencin de Fe o menor entrega, por menor reciclado eritroide). REQUERIMIENTOS DEL HIERRO Los requerimientos de hierro en cada etapa de la vida estn determinados por los cambios fisiolgicos a que se enfrenta el organismo durante su desarrollo. Al nacer, el nio sustituye el suministro seguro de hierro aportado por la placenta por otro mucho ms variable y con frecuencia insuficiente, proveniente de los alimentos. Durante el primer ao de la vida el nio crece rpidamente, como resultado de lo cual al cumplir el ao, debe haber triplicado su peso y duplicado su hierro tempranamente, por lo que se hace necesario el suministro de hierro exgeno antes de los cuatro meses de vida. Durante la infancia, las necesidades de hierro para el crecimiento son menores, alrededor de 10 mg/da, pero continan siendo elevadas en trminos de ingesta relativa, cuando se comparan con las del adulto, por lo que no desaparece el riesgo de desarrollar una deficiencia de hierro. En este perodo es importante evitar los malos hbitos dietticos que limitan la ingesta de hierro o alteran su biodisponibilidad. En la adolescencia se produce nuevamente un incremento de las demandas de hierro, como consecuencia del crecimiento acelerado.
Durante el desarrollo puberal un adolescente aumenta unos 10 kg de peso, que debe acompaarse de un incremento de unos 300 mg de su hierro corporal para lograr mantener constante su hemoglobina, que en este perodo aumenta a razn de 50-100 g/L/ao. En consecuencia, un adolescente varn requiere alrededor de 350 mg de hierro por ao durante el pico de crecimiento de la pubertad. Las necesidades de hierro en las hembras son ms altas, pues aunque su velocidad de crecimiento es menor, se adicionan las prdidas menstruales. El aumento de unos 9 kg de peso de una adolescente durante la pubertad, representa la necesidad de un aporte de unos 280 mg de hierro para el mantenimiento de la concentracin de hemoglobina. Un sangramiento menstrual promedio de unos 30 mL de sangre implica la prdida de unos 75 mg de hierro. En consecuencia, una adolescente en pleno pico de crecimiento requiere alrededor de 455 mg de hierro por ao. En las mujeres en edad frtil los requerimientos son similares a los de la adolescente, fundamentalmente debido a las prdidas menstruales. Estos requerimientos pueden verse aumentados por el uso de dispositivos intrauterinos, que provocan aumentos imperceptibles de las prdidas, unido en ocasiones a una dieta inadecuada; los embarazos y la lactancia pueden agravar la situacin. EXCRECION DEL HIERRO La capacidad de excrecin de hierro del organismo es muy limitada. Las prdidas diarias de hierro son de 0,9-1,5 mg/da (0,013 mg/kg/da) en los hombres adultos. De stos, 0,35 mg se pierden en la materia fecal, 0,10 mg a travs de la mucosa intestinal (ferritina), 0,20 mg en la bilis, 0,08 mg por va urinaria y 0,20 mg por decamacin cutnea. Las mujeres en edad frtil estn expuestas a una deplecin adicional de hierro a travs de las prdidas menstruales que incrementan los niveles de excrecin diarios a 1,6 mg/da como mnimo. Los cambios en los depsitos de hierro del organismo provocan variaciones limitadas en la excrecin de hierro, que van desde 0,5 mg/da en la deficiencia de hierro a 1,5 mg/da en individuos con sobrecarga de
hierro. Aunque hay pocos estudios en lactantes y nios, se plantea que en stos las prdidas gastrointestinales pueden ser mayores que en los adultos. Algunos investigadores plantean que las prdidas promedio son de aproximadamente 2 mg/da en los lactantes y de 5 mg/da en los nios de 6 a 11 aos de edad. Otras causas importantes de prdidas son las donaciones de sangre y la infestacin por parsitos.
Vous aimerez peut-être aussi
- Metabolismo Del Hierro y Anemia Del EmbarazoDocument25 pagesMetabolismo Del Hierro y Anemia Del EmbarazoJose Wildo Oblitas ZeaPas encore d'évaluation
- Introducción Hierro Hem y No HemDocument17 pagesIntroducción Hierro Hem y No HemYubissa MGPas encore d'évaluation
- Almacenamiento Del HierroDocument2 pagesAlmacenamiento Del HierroJoshue MurrietaPas encore d'évaluation
- Hierro - 2 234Document7 pagesHierro - 2 234karenPas encore d'évaluation
- Metabolismo Del HierroDocument47 pagesMetabolismo Del HierroNelson TellezPas encore d'évaluation
- HEPCIDINADocument19 pagesHEPCIDINAFabi M. Quique PerezPas encore d'évaluation
- Metabolismo Del Hierro Folico y b12Document19 pagesMetabolismo Del Hierro Folico y b12Remmy ValdezPas encore d'évaluation
- Metabolismo Del HierroDocument10 pagesMetabolismo Del HierroGabriel Henrique OliveiraPas encore d'évaluation
- Bioquimica Del FeDocument5 pagesBioquimica Del FeMiriam SanchezPas encore d'évaluation
- Preguntas de Metabolismo de HierroDocument3 pagesPreguntas de Metabolismo de HierroAle Roque100% (1)
- 7.7 HemocromatosisDocument18 pages7.7 HemocromatosisNicöle AndradePas encore d'évaluation
- Metabolismo Del HierroDocument27 pagesMetabolismo Del HierroKarla López CPas encore d'évaluation
- Mecanismos de Absorcion Del Fe (Hierro) en El Enterocito y El Eritroblasto.Document27 pagesMecanismos de Absorcion Del Fe (Hierro) en El Enterocito y El Eritroblasto.miguel angel100% (14)
- Metabolismo Del HierroDocument5 pagesMetabolismo Del Hierrogiovanna ramosPas encore d'évaluation
- FerroportinaDocument4 pagesFerroportinaAriel Lòpez VelazquezPas encore d'évaluation
- Bioquimica Del Metabolismo Del Hierro 2011Document52 pagesBioquimica Del Metabolismo Del Hierro 2011Brenda TorresPas encore d'évaluation
- Cuestionario y VocabularioDocument2 pagesCuestionario y VocabularioVilma Zeballos HuamaniPas encore d'évaluation
- Monografia Anemia FerropenicaDocument42 pagesMonografia Anemia FerropenicaDiego PacherresPas encore d'évaluation
- Absorción y Metabolismo Del Hierro - MGVDocument10 pagesAbsorción y Metabolismo Del Hierro - MGVMica Salas VictoriaPas encore d'évaluation
- Conglomerados Sulfuro Sintesis HemDocument24 pagesConglomerados Sulfuro Sintesis HemDavid RechartePas encore d'évaluation
- Anemias carenciales: hierro, B12 y folatoDocument10 pagesAnemias carenciales: hierro, B12 y folatoSabrina BronfenPas encore d'évaluation
- Estudio Del HierroDocument24 pagesEstudio Del HierroPablo Ignacio Hernández RivasPas encore d'évaluation
- HierroDocument5 pagesHierroFernando Cordova PardoPas encore d'évaluation
- Hematología R - Tarea2Document8 pagesHematología R - Tarea2chrissng21Pas encore d'évaluation
- Cuestinario de Metabolismo de HierroDocument4 pagesCuestinario de Metabolismo de HierroVane AguilarPas encore d'évaluation
- Anemia Por Deficiencia de HierroDocument4 pagesAnemia Por Deficiencia de HierroDanielaPas encore d'évaluation
- Metabolismo Del HierroDocument27 pagesMetabolismo Del HierroLuis Antonio García RomeroPas encore d'évaluation
- HIERRODocument3 pagesHIERROWilliam EspinozaPas encore d'évaluation
- El metabolismo del hierro en el organismoDocument4 pagesEl metabolismo del hierro en el organismoAntony Barboza GalvezPas encore d'évaluation
- Metabolismo Del Hierro - Fisiologà - A IDocument13 pagesMetabolismo Del Hierro - Fisiologà - A IKeka QuijanoPas encore d'évaluation
- V. Anemia Ferropenica y Sobrecarga de HierroDocument49 pagesV. Anemia Ferropenica y Sobrecarga de HierroCitlali SanchezPas encore d'évaluation
- Alteraciones Del Metabolismo Del HierroDocument11 pagesAlteraciones Del Metabolismo Del HierroOmar CarrizoPas encore d'évaluation
- Metabolismo Del HierroDocument2 pagesMetabolismo Del HierroGastón RodriguezPas encore d'évaluation
- 3) Metabolismo Del HierroDocument7 pages3) Metabolismo Del HierroAlfonso PrietoPas encore d'évaluation
- Ciclo del hierro y sus componentesDocument19 pagesCiclo del hierro y sus componentesSilvia Beatriz Rojas MuñozPas encore d'évaluation
- Anemia ferropénica: concepto, clasificación, fisiopatología y tratamientoDocument35 pagesAnemia ferropénica: concepto, clasificación, fisiopatología y tratamientoJhoselyn Laura Choquenaira BaltazarPas encore d'évaluation
- Metabolismo Del HierroDocument5 pagesMetabolismo Del HierromariacssolanoPas encore d'évaluation
- Capacidad de fijación de hierro en la sangreDocument2 pagesCapacidad de fijación de hierro en la sangreAugusto MáximoPas encore d'évaluation
- Química Bioinorgánica Del HierroDocument30 pagesQuímica Bioinorgánica Del HierroDiana De Fatima RomeroPas encore d'évaluation
- ANEMIA FisiopatologiaDocument51 pagesANEMIA Fisiopatologiaspartaco82Pas encore d'évaluation
- METABOLISMO (Fe, CaDocument40 pagesMETABOLISMO (Fe, CasayraPas encore d'évaluation
- Homeostasis del hierro en el organismo humanoDocument2 pagesHomeostasis del hierro en el organismo humanoYasuri Celia Trujillo GarcíaPas encore d'évaluation
- Trastornos en El Metabolismo Del HierroDocument8 pagesTrastornos en El Metabolismo Del HierroVictor CastroPas encore d'évaluation
- Anemias hipoproliferativas y ferropeniaDocument11 pagesAnemias hipoproliferativas y ferropeniaAmbar ToledoPas encore d'évaluation
- Anemia y Su ClasificacionDocument7 pagesAnemia y Su ClasificacionAngela CVPas encore d'évaluation
- Interpretacion Parametros Hematimetricos Bioquimicos PDFDocument15 pagesInterpretacion Parametros Hematimetricos Bioquimicos PDFmilleralselmoPas encore d'évaluation
- Metabolismo de Fe, Anemia FerropénicaDocument7 pagesMetabolismo de Fe, Anemia FerropénicaCatalina CirausPas encore d'évaluation
- Metabolismo Del Hierro PDFDocument12 pagesMetabolismo Del Hierro PDFVannia Rodriguez MartinezPas encore d'évaluation
- 2017 CHile Biomarcadores de Anemia y NutriciónDocument9 pages2017 CHile Biomarcadores de Anemia y NutriciónVictor Arellano NuñezPas encore d'évaluation
- Anemia Por Deficiencia de HierroDocument6 pagesAnemia Por Deficiencia de HierroFranco IslaPas encore d'évaluation
- Metabolismo Del HierroDocument18 pagesMetabolismo Del HierroHeriberto Richard IllanesPas encore d'évaluation
- Cuestionario 3 Anemia Def Hierro 2020Document6 pagesCuestionario 3 Anemia Def Hierro 2020Liliana MoránPas encore d'évaluation
- Sem 6 Presencial HEMOGLOBINADocument22 pagesSem 6 Presencial HEMOGLOBINACarlosAlbertoDangeloToledoPas encore d'évaluation
- Anemias FinalDocument9 pagesAnemias FinalRocio sosaPas encore d'évaluation
- Práctica Nº3 Anemia FerropenicaDocument13 pagesPráctica Nº3 Anemia FerropenicaCristian Rodrigo Barrios SotomayorPas encore d'évaluation
- 6.0 - Anemia Por Defectos en La Síntesis Del HemDocument47 pages6.0 - Anemia Por Defectos en La Síntesis Del HemMark JaraPas encore d'évaluation
- HEMOGLOBINADocument9 pagesHEMOGLOBINAJenniferIdrogoSosaPas encore d'évaluation
- PhysioEx Ejercicio 9 Actividad 2 (PG)Document3 pagesPhysioEx Ejercicio 9 Actividad 2 (PG)Yael Yomira Ramos Tataje100% (1)
- Maycolm Alegre Evaluacion V Salud OcupacionalDocument19 pagesMaycolm Alegre Evaluacion V Salud OcupacionalAssasin Des RevesPas encore d'évaluation
- Reconocimiento de Macro y Micro Nutrientes en Hortalizas y FrutasDocument3 pagesReconocimiento de Macro y Micro Nutrientes en Hortalizas y FrutasCarlos Jhair RodriguezPas encore d'évaluation
- Practica de Vendajes y Curaciones Con FundamentacionDocument30 pagesPractica de Vendajes y Curaciones Con FundamentacionMemoritaSeisversnPas encore d'évaluation
- EncurtidosDocument15 pagesEncurtidosAnthonyPonceParedesPas encore d'évaluation
- Sistema MuscularDocument8 pagesSistema Muscularyulieth100% (1)
- Análisis de alimentos: agua, proteínas, carbohidratos y lípidosDocument16 pagesAnálisis de alimentos: agua, proteínas, carbohidratos y lípidosEdwinPas encore d'évaluation
- La Psicología Como CienciaDocument3 pagesLa Psicología Como CienciaBro peliPas encore d'évaluation
- Down RegulationDocument1 pageDown Regulationguadalupe.vazquez.moraPas encore d'évaluation
- Caso Clinico Icteric 525632 Downloadable 2808545Document10 pagesCaso Clinico Icteric 525632 Downloadable 2808545Yesenia CaloPas encore d'évaluation
- Taller sobre verbos y descomposición de númerosDocument5 pagesTaller sobre verbos y descomposición de númerosJhoanna HernandezPas encore d'évaluation
- Lamarck DarwinDocument20 pagesLamarck DarwinGuille Pineda100% (1)
- DiencefaloDocument11 pagesDiencefaloJose CadenasPas encore d'évaluation
- Barrera HematoencefalicaDocument6 pagesBarrera HematoencefalicaYamisel GonzálezPas encore d'évaluation
- Semana 06 SimulacroDocument8 pagesSemana 06 SimulacroTotti Di Franchesco PelaezPas encore d'évaluation
- VI Consenso HPPRN SIBENDocument72 pagesVI Consenso HPPRN SIBENJhonny Marquez100% (2)
- Tu Perro Piensa y Te Quiere Carlos Alfonso Lopez Garcia Educan PDFDocument34 pagesTu Perro Piensa y Te Quiere Carlos Alfonso Lopez Garcia Educan PDFkruczynskidelic100% (2)
- Caso Perfiles IntroDocument2 pagesCaso Perfiles IntroCarolina TorresPas encore d'évaluation
- Tipos de Reactores Con Sus CaracteristicDocument323 pagesTipos de Reactores Con Sus CaracteristicKatia Gutierrez GalaPas encore d'évaluation
- Etica Profesional en FisioterapiaDocument82 pagesEtica Profesional en FisioterapiaBrayan Flores100% (1)
- Tendido de Cama PDFDocument8 pagesTendido de Cama PDFludy castañedaPas encore d'évaluation
- Apexogenesis, apexificacion e induccion al cierre apicalDocument25 pagesApexogenesis, apexificacion e induccion al cierre apicaljatnabPas encore d'évaluation
- Chia Corp Sa Informe UltimoDocument25 pagesChia Corp Sa Informe UltimoJessil LC100% (1)
- 2014 04 - Alejandra Maciel - Clasificacin Cito Histolgica PDFDocument37 pages2014 04 - Alejandra Maciel - Clasificacin Cito Histolgica PDFFelix CamposPas encore d'évaluation
- El Perfume Historia de Un AsesinoDocument18 pagesEl Perfume Historia de Un AsesinoAlexis SilvaPas encore d'évaluation
- 9 Liquido SinovialDocument47 pages9 Liquido SinovialLeonardoCapuñayEffioPas encore d'évaluation
- Aparatología AbdominalDocument52 pagesAparatología AbdominalVicky Saavedra100% (2)
- El Síndrome de RamboDocument5 pagesEl Síndrome de RamboPedro Carranza AthoPas encore d'évaluation
- Potencial hidrocarburífero del Subandino Sur de BoliviaDocument33 pagesPotencial hidrocarburífero del Subandino Sur de BoliviaRomy Iván Cruz Villarroel75% (4)
- FT FUN MEX Rally 40wDocument2 pagesFT FUN MEX Rally 40wdobbertin alexisPas encore d'évaluation