Académique Documents
Professionnel Documents
Culture Documents
Previo 6 Sintesis de Hantzsch para Piridinas
Transféré par
Julio Cesar Venegas MuñozTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Previo 6 Sintesis de Hantzsch para Piridinas
Transféré par
Julio Cesar Venegas MuñozDroits d'auteur :
Formats disponibles
UNIVERSIDAD NACIONAL AUTONOMA DE MEXICO FACULTA DE ESTUDIOS SUPERIORES CUAUTITLAN CAMPO 1 QUIMICO FARMACEUTICO BIOLOGO QUIMICA ORGANICA III
PREVIO 6
EQUIPO: 6
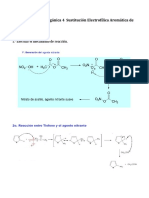
SINTESIS DE HANTZSCH PARA PIRIDINAS OBJETIVO.
Obtencin de dihidropiridina por la reaccin de Hantzsch, y su consiguiente oxidacin para dar piridinas polisustitudas.
1.- Sntesis de Hantzsch. La Sntesis de pirroles de Hantzsch es un mtodo de sntesis orgnica que consiste en la preparacin de pirroles sustituidos (3) a partir de -cetosteres (1) con -halocetonas (2) en presencia de amoniaco (o aminas primarias). La describi por primera vez el qumico Arthur Rudolf Hantzsch. El mtodo consiste en 4 etapas:[] 1) Se forma de la base de Schiff entre el amoniaco y el -cetoster. La imina se encuentra en equilibrio con su enamina. 2) La enamina se condensa con el carbonilo de la -halocetona, formando la imina ,insaturada. 3) El nitrgeno de la imina reacciona con el carbono unido al halgeno en una reaccin de SN2 4)Se elimina el protn disponible en la posicin 2 del pirrol formado para dar el producto aromtico.
2.- Formacin y reaccin de enaminas, condensacin de Knoevenagel, adicin tipo Michael, mtodo de sntesis de piridinas. Las enaminas se obtienen por reaccin de aldehdos o cetonas con aminas secundarias. Mecanismo de formacin de enaminas Despus del ataque inicial de la amina secundaria al carbonilo, se elimina agua formndose el doble enlace entre el carbono carbonilo y el alfa del carbonilo de partida. La condensacin o reaccin de Knoevenagel es una reaccin en la que se produce la adicin nuclefila sobre el carbonilo, de un aldehdo o cetona, de un carbono activado (cido) situado entre dos grupos aceptores de electrones por resonancia, grupo seguido por una reaccin de deshidratacin en el que se elimina una molcula de agua. La condensacin o reaccin de Knoevenagel es una reaccin qumica orgnica en la que se produce la adicin nuclefila sobre el carbonilo, de un aldehdo o cetona, de un carbono activado (cido) situado entre dos grupos aceptores de electrones por resonancia, por ejemplo un compuesto -dicarbonlico, seguida a continuacin de deshidratacin (prdida de una molcula de agua), en lo que sera globalmente una reaccin de tipo condensacin aldlica, obtenindose un producto ,-insaturado. La reaccin es catalizada por una amina, en la forma de hidrocloruro o acetato de la misma. Ejemplo de reaccin de Knoevenagel
En general, el papel como catalizador de la amina, dada adems su relativa debilidad como base, no es tanto el de desprotonar el metileno activo (cido) para generar el enolato como s el de adicionarse al carbonilo del aldehdo o cetona para formar la sal de iminio, un buen electrfilo. La reaccin de Michael o adicin de Michael consiste en una adicin nuclefila de un carbanin a un compuesto carbonlico ,-insaturado. Pertenece a la clase ms grande de las adiciones conjugadas. Es uno de los mtodos ms tiles de formacin de enlaces C-C en condiciones suaves. Existen muchas variantes asimtricas. Mecanismo general de la reaccin de Michael
En este esquema los sustituyentes R y R' en el nuclefilo son grupos electroaceptores tales como los acilo y ciano convirtiendo al hidrgeno metilnico en cido, que al reaccionar con la base B: da lugar al carbanin. El sustituyente en el alqueno activado es normalmente una cetona, lo que la convierte en una enona, pero puede ser tambin un grupo nitro. Tal como fue definida originalmente por Michael,3 la reaccin es una adicin de un enolato de una cetona o aldehdo sobre el carbono de un compuesto carbonlico ,-insaturado (el "aceptor" de Michael). Una definicin posterior, propuesta por Kohler,4 es la adicin 1,4 de un carbono nuclefilo doblemente estabilizado a un compuesto carbonlico ,-insaturado. Algunos ejemplos de nuclefilos incluyen a beta-cetoesteres, malonatos y beta-cianoesteres. El producto resultante contiene un altamente til patrn de dos carbonilos (C=O) en 1,5. El mecanismo de reaccin es esbozado a continuacin con un compuesto 1,3-dicarbonilo 1, (siendo p.ej. R un residuo alcoxi), como nuclefilo:
Mecanismo de la reaccin de Michael
La desprotonacin de 1 por la base conduce al carbanin 2 estabilizado por sus grupos electroaceptores. Las estructuras 2a a 2c son tres estructuras de resonancia que pueden ser dibujadas para esta especie, dos de las cuales son iones enolato. Este nuclefilo reacciona con el alqueno eletroflico 3 dando 4 en una reaccin de adicin conjugada. La abstraccin del protn de la base protonada (o del solvente) por el enolato conduce al producto 5, siendo este el paso final. 3.- Importancia y aplicacin de piridinas La piridina y los compuestos relacionados con ella encuentran gran utilidad como disolventes, en anlisis qumicos, y como reactivos para la sntesis de frmacos, insecticidas, herbicidas, saborizantes, colorantes, adhesivos, pinturas, explosivos, desinfectantes y qumicos para el caucho. Tambin es utilizada junto con las picolinas como desnaturalizante en mezclas anticongelantes y en el alcohol etlico, en fungicidas, y en la tincin de textiles. REFERENCIAS: Fundamentos de quimica heterociclica, Leo Paquete 1 edicin, editorial limusa Quimica Organica , Mc Macmurry, 6-edicion, Editorial Tomson, Mexico 1999. http://www.academiaminasonline.com/aldehidos-cetonas/198-formacion-enaminas.html
Vous aimerez peut-être aussi
- Reporte 5 PirazolonasDocument4 pagesReporte 5 PirazolonasAnonymous enA4SSPas encore d'évaluation
- Previo HidantoínasDocument9 pagesPrevio HidantoínasUriel RamosPas encore d'évaluation
- Previo 2 NitrotiofenoDocument4 pagesPrevio 2 NitrotiofenoAngelicaBaezPas encore d'évaluation
- Reporte FurfuralDocument9 pagesReporte FurfuralMary FallPas encore d'évaluation
- Previo 5 Q.O IIIDocument2 pagesPrevio 5 Q.O IIIMichell Maximiliano Santillan HerrejonPas encore d'évaluation
- PRÁCTICA No. 4: OBTENCIÓN DE 5,5-DIFENILHIDANTOINADocument7 pagesPRÁCTICA No. 4: OBTENCIÓN DE 5,5-DIFENILHIDANTOINADiana HMPas encore d'évaluation
- NitrotiofenoDocument3 pagesNitrotiofenoGaby RodriguezPas encore d'évaluation
- Formacion de IndolesDocument4 pagesFormacion de IndolesMariana CervanteesPas encore d'évaluation
- Síntesis de epóxido de menadiona y apertura a ftiocolDocument2 pagesSíntesis de epóxido de menadiona y apertura a ftiocolFrancisco QuirozPas encore d'évaluation
- Reporte Practica 3Document5 pagesReporte Practica 3Daniel OlveraPas encore d'évaluation
- Previo 2-NitrotiofenoDocument5 pagesPrevio 2-NitrotiofenoEdgar Armando100% (5)
- Investigación Previa Obtención de Hidantoinas OrgánicaDocument8 pagesInvestigación Previa Obtención de Hidantoinas OrgánicaDaniel Romano100% (1)
- Practica 4 Sintesis de 1-Fenil-3metilpirazol-5-OnaDocument2 pagesPractica 4 Sintesis de 1-Fenil-3metilpirazol-5-OnaJackCrack1221Pas encore d'évaluation
- BenciloDocument3 pagesBenciloLily LeroPas encore d'évaluation
- Previo 3 Orgánica 4Document5 pagesPrevio 3 Orgánica 4dany_289Pas encore d'évaluation
- Formación de CumarinasDocument6 pagesFormación de CumarinasJessica BMPas encore d'évaluation
- Síntesis de pirrol mediante modificación de Paal-Knorr usando bentonitaDocument4 pagesSíntesis de pirrol mediante modificación de Paal-Knorr usando bentonitaAngel ZurielPas encore d'évaluation
- Cuestionario Previo 16 BenciloDocument5 pagesCuestionario Previo 16 BenciloDavid AquinoPas encore d'évaluation
- Previo BenciloDocument6 pagesPrevio BenciloHeber Daniel Andrade Rivera100% (1)
- AzocompuestosDocument11 pagesAzocompuestosIsabel Centeno100% (1)
- Reacciones SEA en sistemas heterocíclicos aromáticosDocument5 pagesReacciones SEA en sistemas heterocíclicos aromáticosLyn Quinn Mim100% (1)
- Investigación Previa Practica No.3Document12 pagesInvestigación Previa Practica No.3Alvarado Fernández Juan CarlosPas encore d'évaluation
- Sustitución Electrófilica Aromática en Tiofeno.2Document2 pagesSustitución Electrófilica Aromática en Tiofeno.2dany_289Pas encore d'évaluation
- Síntesis 6-Metiltiouracilo USACDocument3 pagesSíntesis 6-Metiltiouracilo USACKarenPas encore d'évaluation
- Reporte 3. TiofenoDocument4 pagesReporte 3. TiofenoJosh Tapia MuciñoPas encore d'évaluation
- Aldair 201 Q Qo4 Vi B Hidantoinas 1° Intento PDocument9 pagesAldair 201 Q Qo4 Vi B Hidantoinas 1° Intento PAldair HernandezPas encore d'évaluation
- 2 Nitro TiofenoDocument7 pages2 Nitro TiofenoAngel HernándezPas encore d'évaluation
- Bencilo ReporteDocument2 pagesBencilo ReporteDavid Ramirez50% (2)
- Investigacion Previa Practica Sintesis de Acido BarbituricoDocument3 pagesInvestigacion Previa Practica Sintesis de Acido BarbituricoDaniel RomanoPas encore d'évaluation
- CUESTIONARIO PREVIO 3 TiofenoDocument4 pagesCUESTIONARIO PREVIO 3 TiofenoJose Antonio Silva100% (2)
- Reporte MenadionaDocument5 pagesReporte MenadionaRodary Dymarcuz100% (6)
- Cuestionario Preparación de IndolesDocument3 pagesCuestionario Preparación de IndolesAle-Bere GarcíaPas encore d'évaluation
- Nitracion Del Benzoato de MetiloDocument4 pagesNitracion Del Benzoato de MetiloandreaPas encore d'évaluation
- Síntesis de 5,5-DifenilhidantoínaDocument2 pagesSíntesis de 5,5-DifenilhidantoínajuanPas encore d'évaluation
- Identificacion de Aldehidos y CetonasDocument48 pagesIdentificacion de Aldehidos y CetonasUriel Ramos100% (1)
- SEA nitración tiofenoDocument3 pagesSEA nitración tiofenoabdielo88Pas encore d'évaluation
- (REPORTE) Práctica #2 Síntesis de DibenzalacetonaDocument3 pages(REPORTE) Práctica #2 Síntesis de DibenzalacetonaVanesa Cx SlumberPas encore d'évaluation
- HidantoínasDocument9 pagesHidantoínasNaty TitiPas encore d'évaluation
- Pirroles Sintesis y AplicacionesDocument3 pagesPirroles Sintesis y AplicacionesAnonymous kpcIWGgLePas encore d'évaluation
- Dibenzalacetona PracticaDocument4 pagesDibenzalacetona PracticaBrayan Efrain Orozco SoteloPas encore d'évaluation
- Formación de PirazolonasDocument4 pagesFormación de PirazolonasAdrian PIPas encore d'évaluation
- Ácido Pícrico-PrevioDocument2 pagesÁcido Pícrico-PrevioScrolla BerserkerPas encore d'évaluation
- Síntesis de 2,4-Dietoxicarbonil 3,5 DimetilpirrolDocument25 pagesSíntesis de 2,4-Dietoxicarbonil 3,5 DimetilpirrolEdgar ArmandoPas encore d'évaluation
- HidantoinaDocument4 pagesHidantoinaAndresDuranPas encore d'évaluation
- Práctica 3. Síntesis de PiridinasDocument5 pagesPráctica 3. Síntesis de PiridinasAde TimPas encore d'évaluation
- Reporte Practica 2 - Sintesis de AzocompuestosDocument7 pagesReporte Practica 2 - Sintesis de AzocompuestosNicte Llanes0% (1)
- Previo Org Acetanilida.Document27 pagesPrevio Org Acetanilida.Anonymous wGV7fYXgPas encore d'évaluation
- Sintesis 5,5 DifenilhidantoínaDocument5 pagesSintesis 5,5 DifenilhidantoínaAdrian Quintanilla100% (1)
- Organo Pre VioDocument17 pagesOrgano Pre VioJonathan VillafañePas encore d'évaluation
- Síntesis benzoína 3 etapasDocument14 pagesSíntesis benzoína 3 etapasxPiixaaaPas encore d'évaluation
- Practica 11Document3 pagesPractica 11Kimberly TorresPas encore d'évaluation
- Investigacion Previa BenciloDocument2 pagesInvestigacion Previa BenciloEve TenorioPas encore d'évaluation
- UNAM-FQ: Síntesis de p-terc-butilfenol mediante alquilación de Friedel-CraftsDocument6 pagesUNAM-FQ: Síntesis de p-terc-butilfenol mediante alquilación de Friedel-CraftsAlan ZamudioPas encore d'évaluation
- AspirinaDocument7 pagesAspirinaFernanda GómezPas encore d'évaluation
- Acetanilida derivados ácidosDocument7 pagesAcetanilida derivados ácidosLiLiana Niño100% (1)
- Sintesis de 5,5difenilhidantoinafinalDocument4 pagesSintesis de 5,5difenilhidantoinafinalAntonio Gamiño GarciaPas encore d'évaluation
- Antecedentes 2Document3 pagesAntecedentes 2Julio Cesar FeruizPas encore d'évaluation
- Tarea Clase 13 - 10 - 2021Document6 pagesTarea Clase 13 - 10 - 2021Romel Esteban ReyesPas encore d'évaluation
- Alquenos y AlquinosDocument7 pagesAlquenos y AlquinosJesúsHenriquezPas encore d'évaluation
- Reacciones de AlquinosDocument8 pagesReacciones de AlquinoskarinaPas encore d'évaluation
- Informe Viscosidad FIMDocument26 pagesInforme Viscosidad FIMRicardo Vega100% (1)
- DB 1-1smaw-01Document1 pageDB 1-1smaw-01Neidy Andrea RamirezPas encore d'évaluation
- Digestión y Absorción de LípidosDocument20 pagesDigestión y Absorción de LípidosmaitemedranoPas encore d'évaluation
- Titulación Ácido Base y de AminoácidosDocument5 pagesTitulación Ácido Base y de AminoácidosJennifer GuevaraPas encore d'évaluation
- Propiedades Físicas y QuímicasDocument4 pagesPropiedades Físicas y QuímicasNorma Torres100% (1)
- Depuracion de Aguas Residuales Por Medio de Humedales ArtificialesDocument115 pagesDepuracion de Aguas Residuales Por Medio de Humedales Artificialescanoluising100% (2)
- BiocaDocument22 pagesBiocaMonica Arias OrduñoPas encore d'évaluation
- Teoría de Arrhenius ácidos basesDocument3 pagesTeoría de Arrhenius ácidos basesOmar MBnPas encore d'évaluation
- Seminario de Glucidos Parte 4-Via de Las Pentosas Fosfato Audio 2021Document20 pagesSeminario de Glucidos Parte 4-Via de Las Pentosas Fosfato Audio 2021Estefania IturrietaPas encore d'évaluation
- Presentacion Piscinas Semana 1Document33 pagesPresentacion Piscinas Semana 1CLARA INES LOPEZ MEJIAPas encore d'évaluation
- Tema 1 Parte III Polimerización Por Pasos.2Document24 pagesTema 1 Parte III Polimerización Por Pasos.2Francisco Gonzalez GilPas encore d'évaluation
- Ductilidad y compresibilidadDocument7 pagesDuctilidad y compresibilidadcarlos deladoPas encore d'évaluation
- EvaporadoresDocument14 pagesEvaporadoresNoeli Cutipa CcoaritePas encore d'évaluation
- GCS 8BDocument6 pagesGCS 8BAlexander George Madden PavónPas encore d'évaluation
- Lagos Pacanchique Caracterización AsfaltitaDocument23 pagesLagos Pacanchique Caracterización AsfaltitaJHONATAN ALFREDO LAGOS PACANCHIQUEPas encore d'évaluation
- Ataque A Oxidos, Tierras Raras PDFDocument316 pagesAtaque A Oxidos, Tierras Raras PDFnitrek_vrc12Pas encore d'évaluation
- Botella ComestibleDocument3 pagesBotella ComestibleJazmin CorreaPas encore d'évaluation
- Calor EspecificoDocument13 pagesCalor Especificobart3299Pas encore d'évaluation
- Experimeto de Hershey y Chase ResumenDocument3 pagesExperimeto de Hershey y Chase ResumenLuis Reyes BeltranPas encore d'évaluation
- Determ Emisivida Efectiva Calibrador IRDocument6 pagesDeterm Emisivida Efectiva Calibrador IRjuncar25Pas encore d'évaluation
- Teórico de Fijación - Configuración Electrónica - Tabla Periódica - 6° Bancario 2023.Document9 pagesTeórico de Fijación - Configuración Electrónica - Tabla Periódica - 6° Bancario 2023.Estela MirandaPas encore d'évaluation
- Taller 1Document6 pagesTaller 1jhon lopezPas encore d'évaluation
- Principios de IngenieriaDocument30 pagesPrincipios de IngenieriaMarianny FernandezPas encore d'évaluation
- Food - Wastes BookDocument140 pagesFood - Wastes BookDaniela Giselle Araújo RodríguezPas encore d'évaluation
- 9 Espectroscopia de Altura de PulsosDocument58 pages9 Espectroscopia de Altura de PulsosbiomedicaPas encore d'évaluation
- A EstimulantesDocument3 pagesA EstimulantesDaniela Nohemí Alonso CruzPas encore d'évaluation
- Dynadet-C2-XXXms TDS 2018-03-20 Es SpainDocument2 pagesDynadet-C2-XXXms TDS 2018-03-20 Es SpaintiburcioPas encore d'évaluation
- Informe ADNDocument4 pagesInforme ADNPaulina Velandia LopezPas encore d'évaluation
- Practica 4 Ley de HessDocument2 pagesPractica 4 Ley de HessAnyi Vanessa Muñoz CampoPas encore d'évaluation
- Instructivo CuantiDocument12 pagesInstructivo CuantiManuel ValenzuelaPas encore d'évaluation