Académique Documents
Professionnel Documents
Culture Documents
Suero Antiofidico
Transféré par
Guander GuillenDescription originale:
Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Suero Antiofidico
Transféré par
Guander GuillenDroits d'auteur :
Formats disponibles
ARTICULOS
ORIGINALES
Rev Med Uruguay 1994; 10: 147-154
Produccin de suero antiofdico en Uruguay
Dra. Araceli Pino Cheroni
Resumen El presente trabajo, describe el proceso de produccin del suero antiofdico antibothrops bivalente, para uso teraputico, llevado a cabo por primera vez en el pas en la Divisin Produccin del Instituto de Higiene de la Facultad de Medicina. El suero, proveniente de equinos inmunizados con dosis crecientes de venenos bothrpicos activos, fue purificado mediante precipitaciones salinas, accin enzimtica y calor. De esta forma se obtiene una inmunoglobulina hipotxica e hiperinmune, capaz de neutralizar especljcicamente la accin de los venenos de Bothops neuwiedi y alternatus. El producto, que cumple con las normas internacionales, se presenta lquido, en frascos de 10 ml, conservado refrigerado, y es distribuido en todo el territorio, ~610 por el Ministerio de Salud Pblica. La aplicacin teraputica de este suero, desde el comienzo, demostr su total eficacia y no se han producido accidentes por el uso del mismo. Estos resultados han demostrado que es posible la produccin nacional de este inmunobiolgico con neutralizacin especfica, para los venenos de ofidios que producen uccide;ztes de entiak u en Uruguay. Asimismo se asegura para el pas su abastecimiento ,J permanente con una cobertura de lOO%, logrndose adems la independencia de laboratorios extranjeros y ganancia de divisas.
Palabras clave: Antivenenos - uso teraputico
Seroterapia Inmunoglobulina Mordeduras de serpiente - terapia Uruguay
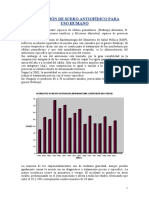
Antecedentes En Uruguay, los accidentes ofdicos por especies ponzoosas, si bien no son muy frecuentes, han sido causa de numerosas muertes. A los efectos de conocer su magnitud y normatizar el tratamiento, en 1986 la Divisin Epidemiologa del Ministerio de Salud Pblica (MSP) estableci que la mordedura por ofidios venenosos es de denuncia obligatoria. La mayor incidencia ocurre en primavera y verano, aunque pueden sucederse casos fuera de estos perodos
1. Mdico Especialista en Enfermedades Infectocontagiosas Jefe de Seccin, Divisin Produccin Sueros y Vacunas del Instituto de Higiene. Montevideo Correspondencia: Dra. Araceli Pino Cheroni. Atlntico 1654 bis. Montevideo. Presentado: 7/11/94 Aceptado: 21/11/94
si existen condiciones meteorolgicas favorables para la actividad del ofidio. Los accidentes predominan en trabajadores rurales, afectando en 20% a nios menores de 10 aos. Todos los casos registrados fueron producidos por ofidios del gnero Bothrops (l,*) (figura 1). El recurso teraputico frente al empozoamiento ofdico es la administracin del suero antiofdico (SAO) especfico que neutralice el veneno(,4). Segn la Organizacin Mundial de la Salud (OMS), la mortalidad en estos accidentes desciende de 74 a 12%, cuando se realiza el tratamiento precoz con el suero especfico? Hasta 1988, Uruguay importaba los SAO de Brasil y Argentina a travs del MSP, que es quien regula su abastecimiento. La dependencia de laboratorios extranjeros para la provisin del SAO, tiene varios inconvenientes:
147
Vol. 10 N3 Diciembre
1994
Dra. Araceli Pino Cheroni
del personaltcnico en el Instituto Malbrn de la Repblica Argentina (RA) por medio de becasotorgadas por la Oficina Panamericana la Salud (OPS)y con el resto de del personalque funcionabaen el Instituto de Higiene. Animales El primer lote de diez equinosfue proporcionado el por MSP. Los animales eran sanos. jvenesentre 2 y 5 aos y de msde 500 quilos de peso. Paralas pruebas potenciay seguridad, utilizaron de se ratonesblancosde 18 a 20 g de peso(IMusmusculus) de ambossexos,y libres de patgenos especficos. Paralas pruebasde inocuidad y seguridadseutilizaron cobayos machosde 300 a 350. g de peso y libres de patgenos especficos. Antgenos Como se careca de produccin local de veneno, en el comienzoseutilizaron venenosde Bothrops neuwiedi, y B. alternatus cedidospor el Instituto Malbrn obtenidos por la tcnicade ordeemanual,desecado vaco y conal servadosen fro hastasu reconstitucin. Adyuvantes Adyuvante de Freund completo (AFC), preparadoen nuestrolaboratrio segnla siguientefrmula: Arlacel 13,l ml, vaselina lquida 85 ml, tween 80 1,9 ml y BCG 1 mg/ml. Todos los componentes estese rilizaron por separado luegosemezclaronaspticameny te. Adyuvante de Freund incompleto (AFI), preparado con igualescomponentes el anterior, pero sin BCG, que y en condicionesde esterilidad. Solucin salina tamponada (SSB) estril, utilizada en la preparacinde la solucinmadrede venenosy SU posterior dilucin para las inmunizaciones segnlos requerimientos NaCI del protocolo estipulado. 8g
1986
1987
1988
1989
1990
1991
1992
1993
1994
Abril
1986-Abril
1994
Figura 1. Accidentes ofidicos en Uruguay, (segn datos de la Divisin Epidemiologa del Ministerio de Salud Pblica (MSP)
1)inseguridaden el abastecimiento que la produccin ya de estoslaboratoriosera insuficientepara la demanda de suspropios pases, 2) gasto de divisas, 3) limitacin de la importacina pases limtrofes, ya que de lo contrario, los antgenosutilizados en la produccin, suelentenerdiferente especificidad lo quelos por SAO son inadecuados para el tratamientodel emponzoamiento provocado por nuestrosofidios. No seconoce adems, antecedentes produccinnade cional, @VO el estudiode investigacinrealizadopor Laborde y col. @) el que describenla produccina nivel en experimental de una inmunoglobulinaespecficacontra el veneno de B. neuwiedi purificada solamente por precipitacin salina y liofilizada. Por todasestasrazones,las autoridades sanitarias consideraron de valor estratgicopara nuestropas, la produccin de SAO nacional. Siendo que el Instituto de Higiene deMontevideo, desde su fundacin en 1896,elaborasuerosheterlogosantitetnico y antidiftrico para uso humanoy veterinario de origen equino, resultla institucin idneaparatomar la iniciativa. En 1987la Divisin Produccindel Instituto de Higiene a travs de su SeccinSueros con el apoyo del MSP, y encar la produccin de suero bivalente antibothrops para uso humano.A continuacin sedescribeel proceso y susresultados.
Material y mtodo
CIK
Na2HPG4
KHzP04 c.s.p. Productos qumicos y otros
wo g !.!5 g 0.20g 1.000 ml
Materiales tcnicos El entrenamientonecesariose logr con la capacitacin 148
o Sulfato de amonio pursimo (Carlo Erba), 32 kg para 100litros de plasma i Toluol O,l% - 300 ml para 1OOlitros de plasma 3 Pirofosfato de sodio 0,2% - 600 ml para 100 litros de plasma 3 Soda a 40% 3 Acido clorhdrico p.p.a. 3 Pepsinal/lO.OOO(Sigma)- 1,25g por litro deplasma Revista Mdica
del Uruguay
Produccin de suero antiofdico en Uruguay
o Merthiolate a 10% (concentracin final l/lO.OOO) o Cloruro de Bario o Cloruro de Calcio a 25% Mtodos
Caracterizacin de los venenos
Cuadro 1
Protocolo de inmunizacin Equinos nmeros 21 al 30
Se sigui la metodologaaconsejada la OPS/OMS por parala elaboracin sueros de heterlogos, segn aplica se en el Instituto Malbrn(7-10). Antes de comenzarla inmunizacin se determin la potenciade cada uno de los venenos, utilizando ratones de 18 a 20 g, paracalcular la dosisletal 50 (DL50) aplicando mtodosestadstico&,*). La misma estuvo en menos 4 yglml para el venenode B. ulternatus y mede nosde 10 l.tg/ml paraB. neuwiedi.
Animales seroproductores
Los equinosfueron controlados un mdicoveterinapor rio, realizndosele, cada uno, su ficha sanitariaen la a cual se anotaronlascaractersticas su pelaje,identifide cacin, sexo, nmero,estadode las mucosas, dentadura y peso.Fueron numerados 21 al 30. del Se los vacun contra ttanosy sedesparasitaron. Antgenos: Sepreparunasolucinmadrede venenos de B. alternatusy B. neuwiedia unaconcentracin 10 de mg/ml, utilizando venenoscompletosy secos,reconstituidosc7). corrigi su pH a 7,2. Se los filtr clariesteSe rilizante por membranas Millipor de dimetro47 mm y poros0,8 y 0,22 u. Se control la esterilidad,seleccionando medios que desarrollarangrmenesaerobiosy anaerobios segnlo pautadopor la OMS-. Se realizaron las dilucionesdel veneno siguiendoel protocolo y usandocomo adyuvanteel de Freund completo (AFC), (AFI), y solucinsalinatamponada (SSB). Los mismosfueron completamente homogeneizados y conservados 5C. Para tal fin, se idearonfrascosesta riles que contenanuna barra magntica su interior y en cerrados hermticamente.Los componentesestriles, fueron mezcladosaspticamente dentro de estosrecipientes,los cualesuna vez cerrados,secolocaron sobre un agitadormagnticoobtenindose una correcta hoas mogeneizacinde los antgenoscon los adyuvantes y evitando la contaminacin.Se mantuvierona 5C hasta su inoculacin. En todasestasetapas personal el tcnico us sobretnica, gorro, guantesy tapabocas estriles.
Protocolos de inmunizacin
10 ml Subcutnea 0 1 mg AFC 10 ml Subcutnea 7 1 mg AFI 14 2 mg SS6 18 ml Subcutnea 21 2 mg SSB 18 ml Subcutnea Se interrumpe durante 30 dias por intolerancia 52 1 mg SSB 18 ml Subcutnea 56 1 mg SSB 18 ml Subcutnea 60 1 mg SSB 18 ml Subcutnea 67 1 mg SSB 18 ml Subcutnea Se descansa 60 das 10 ml Subcutnea 127 2 mg AFI 10 ml Subcutnea 134 3 mg AFI 139 4 mg SSB 18 ml Subcutnea 4 mg SSB 18 ml Subcutnea 140 18 ml Subcutnea 141 4 mg SSB 145 4 mg SSB 18 ml Subcutnea 146 4 mg SSB 18 ml Subcutnea 4 mg SSB 18 ml Subcutnea 147 18 ml Subcutnea 159 4 mg SSB 160 4 mg SSB 18 ml Subcutnea 161 4 mg SSB 18 ml S. Explorat. 171 Sangra de produccin
dosistambinsemanales variaron entre 1 y 2 mg de que veneno en AFI, completandoas un volumen de 10 ml por va subcutnea (sk). A los 21 dasde iniciadaslas inoculaciones,sedebieron interrumpir durante30 das,por intoleranciaal veneno, que apareci precozmentey se manifest por una marcadaprdida de pesoy reaccin local importante. Se prosiguia partir del da 52 al 67, con dosisque no superaronel miligramo de veneno, en un volumen total de 18 ml (SSB) por va s/c cada4 das. Previo a la reinmunizacinsedej descansar todo el a lote durante60 das, y sereinici el da 127 prolongndose hastael da 161. Se utilizaron dosis crecientesde venenosque fueron desde2 mg/ml a 4 mg/ml, en un volumentotal de 10 ml AFI y de 18 ml de SSB por va sic con una frecuencia al inicio de una dosis semanal en y las tres ltimassemanas, durantetres das seguidos. Obtencin del suero
Sangra
La primoinmunizaciny reinmunizacin se realizaron segnel protocolo preparadopara tal fin (cuadro 1) en el cual se estipularonuna dosisde un mg de solucin madrede veneno en adyuvante de AFC, seguidode una
Val. 10 NE3 Diciembre 1994
La sangraexploratoria se realiz el da 161 de la reinmunizacin, por puncin de la vena yugular del equino. El sueroobtenido setitul para cadaveneno por separado, mediantela tcnicade seroneutralizacin vivo, utiin 149
Dra. Araceli Pino Cheroni
lizando como animalde experimentacin ratn que fue el inoculado por va intravenosaen vena de la colai~Y. Cada ratn recibi 0,5 ml i/v de venenoa una concentracin l/lOOO, mezcladocon cantidades variablesdel suero de prueba. Se los observ durante 72 horas,al cabo de lascualesseprocedi a la lectura y a realizar losclculos estadsticoscorrespondientes(i2). De los iO equinosinmunizados,9 ienan ttuios neutralizantes aceptables (msde 900 pg/ml). Un caballo,el nmero2 1, mostruna neutralizacinincompletaparael componente neuwiedi. A los diez das de la ltima inoculacin serealizaron dos sangrasdefinitivas, separadas 48 horas,a los 9 por equinosque tenan buenarespuesta inmune. No serepuso el paqueteglobular por falta de estandarizacin de la tcnicac7). embargo,el procedimiento Sin fue muy bien tolerado por los animales.Se extrajeron 8 litros de plasmade cada uno. Dicho plasmase recogi en damajuanas estrilesde diez litros conteniendocitrato de sodioa 33%. El mismo da de la sangrasesepar paqueteglobularpor decanel tacin y se obtuvo un total de 79 litros de plasmasobrenadante. Purificacin del suero: obtencin de inmunoglobulina especfica Se realiz siguiendo las recomendaciones la OPS(7, de mediantedigestin pptica y precipitacionessalinas con sulfato de amonio (mtodo utilizado en el Instituto Butantn de Brasil), al cual se le agregpreviamenteuna etapade desfibrinacincon cloruro de calcio a 25%. Luego fue dializado contra agua destiladaa 5Cparaeliminar la sal de amonio. Se isotoniz con cloruro de sodio a 0.85% y seestabiliz supH entre6,00 y 7,OO. Comopreservativo seusel timerosala unaconcentracinfinal de 1/10.000 (figura 2). Posteriormentesiguieron las etapasde filtracin clariesterilizante, utilizando membranas acetatode celude losa con equipos de filtracin Sartoriuscon membranas de poro de 0,8 y 0,20 I-L. Se tomaron lascorrespondientes muestras paracontroles qumicos (protenas,pH, Hg, sulfato, PEF) y biolgicos (potencia, esterilidad,inocuidad y seguridad). Seenvasaspticamente frascosconteniendo10ml. en Determinacin de la actividad neutralizante de la hmunoglobulina especfica Paracada uno de los venenospor separado, inocularon se ratones de ambos sexosde i 8 a 20 gramos,con unamezcla de venenolantiveneno,de-jando constanteel antiveneno y aumentandola dilucin del veneno segnun factor de dilucin constante. 150
Plasma hiperinmune 1 Desfibrinacin con CICa, al 25% Plasma hiperinmune + Doble Hz0 estril l Subir temperatura a 30C y bajar pH a 3,2 Pepsrna 1/10.000-l, 25 gil plasma Digerrr durar-i& 30 mrnutos
Pirofosfato de sodio, 0,2% + Toluol 0,i % + Sulfato de amonio pursimo 12%, pH 4,3 calentar a 55 y mantener caliente 1 hora 1 Refrigerar a 40C y filtrar 0 centrifugar (descartar el precipitado) 1 Medir volumen sobrenadante, tPirofosfato 0,2% pH a 7.2 con Hidrxido de Sodio 10 M Precipitar con 20% de Sulfato de amonio pursimo Eliminar la espuma con antiespumante. I Dejar en reposo durante 12 horas. I Sifonar el sobrenadante que se descarta Filtrar el precipitado que se recoge. 1 Solubilizar el precipitado con Hz0 destilada estril y dializar en Hz0 destilada a 5C para eliminar sulfato. 1 Controlar pH, isotonizar y Merthiolatar 1110.000 Controles qumicos, biolgicos, esterilizacin por filtracin, controles, dilucin estril, controles, envasado y etiquetado. 1 Controles finales. Distribucin.
i
Figura 2.
Tcnica de procesamiento
del plasma.
Cada mezcla fue incubadaa 37C duranteuna hora y luego inyectada i/v en vena de cola. Se observaronlas muertes sobreel total de animales inyectados, luego dela primera hora de inoculacin (para descartarlas muertes provocadas por este procedimiento) y durante 48 hoTambinse inyectaron ratonescomo grupo control de los venenos en similares condiciones que lasreferidasanteriormente.
Prueba de esterilidad: Se inocul I ml de sueroa 28
Revista Mdica del Uruguay
Produccin de suero antiofdico en Uruguay
tubosque contenan14 ml de tioglicolato, cadauno. Se mantuvierona 34 y a 24 grados durante 14 das.Dos tuboscon el mediodecultivo, sedejaroncomocontrol, sin sembrar(). Prueba de inocuidad: Se inocularon 5 cobayos de 300-350 gramos,con 5 ml de sueropor va subcutnea. Se mantuvierondurantecuatro semanas observacin. en No se produjeronmuertesy todo el grupo aumentde peso;tampocohubo signosde intolerancia. Prueba de seguridad: Se inocularon2 ratonesde 18 a 20 g de peso,con 0,5 ml de sueropor va subcutnea. Se mantuvieronen observacin das.Se obtuvo iguales 7 resultados en el grupo anterior(). que Presenciade sulfatos: Comoreactivo seusel cloruro de bario a 5% ms0,5% de cido actico.Se tomaron 8 ml del aguade dilisisy sele agregaron2 ml del reactivo. No seobservturbidez, comparndolo el patrn con que contiene 0,08 g de SA por litro (mximo permitido)(7). Se enviaron adems, muestras dos laboratoriosde a control extranjero: Instituto Malbrn, RepblicaArgentina y LaboratoriosINCQS de Ro de Janeiro. Resultados El suerode produccinuruguaya,es una inmunoglobulina especfica,purificada y estril, que se presentaen frascosde 10ml. Cadamililitro neutraliza, msde 2.500 Fg de venenode B. alternatusy msde 1.500 vg de venenode B. neuwiedi. Comoconservante contienetimerosaly no msde 16 g% de protenas,pH 6-7. Tiene un perodo de validez de 3 aos. Su calidadcumplecon lasnormas para inmunoglobulinas heterlogas especficas la OMS.8~9 de Los informeselevadospor los dos laboratoriosde referenciafueron los siguientes: El Boletn de Anlisis del Laboratorio INCQS N 0948189 expresa:Potencia = 6,97 mg/ml, Toxicidad = Satisfactorio.Conclusiones: Satisfactorio.Departamento de Microbiologa e Inmunologa(7 dejunio de 1989). El Instituto Malbrn haceconstar: Potencia: 1 ml de sueroneutraliza3162 pg de veneno de B. alternatus. 1 ml de sueroneutraliza 1756 pg de venenode B. neuwiedi. Conclusiones: seformulan objeciones los resulno a tadoshallados.Departamento Contralor (3 1 de enero de de 1989) A principiosde 1988,secomenzsu aplicacinclnica, con excelenteresultado. Se distribuy en todoslos centroshospitalarios indel terior de la Repblica, en dondemsfrecuentemente se deben asistir accidentadospor mordedurasde ofidios
Vol. 10 N3 Diciembre 1994
ponzoosos. Esto permiti realizar el tratamientodel paciente en el Centro Asistencial msprximo, siguiendo laspautas establecidas la ComisinAsesoraNacional por de Ofidismo. Se reducenas, los trasladosa la capital(). Al momentoactual (1994), se ha abastecidoal MSP con 4.500 frascos. Se han tratado a 389 pacientesdesde1988. Falleci uno, a causade envenenamientograve, con diagnsticotardo, que sepresentcon un sangradomenngeo. La mortalidadsegnestacasustica, pues,de 0,25%. es No seprodujeronaccidentes el suministrodel sueen ro. Discusin La administracindel antiveneno especficopara el tratamiento de las mordeduras ofidios ponzoosos,es por mundialmente aceptada(~,8,9~19). Como animalseroproductor, todos los pases concuerdan, en que el equinoesel adecuado, su fcil manejo por y alto rendimientoen plasma(720). A diferencia nuestra,en Brasil y Costa Rica(20Z2), se ralizan sangras diariasdurantecuatro das,pero reponen el paqueteglobular. Este procedimientopresentala ventaja de obtenerel doble de plasma(16 litros) y poderreutilizar al animaldador, luego de un corto perodo de descanso. El lote equino nacional, no ha sufrido bajasy su rendimiento esel adecuadopara la demanda,por lo que no seplanteael realizar dicha tcnica. Ademsno secuenta con la infraestructuranecesaria, lo que los riesgosde por contaminacinseranmuy elevados. Costa Rica produce tambin pequeas cantidadesde suerode carnero, para aquellospacientesalrgicosa las protenasde caballos,o que ya han recibido sueros heterlogos en otrasoportunidades(2). Seentiendeque paranuestropasno sejustificara encarar estaproduccin, por el bajo rendimiento en volumen plasmtico carnero,sumado,a la infrecuenciade del la sensibilizacin sueroen la poblacin. por En cuanto al esquema inmunizacin, se ha reprode ducido lo recomendado la OPS variando los adyupor vantes. Esta experiencia se viene realizando tambin en Argentina y Brasil, con buenosresultados, que la cantiya dad de venenosrequeridaes menor,y los efectoslocales sonde escasa entidad(21,23). Referenteal usodel antgenocrudo, Kondo y col. proponen la toxoidizacin de los venenosmedianteel formol y calor, recomendandoesto para primoinmunizaCin(24). En Uruguay, Labordey col. (@ reprodujerondicha tc151
Dra. Araceli Pino Cheroni
nica lo cual prolong enormemente el protocolo de inmunizacin (510 das). Trabajos brasileos proponen el uso del glutaraldehdo para el tratamiento de venenos crotlicos y bothrpicos, pero no queda claro que sea adecuado para los venenos bothrpicos(2s). Al respecto, la OPS estima que deberan emplearse venenos toxoidizados. Sin embargo, ninguno de los tratamientos conocidos hasta el momento, proporciona toxoides con su antigenicidad sin alterar(). Nuestra experiencia fue favorable usando venenos activos desde el inicio de la inmunizacin. Si bien se produjo intolerancia, la misma fue resuelta poniendo en descanso al lote equino, durante 30 das se logr la inmunizacin completa al cabo de 161 das. No se perdi ningn equino y todos mantuvieron posteriormente buen estado. Los expertos recomiendan la mezcla de antgenos, ya que proporciona mejores ttulos que los sueros monovalentes, porque da un mejor balance de los antgenos y redunda en ptimos resultados teraputicos. Este procedimiento fue el adoptado por nosotros, preparando una solucin madre conteniendo los dos venenos. Se obtuvieron buenos resultados. En la purificacin de las inmunoglobulinas, la OMS afirma que no puede recomendarse una determinada tcnica de fraccionamiento, ya que las que se conocen obtienen productos inocuos, eficaces, estables y nada demuestra que un mtodo sea preferible a otro. Sin embargo, describe tres tcnicas que se utilizan en el Instituto Clodomiro Picado de Costa Rica y en el Instituto Nacional de Higiene de Mxico(7Z20X22). Nosotros optamos por la que proporciona preparaciones ms estables, de menor peso molecular y ms puras, a la cual se agrega una etapa de desfibrinacin con cloruro de calcio, ya que no se fenola el plasma. Esto ha permitido continuar con el proceso en forma inmediata. El resultado es un producto ms estable y menos antignico(7.26) Como contrapartida la prdida de potencia puede llegar a 50%. No podemos evaluar nuestro procedimiento desde este punto de vista, por tratarse de una inmunizacin e hiperinmunizacin iniciales, con resultados satisfactorios. La inmunoglobulina obtenida fue potente de acuerdo al requerimiento internacional y no se produjeron accidentes por suero. Referente a nuestra planta de fraccionamiento, si bien se adecua a la metodologa empleada, sera deseable poseer equipamiento ms moderno. tales como columnas cromatogrficas de intercambio inico y ultracentrfugas, 152
permitiendo as un proceso en circuito cerrado con alto rendimiento, poca manipulacin y baja contaminacin. Brasil en su centro de biotecnologa del Instituto Butantn ha instalado una planta piloto para fraccionamiento de inmunoglobulinas, que se encuentra en etapa experimental(2). Para la determinacin de la potencia de los antivenenos y venenos propiamente dichos, no existe nmgn mtodo que pueda recomendarse internacionalmente. La variacin en la composicin de los venenos, es tan grande, que difcilmente pueda concebirse una prueba nica general. Cada pas o regin, debe establecer sus propios parmetros para la dosificacin de sus sueros. An as, el requerimiento internacional en cuanto a la medida de potencia. exige la determinacin de la cantidad de veneno (en miligramos), que una unidad de volumen del antiveneno neutraliza por titulacin irz vivo. Se utiliza como animalde experimentacin,el ratn(7). Al igual que Bolaos y col., preferimosel uso de la va endovenosa ser msefectiva que la intraperitopor neal para la determinacinde la toxicidad de los venenos(7). Esta metodologa,que nosotrosadoptamos, tambin, tiene varios inconvenientes: ej. serequierede un elepor vado nmerode animales experimentacin,de deterde minado peso,libre de patgenos especficos,en un determinadotiempo. Esta tcnica eslaboriosay costosa. En cambioBrasil (27) prefiere la va intraperitoneal po~ encontarque de estamanerase eliminanlasmuertesinmediatas producidas losanimales experimentacin. en de por los componentes coagulantes los venenos. de Entendemosnecesario,desarrollartcnicasalternativas in vitro. As lo vienen realizandoBrasil, CostaRica y Argentina(780). Boche y Russellen 1968 y Kupulsupy col. en 1981 han propuestouna hernaglutanacin pasivay Teakstony Reid, en 1979 un ELISA). Recientemente, Gutirrez y col. en 1988,describieron una tcnica en placa, muy sensible,para cuantificar la actividad hemoltica indirecta de los venenosy para estudiar la capacidadneutralizantedel suero.Estosautores la proponencomo alternativa, al observarcorrelacinentre la neutralizaciny el efecto hemoltico indirecto@.33)
En el Instituto Butantn, Guidoln, Rosalvo y col. en 1989,describenel seguimientodel ttulo de anticuerpos antivenenomedianteel test de floculacin. Entendemos todos estostest in vitro, constituyen que una buenasolucin alternativa al problemade la tcnica de seroneutralizacin. Pensamos encaminarnuestrametodologa, en un sentido similar, tratando de lograr un mtodosencillo. confiable, y fcilmente reproducible. Revista Mdica del Uruguay
Produccin de suero antiofdico en Uruguay
Conclusiones Se cuenta con un organismo productor nacional de larga trayectoria, el Instituto de Higiene, en el cual se incorpor la tcnica de produccin de suero antiofdico, con escasas inversiones. El suero de produccin uruguaya, para uso teraputico, demostr ser de excelente calidad, cumpliendo con las normas internacionales en la materia. Por la metodologa empleada en su elaboracin, se obtuvo una inmunoglobulina hiperinmune bivalente, que neutraliza la accin de los venenos de Bothrops alternatus y B. neuwiedi simultneamente. Por tratarse de una preparacin en estado lquido, debe ser refrigerada y su validez es de 3 aos. Por otra parte, para mantener la continuidad y especificidad en la produccin, se ha puesto de manifiesto la necesidad de contar con un serpentario propio, de produccin. Esta etapa recientemente se ha culminado, a travs de un convenio con la Facultad de Ciencias (Ctedra de Zoologa Vertebrados). Se cuenta con reservas de venenos nacionales procedentes de los Serpentarios del Zoolgico de Montevideo y del Cerro Pan de Azcar. Es posible la exportacin a otros pases ya que hay capacidad tcnica instalada. Agradecimientos La autora agradece: 1) A todos los funcionarios de la Divisin Produccin de Sueros y Vacunas, del Instituto de Higiene, con cuyo esfuerzo y colaboracin se logr la fabricacin nacional de este suero. 2)Al MSP, por haber proporcionado el primer lote de equinos. 3) A las autoridades del Instituto Malbrn de la Repblica Argentina, por haber cedido los primeros venenos que permitieron iniciar este trabajo. 4) A OPS, por haber otorgado becas de capacitacin. 5)A las autoridades y funcionarios de las Intendencias de Montevideo (Zoolgico Municipal) y de Maldonado (Reserva de Flora y Fauna Autctona del Cerro Pan de Azcar), quienes autorizaron a extraer venenos de los ofidios all existentes y que hoy constituyen parte de nuestra reserva nacional de venenos. 6) A los licenciados F. Achaval y M. Meneghel, por colaborar en la extraccin de venenos de los ofidios del serpentario del Zoolgico de Montevideo y del Instituto de Higiene. 7)Al colega, Prof. Agdo. Dr. H. Purtscher, y al Ing. H. Massaldi, por la lectura crtica de este manuscrito. Rsum On dcrit ici le processus de production du srum antiopVo]. 10 N3 Diciembre 1994
hidien antibothrope bivalent, pour son emploi thrapeutique, men bout pour la Premiere fois au pays, au Dpartement de Production de 1 Institut d Hygine de la Facult de Mdecine. Le srum, provenant d quins immuniss avec des doses croissantes de venins bothropiques actifs, a t purifi au moyen de prcipitations salines, action enzimatique et temprature. Ainsi, on obtient une irnmunoglobuline hypotoxique et hyperimmunisante, capable de neutraliser spcifiquement 1 action des venins de Bothrops neuwiedi et alternatus. Le produit, qui respecte les normes internationales, se prsente liquide, dans des flacons de 10 ml, conserv au froid, et est distribu dans tout le territoire par le Ministre de la Sant Publique uniquement. L emploi thrapeutique de ce srum, depuis le dbut, a dmontr sa complete efficacit, ne s tant pas produit d accidents par son utilisation. On conclut que la production nationale de cet immunobiologique neutralisation spcifique, est possible en ce qui concerne les venins des serpents qui produisent des accidents graves en Uruguay. Tout de mme, on assure leur fournissement permanent 100% du pays, tout en restant indpendants des laboratoires trangers. Summaty The present work describes the process of production of the bivalent antibothrops antiophidian serum for therapeutic purposes, first implemented in Uruguay at the Production Division of Hygiene Institute of the Faculty of Medicine. The serum, derived from horses immunized with growing doses of active bothropic poisons, was purified by means of saline precipitations, enzymatic action and heat. In this manner it is possible to obtain a hypotoxic and hyperimmune immunoglobulin, capable of neutralizing sepecifically the action of poisons Bothrops neuwiedi and alternatus. The product, which meets international standards, presents a liquid consistence and is stored in 10 ml vials, preserved refrigerated and distributed throughout Uruguay only by the Ministry of Public Health. The therapeutic applications of this serum, from the onset, displayed its total effectiveness with overa11 absence of accidents. Available results have demonstrated the possibility of domestic production of this immunobiologic with specific neutralization for poisons of ofidians which produce a substantial number of accidents in Uruguay. Moreover it ensures its permanent supply with 100% coverage, independently of foreign laboratories. 153
Dra.
Araceli Pino Cheroni
Bibliografa 1. Purtscher H, Burger M, Savio E, RodrguezL, Vila B, CaorsiEL et al. Ofidismo y aracnoidismo en el Uruguay.
Diagnstico. tratamiento y complicaciones. Rev Med Uruguay 1983.7: (1) ll al 28. 2. Caritat R (hijo). Ofidismo en el Uruguay. In: Negro RC, Gentile 1. Enfermedades infecciosas. 2 ed. Montevideo: Edilimed, 1989: 1059-69 (tomo 2). ? Raid HA j Theakstnn RDG. I,esmorsures de scrpent. Bu11 Org Mond Sant 1984, 62 (1): 27-38. 4. Trinca GF. The treatment of snakebites. Med J Aust. 1963:
miologa. Comisin Asesora de Ofidismo. Medidas de emergencm frente a mordeduras de ofidios ponzofiosos. Montcvidco: MSP, 1989-93. 20.Prezdela Mora S, PrezMiravete A, Garca PrezG.
Estudio de proteccion cruzada cntrc sueros y venenos de las especies ms comunes de serpientes mexicanas. Rev Inv Salud Pblica Mxico 1972; 32: 145-57. 21. Raw1,Guidolin R, HisakoH, KelenE. Antivenins in Brazil: Preparation. Handbook of Natural Toxins Val. 5 Keptile and Anphibian Venoms. New York: Marcel Dekker, 1991: 557-81. 22.Bolaos Cerdas Produccin y control de sueros antiofR, L. dices en Costa Rica. Bol Of Sanit Panam 1980; 88 (3): 189-96.
275-80. 5. World HeaIth Organization.Progress in the characterization of venoms and standardization of antivenoms. Geneva: WHO 1984 (WHO offset Publication N 58). 6. Laborde H, SevcecC, LegnaniC. Preparacin y ensayo de un antiveneno (inmunoglobulina antiofdica) liofilizado activo contra veneno de Bothrops Neuwiedi (yara). Rev Med Uruguay 1989; 5: 20-27. 7. Organizacin Panamericana la Salud. de Manual de Procedimiento. Produccin y Pruebas de Control en la preparacin de antisueros diftricos, tetnico, botulnico, antivenenosos y gangrena gaseosa. Washington: OPS, 1977: 1@&41, 8. OrganizacinMundial dela Salud.Normas para los sueros antiponzoosos (Mordeduras de serpiente) (Normas para sustancias biolgicas, 21) (Serie de informes tcnicos, N 463) 1971:2&44. 9. OMS Comitde expertosen Patrones Biolgicos. 21er. informe. Normas para los sueros inmunes de origen animal. (Serie de Informes Tcnicos No41 3) Ginebra, 1969: 4944. I0. World Health Organization.Progress in the Characterization of venoms and standardization of antivenoms. Geneva: WHO, 1981. ll. ReedLJ, Muench H. A simple method of estimating fifty percent endpoints. Am J Hyg 1938; 27 (3): 493-7. 12.Finney DJ. Probit analysis, 3 ed. London: Cambridge University Press, 197 1. 13. GrassetE. Survey of assay methods of antivenins. Inmunological factors influencing antivenin standardization. Bull Org Mond Sant, 1957; 16: 79-122. 14. Kocholaty WF, Billings TA, Ashley BD, Ledford EB, Goetz JC. Effect of the route of administration on the neutralizing potency of antivenins. Toxicon, 1968; 5: 165-70.
23.Rolim RosaR, Viera EGJ, SilesVillarroel M, Siracusa YO, Iizuka H. Anlise comparativa entre os diferentes esquemas de hiperinmuniacao empregados na producao de soros antiofdicos pelo Instituto Butantn. Mem lnst Butantn 1980/X1; 44/45: 259-70.
24.Kondo S, SadahiroS,Yamauchi K, Kondo H, Muraba R. Preparation and standardization o toxoid from the venom of Trimeresurus tlavoviridis Biol, 1971; 24: 281-94. (Habu). Jpn J Med Sc
25.Guidolin R, Dazda Silva W, Higashi HG, Caricati CT, Lima ML, Morais JF, Pinto JR, MarcelinoJR. Hiperinmunizacao de cavalos soroproductores com venenos Botrpicos e crotlico tratados por glutaraldedo. Mem Inst Butantn, 1989: 51 (3): 85-90. 26. PopeCG. The action of proteolytic enzymes on the antitoxins and proteins in inmune sera. ll Heat denaturation after partial enzyme action. Br J Exp Path, 1939; 20: 201-12.
27.Villarroel Siles ZelanteF, RolimR, FurlanettoR. PaM,
dronizacao da titulacao de atividade txica de venenos Bothropicos, em camondongos. Mem lnst Butantn, 1978-
79;42/43:3I l-23. 28.EstradaR, GutierresJM, Alvarado J, RoblesA, Avila C, GonzlezM. Desarrollo de la respuesta de anticuerpos
antifosfolipasa A2 en caballos inoculados con veneno para la produccin de suero antiofdico polivalente en Costa Rica. Rev Biol Trop, 1989; 37 (2): 187-9 1. 29.BocheRD, Russell FE. Passive hemaglutination studies with snake venom and antivenin. Toxicon. 1968: 6: 125-30. 30.Gutirrez JM, Avila C, RojasG, Cerdas An alternaL. tive in vitro mcthod for testing the potency of the polyvalent/antivenenom produced in Costa Rica. Toxicon, 1988:
15.SilesVillaroel M, Rolim RosaR, ZelanteF, Furlanetto RS. Padronizakao de avalicao da potencia de antivenenos
Biotrpicos, en camondongos. 1978179; 42J43: 3254. Mem Inst Butantn,
26: (4): 41I-13. 3 1. TeakstonRDG, Reid H.4. Enzyme!inked inmunororbent
assay (ELISA) in assesing antivenom potency. Toxicon, 1979; 17: SI l-15.
16.Kocholaty WF, Ledford EB, Daly JG, Billing TA. ToxiCity and some enzymatic properties and activities in the venoms of Crotalidae, Elapidae and Veperidae. Toxicon 9, 1971: 131-S. 17.BolaosR. Toxicity of Costa Rican Sanke venoms for the white mouse. Am J Trop .%Ied Hyg 1972; 21: 36G-3. 18.OrganizacinMundial de la Salud.Normas generales de esterilidad para sustancias biolgicas en OMS. Serie de lnformes Tcnicos.Normas generales para sustancias biolgicas. Ginebra: OMS. 1960 (N 20): 13. 19. Uruguay, Ministerio de Salud Pblica-DivisinEpide-
32.DiasDa Silva W, Guidolin R, Raw 1, HigashiHG, Caricati CP,Morais JF et al. CROSS-rcactivity of horse monovalent anlivenoms to venoms of ten Bothrops species. Mem Inst Butantn, 1989; 51 (4): 153-68.
33.Higashi HG, GuidolinR, Nishikawa Yamaguchi AK, IK, Stephano Do Santos et al. ProduCao de anticorpos MA, MJ,
antiveneno total de corotalus durissus terrifucus em ca\.a/os por fosfolipase A2. Mem Inst Butantn. 1989: 5 1 (3): 91-100. 14.,irantes JB, Karmann G, Bier OG. Emprego d:! re;l;nn de tloculaqao especfica na dosagem do antiveneno crotdlico. Mem lnst Butantn, 1944145; 28: 214.
154
Revista Mdica del Uruguay
Vous aimerez peut-être aussi
- Producción de Suero Antiofidico PDFDocument5 pagesProducción de Suero Antiofidico PDFPatricia Santos TossiPas encore d'évaluation
- Guia Practicas Inmunologia 2013-IIDocument4 pagesGuia Practicas Inmunologia 2013-IIJose Marco Muñoz BocanegraPas encore d'évaluation
- Laboratorios de Parasitología y Planta de Producción de Productos BiológicosDocument13 pagesLaboratorios de Parasitología y Planta de Producción de Productos BiológicosBertha Felix TarazonaPas encore d'évaluation
- Trabajo de Investigación Sobre Serpentientes 3Document110 pagesTrabajo de Investigación Sobre Serpentientes 3jmpolycroPas encore d'évaluation
- Uso de Venenos de Origen AnimalDocument5 pagesUso de Venenos de Origen AnimalEster Elena Quijano MártirPas encore d'évaluation
- Brotes Epidemiologicos Por AntinutrientesDocument5 pagesBrotes Epidemiologicos Por AntinutrientesYöhana Flörëz100% (1)
- Eirc AlacranDocument6 pagesEirc AlacranErick RodriguezPas encore d'évaluation
- Practica Semana 13 ParasitologiaDocument11 pagesPractica Semana 13 ParasitologiaBertha Felix TarazonaPas encore d'évaluation
- Actualización Sobre La Suero Terapia (Año 2019)Document3 pagesActualización Sobre La Suero Terapia (Año 2019)mariaPas encore d'évaluation
- Trabajo Lucha SerpienteeeeeDocument82 pagesTrabajo Lucha SerpienteeeeejmpolycroPas encore d'évaluation
- Informe Desparasitación Vacas y PesajeDocument8 pagesInforme Desparasitación Vacas y PesajeJulio Pza100% (1)
- Evaluación de La Toxicidad Aguda Oral y de Sensibilización Cutánea de Microorganismos EficientesDocument12 pagesEvaluación de La Toxicidad Aguda Oral y de Sensibilización Cutánea de Microorganismos EficientesConsuelo González TrianaPas encore d'évaluation
- Trabajo Serpienteeeee (1) 99-1Document108 pagesTrabajo Serpienteeeee (1) 99-1jmpolycroPas encore d'évaluation
- Trichuris SPP., Strongyloides SPP., Moniezia SPP., Paramphistomum SPP., y Trichostrongylus SPPDocument1 pageTrichuris SPP., Strongyloides SPP., Moniezia SPP., Paramphistomum SPP., y Trichostrongylus SPPMirella MendozaPas encore d'évaluation
- Trabajo 13 T-1 - Pruebas de Laboratorio para El Diagnóstico de Enfermedades Zoonóticas y EtasDocument4 pagesTrabajo 13 T-1 - Pruebas de Laboratorio para El Diagnóstico de Enfermedades Zoonóticas y EtasJunior MamaniPas encore d'évaluation
- Qué Son Los AntivenenosDocument10 pagesQué Son Los AntivenenosChavivito0% (1)
- Determinacion de Staphylococcus AureusDocument26 pagesDeterminacion de Staphylococcus AureusDanni Mayorga MoralesPas encore d'évaluation
- Antidoto AntivenenoDocument8 pagesAntidoto AntivenenoEveling MendezPas encore d'évaluation
- Informe Final DE InvestigaciónDocument42 pagesInforme Final DE InvestigaciónOphidia.100% (4)
- Flavo TruchaDocument8 pagesFlavo TruchaErick FigueroaPas encore d'évaluation
- Inmunologia P2Document12 pagesInmunologia P2Daniel LieraPas encore d'évaluation
- Brotes Epidemiologicos Por AntinutrientesDocument4 pagesBrotes Epidemiologicos Por AntinutrientesYail Manuel Tapia SilgadoPas encore d'évaluation
- 215 705 1 PBDocument8 pages215 705 1 PBfabiPas encore d'évaluation
- Revista INIA 34 P. 10 15 PDFDocument6 pagesRevista INIA 34 P. 10 15 PDFRuben Carvajal CaballeroPas encore d'évaluation
- Presentacion de Un Caso de Tuberculosis Bovina en Tambo UruguayoDocument9 pagesPresentacion de Un Caso de Tuberculosis Bovina en Tambo UruguayoIsabel PereiraPas encore d'évaluation
- Articulos ResumenesDocument10 pagesArticulos ResumenesBrahiam RodriguezPas encore d'évaluation
- St. Aureus Samuel Mijares Alexandra GarciaDocument12 pagesSt. Aureus Samuel Mijares Alexandra GarciaSamuel de jesus mijares villegasPas encore d'évaluation
- Copros Ovinos Fcanto para Rdelab v2Document5 pagesCopros Ovinos Fcanto para Rdelab v2Pia Loreto Cid TroncosoPas encore d'évaluation
- CacacacDocument3 pagesCacacacSergio Del Aguila FelicianoPas encore d'évaluation
- VCM 153 ADocument7 pagesVCM 153 Achristian.sinchePas encore d'évaluation
- Inmunizacioěn y Sangrado de Animales FDocument13 pagesInmunizacioěn y Sangrado de Animales FAlejandra CallejasPas encore d'évaluation
- Serologia SanguineaDocument8 pagesSerologia SanguineaAngie RiscoPas encore d'évaluation
- ANTIOFÍDICOSDocument15 pagesANTIOFÍDICOSSaskia SaiedPas encore d'évaluation
- Micro 2 - Imforme1Document15 pagesMicro 2 - Imforme1Luzin Drelly Fernandez RubinaPas encore d'évaluation
- Vaccimonitor 1025-0298: Issn: Vaccimonitor@finlay - Edu.cuDocument5 pagesVaccimonitor 1025-0298: Issn: Vaccimonitor@finlay - Edu.cusergio_castro8Pas encore d'évaluation
- Brotes EpidemiologicosDocument4 pagesBrotes EpidemiologicosDarwin Junior Trujillo BuitragoPas encore d'évaluation
- Prueba Intradermorreacción para Deteccion de FasciolaDocument5 pagesPrueba Intradermorreacción para Deteccion de FasciolaJavier Manrique SalamancaPas encore d'évaluation
- Bubleja IncanaDocument5 pagesBubleja IncanaAngel Enrique Gómez EyzaguirrePas encore d'évaluation
- Sanidad CaprinaDocument5 pagesSanidad CaprinaValeria AvilaPas encore d'évaluation
- Informe 3Document13 pagesInforme 3DAIRON ELIECER ALMEYDA PIMIENTAPas encore d'évaluation
- Protocolo Solo de SanidadDocument15 pagesProtocolo Solo de SanidadArnold Saul Hernandez MuñozPas encore d'évaluation
- Recuento de StaphilococcusDocument6 pagesRecuento de StaphilococcusXimenaYaraPas encore d'évaluation
- Casos Clinicos y Herramientas de Diagnostico en Principales Enfermedades de AvesDocument12 pagesCasos Clinicos y Herramientas de Diagnostico en Principales Enfermedades de AvesCarlos Tamo0% (1)
- Desparasitacion TecnologicoDocument8 pagesDesparasitacion TecnologicoDiana Vallejos RodríguezPas encore d'évaluation
- Preguntas Frecuentes Sobre Antiofídicos - Héctor Charry RestrepoDocument4 pagesPreguntas Frecuentes Sobre Antiofídicos - Héctor Charry RestrepoOphidia.Pas encore d'évaluation
- 66-Opiniones Consumo CalostroDocument3 pages66-Opiniones Consumo CalostroYeleny De MoyaPas encore d'évaluation
- Trabajo de Virologia (Cerdos)Document24 pagesTrabajo de Virologia (Cerdos)Juan K NolascoPas encore d'évaluation
- ANABASANDocument10 pagesANABASANAnita Elizabeth Layza MendiolaPas encore d'évaluation
- Actividad 1 - Brotes EpidemiologicoDocument14 pagesActividad 1 - Brotes EpidemiologicoFormulacionPas encore d'évaluation
- Informe Parasitologia 2Document9 pagesInforme Parasitologia 2Stephany AlfaroPas encore d'évaluation
- Estudio de Depleción de Enrofloxacino en Huevos de Gallinas de PosturaDocument64 pagesEstudio de Depleción de Enrofloxacino en Huevos de Gallinas de PosturaSantiago Sarria VarelaPas encore d'évaluation
- Introduccion A La Ingenieria de Los Alimentos Paul Singh Dennis HeldmanDocument4 pagesIntroduccion A La Ingenieria de Los Alimentos Paul Singh Dennis HeldmanYuly Espinoza LeandroPas encore d'évaluation
- Perfil Del Proyecto de SeptimoDocument7 pagesPerfil Del Proyecto de SeptimoDiego Fernando Vega ChimarroPas encore d'évaluation
- Act 1 Toxicología y Seguridad AlimentariaDocument5 pagesAct 1 Toxicología y Seguridad AlimentariaAndrea CentenoPas encore d'évaluation
- Microbiologia AlimentosDocument18 pagesMicrobiologia AlimentosLuisPas encore d'évaluation
- Implementacion y Verificacion de Dos Metodos Cualitativos para La Deteccion de Salmonella SPP en Productos HidrobiologicosDocument30 pagesImplementacion y Verificacion de Dos Metodos Cualitativos para La Deteccion de Salmonella SPP en Productos HidrobiologicosVirginia AlmonacidPas encore d'évaluation
- 1091-Texto Del Manuscrito Completo (Cuadros y Figuras Insertos) - 4712-1!10!20120923Document4 pages1091-Texto Del Manuscrito Completo (Cuadros y Figuras Insertos) - 4712-1!10!20120923MariaPas encore d'évaluation
- Boletín Informativo INIA (Manejo Saitario Ovino)Document2 pagesBoletín Informativo INIA (Manejo Saitario Ovino)coty_gpmPas encore d'évaluation
- Determinación de Fasciola Por Técnica de ElisaDocument6 pagesDeterminación de Fasciola Por Técnica de Elisaevelin lopezPas encore d'évaluation
- Prevenc - Mordedura de SerpientesDocument60 pagesPrevenc - Mordedura de SerpientesChristiam LozadaPas encore d'évaluation
- Envenenamiento OfidicoDocument31 pagesEnvenenamiento OfidicoCHETOVIVESPas encore d'évaluation
- OPS Serpientes Venenosas Prevencion Tratamiento GuatemalaDocument116 pagesOPS Serpientes Venenosas Prevencion Tratamiento Guatemalapumanei50% (2)
- Suero Antiofifico Polivalente BiolDocument2 pagesSuero Antiofifico Polivalente BiolErick AlvarezPas encore d'évaluation
- Ficha Suero PDFDocument3 pagesFicha Suero PDFvictor montesinoPas encore d'évaluation
- Full Code 36 ResumenDocument4 pagesFull Code 36 ResumenErick Liñan AlarconPas encore d'évaluation
- Ofidismo: Accidentes Por Serpientes de La Especie Lachesis Muta - Héctor Charry RestrepoDocument13 pagesOfidismo: Accidentes Por Serpientes de La Especie Lachesis Muta - Héctor Charry RestrepoOphidia.100% (8)
- Anti Shiga Toxin ADocument6 pagesAnti Shiga Toxin AAle OssesPas encore d'évaluation
- Expo Sae OfidismoDocument27 pagesExpo Sae Ofidismocris7hian05Pas encore d'évaluation
- 2007 Manual Metodos Inmunologicos Completo Web PDFDocument139 pages2007 Manual Metodos Inmunologicos Completo Web PDFLiliana LinoPas encore d'évaluation
- Accidente Ofidico ModificadoDocument46 pagesAccidente Ofidico ModificadoVanessa BastardoPas encore d'évaluation
- Tarea 3 - ElaborarDocument22 pagesTarea 3 - Elaborarcharol noriegaPas encore d'évaluation
- Instructivo Manejo Accidente Ofidico-1Document6 pagesInstructivo Manejo Accidente Ofidico-1Fercho ÁlvarezPas encore d'évaluation
- CUESTIONARIO 2do PARCIAL - TOXICOLOGÍADocument15 pagesCUESTIONARIO 2do PARCIAL - TOXICOLOGÍAArturo Guillermo ChiquitoPas encore d'évaluation
- Empozoñamiento Ofídico y EscorpiónicoDocument33 pagesEmpozoñamiento Ofídico y EscorpiónicoandreaPas encore d'évaluation
- Caso Clinico-Expo FinalDocument16 pagesCaso Clinico-Expo FinalPedro Alejandro Mesias SanchezPas encore d'évaluation
- Mordedura de SerpienteDocument49 pagesMordedura de SerpienteFrancis Nicole50% (2)
- Capacitación en Prevención y Tratamiento de Accidente Biologico Ofídico y Suministro de Suero AntiofidicoDocument6 pagesCapacitación en Prevención y Tratamiento de Accidente Biologico Ofídico y Suministro de Suero AntiofidicoSandra BautistaPas encore d'évaluation
- Accidente OfidicoDocument19 pagesAccidente OfidicoNayla celmary González cunemoPas encore d'évaluation
- Ficha Accidente OfidicoDocument3 pagesFicha Accidente OfidicoHSBCalidadPas encore d'évaluation
- Suero AntiofidicoDocument9 pagesSuero AntiofidicoFiorella SánchezPas encore d'évaluation
- AplsDocument112 pagesAplsJosie Vuckovich100% (1)
- Mordedura de SerpienteDocument34 pagesMordedura de SerpienteGustavo Adolfo Cortes GiraldoPas encore d'évaluation
- Lista MsdsDocument25 pagesLista MsdsCarmen OrtizPas encore d'évaluation
- PRIMEROS AUXILIOS Tablilla Encuesta Miller Montealegre.Document22 pagesPRIMEROS AUXILIOS Tablilla Encuesta Miller Montealegre.Andres GutierrezPas encore d'évaluation
- NOM 033 SSA2 2002 Picadura de AlacranDocument16 pagesNOM 033 SSA2 2002 Picadura de Alacranbecky_meloniPas encore d'évaluation
- Guía de Aprendizaje No. 3 Fundamentos en ToxicologíaDocument11 pagesGuía de Aprendizaje No. 3 Fundamentos en ToxicologíaAna ValenciaPas encore d'évaluation
- Faboterapico - AntiviperinoDocument11 pagesFaboterapico - AntiviperinoAdriana GSPas encore d'évaluation
- Suero AntiofidicoDocument5 pagesSuero AntiofidicoMaferAlonsoPas encore d'évaluation
- Accidente Crotálico: EstudiantesDocument18 pagesAccidente Crotálico: EstudiantesGabriela Prado GumielPas encore d'évaluation