Académique Documents
Professionnel Documents
Culture Documents
Trabajo de Orbitales de 2
Transféré par
latino93Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Trabajo de Orbitales de 2
Transféré par
latino93Droits d'auteur :
Formats disponibles
The master class of rough slutfuck
mbres: Laboratorio de Qumica general Interpretacin probabilstica de los orbitales atmicos
Edgar Mrquez, David Fernndez, Jessica Suarez
Departamento de Qumica, Universidad del Valle, Yumbo, Colombia. * dafernan-@hotmail.com
1. Datos y resultados: Para una mejor observacin de los orbitales atmicos se hizo la prctica de laboratorio mediante el uso de una computadora en la cual tendramos acceso a la la pagina the probabilistic interpretation of atomic orbitals. Despus de acceder a esta pgina se pudieron observar todos los orbitales atmicos situados mediante un plano cartesiano con los ejes x y y posteriormente hacer una anlisis sobre el comportamiento de dichos orbitales y la probabilidad de encontrar electrones en este. 1. orbitales observados Orbitales s: forma esfrica con centro de probabilidad en el ncleo. Referencia 1 Orbital 1s: Foto 1
Orbital 2s: Foto2
Orbital 3s: Foto 3
Orbitales p: forma doble lobular con centro de probabilidad en el eje (x, y o z. tiene un nodo angular en el ncleo donde la probabilidad de encontrar el e- es nula. Referencia 1 0rbital 2px: Foto4
Orbital 2py: Foto 5
Orbital 3px: Foto 6
Orbital 3py: Foto 7
Orbitales d: forma de cudruple lobular con centro de probabilidad variante, tres en las bisectrices de un plano y el otro como doble lobular junto a un anillo sobre el eje no participante en el anterior. Referencia 1
Orbital 3dxy: Foto8
Orbital 3dx2-y2: Foto 9
Orbital 3dz2: Foto 10
1. Los orbitales 2pz, 3dxz, o 3dxy no fueron seleccionados en el grafico, por qu? No se puede ver por qu no existe una profundidad de campo, es decir la grafica solo se est presentando en x e y, debido a esto para la grafica z=0 y no permite seleccionar los elementos que necesiten una grafica en el plano z. 2. Seleccione el orbital 3s, y encuentra con ayuda del ratn el radio del nodo. Luego seleccione el valor del eje z y vari el valor as: 0, 50, 100, 200, 300, 400, 500, dando enter cada vez que quiera cambiar el valor. Que le pasa al nodo y por qu sucede esto. A medida que se va aumentando el nmero de z se reduce la densidad del nmero de electrones debido a que la longitud de onda aumenta, y la probabilidad de encontrar el electrn en una longitud de onda mayor que tienda a 0 es menor. 3. Seleccione el orbital dz2 con Z=0 vari el intervalo de 100 en 100 hasta llegar a 1000 pm. Observar. Encuentre el calor de para el nodo. Como se relaciona este valor con la figura del orbital en tres dimensiones.
A medida que van aumentando los valores en Z se hacen ms notorio el color rojo de manera que aumenta la probabilidad de que el electrn se encuentre en el plano del eje y. en cuanto al valor de dio como resultado 90, este resultado influye en el tipo de hibridacin que presenta el tomo debido a que representa el ngulo de separacin exacto que debe haber para que la atraccin de los electrones sea equilibrada.
4. En el orbital dz2 con el cursor llegue al nodo, seleccione el orbital 2pz con z=0, 100,500 observar.
A medida que aumenta el valor en z se disminuye la densidad de la nube de electrones, debido a que en este tipo de hibridacin los electrones no se reparten por el eje z. 2. clculos y resultados A partir de las fotos tomadas a cada uno de los orbitales se designo: El orbital 1s de color rojo no tiene nodos y tiene un radio de 315.0 pm Orbital 2s tiene un solo nodo de color rojo Orbital 3s cuenta con dos nodos de color rojo y azul el primer nodo rojo cuenta con un radio de 100.6 pm y el segundo nodo azul tiene un radio de 37602 pm Orbital 2px son dos esferas achatadas en las cuales no hay presencia de nodos, aqu hay un radio de o.o pm Orbital 2py tampoco hay nodos Orbital 2pz, 3pz, 3dxz, 3dyz no se visualizan porque solo se logra apreciar en el plano cartesiano los ejes y, y x, adems z se logra visualizar cuando la longitud de onda se hace mayor existe una frecuencia ms alta de la luz. Aqu z tena un valor de 0. 1. Parte dos la segunda parte de la practica tomando de base el orbital 3s se logro visualizar en un momento la presencia de el nodo pero a medida que se fue aumentando el valor de z este nodo fue disminuyendo hasta desaparecer los valores se variaron entre 50,100,200,300,400 y 500. Aqu con estas fotografas lograremos observar lo que paso en el orbital 3s. Z: o
Z: 50
Z: 100
Z: 200
Z: 300
Z: 400
Z: 500
En estas fotografas podemos asumir que a medida que se aumenta el valor de z el nodo se disminuye y la probabilidad de encontrar el electrn se hace ms elevada y la frecuencia de la onda aumenta podemos observarlo en el color rojo. Ntese que cada valor de d es un corte en el eje z y as nos muestra el orbital en tercera dimensin. El radio del nodo de este orbital: 366.4pm, valor que resulta al hacer un promedio entre cuatro medidas del radio: 366.2pm, 367.7pm ,361.2pm y 370.5pm En la siguiente figura se observa el orbital 3dz2, con diferentes distancias (d) entre el eje z y el ncleo y se tiene que en las graficas: 1) d=0, 2) d=100, 3) d=200,4) d=300,5) d= 400,6) d=500,7) d=600,8) d=700,9) d=800,10) d=900,11) d=1000.
Se observa el orbital 2pz, con diferentes distancias (d) entre el eje z y el ncleo. De esta manera en las graficas: 1) d=0, 2) d=100, 3) d=500.
DISCUSIN DE RESULTADOS. Un orbital es una regin del espacio en la cual se mueve un electrn con una frecuencia de aparicin dentro de una nube, debido a que el electrn se ha visto aunque muy poco probable fuera de la densidad o nube electrnica se dicho que esta regin no est limitada, sino marcada por la aparicin del electrn, en donde el electrn va a tender a aparecer y desaparecer en esta regin, por lo tanto no est definido la posibilidad de encontrarlo en una seccin fija aunque ya, la probabilidad de encontrarlo a una distancia fija del ncleo gracias a su frecuencia de aparicin en esa regin alrededor del ncleo la cual es claramente apreciable en las graficas de densidad donde el histograma nos marca en picmetros las zonas ms probables de hallar el electrn. Existe una probabilidad finita, pero muy pequea, de encontrar un electrn a mayores distancias del ncleo. Los volmenes que se utilizan para ilustrar a un orbital, son aquellos que contendrn al electrn 90 a 95% del tiempo esto est demostrado en la medida que los orbitales son zonas probables de hallar el electrn pero no son un confinamiento de la partcula. La interpretacin de que el electrn como una partcula localizada (apareciendo y desapareciendo) en el espacio, pero es probable que se encuentre en ciertas regiones alrededor del ncleo que en otras de acuerdo con la funcin de onda. La posicin del electrn en la pelcula se da cuando se haga una exposicin, si esta pasa cerca del plano XY, su posicin se registra como un punto. Con el paso del tiempo las regiones donde la mayora de observaciones se realizan se ven densamente salpicadas de puntos; mientras que las regiones en las que el electrn no es tan probable que sea visto sigue siendo oscura. Con el tiempo, el brillo de una regin en particular indica la probabilidad de que el electrn se encuentre all. L=0, (2L+1) solo hay un valor para ml, por lo cual se obtiene un orbital s, ambos orbitales 1s, 2s y 3s son esferas (lo mismo que todos los orbitales s superiores). El signo de la funcin de onda, y1s, es positivo (+) en todo el orbital 1s. El orbital 2s contiene una superficie nodal, es decir, un rea en donde y=0. En la posicin interna del orbital 2s, y2s es negativa. La funcin angular que representa a un orbital de tipo s es independiente del ngulo, lo que supone que un orbital s presenta simetra esfrica. Este orbital se representa normalmente mediante una superficie esfrica centrada en el ncleo. Los lmites de esta superficie esfrica definen la regin del espacio para la cual la probabilidad de encontrar al electrn es elevada, generalmente superior al 75%. Cualquier orbital de tipo s se representa con una superficie esfrica. La densidad electrnica decae muy rpido con el aumento de esta distancia al ncleo. Cuando L=1, (2L+1)=3 de modo que existen 3 valores para ml o 3 orbitales representados px, py y pz, tienen la forma de dos esferas que casi se tocan. El signo de fase de la funcin de onda, y2p, es positiva en un lbulo (o esfera) y negativa en el otro. El signo de fase se puede indicar con los smbolos + y -, pero para evitar confusiones con las cargas elctricas, se prefiere usar dos colores o dos tonalidades, tal como se ha hecho. Un plano nodal separa a los dos lbulos de un orbital p y los tres orbitales p se distribuyen en el espacio de manera que sus ejes se encuentran mutuamente perpendiculares. En la prctica hubieron tres orbitales p (2pz, 3pz) que no pudieron observarse en la parte uno
del laboratorio esto se debe a que se est trabajando en el plano XY solo pueden observarse en la parte 2 solo cuando se le dan valores al eje z entre -1000 y 1000 para ver bien definido los orbitales pz tanto en la posicin positiva como en la negativa. Cuando L=2, (2L+1)=5 y existen 5 valores para ml, que corresponden a cinco orbitales d, los cuales se representan como 3dxy, 3dyz, 3dxz, 3dx2-y2, 3dz2.. Todos los orbitales d tienen la misma energa siendo estos importantes porque explican el comportamiento de los elementos con nmero atmico mayor de 57, aunque no es fcil representar su forma. Otra manera de explicar la variacin entre el nmero de nodos es que cada orbital atmico viene determinado por un nmero cuntico principal n, que es simplemente el nmero total de nodos ms uno3. Evidentemente esto tambin se cumple en los diagramas de los orbitales de la figura #2, Por ejemplo el orbital 1s,no tiene nodos entonces el valor de n, va a ser 0+1 que es 1; si el orbital tiene dos nodos entonces 2+1 es 3,su numero cuntico principal seria 3,
Por consiguiente es importante resaltar que el hecho de que los orbitales p presenten n-2 nodos radiales, no quiere decir que los orbitales 2px, 2py no presenten ninguna superficie nodal, puesto que tambin existe otro tipo de nodo que es el llamado nodo angular. Los nodos radiales, son de forma esfrica, y los radiales son los que pasan por el centro del orbital; Esto explica por qu los orbitales s solo tienen nodos radiales. BIBLIOGRAFIA
Qumica- Raymond Chang. Novena Edicin. Pgs. 288-290. http://rabfis15.uco.es/weiqo/Tutorial_weiqo/Hoja6P1.html http://zeus.dci.ubiobio.cl/~allanos/Image87.gif http://www.iesrdelgado.org/tomasgomez/1%C2%BABachillerato/Orbitales.html Fisicoqumica, David Ball, McGraw-Hill pg 362-365
Vous aimerez peut-être aussi
- Problemas McCabe AbsorcionDocument15 pagesProblemas McCabe AbsorcionJurgen Corpi Gómez100% (1)
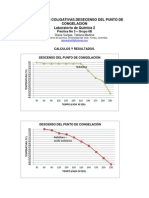
- Propiedades ColigativasDocument5 pagesPropiedades Coligativaslatino93Pas encore d'évaluation
- Celdas Electroquimicas Potencial de ElectrodoDocument7 pagesCeldas Electroquimicas Potencial de Electrodolatino93Pas encore d'évaluation
- Trabajo de Fisica TermodinamicaDocument27 pagesTrabajo de Fisica Termodinamicalatino93Pas encore d'évaluation
- Lab 4. % de Acido AsetilsalicilicoDocument7 pagesLab 4. % de Acido Asetilsalicilicolatino93Pas encore d'évaluation
- Permanganometria IDocument4 pagesPermanganometria Ilatino93Pas encore d'évaluation
- Informe de Analisis OrgánicoDocument5 pagesInforme de Analisis Orgánicolatino93Pas encore d'évaluation
- Determinación Del Agua de Hidratación de Una SalDocument3 pagesDeterminación Del Agua de Hidratación de Una SalAdolfo Ernesto Aguilar CastañedaPas encore d'évaluation
- Esteroquimica Ejercicios ResueltosDocument10 pagesEsteroquimica Ejercicios ResueltosEstela RomeroPas encore d'évaluation
- Lista de Propuestas para Trabajo de CCDocument16 pagesLista de Propuestas para Trabajo de CCQuecha Fafián SeoanePas encore d'évaluation
- Materiales de laboratorio químicoDocument7 pagesMateriales de laboratorio químicoKaren RGPas encore d'évaluation
- Definicion de Las EflorescenciasDocument3 pagesDefinicion de Las EflorescenciasCarlos Moises Yupanqui RomanPas encore d'évaluation
- 5to Examen Virtual Preca 2018 IDocument2 pages5to Examen Virtual Preca 2018 IAndresJuanPas encore d'évaluation
- Estudios de Parámetros en La Lixiviación en Pilas para Optimizar La Extracción de Oro PDFDocument93 pagesEstudios de Parámetros en La Lixiviación en Pilas para Optimizar La Extracción de Oro PDFJhoel SenjuPas encore d'évaluation
- Unidad de Filtro y Regulador LFR/ MicroDocument6 pagesUnidad de Filtro y Regulador LFR/ MicroCarlopio Albert GordonPas encore d'évaluation
- Acv s04 Laboratorio n0 2 Simulador de Propiedades Coligativas Fisicoquimica 8875Document16 pagesAcv s04 Laboratorio n0 2 Simulador de Propiedades Coligativas Fisicoquimica 8875Evelyn Patiño FloresPas encore d'évaluation
- Electromagnetismo y geometría: Una introducción a la física matemática modernaDocument381 pagesElectromagnetismo y geometría: Una introducción a la física matemática modernaKaren VillaPas encore d'évaluation
- Reporte II LEM IV Psicrometria Repaired AutosavedDocument19 pagesReporte II LEM IV Psicrometria Repaired AutosavedDavid Ramirez TorresPas encore d'évaluation
- Mecanica de Materiales 1, Practica 2Document6 pagesMecanica de Materiales 1, Practica 2Josué SandovalPas encore d'évaluation
- Activdad 3 PRUEBAS DE LAB PROTEINASDocument32 pagesActivdad 3 PRUEBAS DE LAB PROTEINASmariana mendezPas encore d'évaluation
- Seguridad IpercDocument48 pagesSeguridad IpercPaul NarvaezPas encore d'évaluation
- Leyes gases Charles AvogadroDocument9 pagesLeyes gases Charles Avogadromaferoliv50% (4)
- Hitamar Deber de InformaticaDocument10 pagesHitamar Deber de InformaticaRobert Hitamar Torres MoreiraPas encore d'évaluation
- Destilación SencillaDocument9 pagesDestilación SencillaSalome GutiérrezPas encore d'évaluation
- Exposicion ESTRIBOS PDFDocument62 pagesExposicion ESTRIBOS PDFerickPas encore d'évaluation
- Problemas de Unidades Quimicas de MasaDocument4 pagesProblemas de Unidades Quimicas de MasaCarlos Alfonso Jara Benites86% (7)
- Determinacion de Acido Acetico en Vinagre Comercial 1Document6 pagesDeterminacion de Acido Acetico en Vinagre Comercial 1JANET RAMIREZPas encore d'évaluation
- Fenilefrina (Agonista Alfa 1)Document2 pagesFenilefrina (Agonista Alfa 1)Jhon Alex Vílchez Altamirano100% (1)
- Cono de AbramsDocument7 pagesCono de AbramsdrekongkPas encore d'évaluation
- SG-SST-PRM-003 Programa de Sustancias QuimicasDocument32 pagesSG-SST-PRM-003 Programa de Sustancias QuimicasChela SalazarPas encore d'évaluation
- Propiedades líquidos, gases y sólidosDocument4 pagesPropiedades líquidos, gases y sólidostayshaPas encore d'évaluation
- M121 Variantes Tratamiento AireDocument4 pagesM121 Variantes Tratamiento AireVictor Angel Miranda Cordero100% (1)
- Anestésicos GeneralesDocument3 pagesAnestésicos GeneralesApolo Nave100% (1)
- Lab5 Tratamientos TérmicosDocument11 pagesLab5 Tratamientos TérmicosCésar SánchezPas encore d'évaluation
- TRYPPLAIDocument18 pagesTRYPPLAITairochi Huansi AlvanPas encore d'évaluation