Académique Documents
Professionnel Documents
Culture Documents
Metabolismo Do Glicogênio
Transféré par
Sara EsterTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Metabolismo Do Glicogênio
Transféré par
Sara EsterDroits d'auteur :
Formats disponibles
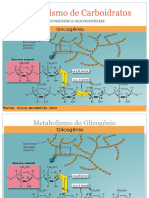
Metabolismo do Glicognio O excesso de glicose convertido em formas polimricas de armazenamento, e no caso dos animais vertebrados e muitos micro-organismos, em forma
ma de glicognio. Nos vertebrados, o glicognio, a reserva energtica dos animais, encontrado principalmente no fgado e no msculo esqueltico, podendo apresentar at 10% do peso do fgado e 1 a 2% do peso do msculo. O glicognio armazenado em grandes grnulos citoslicos, na forma de partculas eltron-densas. A ele so agregados complexos do glicognio junto s enzimas que o sintetizam e o degradam (e sua maquinaria de regulao) continuamente. A partcula bsica do glicognio a partcula , com cerca de 55.000 resduos de glicose (interligados por ligaes -1,4 e ramificaes -1,6). O glicognio armazenado no msculo esqueltico encontra-se sob forma de ATP, uma moeda energtica, sendo, portanto uma fonte de energia rpida para o metabolismo aerbico e anaerbico. J o glicognio heptico serve para a manuteno de glicemia, com um reservatrio de glicose para os outros tecidos quando no h glicose disponvel (entre as refeies ou no jejum); isto especialmente importante para os neurnios do crebro, que no podem usar cidos graxos (gordura) como combustveis. O glicognio do fgado esgota-se no intervalo de 12h e 24h. A quantidade de glicognio armazenada nos mamferos bem menor que a quantidade de gordura armazenada. O glicognio tambm pode ser obtido atravs da dieta, sendo degradado no intestino, e para isso necessrio um conjunto especfico de enzimas hidrolticas que convertem glicognio em glicose livre. Para o metabolismo do glicognio h dois processos essenciais: a sua degradao e sntese. A estes processos, d-se o nome de glicogenlise e glicognese, respectivamente. Em linhas gerais, para que ocorra a degradao de glicognio a glicose-1-fosfato, pela glicogenlise, o indivduo deve estar no estado de jejum breve/curto (cerca de 18h) quando o organismo necessita utilizar as reservas devido ausncia de glicose. Para que ocorra, portanto, a sntese de glicognio, pela glicognese, o indivduo deve estar no estado alimentado, ps-absortivo, onde se h o excesso de glicose, como reserva energtica. A maioria dos msculos esquelticos do corpo humano uma mistura de fibras vermelhas (possuem muita mitocndria e mioglobina; fluxo sanguneo rico; converso
de glicognio em gs carbnico e gua) e fibras brancas (menos mioglobina e mitocndrias; converso de glicognio lactato). Desta forma, o exerccio fsico mobiliza glicognio muscular para formao de ATP. DEGRADAO DO GLICOGNIO: GLICOGENLISE Glicognio heptico: degradado produzindo glicose para manter a glicemia. Glicognio muscular: degradado para produzir energia para a prpria fibra muscular em contrao intensa.
No msculo esqueltico e no fgado, as unidades de glicose das ramificaes externas (equivalente s extremidades redutoras, possuem hidroxila heterosdica livre) entram na via glicoltica pela ao de trs enzimas: 1) Glicognio-fosforilase; 2) Enzima de desramificao; 3) Fosfoglicomutase; A degradao do glicognio catalisada pela glicognio-fosforilase. Esta enzima catalisa a reao na qual uma ligao -1,4 entre dois resduos de glicose em suas extremidades no redutoras atacada por um fosfato inorgnico (Pi), removendo o resduo terminal na forma de glicose-1-P esta reao de fosforlise, onde parte da energia da ligao glicosdica preservada pela formao do ster de fosfato, que a glicose-1-fosfato. Um importante cofator na reao da glicognio-fosforilase o piridoxal-fosfato, onde o seu grupo Pi quem promove o ataque (resulta na clivagem) ligao glicosdica. A glicognio-fosforilase vai agindo repetidamente sobre as ligaes -1,4 das extremidades no redutoras at que, ao findar 4 resduos de glicose de um ponto de ramificao, ela pra (a enzima) para sofrer ao de outra enzima, a de desramificao (formalmente chamada de oligo -1,6 a -1,4 glican-transferase). A enzima de desramificao catalisa duas reaes sucessivas ( bifuncional) que removem as ramificaes: primeiro na forma de transferase, removendo um bloco de trs resduos de glicose da ramificao para uma extremidade no redutora prxima, a qual religado por uma ligao -1,4; segundo, na forma de glicosidase, onde o resduo remanescente no ponto de ramificao, em ligao -1,6, ento liberado como glicose livre. A glicose-1-fosfato (glicose livre, produto final da glicognio-fosforilase) convertida em glicose-6-fosfato pela terceira enzima envolvida no processo de glicogenlise, a fosfoglicomutase (catalisa uma reao reversvel) doa um grupo fosforil ao C6 e aceita um grupo fosforil em C1. Quando formada no msculo esqueltico, a glicose-6-P pode entrar na gliclise e servir como fonte de energia para a contrao muscular. Quando no fgado, a degradao de glicognio serve para liberar glicose para o sangue quando o nvel glicmico no mesmo encontra-se diminudo (como entre as refeies), por isso requer a enzima glicose-6-fosfatase presente neste rgo e nos rins. A G6P,
A PP1 (fosforilase--fosfatase) atua sobre o mm em repouso, removendo os grupos fosforil da GPa, convertendo-a em GPb. FIK A DIKA
que formada no citosol, sofre hidrlise da glicose-6-fosfatase na superfcie do lmen do retculo endoplasmtico aps ser transportada para o mesmo atravs de um transportador especfico T1. Acredita-se que os produtos resultantes, Pi e glicose sejam transportados de volta para o citosol por transportadores tambm especficos, o T2 e T3, sendo que a glicose deixa o hepatcito por um outro transportador, o GLUT2 presente na membra plasmtica. Os msculos e tecido adiposo no podem converter glicose-6-P em glicose atravs da degradao de glicognio porque no possuem a enzima glicose-6-fosfatase; portanto, estes tecidos no fornecem glicose para o sangue. REGULAO DA GLICOGNIO-FOSFORILASE: esta enzima no msculo esqueltico existe em duas formas interconversveis: glicognio-fosforilase a, cataliticamente ativa, e glicognio-fosforilase b, menos ativa. A GPb predomina no mm em repouso, mas que numa atividade muscular intensa, a adrenalina capaz de converter a GPb em GPa, sua forma mais ativa. Ainda h a atuao do glucagon na ativao da GPb em GPa, sendo o local desta converso nos hepatcitos e no nos micitos. Como ocorre? Em sntese, o glucagon/adrenalina liga-se a um receptor proteico especfico na membrana plasmtica dos hepatcitos/micitos, estimulando a protena Gs, que atravs de uma conformao proteica, sua subunidade liga-se a adenilato ciclase, que converte ATP em cAMP, que por sua vez ativa protenas-quinases (mais especificamente PKA), que atravs de tantas outras cascatas de sinalizaes vai ativando e/ou desativando, por fosforilao, outras molculas. A PKA ativa ser responsvel pela fosforilao da fosforilase-b-quinase, que catalisa e fosforila os resduos presentes nas duas subunidades idnticas da glicogniofosforilase, ativando-a e estimulando, desta forma, a degradao de glicognio. Esse resultado no msculo corresponde ao combustvel para a gliclise sustentar a contrao muscular para a resposta de luta ou fuga sinalizada pela adrenalina. No fgado, a degradao do glicognio age contra a baixa glicose sangunea sinalizada pelo glucagon, liberando glicose. No msculo ocorre regulao da glicognio-fosforilase por modificaes covalentes. O Ca2+, que o sinal para a contrao muscular, liga-se fosforilase-b-quinase deixandoa em sua forma mais ativa, que a fosforilase-a-quinase, pela ao da calmodulina. O acmulo de cAMP devido contrao vigorosa no msculo, resultado da degradao de ATP, se liga a PKA ativando-a, acelerando a liberao da glicose-1-P a partir do glicognio. Quando os nveis de ATP esto normais, o ATP bloqueia o stio alostrico para converso em cAMP, causando a inativao da fosforilase-quinase. No fgado, a glicognio-fosforilase regulada hormonalmente. Aqui, a forma desfosforilada totalmente inativa. glicose no sangue, o glucagon ativa a fosforilase-b-quinase, convertendo-se em sua forma mais ativa, a fosforilase-aquinase, que d incio a liberao da glicose para o sangue. Quando os nveis de glicose esto normalizados, a glicose entra nos hepatcitos ligando-se a um stio alostrico inibitrio da fosforilase a. O stio alostrico para a glicose permite a glicognio-
Glicognio-fosforilase a ou b (GPa ou denominada sendo GPb) est posteriormente como fosforilase a ou b. FIK A DIKA
fosforilase heptica atuar como seu prprio sensor de glicose e responder adequadamente s alteraoes na glicose sangunea.
MECANISMO DE CASCATA DA AO DA ADRENALINA E DO GLUCAGON Tanto a adrenalina nos micitos quanto o glucagon nos hepatcitos ligam-se a receptores especficos de superfcie e ativam uma protena de ligao a GTP, Gs. Esta protena quando ativada provoca uma elevao na [cAMP], mediante converso do ATP em cAMP pela adenilato ciclase, o que ativa PKA. Isto inicia uma cascata de fosforilaes; PKA ativa a fosforilase-b-quinase, que ativa a gligognio-fosforilase. Sendo que nos micitos, para que a PKA possa ativar a fosforilase-b-quinase que se encontra inativa nessas clulas, h necessidade de [Ca2+]. Na forma de GPa ativa, o [cAMP] nos micitos permite a posterior degradao de glicognio em glicose-1-P, enquanto que nos hepatcitos a forma ativa de GPa j encaminha para a degradao de glicognio em glicose. Tais caractersticas causam amplificao do sinal inicial. A degradao de glicognio decorrente fornece glicose, que no micito pode suprir o ATP (via gliclise) para a contrao muscular e no hepatcito liberada para o sangue para se opor glicose sangunea baixa.
REVIEW ~ TRS FORMAS DE REGULAO DA GLICOGNIO-FOSFORILASE 1) Alostrica; 2) Modificao Covalente; 3) Hormonal; A regulao alostrica d-se da seguinte forma (resumidamente, sem detalhes): 1) A adrenalina une-se ao seu receptor especfico; 2) O receptor ocupado causa troca do GDP ligado protena Gs (estimulatria e neste caso inativa) por GTP, ativando a Gs; 3) A subunidade da Gs move-se at a adenilato ciclase, ativando-a; 4) A adenilato ciclase catalisa a formao de cAMP a partir de ATP; 5) O cAMP ativa a PKA; 6) A fosforilao das protenas celulares pela PKA causa resposta celular adrenalina; 7) Quando ocorre a degradao do cAMP, no h ativao da PKA (pela ao da enzima fosfodiesterase, um nucleotdeo cclico). GLICOGNSE Corresponde sntese de glicognio, que ocorre em quase todos os tecidos animais, mas mais importante no fgado e no msculo esqueltico. A condensao de um nucleosdeo-trifosfato com uma hexose-1-fosfato para formar um nucleotdeo de acar tem uma pequena variao de energia livre positiva, mas a reao libera pirofosfato (PPi) que rapidamente hidrolisado pela pirofosfatase inorgnica, reao esta que fortemente exergnica. O ponto de partida para a sntese de glicognio a glicose-6-P: a primeira reao a da glicoquinase no fgado ou hexoquinase em tecidos perifricos que converte a glicose livre na presena de ATP em glicose-6-P + ADP.
Para dar incio sntese do glicognio, a fosfoglicomutase transforma glicose-6-fosfato em glicose-1-fosfato. O produto da ao da fosfoglicomutase, a glicose-1-P convertida na presena de UTP (nucleotdeo carreador da glicose para a sntese de glicognio) pela ao da UDPglicose-pirofosforilase a UDP-glicose (um nucleotdeo de acar) + PPi. O UDP formado convertido de volta a UTP pela enzima nucleosdeo difosfato quinase (UDP + ATP UTP + ADP). UTP perde 2Pi UMP. O UMP por sua vez pega o Pi da glicose-1-P e transforma-se em UDP-glicose (UDPG), atravs da ao enzimtica da UDPG pirofosforilase. Quando ocorre a formao de UDPG a partir da juno do UMP com o grupo fosforil da glicose, este apresenta consigo o grupamento pirofosfato (PPi), que sofre ao de uma enzima denominada de pirofosfatase inorgnica, transformando o PPi em 2 molculas de fosfato inorgnico 2Pi (processo irreversvel). A insulina, um hormnio anablico, importante por aqui: seu aumento acarreta o aumento da sntese de glicognio, que faz com que ocorra a ativao da enzima glicognio sintase em seu stio alostrico. A glicognio sintase transfere o resduo glicosil ativado de UDPG para o C4 de um resduo da cadeia de glicognio em crescimento para formar nova ligao glicosdica do grupo hidroxilado C1 do acar ativado. A glicognio sintase no forma as reaes glicosdicas -1,6, quem as forma a glicosil4,6-transferase (a enzima de ramificao). Ramificao: uma vez formada uma cadeia com pelo menos 11 resduos, uma enzima ramificadora remove um bloco de cerca de 7 resduos e transfere para a outra cadeia para produzir ligao -1,6. Resduos adicionais de glicose podem ser ligados nova ramificao pela glicognio-sintase. O efeito biolgico da ramificao tornar a molcula mais solvel e aumentar o nmero de stios acessveis glicognio-fosforilase e glicognio-sintase, as quais agem somente nas extremidades no redutoras. A glicogenina uma protena iniciadora ou primer necessrio para a sntese de glicognio, assim como a enzima que catalisa essa montagem. Assim, s ocorre ao da glicognio sintase caso aja previamente a atuao da glicogenina. Esta enzima capaz de se auto glicosidar, ou seja, forma uma cadeia de resduos glicosil nela mesma com ligaes -1,4. A glicogenina catalisa duas reaes diferentes: o ataque inicial pelo grupo hidroxlico da Tyr194 sobre o C1 da parte glicosil da UDP-glicose resulta em um resduo de Tyr glicosilado. O C1 de outra molcula de UDP-glicose agora atacado pelo grupo hidroxlico do C4 da glicose terminal, e essa sequncia se repete at formar uma molcula nascente de glicognio com oito resduos de glicose unidos por ligaes glicosdicas -1,4. FORMA HEPTICA O fgado responsvel por sintetizar, armazenar e degradar o glicognio, alm de manter estveis as taxas de glicemia. A ocorrncia de uma disfuno heptica devido ao depsito de glicognio com hepatomegalia e hipoglicemia.
Vous aimerez peut-être aussi
- Resumo - GlicóliseDocument11 pagesResumo - Glicólisemaelson100% (2)
- Prolactina e Diabetes Melito do tipo 2: o efeito protetor de um hormônio sobre o metabolismo glicídicoD'EverandProlactina e Diabetes Melito do tipo 2: o efeito protetor de um hormônio sobre o metabolismo glicídicoPas encore d'évaluation
- Glicogênese e Glicogenólise OKDocument3 pagesGlicogênese e Glicogenólise OKlau24bronzattoPas encore d'évaluation
- Metabolismo Do GlicognioDocument15 pagesMetabolismo Do GlicognioDaniel FreirePas encore d'évaluation
- Topologia dos Principais Transportadores de Açúcares: uma abordagem sobre a estrutura e função dos GLUT'sD'EverandTopologia dos Principais Transportadores de Açúcares: uma abordagem sobre a estrutura e função dos GLUT'sPas encore d'évaluation
- Metabolismo GlicogênioDocument25 pagesMetabolismo GlicogênioLara SalesPas encore d'évaluation
- Metabolismo EnergéticoDocument7 pagesMetabolismo EnergéticoMariana PaesPas encore d'évaluation
- Atividade GliconeogêneseDocument5 pagesAtividade GliconeogêneseGatodo FabaPas encore d'évaluation
- Resumos BioquímicaDocument14 pagesResumos BioquímicaGabrieli HoepersPas encore d'évaluation
- Gliconeogenese e Metabolismo Do GlicogênioDocument27 pagesGliconeogenese e Metabolismo Do GlicogênioRicardo BorgesPas encore d'évaluation
- Aula 22 - Neoglicogênese, Ciclo de Cori e de AlaninaDocument22 pagesAula 22 - Neoglicogênese, Ciclo de Cori e de AlaninaAndré Jason MendesPas encore d'évaluation
- Metabolismo Glicognio Regulao2022Document35 pagesMetabolismo Glicognio Regulao2022amanda abreuPas encore d'évaluation
- Sintese e Degradação Do Glicogênio e CKDocument33 pagesSintese e Degradação Do Glicogênio e CKwandersom costa de souzaPas encore d'évaluation
- Introdução Ao MetabolismoDocument6 pagesIntrodução Ao MetabolismoLuanaPas encore d'évaluation
- GliconeogeneseDocument4 pagesGliconeogeneseAline PereiraPas encore d'évaluation
- Bioquímica-Fisiológica-Exame 210129 010644Document7 pagesBioquímica-Fisiológica-Exame 210129 010644Joana Carolina Teixeira RibeiroPas encore d'évaluation
- Estudo Dirigido BioquimicaDocument5 pagesEstudo Dirigido Bioquimicaadelsonribeiro100% (4)
- Biossintese de Carboidratos BioquímicaDocument6 pagesBiossintese de Carboidratos BioquímicaMarcela Lima de BritoPas encore d'évaluation
- GLICONEOGÊNESEDocument3 pagesGLICONEOGÊNESEHermes Sales CamposPas encore d'évaluation
- Metabolismo de CH II (Odonto)Document17 pagesMetabolismo de CH II (Odonto)Fernanda LacerdaPas encore d'évaluation
- Aula 9 - GLICONEOGÊNESE - 2020-1Document21 pagesAula 9 - GLICONEOGÊNESE - 2020-1Eveny PereiraPas encore d'évaluation
- 6.2 Metabolismo de CHO - Gliconeogênese e GlicogênioDocument20 pages6.2 Metabolismo de CHO - Gliconeogênese e GlicogênioAna SilvaPas encore d'évaluation
- Glicogênese, Glicenolise, GliconeogeneseDocument3 pagesGlicogênese, Glicenolise, GliconeogeneseLaryssa KlugePas encore d'évaluation
- Bioquimica Metabolica-ResumoDocument15 pagesBioquimica Metabolica-Resumodani_eleine0% (1)
- BIOQUÍMICA II 02 - Glicólise e GliconeogêneseDocument8 pagesBIOQUÍMICA II 02 - Glicólise e GliconeogêneseTúlio MaranhãoPas encore d'évaluation
- Gliconeogênese - Wikipédia, A Enciclopédia LivreDocument25 pagesGliconeogênese - Wikipédia, A Enciclopédia LivreAnderson SilveiraPas encore d'évaluation
- Metabolismo Dos HC - Glicogénsese e Glicogenólise 05-11-2018Document28 pagesMetabolismo Dos HC - Glicogénsese e Glicogenólise 05-11-2018DiogoFevereiroPas encore d'évaluation
- Bioquímica Área IIDocument35 pagesBioquímica Área IINilza UFRGSPas encore d'évaluation
- Metabolismo de CarboidratosDocument4 pagesMetabolismo de CarboidratosHellycláudia ChavesPas encore d'évaluation
- Trabalho GlicogenóliseDocument6 pagesTrabalho GlicogenóliseJulia MoraesPas encore d'évaluation
- Metabolismo de CarboidratosDocument16 pagesMetabolismo de CarboidratosIhury JhonsonPas encore d'évaluation
- Revisão Prova 2 - CarboidratosDocument28 pagesRevisão Prova 2 - CarboidratosJohanaPas encore d'évaluation
- Resumos de BioquimicaDocument42 pagesResumos de BioquimicaAna Carolina Soares EstevesPas encore d'évaluation
- Fichamento Sobre CarboidratosDocument20 pagesFichamento Sobre CarboidratosAline da Silva Fernandes MatiasPas encore d'évaluation
- Estudos Dirigidos de Bioquã - Mica - Google DriveDocument6 pagesEstudos Dirigidos de Bioquã - Mica - Google DriveMONARA DE ANDRADE MARTINSPas encore d'évaluation
- GlicogêneseDocument5 pagesGlicogêneseLuanaPas encore d'évaluation
- Glicolise e Ciclo de KrebsDocument12 pagesGlicolise e Ciclo de KrebsLaryssa KlugePas encore d'évaluation
- Lista Metabolismo Do Glicogênio e Ciclo de KrebsDocument17 pagesLista Metabolismo Do Glicogênio e Ciclo de KrebsGuilherme Belak SchmitkePas encore d'évaluation
- SP 8 - BioquímicaDocument21 pagesSP 8 - BioquímicaNathally NeriPas encore d'évaluation
- Aula 14 - GluconeogéneseDocument24 pagesAula 14 - GluconeogéneseaptgaptgPas encore d'évaluation
- Metabolismo Dos CarboidratosDocument31 pagesMetabolismo Dos CarboidratosRenata AdonesPas encore d'évaluation
- BIOQUÍMICA II 02 - Glicólise e Gliconeogênese PDFDocument8 pagesBIOQUÍMICA II 02 - Glicólise e Gliconeogênese PDFCharles Lameira ValentePas encore d'évaluation
- Resumo REGULACAO DA GLICOLISEDocument5 pagesResumo REGULACAO DA GLICOLISEJOCOSO GPLAYPas encore d'évaluation
- Tutoria VitaminasDocument18 pagesTutoria Vitaminas002-025384Pas encore d'évaluation
- T1 - Glicólise e Oxidação Do PiruvatoDocument6 pagesT1 - Glicólise e Oxidação Do PiruvatochicoPas encore d'évaluation
- BioquimiscDocument7 pagesBioquimiscJuca Do sabugueiro loucoPas encore d'évaluation
- Resposta Estudo Dirigido BqiiDocument13 pagesResposta Estudo Dirigido BqiiVitor Ferreira ValentePas encore d'évaluation
- Uma Panorâmica Geral Das Vias MetabólicasDocument4 pagesUma Panorâmica Geral Das Vias MetabólicasVanessa TomazPas encore d'évaluation
- Metabolismo Cho PTN LipDocument20 pagesMetabolismo Cho PTN LipMariana CarvalhoPas encore d'évaluation
- Metabolismo Do GlicogênioDocument24 pagesMetabolismo Do GlicogênioDominique SakagamiPas encore d'évaluation
- Via GlicolticaDocument15 pagesVia GlicolticaCamila MendesPas encore d'évaluation
- Metabolismo GlicogenioDocument22 pagesMetabolismo GlicogenioAndré Duarte CanellasPas encore d'évaluation
- 15) NeoglicogêneseDocument4 pages15) NeoglicogêneseMary FreitasPas encore d'évaluation
- LIsta Met GlicogênioDocument4 pagesLIsta Met GlicogênioAlbert DiasPas encore d'évaluation
- Metabolismo Do GlicogênioDocument3 pagesMetabolismo Do GlicogênioLuanaPas encore d'évaluation
- Metabolismo de CHO (Questões)Document10 pagesMetabolismo de CHO (Questões)Iana Ferreira100% (1)
- Fichamento Sobre CarboidratosDocument16 pagesFichamento Sobre CarboidratosPatricia AlvesPas encore d'évaluation
- Carboidratos - MetabolismoDocument108 pagesCarboidratos - MetabolismoMathews Oviedo100% (1)
- Plano de Aula - Arboviroses e Seus VetoresDocument10 pagesPlano de Aula - Arboviroses e Seus VetoresSara EsterPas encore d'évaluation
- Histologia Das Glândulas EndócrinasDocument10 pagesHistologia Das Glândulas EndócrinasSara Ester100% (3)
- Via Das PentosesDocument4 pagesVia Das PentosesSara Ester100% (1)
- Termodinâmica Dos Seres VivosDocument5 pagesTermodinâmica Dos Seres VivosSara EsterPas encore d'évaluation
- BL 06 - Prog. Maquinas Primarias-Vs.bDocument4 pagesBL 06 - Prog. Maquinas Primarias-Vs.bJorge PauloPas encore d'évaluation
- Banner Do Projeto SKILL - Ruan Miller de Paula Neves Da SilvaDocument1 pageBanner Do Projeto SKILL - Ruan Miller de Paula Neves Da SilvaRuan Miller de Paula100% (2)
- Princípio Do Prazer - Reflexões Teóricas e Clínicas - Editora EscutaDocument7 pagesPrincípio Do Prazer - Reflexões Teóricas e Clínicas - Editora Escutamig1747Pas encore d'évaluation
- Manual Cam. Fora Estrada Randon RK-430M PDFDocument934 pagesManual Cam. Fora Estrada Randon RK-430M PDFNaiane Fuchs Luiz Lopes88% (8)
- Tratamento de Efluentes GasososDocument17 pagesTratamento de Efluentes GasososJoseane SantosPas encore d'évaluation
- IT1 - Procedimentos AdministrativosDocument34 pagesIT1 - Procedimentos AdministrativosSergio JuniorPas encore d'évaluation
- MICROLITOTIPOSDocument22 pagesMICROLITOTIPOSKathelyn BernardoPas encore d'évaluation
- Estudo de Curto - Circuito e SeletividadeDocument29 pagesEstudo de Curto - Circuito e SeletividadeJoão Carlos Cabral100% (1)
- Fichamento 15 Anos de Politica EconomicaDocument9 pagesFichamento 15 Anos de Politica EconomicaDaniela AnandaPas encore d'évaluation
- Diagnóstico Socioambiental Na Comunidade Costa de Santana - Zona Ribeirinha de Mocajuba-PA, Sobre A Implantação Da Hidroelétrica de TucuruíDocument7 pagesDiagnóstico Socioambiental Na Comunidade Costa de Santana - Zona Ribeirinha de Mocajuba-PA, Sobre A Implantação Da Hidroelétrica de TucuruíCláudia PuentesPas encore d'évaluation
- ExotermicoDocument95 pagesExotermicoKayo CesarPas encore d'évaluation
- 13 R3MO Nao Controlado Resistivo 17 11 21Document20 pages13 R3MO Nao Controlado Resistivo 17 11 21Gabriel GustavoPas encore d'évaluation
- Auto Conformidade Processo Simplificado MaxissoDocument1 pageAuto Conformidade Processo Simplificado Maxissomarcos henriquePas encore d'évaluation
- A Exploração Racional Do MeioambienteDocument6 pagesA Exploração Racional Do MeioambienteJUNIORPas encore d'évaluation
- Logica SequencialDocument2 pagesLogica SequencialventooestePas encore d'évaluation
- ListaDocument2 pagesListaLosango PmPas encore d'évaluation
- PRDNE v.09.10.2019Document220 pagesPRDNE v.09.10.2019faacscribdPas encore d'évaluation
- En Carte Abril 13Document33 pagesEn Carte Abril 13vicurcioPas encore d'évaluation
- TD028FIS12 AFA EFOMM Dinamica Impulsiva FisicaDocument23 pagesTD028FIS12 AFA EFOMM Dinamica Impulsiva FisicaIsaac Santos 705Pas encore d'évaluation
- Check-List - Final de ObraDocument2 pagesCheck-List - Final de ObraGISELLEPas encore d'évaluation
- Atividade 01Document11 pagesAtividade 01gkmds1996Pas encore d'évaluation
- Medicina NuclearDocument120 pagesMedicina NuclearSidney Arcanjo100% (2)
- NBR 09368 - 1987 - Transformadores de Potência de Tensões Máximas Até 145 KV - Características Elétricas e MecânicasDocument33 pagesNBR 09368 - 1987 - Transformadores de Potência de Tensões Máximas Até 145 KV - Características Elétricas e MecânicasDavid Vichi de Brito0% (1)
- Apostila EFM Ar Condicionado PDFDocument81 pagesApostila EFM Ar Condicionado PDFJefferson Silva0% (1)
- Exercicio 08 - Prende Fura - ISO - A4 PDFDocument1 pageExercicio 08 - Prende Fura - ISO - A4 PDFRafael MarquesPas encore d'évaluation
- Obtención de Bioproductos Por Pirólisis Lenta de Cascarillas de Café y Cacao para Su Posible Uso Como Fuentes de Energía y FertilizantesDocument7 pagesObtención de Bioproductos Por Pirólisis Lenta de Cascarillas de Café y Cacao para Su Posible Uso Como Fuentes de Energía y FertilizantesAntonio PerezPas encore d'évaluation
- Dimensionamento de MotobombaDocument8 pagesDimensionamento de MotobombaflavioeustaquionogPas encore d'évaluation
- Manual Do LocatarioDocument18 pagesManual Do LocatarioRobinsonHenriquePas encore d'évaluation
- Apostila - Revisada para PDF 1Document51 pagesApostila - Revisada para PDF 1Leonardo100% (1)
- CASTEL-BRANCO, C. N. Notas de Reflexão Sobre A "Revolução VerdeDocument30 pagesCASTEL-BRANCO, C. N. Notas de Reflexão Sobre A "Revolução VerdeLuis BembelePas encore d'évaluation