Académique Documents
Professionnel Documents
Culture Documents
Dicroismo Circular
Transféré par
Marco APCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Dicroismo Circular
Transféré par
Marco APDroits d'auteur :
Formats disponibles
Dicrosmo
Circular:
anlisis de protenas
Gabriela Olvera A00806132
Francisco Gallegos A00948383
Jorge Garza A01135359
J. Gerardo Lpez A00366856
Introduccin
El dicrosmo circular se refiere a la diferencia
de absorcin de luz entre luz circular
polarizada derecha e izquierda. La diferencia
de absorcin entre la luz derecha e izquierda
crea un haz de luz resultante el cual sirve
para el anlisis de la estructura secundaria
de protenas, as como su plegamiento.
Principios
Haz de luz polarizado en un plano: Vibracin
en un solo plano.
Superposicin de dos ondas
polarizadas
Polarizacin Circular
Si los dos haces de luz superimpuestos, an
con la misma amplitud y longitud de onda se
superimponen PERO desfasados 90 o -90
grados, se obtiene una polarizacin circular:
el haz resultante ya no est polarizado en el
plano.
Polarizacin Circular
Desfasados 90 y -90 grados: Los picos y los cruces del
plano de los dos haces ya no coinciden.
El haz que gira en sentido de las manecillas del reloj se le
llama onda polarizada circular derecha (ED) y en el
sentido contrario se le denomina onda polarizada circular
izquierda (EI).
Lo mismo pero al revs
Dos haces circulares
suman un haz polarizado
en plano.
Interaccin con Materia
Al interactuar con materia, la luz sufre dos
fenmenos principales:
1. Absorcin: la materia absorbe una parte de
la luz por lo que disminuye su amplitud
(intensidad).
2. Cambio en velocidad (refraccin): cuando la
luz pasa de un medio a otro.
Interaccin con Materia
Absorcin
Refraccin
Concepto: Dicrosmo Circular
Dicrosmo circular (CD):Cuando una muestra absorbe el rayo ED de una manera diferente (mayor
o menor) al EI. Al salir de la muestra el rayo no se encuentra polarizado circular ni planarmente,
sino elpticamente:
Concepto: Birrefringencia
La misma diferencia pero con refraccin en vez de absorcin, crea dispersin ptica rotatoria
(ORD):
Y la suma de ambos...
Estos fenmenos provocan una
rotacin del plano de
polarizacin en un ngulo alpha
y la distorsin de este plano
tambin genera una elipse.
Equipo general
El proceso empieza con
un rayo de luz polarizada.
La polarizacin va
cambiando
peridicamente.
Al pasar por la muestra, el
detector identifica si una
molcula es pticamente
activa, ya que habr un
cambio en la absorcin en
algn perodo de
polarizacin especial y la
luz transmitida variar.
La variacin est directamente
relacionada con el DC de la muestra a
esa longitud de onda. Al hacer un
barrido de varias longitudes se obtiene
el espectro completo de DC. Que lleva
a las interpretaciones.
Equipo de DC
Caractersticas
importantes
Debe contar con fuente de
luz polarizada.
Cuenta con generador de
radiacin (carburo de silicio)
que se filtra y polariza.
Un modulador fotoelstico
(cristal) produce la
radiacin circularmente
polarizada.
La muestra se coloca
disuelta en un solvente
adaptado a longitud de
onda deseada.
Aplicaciones
Determinacin de estructura secundaria de
protenas
Estudio de cambios de entorno (pH, temperatura,
etc.)
Determinacin de conformacin de cidos
nucleicos
Estudio de interacciones protena - protena
Interpretacin
La diferencia en la absorcin entre el ED y el
EI es muy pequea, es usualmente entre
1/100 y 1/10 de un porciento, sin embargo se
puede determinar de una manera muy
precisa. Con estos datos se puede obtener la
elepsicidad de la muestra.
Para poder comparar los valores de
elipcicidad, se tienen que normalizar los
valores, obteniendo la elipsicidad molar
especfica por residuo. Se debe de
considerar la longitud del trayecto (l), la
concentracin ( c ), la masa molecular (M) y
el nmero de residuos (nr).
Para analizar la estructura secundaria de las
protenas, cada estructura secundaria bsica
(hlice alfa, lmina beta o espiral) tiene un
espectro de DC caracterstico. Por lo tanto
una protena que consiste de estas tres
diferentes estructuras debe de contener el
espectro caracterstico de cada una. Para
interpretar estas grficas se han creado
grficas estndar de protenas con estructura
conocida.
Estas interpretaciones tienen algunas
limitaciones inherentes al mtodo, por
ejemplo no se considera las interacciones
que pudieran tener los cromforos entre
otras regiones de la protena y otros
elementos, es por eso que el mtodo no es
muy exacto. Sin embargo este mtodo es
muy confiable para monitorear cambios en la
conformacin de protenas en diferentes
condiciones (estudios de desnaturalizacin,
plegamiento, etc.)
Cada estructura secundaria tiene
diferentes caractersticas del
espectro DC en UV:
Alfa Hlice:
Bandas negativas en 222 y 208
nm.
Bandas positivas a 193 nm.
Lminas Beta-plegadas:
Bandas negativas a 218 nm y
positivas a 195nm.
Para la conformacin de espiral:
+ a 212nm
- A 195 nm
Ejemplo
Industria
Biotecnolgica
Tcnicas de
purificacin
Produccin
de protenas
Desplegamiento de
protenas
Incremento de condiciones desnaturalizantes
Temperatura
Qumicos (urea)
pH extremo
Disminuye la estabilidad de la
protena
Se despliega
CD es una tcnica muy til
debido a que los espectros de
protenas plegadas y
desplegadas son muy diferentes.
(Figura 1)
La transicin de desplegamiento
se puede terminar escogiendo
una longitud de onda donde la
diferencia en la seal de protena
plegada y no plegada sea muy
grande.
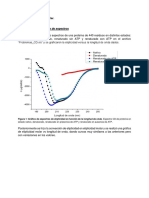
Figura 1. Caractersticas del espectro en -hlices, -
plegada y espirales aleatorios.
Dicrosmo Circular: Efecto del pH y del uso de agentes
desnaturalizantes
Espectro de dicrosmo circular de una apomioglobina (apoMb)
como funcin de condiciones desnaturalizantes.
Transicin de desplegamiento inducida por pH y por urea
(@222nm)
Fuentes
1. http://www.informatics.indiana.edu/predrag/classes/2008springi619/week4_m.pdf
2. http://www.biomachina.org/courses/structures/052.pdf
3. http://depa.fquim.unam.mx/amyd/archivero/exposicion_dicroismo_circular_5050.pdf
4. http://www.photophysics.com/products/chirascan-cd-spectrometer
5. http://www.ruppweb.org/cd/cdtutorial.htm
6. Correa, D. & Ramos, C. (2009). The use of circular dichroism spectroscopy to study protein folding, form and
function. African Journal of Biochemistry Research 3(5): 164-173
7. http://download.springer.com/static/pdf/362/art%253A10.1007%252Fs00249-004-0401-
8.pdf?auth66=1381682487_9868968b74f62d1b6e43d068d89b501b&ext=.pdf
Vous aimerez peut-être aussi
- Streptococcus PyogenesDocument8 pagesStreptococcus PyogenesGonzalo Ferreiros MiguelPas encore d'évaluation
- Adultez Temprana, Intermedia, TardiaDocument20 pagesAdultez Temprana, Intermedia, TardiaJairo Turriate100% (1)
- Biologia Tema 2 SM Xerme 3 EsoDocument4 pagesBiologia Tema 2 SM Xerme 3 EsoElba Blanes Cabanelas100% (1)
- TPDocument7 pagesTPNicolás LarreguiPas encore d'évaluation
- Técnicas EspectrofotométricasDocument31 pagesTécnicas EspectrofotométricasJose Luis Leiva Inga100% (1)
- Determinación Del Grado de Disociación, Del Coeficiente de Actividad Iónica Medio y de Las Constantes Del Equilibrio de Disociación (Ka y KC) de Un Ácido Débil Por Medidas de ConductividadDocument12 pagesDeterminación Del Grado de Disociación, Del Coeficiente de Actividad Iónica Medio y de Las Constantes Del Equilibrio de Disociación (Ka y KC) de Un Ácido Débil Por Medidas de ConductividadCarolinaQuimbayaPas encore d'évaluation
- COMPARACIONDocument1 pageCOMPARACIONDiego Fidelli LopezPas encore d'évaluation
- Sesión 5 Aplicaciones en Cromatografía InstrumentalDocument8 pagesSesión 5 Aplicaciones en Cromatografía InstrumentalClaudia100% (1)
- 2 Isomería y EstereoquímicaDocument47 pages2 Isomería y EstereoquímicaMaria Fernanda Izquierdo GarnicaPas encore d'évaluation
- Aparato Reproductor FemeninoDocument33 pagesAparato Reproductor FemeninoFabricio PumisachoPas encore d'évaluation
- Aula Virtual de Examen. UNED 5Document9 pagesAula Virtual de Examen. UNED 5RELLANODEBERNARDOPas encore d'évaluation
- ANALISIS INSTRUMENTAL. Unidad 1 y 2. Introd - Metodos Electroan. Potenciociometria Definitivo.Document22 pagesANALISIS INSTRUMENTAL. Unidad 1 y 2. Introd - Metodos Electroan. Potenciociometria Definitivo.Denisse Durán Meza100% (1)
- Taller 1 (UV-VIS)Document4 pagesTaller 1 (UV-VIS)Cristian MartinezPas encore d'évaluation
- Schwaller de Lubicz, René - Esoterismo y SimbolismoDocument72 pagesSchwaller de Lubicz, René - Esoterismo y SimbolismoLuxor2020100% (1)
- EstereoisomeríaDocument48 pagesEstereoisomeríaCatherine MartinezPas encore d'évaluation
- Labo 3 - Cuentificacion de La GlucosaDocument5 pagesLabo 3 - Cuentificacion de La GlucosaanonymuusPas encore d'évaluation
- UV VisibleDocument24 pagesUV VisibleHaydeé A Brassea0% (1)
- Función de Partición RotacionalDocument11 pagesFunción de Partición RotacionalRrope PerroPas encore d'évaluation
- Dicroismo CircularDocument24 pagesDicroismo CircularDenis DominguezPas encore d'évaluation
- Efecto RamanDocument4 pagesEfecto Ramancaturro77Pas encore d'évaluation
- Separación e Identificación de Compuestos Orgánicos Mediante Cromatografía Líquida de AltaDocument10 pagesSeparación e Identificación de Compuestos Orgánicos Mediante Cromatografía Líquida de AltaManolo Cabezabolo CabezaboloPas encore d'évaluation
- Estructura Cristalina3bDocument19 pagesEstructura Cristalina3bsebastian coboPas encore d'évaluation
- Cuestionario para Estudiar. Potenciometría.Document8 pagesCuestionario para Estudiar. Potenciometría.Fernanda BlancoPas encore d'évaluation
- Cuestiones Examen SMNDocument16 pagesCuestiones Examen SMNMelaniaPas encore d'évaluation
- Espectroscopia IinfrarrojaDocument8 pagesEspectroscopia IinfrarrojaCamilo Santana CPas encore d'évaluation
- Analisis InstrumentalDocument11 pagesAnalisis InstrumentalManuel Solano CepedaPas encore d'évaluation
- VoltamperometríaDocument6 pagesVoltamperometríaDenisse MojarrangoPas encore d'évaluation
- SpectrosDocument24 pagesSpectrosDaniel Menéndez CrespoPas encore d'évaluation
- Tema 4 - Espectroscopia de Luminiscencia MolecularDocument6 pagesTema 4 - Espectroscopia de Luminiscencia MolecularBubble GumPas encore d'évaluation
- Espectro Del SodioDocument12 pagesEspectro Del Sodiomarianacazadora1Pas encore d'évaluation
- Determinación Espectrofotométrica de HierroDocument6 pagesDeterminación Espectrofotométrica de HierroValentina LunaPas encore d'évaluation
- Espectrometria de MasasDocument57 pagesEspectrometria de Masaslg_abantoPas encore d'évaluation
- Preinforme Laboratorio 5Document3 pagesPreinforme Laboratorio 5Valentina Monsalve PalauPas encore d'évaluation
- Emision y AbsorcionDocument7 pagesEmision y Absorcionmartha castroPas encore d'évaluation
- Informe 2-Inorgánica IIIDocument13 pagesInforme 2-Inorgánica IIIJose Luis Goicochea100% (2)
- Reacción de ReformatskyDocument11 pagesReacción de ReformatskyAngie Tatiana Gonzalez GalindoPas encore d'évaluation
- Ecuación de NernstDocument2 pagesEcuación de NernstGaby100% (1)
- Ciclo de Born-HaberDocument6 pagesCiclo de Born-HaberJuan Ramírez100% (1)
- Informe 1 Medidas Basicas NoDocument17 pagesInforme 1 Medidas Basicas NoChiquinquira AnguloPas encore d'évaluation
- EJERCICIOS - Potenciales de Reduccion y Oxidacion - Celdas GalvanicasDocument10 pagesEJERCICIOS - Potenciales de Reduccion y Oxidacion - Celdas Galvanicasefrain chaccaPas encore d'évaluation
- PROBLEMAS Bioquimica PDFDocument11 pagesPROBLEMAS Bioquimica PDFFederico VillanuevaPas encore d'évaluation
- 1.selección de Detectores en Cromatografía de Gases MasasDocument44 pages1.selección de Detectores en Cromatografía de Gases MasasJuan Carlos VazquezPas encore d'évaluation
- Practica 4 ER NI-Co-BDocument4 pagesPractica 4 ER NI-Co-BLuis AlbertoPas encore d'évaluation
- Dicroismo Circular s2018Document8 pagesDicroismo Circular s2018Ariel Pinto MarchantPas encore d'évaluation
- Trabajo Práctico 5Document17 pagesTrabajo Práctico 5paez lamaPas encore d'évaluation
- Determinación Del Estado de Transición de Dos Reacciones Concertadas A Través Del Paquete Computacional Gaussian/gaussviewDocument7 pagesDeterminación Del Estado de Transición de Dos Reacciones Concertadas A Través Del Paquete Computacional Gaussian/gaussviewRicardo GonzálezPas encore d'évaluation
- Taller Corriente Resistencia y Ley de OhmDocument4 pagesTaller Corriente Resistencia y Ley de OhmJuanAgustin0% (1)
- Determinación de Quinina Por FluorescenciaDocument4 pagesDeterminación de Quinina Por FluorescenciaChurrumino Rojas LunaPas encore d'évaluation
- Articulo Difraccion Cu PDFDocument4 pagesArticulo Difraccion Cu PDFLucía HernándezPas encore d'évaluation
- Efecto RamanDocument19 pagesEfecto RamanBrynncess PollocksPas encore d'évaluation
- P. Curva PatrónDocument4 pagesP. Curva PatrónLichita RomanovPas encore d'évaluation
- Informe Difraccion de Rayos XDocument3 pagesInforme Difraccion de Rayos XWendy Zarza HerazoPas encore d'évaluation
- Electroforesis CapilarDocument13 pagesElectroforesis CapilarChris EmanuelPas encore d'évaluation
- Disco RotatorioDocument3 pagesDisco RotatorioDario RiveraPas encore d'évaluation
- Cuestionario SesionDemostrativa LuminiscenciaDocument2 pagesCuestionario SesionDemostrativa LuminiscencialzbethmPas encore d'évaluation
- Tarea No. 3 Espectro UV Visible Analisis Instrumental IBQ UAA 2021 (Completo 2)Document10 pagesTarea No. 3 Espectro UV Visible Analisis Instrumental IBQ UAA 2021 (Completo 2)Derek Ebenezer Mata NavarroPas encore d'évaluation
- Fundamentos de Electroforesisi CapilarDocument71 pagesFundamentos de Electroforesisi CapilararodmejgmailPas encore d'évaluation
- DisolucionesDocument29 pagesDisolucionesPepe PertíñezPas encore d'évaluation
- Cues Ti Ones de BioquímicaDocument2 pagesCues Ti Ones de Bioquímicaapi-26645842Pas encore d'évaluation
- Espectroscopia de Emisión de LlamaDocument5 pagesEspectroscopia de Emisión de LlamaANA CRISTINA TAMAYO PARRAPas encore d'évaluation
- Electrodos de Membrana SolidaDocument9 pagesElectrodos de Membrana SolidaWilmar SalcedoPas encore d'évaluation
- Tema 5 - Dicroísmo CircularDocument21 pagesTema 5 - Dicroísmo CircularDiego AngelPas encore d'évaluation
- Tema 5: Dicroísmo CircularDocument21 pagesTema 5: Dicroísmo Circulartaniarom14100% (1)
- Dicroísmo CircularDocument2 pagesDicroísmo CircularFederico CalvoPas encore d'évaluation
- Estudio Biofisicos de MacromoleculasDocument24 pagesEstudio Biofisicos de MacromoleculasMaicol Sleiter Rojas Rojas - 020175017kPas encore d'évaluation
- PulvimetalurgiaDocument3 pagesPulvimetalurgiaMarco APPas encore d'évaluation
- Comenzar Con DropboxDocument4 pagesComenzar Con Dropboxvalsar33Pas encore d'évaluation
- Práctica 1 - Compuertas Digitales Basicas TTL y El Display de 7 SegmentosDocument4 pagesPráctica 1 - Compuertas Digitales Basicas TTL y El Display de 7 SegmentosMarco APPas encore d'évaluation
- Quiz TermoDocument3 pagesQuiz TermoMarco APPas encore d'évaluation
- Sistema NerviosoDocument25 pagesSistema NerviosoAuraLuzTorresAndradePas encore d'évaluation
- Parasitos Gastrointestinales en OvinosDocument6 pagesParasitos Gastrointestinales en OvinosRene VidalPas encore d'évaluation
- La Bacteria e ColiDocument4 pagesLa Bacteria e ColiDavid Espinosa SuárezPas encore d'évaluation
- LB 16 El Arte de Relacionarse OkDocument7 pagesLB 16 El Arte de Relacionarse OkDYALAPas encore d'évaluation
- Definición y Clasificación Del HeladoDocument4 pagesDefinición y Clasificación Del HeladoCamila zabalaPas encore d'évaluation
- La Percepción VisualDocument8 pagesLa Percepción VisualCyntia Yenifer Vargas GallardoPas encore d'évaluation
- Actividad Integradora 1 Descubrimiento Científico y Desarrollo Tecnológico M21S1Document6 pagesActividad Integradora 1 Descubrimiento Científico y Desarrollo Tecnológico M21S1Edgar Roel Acosta Carrillo93% (15)
- ZoometríaDocument35 pagesZoometríaSofy PMPas encore d'évaluation
- Penicilinas. Utilidad y LimitacionesDocument36 pagesPenicilinas. Utilidad y LimitacionesCarlos MenjivarPas encore d'évaluation
- Trabajo X Imprimir y Anillar2Document25 pagesTrabajo X Imprimir y Anillar2Levi PachecoPas encore d'évaluation
- BIOQUÍMICA - LABORATORIO - SEM-06 - SESIÓN-18 - Técnicas Básicas de Identificación de Biomoléculas - 2023 - 1Document34 pagesBIOQUÍMICA - LABORATORIO - SEM-06 - SESIÓN-18 - Técnicas Básicas de Identificación de Biomoléculas - 2023 - 1Alexandra LoretoPas encore d'évaluation
- Tesis Casos M. CaninosDocument60 pagesTesis Casos M. Caninoscyntia medina de martinezPas encore d'évaluation
- Guía 3.8 Noveno BiologíaDocument4 pagesGuía 3.8 Noveno Biologíajuan guillermo alvarezPas encore d'évaluation
- MetahemoglobinemiaDocument17 pagesMetahemoglobinemiaChristianPas encore d'évaluation
- Factores Ambientales Que Afectan A La Nutricion Vegetal Antonio CasasDocument75 pagesFactores Ambientales Que Afectan A La Nutricion Vegetal Antonio CasasRoberto Carlos Rojas HuancaPas encore d'évaluation
- Alimentos TransgénicosDocument7 pagesAlimentos TransgénicosAlondraPas encore d'évaluation
- Apoptosis - Dra. Rina ZumaetaDocument18 pagesApoptosis - Dra. Rina ZumaetaJuan VasquezPas encore d'évaluation
- FT Disan Masterfos ZN 12-45-0-5 (S) PDFDocument2 pagesFT Disan Masterfos ZN 12-45-0-5 (S) PDFNorma Romero100% (1)
- Áreas Protegidas de PanamáDocument2 pagesÁreas Protegidas de PanamáJohana Massiel0% (1)
- Evolución Del Pensamiento EstratégicoDocument22 pagesEvolución Del Pensamiento EstratégicoIvette Durán Seguel100% (1)
- Fisioterapia Puntos GatillosDocument85 pagesFisioterapia Puntos Gatilloscamila prostPas encore d'évaluation
- Evaluacion NaturalesDocument2 pagesEvaluacion NaturalesLiliana AltamarPas encore d'évaluation
- Modelo Apuntes Micro BIR Bio BirDocument5 pagesModelo Apuntes Micro BIR Bio BirgabriPas encore d'évaluation
- Carbonizado e Inhalacion de Monoxido de CarbonoDocument9 pagesCarbonizado e Inhalacion de Monoxido de CarbonoDavid DiazPas encore d'évaluation
- Reseña Critica de AntropologiaDocument3 pagesReseña Critica de AntropologiaBonillaAndradeLilianitaPas encore d'évaluation