Académique Documents
Professionnel Documents
Culture Documents
Aminoácidos, Péptidos y Proteínas
Transféré par
freshkipolloCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Aminoácidos, Péptidos y Proteínas
Transféré par
freshkipolloDroits d'auteur :
Formats disponibles
AMINOCIDOS,
PPTIDOS Y
PROTENAS
Son compuestos orgnicos y como su nombre lo indica son bifuncionales
contienen un grupo amino (NH2) y un grupo carboxilo (COOH).
Estos compuestos tienen un carbono donde se
encuentran unidos el grupo funcional amino y
carboxlico.
Los aminocidos son anfteros, y adems de esto
forman un ion dipolar o zwitterion.
AMINOCIDOS
Existen infinidad de aminocidos pero de estos, slo estn presentes en las
protenas 20, y nueve de estos son considerados esenciales.
Todos estos son -aminocidos es decir el grupo amino es un sustituyente del
tomo de carbono adyacente al carbono del grupo carbonilo y difieren en el
sustituyente unido al carbono , llamado cadena lateral.
La prolina es el nico aminocido en el que los tomos de nitrgeno y
carbono son parte de un anillo.
A excepcin de la glicina, los carbono son centros quirales, son posibles los
enantiomeros R y S. Pero el enantiomero presente en las protenas es el
Levgiro (L).
ESTRUCTURA DE AMINOCIDOS
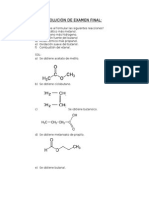
Uno de los mtodos ms antiguos para la sintesis de -aminocidos es la
bromacin con Br2, PBr3 y posteriormente agregar amoniaco en exceso.
Por medio de una aminacin reductiva de un -ceto cido con amoniaco se
pueden generar aminocidos.
SNTESIS DE AA
Otra forma de obtener aminocidos es por medio de la reaccin de gabriel.
Las reacciones que pueden sufrir estas molculas son las mismas que llevan a
cabo los cidos carboxlicos y las aminas.
Transaminacin
Descarboxilacin.
Racemizacin.
REACCIONES DE AMINOCIDOS
Qu son?
PPTIDOS
Son molculas que
contienen dos o tres
aminocidos (AA) o hasta
molculas muy grandes
que contienen miles de
aminocidos.
La unin de dos o ms aminocidos (AA) mediante
enlaces amida origina los pptidos. En los pptidos y en
las protenas, estos enlaces amida reciben el nombre de
enlaces peptdicos y son el resultado de la reaccin del
grupo carboxilo de un AA con el grupo amino de otro, con
eliminacin de una molcula de agua.
ENLACE PEPTDICO
Las distancias interatmicas medidas en los enlaces C-O
y C-N son intermedias entre las del enlace sencillo y el
doble enlace. Esta disposicin atmica est estabilizada
por resonancia, de forma que los seis tomos implicados
en la formacin del enlace peptdico estn contenidos en
el mismo plano.
El carcter parcial de doble enlace impide la libre
rotacin del enlace que une los tomos de C y N
en el enlace peptdico. Esta rigidez del doble
enlace limita las posibilidades conformacionales
de los pptidos.
Presentan isomera cis/trans, pero prcticamente
estn en trans, salvo los enlaces X-Pro que
pueden ser cis o trans.
Dependiendo del nmero de aminocidos unidos.
Los pptido se denominan.
Oligopptidos (menos de 15 uniones)
Polipptidos (entre 15 y 50 uniones)
Protenas (mas de 50 uniones)
Antibioticas: Son medicamentos potentes que combaten
las infecciones bacterianas.
Hormonales: Las hormonas son seales quimicas que
ejercen su accin sobre rganos y tejidos situados lejos
del lugar donde se han sintetizado.
FUNCIONES
Neurotransmisores: Son el producto de sntesis
especfico por parte de la neurona y que es
liberado al medio extracelular en el proceso que
se denomina sinapsis. Ejerce su accin sobre
receptores especficos de membrana que son
diferentes por cada neurotransmisor.
Oxitocina: Pptido con funcin hormonal,
produce la hipfisis para provocar las
contracciones uterinas durante el parto.
EJEMPLOS
Encefalina: Pptido de 5 aminocidos producido
por las neuronas para inhibir el dolor (acta como
morfina).
Veneno de escorpiones y algunas serpientes:
Pptidos con accin neurotxica, y por tanto
producen irritaciones, paralizaciones y la muerte
en las presas.
Son polipptidos naturales
de elevado peso molecular.
Se encuentran en todas las
partes de los organismos
vivos y constituyen la clase
de compuestos
biolgicamente importantes
de mayor diversidad.
PROTENAS
Protenas
Simples Conjugadas
CLASIFICACIN
Primaria
Estructura lineal:
Secuencia de
aminocidos y
componentes
prostticos con
los que est
constituida.
Secundaria
La organizacin de la
cadena se le
denomina hlice
Se observa que cada
grupo amida est
unido por puente de
hidrgeno a otra
amida.
ESTRUCTURA
Terciaria
Existe
interaccin de
unas partes de la
protena con
otras por medio
de las cadenas
laterales de los
aminocidos.
Cuaternaria
Describe cmo
muchas
subunidades, que
no siempre son
idnticas, se
renen para
formar
complejos ms
grandes.
ESTRUCTURA
Pauling y Corey estudiaron las
protenas a travs de los rayos
X encontrando que cuando
una serie de enlaces peptdicos
formados entre _-aminocidos
estn unidos entre s, la
orientacin espacial de la
cadena depender de las
relaciones entre los planos de
los grupos amida.
LA HLICE
Las rotaciones ms
importantes son las de los
enlaces sencillos que
conectan los grupos amida a
los tomos de carbono en _.
Las interacciones dipolares y
estricas entre aminocidos
(relaciones espaciales entre
los planos de los grupos
amida) restringirn
parcialmente la libertad de
movimiento respecto a estos
enlaces.
LA HLICE
Adems, indicaron que las
caractersticas espaciales de
la cadena polipeptdica se
repite a menudo 540 pm.
Utilizando estos datos y
construyendo modelos
moleculares, Pauling y Corey
dedujeron que tales cadenas
de aminocidos poseen una
conformacin de hlice.
LA HLICE
Una conformacin de
hlice-_ permite la
formacin de enlaces de
hidrgeno intramoleculares
entre el tomo de oxgeno
carbonlico y el hidrgeno
amdico del tercer
aminocido siguiente.
LA HLICE
La estructura terciaria de una protena representa el
plegamiento de las cadenas polipetdicas, es ms aleatorio
que las caractersticas estructurales secundarias pero puede
mostrar una forma regular. Las cadenas se mantienen
unidas por enlaces de hidrgeno intercadena.
OTRAS CARACTERSTICAS
ESTRUCTURALES 2 Y 3
LMINA PLEGADA
La fuerzas que mantienen la
estructura tridimensional de
las protenas son relativamente
dbiles. Pueden ser
desbaratadas por el calor, un
cambio en el pH, efectos del
medio o tensin mecnica. El
proceso mediante el cual la
conformacin natural de una
protena es desbaratada o
destruida se le conoce como
desnaturalizacin.
LMINA PLEGADA
Qumica Orgnica. Pine. Pg. 821
Qumica Orgnica V2. Allinger. Pg. 1089
BIBLIOGRAFA
Vous aimerez peut-être aussi
- Formulario de Reacciones de Química IIIDocument5 pagesFormulario de Reacciones de Química IIIJuan Carlos FuentesPas encore d'évaluation
- Formas Alotrópicas Del CarbonoDocument3 pagesFormas Alotrópicas Del CarbonoMirella Damian VerasteguiPas encore d'évaluation
- Informe 9 Compuestos de Coordinación Labo Inorganica Uni FiqtDocument10 pagesInforme 9 Compuestos de Coordinación Labo Inorganica Uni FiqtAdorian FārPas encore d'évaluation
- Halogenuros de AlquiloDocument15 pagesHalogenuros de AlquiloMarco Antonio Sierra100% (2)
- Fuerzas IntermolecularesDocument2 pagesFuerzas IntermolecularesKevin Lopez PastorPas encore d'évaluation
- Estructura de LewisDocument12 pagesEstructura de LewisJailene Gómez CollazoPas encore d'évaluation
- HidrocarburosDocument59 pagesHidrocarburosbrenda coronelPas encore d'évaluation
- E Teres 2010Document15 pagesE Teres 2010Eduardo SalinasPas encore d'évaluation
- Casos Administracion FinancieraDocument9 pagesCasos Administracion FinancieraBrendaPas encore d'évaluation
- 2017 TP03 Macromoléculas ModificadoDocument9 pages2017 TP03 Macromoléculas ModificadonataliaPas encore d'évaluation
- Reacciones de Sistemas de Anillos Fusionados 01Document30 pagesReacciones de Sistemas de Anillos Fusionados 01Dan Arbañil Yumpo100% (2)
- Formulación y Nomenclatura de AlquenosDocument6 pagesFormulación y Nomenclatura de AlquenosJose Leonardo VelasquezPas encore d'évaluation
- Guia 12Document4 pagesGuia 12Jorge Ropón100% (1)
- 18 Aldehidos y Cetonas PDFDocument44 pages18 Aldehidos y Cetonas PDFLuz De Maria de GuneraPas encore d'évaluation
- Quimica IIDocument15 pagesQuimica IIMarthaLorenzoCastilloPas encore d'évaluation
- Nomenclatura-Quimica GeneralDocument108 pagesNomenclatura-Quimica GeneralBruce WalkerPas encore d'évaluation
- 04-Alcanos y HalogenacionDocument11 pages04-Alcanos y HalogenacionnubrolitoPas encore d'évaluation
- Composicion Quimica de La Materia Viva (Completo)Document82 pagesComposicion Quimica de La Materia Viva (Completo)Dency ParedesPas encore d'évaluation
- La Química de Los Minerales-2 PDFDocument59 pagesLa Química de Los Minerales-2 PDFFelipe Andres Santiago DiazPas encore d'évaluation
- Informe 06Document50 pagesInforme 06sunjullay0% (1)
- Catalizadores HeterogéneosDocument3 pagesCatalizadores HeterogéneosMaría José Rivas0% (1)
- Tema 8Document15 pagesTema 8Jorge Cortez ElizaldePas encore d'évaluation
- Tema 2. Capitulo III Isomeria en Los Compuestos de Coordinacion 2014Document31 pagesTema 2. Capitulo III Isomeria en Los Compuestos de Coordinacion 2014JorgeMartinPas encore d'évaluation
- Informe de Alcoholes y FenolesDocument6 pagesInforme de Alcoholes y FenolesAlex Rojas PatiñoPas encore d'évaluation
- Informe 1Document6 pagesInforme 1JessikaRealpePas encore d'évaluation
- 2.1. Introd. - 2.2 Conceptos y 2.3 CLASIFDocument3 pages2.1. Introd. - 2.2 Conceptos y 2.3 CLASIFMar Guadalupe NamzugPas encore d'évaluation
- Informe de CondensaciónDocument5 pagesInforme de CondensaciónDaniela SalermiPas encore d'évaluation
- CicloalcanosDocument20 pagesCicloalcanosOscar ForcePas encore d'évaluation
- Informe Nº1 - CarbohidratosDocument21 pagesInforme Nº1 - CarbohidratosKarina Elizabeth Dueñas Granados100% (1)