Académique Documents
Professionnel Documents
Culture Documents
Aula On-Line 5 Proteoma e MS
Transféré par
Carla Möllmann0 évaluation0% ont trouvé ce document utile (0 vote)
74 vues28 pagesTitre original
Aula on-line 5 proteoma e MS.ppt
Copyright
© © All Rights Reserved
Formats disponibles
PPT, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PPT, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
74 vues28 pagesAula On-Line 5 Proteoma e MS
Transféré par
Carla MöllmannDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PPT, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 28
BIO10-329 Biofsica de Protenas
Regente: Clia R. Carlini
Ateno ! Use o modo apresentao de slides para ativar as animaes
Proteomas e Espectrometria de Massa
Principais componentes moleculares da bactria E. coli
Componentes N de molculas diferentes % peso total
H
2
O 1 70
Protenas 3.000 15
Ac. Nuclico 1 - DNA e 1000-RNA 7
Carbohidratos 50 3
Lipdeos 40 2
Outros ons - 12 3
Mol. Monomricas - 500
A tabela mostra a percentagem em peso dos principais tipos de molculas presentes
em um clula simples, a bactria Escherichia coli. Observe que as protenas compem o
grupo mais diverso de molculas.
Antes das tcnicas de protemica, para se obter informaes sobre uma protena em
particular, era necessrio separ-la de todas as outras que esto presentes na mesma
fonte biolgica.
Atualmente, possvel analisar-se um grande conjunto de protenas ao mesmo
tempo, e obter informaes de uma protena em particular sem separ-la das demais,
graas s tcnicas de espectrometria de massa acoplada com eletroforese 2D e/ou
cromatografia lquida.
METABOLOMA - metablitos
GENOMA DNA 3,4 bilhes de nt
SIGNALOSOMA interaes entre protenas
de uma via de sinalizao
TRANSCRIPTOMA mRNA 30 mil genes
INTERACTOMA interaes entre protenas
PROTEOMA Protenas 0,3-1,2 milho protenas
Homo sapiens
Atualmente, a capacidade de processamento de grandes volumes de
informaes e tcnicas analticas de alta resoluo, entre as quais se
destaca a espectometria de massas, permitem o estudo de clulas e
organismos inteiros so os OMAS.
Estratgias experimentais
Do geral para o particular
Analisar diversos proteomas em
condies diferentes e identificar
as diferenas
Do particular para o geral
Analisar uma nica protena e
inferir suas funes no contexto
do todo
Separao de protenas nas amostras
Eletroforese bidimensional Cromatografia lquida (LC)
fragmentao
Determinao de massas para identificao
Peptide mass fingerprint Sequenciamento de novo
ELETROFORESE BIDIMENSIONAL:
anlise simultnea de at 5.000 protenas
permite comparao de todas as protenas
expressas por uma clula em dois momentos
diferentes:
anlise do efeito de hormnios,
anlise do efeito de drogas;
estados fisiolgicos (desenvolvimento);
condies patolgicas diversas (vrus,
bactrias,etc.)
Eletroforese 2D de protenas
totais (proteoma) de clulas de
Escherichia coli
Protenas com mesmo pI
Protenas com a
mesma massa
Proteoma Comparativo ou Diferencial
condio condio
Sobreposio permite identificar diferenas nos padres de bandas
Sobreposio para anlise das protenas
diferentemente expressas
Protenas de cada condio so marcadas com tags fluorescentes
diferentes para facilitar a visualizao das diferenas
Interatoma de C. elegans
- protenas individuais, representadas por crculos, agrupam-se
(indicado por linhas) conforme suas interaes, formando uma rede que
permite entender detalhes do controle das funes vitais do organismo.
Identificao de Protenas por MS: 10 passos
Espectro de massas
dos fragmentos
virtuais
Tripsinizao
virtual
Banco de
seqncias
(i.e. SwissProt)
Banda removida
do gel
Fragmentar
com tripsina
Obter espectro
de massas dos
fragmentos
comparao
B
a
n
c
o
d
e
e
s
p
e
c
t
r
o
s
(1)
(2) (3)
(4)
Espectro de massas
(5)
(6)
(7)
(8)
(9)
Identificao
(10)
Peptide fingerprint ou impresso digital de peptdeos:
protenas so identificadas com base no tamanho dos
peptdeos resultantes da hidrlise com tripsina,
comparando-se o espectro de massa real com o terico,
obtido a partir dos bancos de dados de protenas.
1529 1 478
1529.7 0.1 164
1529.73 0.01 25
1529.734 0.001 4
1529.7348 0.0001 2
Massa/carga Mass Tolerance (Da) # Hits in Database
Quanto maior a exatido da medida de massas, maior a segurana na
identificao da protena (hits) que originou os peptdeos trpticos.
Impresso digital de peptdeos: efeito de peptdeos mltiplos
1529.73 0.1 204
1529.73
1252.70
0.1 7
1529.73
1252.70
1833.88
0.1 1
Massa/carga m/z Mass Tolerance # Hits Database
A identificao de mais de um peptdeo triptco de uma mesma protena
aumenta a confiabilidade da identificao dessa protena por
espectrometria de massa.
2 peptdeos
3 peptdeos
Thomson, 1897 fez descoberta do eltron e inventou a espectrometria de
massa, com a primeira medida da razo massa/carga de uma partcula.
Prmio Nobel de Qumica, 2002 foi para os inventores de mtodos de
ionizao branda em espectrometria de massa, que permitiu anlise de
macromolculas como protenas
John B. Fenn (E.U.A.) - Electrospray (ESI)
Koichi Tanaka (Japo) - Soft Laser Desorption (SLD).
Espectrometria de Massas
Espectrmetros de massas usam diferenas na razo massa-carga (m/z) de tomos ou
molculas ionizadas para separ-los, e/ou para determinar a composio e a estrutura
qumica. Molculas fragmentam-se de maneiras diferentes, sendo que a anlise MS dos
fragmentos permite sua caracterizao estrutural.
O poder de separao de ons de um MS descrito por sua resoluo, que definida
como:
R = m /D m sendo m, a massa do on
Dm, a diferena de massa entre dois picos no
espectro de massa
Ex: um MS com resoluo de 1000 consegue separar ons com m/z de 100.0 e 100.1
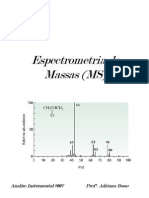
O espectro de massas de uma molcula
consiste de uma famlia de picos, correspondendo
a espcies carregadas que diferem de 1 unidade
de massa e carga.
A deconvoluo desses picos, gerando o
grfico acima, d a massa de uma molcula com
preciso de 0,01%
A massa de uma molcula pode
ser determinada a partir dos m/z
de quaisquer dois picos vizinhos,
que diferem por 1 carga (+) ou 1
prton:
(m/z)
1
= M + n
2
x
n
2
M a massa da molcula
n
2
o nmero de cargas
X a diferena entre dois picos
(m/z)
2
= M + (n
2
x +1)X
n
2
+ 1
Temos duas equaes e dois
desconhecidos, M e n
2
, que podem
ser calculados resolvendo-se esse
sistema de equao:
n
2
= (m/z)
2
X
(m/z)
2
(m/z)
1
M = n
2
[(m/z)
2
X]
MS de setor magntico:
Ionizao: um feixe de eltrons de alta energia utilizado para ejetar um eltron de
uma molcula, formando um radical catinico designado como on molecular. Se o on
molecular for muito instvel ele poder se fragmentar em ons menores.
Analisador de massa: os ons moleculares so focalizados, formando um feixe, so
acelerados atravs de um campo magntico, sendo defletidos (desviados) de acordo
com as massas dos ons.
Analisadores de massa
Analisadores de massa
Quadrupolo
- consiste de quatro eletrodos (tubos metlicos), dois positivos e dois negtivos. A
voltagem aplicada afeta a trajetria de ons passando atravs aos eletrodos. Para
uma dada condio de corrente e voltagem, somente ons com uma dada razo
massa/carga seguem o trajeto entre os tubos, e todos os outros so desviados para
fora do quadrupolo. Obtem-se um espectro de massas variando-se gradualmente a
corrente e voltagem para detectar-se todos os ons presentes.
MS quadrupolo de transmisso:
consiste de um ionizador, lentes para
acelerar e focalizar os ons para a
entrada no quadrupolo, o quadrupolo
com controles de V e A, um detector
de ons. Todo o sistema necesssita
de alto vcuo.
Resoluo: separa ons com
diferenas de 0.3 m/z
A equao que governa a separao de ons por TOF :
m/z razo massa/carga do on
E potencial do pulso de extrao
s comprimento do setor em que E aplicado
d comprimento do tubo de vo
t tempo de vo do on
A energia cintica de um on
0.5mv
2
, assim ions mais leves
tm velocidade maior que os
pesados e atingem o detector
em menos tempo.
MS tempo de vo: ons so acelerados a partir do ionizador at um tubo de vo, sem campo
eltrico ou magntico, onde se movem na direo do detector com uma velocidade proporcional a
m/z. Ao contrrio de outros MS, no h limite superior de deteco de m/z. O TOF-MS afetado
pela energia inicial dos ons antes de serem acelerados. Para corrigir, utiliza-se um conjunto de
campos eltricos, o reflectron, que refocalizam os ons de mesma m/z com velocidades diferentes.
o mais preciso de todos os MS, permitindo anlise elementar. Podem fazer at 100 espectros
por segundo. Originalmente desenvolvido na dcada 1950, foi obscurecido pelos MS quadrupolos
at o desenvolvimento do MALDI nos anos 1980.
MS-TOF
Analisadores de massa
Espectrmetro de massa por tempo de vo
MS on-trap: formado por um quadrupolo tridimensional
Consiste de eletrodos cilndricos simtricos, que formam dois end caps e um anel. Pode ser
bastante pequeno, com somente 1-2 cm separando os eletrodos. A face interna de cada eletrodo
tem uma superfcie hiperblica. Uma corrente e voltagem so aplicadas ao eletrodo em forma de
anel, enquanto os end caps ficam aterrados.
De maneira anlogo ao MS quadrupolo linear, variando-se a voltagem ocorrem rpidas inverses
na direo do campo, com os ons sendo alternadamente acelerados e desacelerados na direo
axial e vice versa na direo radial, aprisionando-os. Aumentando-se a voltage, os ons assumem
trajetrias instveis e saem do trap, numa ordem de m/z crescente. Ainda que a resoluo do
MS ion trap seja mais baixa, apresenta como vantagem a pr-concentrao do on de interesse
antes da anlise.
Analisadores de massa
Ionizao por impacto de elctrons (EI)
As molculas so vaporizadas e bombardeadas
com eltrons de alta energia (70 eV), formando
de ons moleculares (+) quando esses eltrons
colidem com a molecula e deslocam elctrons
mais externas. Alguns desses ons so instveis
e de fragmentam em ons menores. Adequada
para compostos no termolbeis.
Dessorpo por Laser assistida por matriz (Matrix Assisted Laser Desorption)
(MALDI):
Tcnica desenvolvida por Karas e Hillkamp em 1988, para ionizao de
peptdeos e protenas, oligossacardeos, glicolipdeos, nucleotdeos, etc.
As amostras so co-cristalizadas com uma matriz (substncia que absorve luz
ultravioleta). Para protenas, utiliza-se o cido sinapnico, que absorve a radiao
de 337 nm do laser de nitrognio. A energia absorvida pela matriz transferida para
as molculas, evitando sua decomposio por calor. Aps a incidncia do pulso de
laser, uma grande quantidade de energia absorvida pela matriz e h uma
"exploso" com emisso de um gs com ons moleculares com uma carga.
Tcnicas de Ionizao
Mass Spectrometry
Matrix-assisted laser desorption ionizaton time of flight
Maldi-Tof
Tcnicas de Ionizao
Ionizao por electronspray (ESI)
Mtodo adequado para anlise de molculas termolbeis, como protenas.
O processo de ionizao das molculas ocorre pela nebulizao de gotculas
(nanolitros) de uma soluo em um campo eltrico intenso, formando gotculas
altamente carregadas. Quando o solvente evapora, formam-se ons moleculares de
simples ou mltiplas cargas. Podem ser formados ons (-) ou (+), de acordo com o
campo elctrico aplicado. No modo positivo, observam-se adutos alcalinos
(protonados) dos analitos e no modo negativo, os ons so desprotonados.
Tcnicas de Ionizao
Sequenciamento de novo de protenas por espectrometria de massas
Para sequenciar protenas
preciso obter o espectro
MS/MS de seus peptdeos.
Isso significa 2 etapas de
MS acopladas.
Depois de fazer o MS da
molcula inteira, esta
fragmentada dentro do
aparelho por coliso com
gases.
Os fragmentos so ento
separados e analisados por
MS.
hlio ou argnio
A ligao peptdica se quebra formando fragmentos tpicos, como os ons b e y
mostrados na figura acima, que tero massas diferentes de acordo com o radical
R de cada aminocido.
Quando um peptdeo analisado por MS/MS, a fragmentao gera uma famlia de
fragmentos peptdicos com massas que vo diferir uma da outra em valores que
correspondem a um on b, permitindo a identificao de cada aminocido.
Sequenciamento de novo de protenas
A sequncia obtida pela anlise dos ons de uma srie pode ser confirmada pela
determinao da sequncia feita a partir da srie complementar de ons, no caso do
exemplo, os ons y.
Sequenciamento de novo de protenas
Espectro MS/MS do peptdeo
trptico
GLSDGEWQQVLNVWGK.
AA Codes Mono. AA Codes Mono.
Gly G 57.021464 Asp D 115.02694
Ala A 71.037114 Gln Q 128.05858
Ser S 87.032029 Lys K 128.09496
Pro P 97.052764 Glu E 129.04259
Val V 99.068414 Met M 131.04048
Thr T 101.04768 His H 137.05891
Cys C 103.00919 Phe F 147.06841
Leu L 113.08406 Arg R 156.10111
Ile I 113.08406 CMC 161.01467
Asn N 114.04293 Tyr Y 163.06333
- - - Trp W 186.07931
Analiza-se o espectro
buscando diferenas de
m/z equivalentes a um
resduo de aminocido,
que permitem conhecer
a seqncia do
peptdeos
perda de amnia = 17 u.m.
perda de H2O = 18 u.m.
perda de CO2= 28 u.m.
Sequenciamento de novo
Espectro MS/MS do peptdeo
GLSDGEWQQVLNVWGK.
ons b e a
ons y
http://prospector.ucsf.edu/
http://db.systemsbiology.net:8080/proteomicsToolkit/index.html
http://www.ionsource.com/
Vous aimerez peut-être aussi
- Espectrometria de Massas - Estudo DirigidoDocument9 pagesEspectrometria de Massas - Estudo DirigidoHenriqueTeotônioPas encore d'évaluation
- QAII JobDocument8 pagesQAII JobplacidoPas encore d'évaluation
- Aula - Espectrometria de MassasDocument4 pagesAula - Espectrometria de MassasNoby TCPas encore d'évaluation
- Espectrometria de MassaDocument2 pagesEspectrometria de MassaIMVG DatabasePas encore d'évaluation
- Fisiologia TOTALDocument297 pagesFisiologia TOTALVitoria GomesPas encore d'évaluation
- FBF5704 Aula1 PDFDocument111 pagesFBF5704 Aula1 PDFMarli CorreaPas encore d'évaluation
- Icp OesDocument19 pagesIcp OesMaria Clara de Oliveira100% (1)
- Lista Eletricidade Biofísica Membrana ResolvidaDocument5 pagesLista Eletricidade Biofísica Membrana ResolvidaatividadesmarciaPas encore d'évaluation
- Farmacologia Do Sistema Nervoso Autônomo e Motor SomáticoDocument77 pagesFarmacologia Do Sistema Nervoso Autônomo e Motor SomáticoSabrina FerreiraPas encore d'évaluation
- 2-Espectrometria de MassasDocument6 pages2-Espectrometria de MassasCarlos AlcantaraPas encore d'évaluation
- 1 Importancia Da Espectrometria de MassasDocument7 pages1 Importancia Da Espectrometria de MassasksmalaquiasPas encore d'évaluation
- Apostila Espectrometria de Massas - Débora AzevedoDocument106 pagesApostila Espectrometria de Massas - Débora AzevedoVinícius Benedetti100% (1)
- Aulas Massa para AlunosDocument27 pagesAulas Massa para AlunosCarol MantovaniPas encore d'évaluation
- Gosme AntónioDocument7 pagesGosme AntónioGOSMEPas encore d'évaluation
- Aula 4 - Farmacologia Do Sistema Nervoso Autônomo e Motor SomáticoDocument69 pagesAula 4 - Farmacologia Do Sistema Nervoso Autônomo e Motor SomáticoFisio BooksPas encore d'évaluation
- Apostila Espectrometria de MassasDocument106 pagesApostila Espectrometria de MassasDanillo Nunes100% (1)
- Radiologia - Módulo I - RadiobiologiaDocument77 pagesRadiologia - Módulo I - RadiobiologiaROBERTO KENNEDY RAPOSO BRAGA MARTINSPas encore d'évaluation
- Espectros de MassaDocument4 pagesEspectros de MassaAlcidênio PessoaPas encore d'évaluation
- Atividade Rafaela 9Document2 pagesAtividade Rafaela 9Daniel OliveiraPas encore d'évaluation
- Exp01 (Transições Eletrônicas)Document8 pagesExp01 (Transições Eletrônicas)Isaac RosaPas encore d'évaluation
- Espectofotometria IFRJDocument36 pagesEspectofotometria IFRJMarlon FariaPas encore d'évaluation
- EspectofotometriaDocument36 pagesEspectofotometriaGraciela CentenaroPas encore d'évaluation
- Espectroscopia Molecular e Lei de Lamber-BeerDocument31 pagesEspectroscopia Molecular e Lei de Lamber-BeerHelder OliveiraPas encore d'évaluation
- BIOELETROGENESEDocument9 pagesBIOELETROGENESEDenise Barth RebescoPas encore d'évaluation
- Resumo de Radiologia IDocument21 pagesResumo de Radiologia ITropa dos ClínicosPas encore d'évaluation
- Espectrofotometria CEFET QuimicaDocument25 pagesEspectrofotometria CEFET QuimicaKakai XavierPas encore d'évaluation
- Lista de Biologia CelularDocument6 pagesLista de Biologia CelularPriscila OliveiraPas encore d'évaluation
- Microscopia EletrônicaDocument12 pagesMicroscopia Eletrônicabrgg.86.rpgPas encore d'évaluation
- Proteómica PPDocument24 pagesProteómica PPPatrícia Marques0% (1)
- Sebenta Teorica AEst Parte IIIDocument235 pagesSebenta Teorica AEst Parte IIIDiego FigueiraPas encore d'évaluation
- CIENCIA HOJE Vol 34 N 199 MitocondriaDocument8 pagesCIENCIA HOJE Vol 34 N 199 MitocondriaLeticia EmidioPas encore d'évaluation
- Espctroscopia MolecularDocument6 pagesEspctroscopia MolecularJosuel BarbosaPas encore d'évaluation
- Artigo Espectrometira de Massa de Proteínas Revista BiotecnologiaDocument7 pagesArtigo Espectrometira de Massa de Proteínas Revista BiotecnologiaMagaly LaylaPas encore d'évaluation
- Espectrometria de MassasDocument6 pagesEspectrometria de MassaskellysonmatheusPas encore d'évaluation
- JanelasDocument26 pagesJanelasAlessandro Marcondes DellaCasaPas encore d'évaluation
- Química 1 - Elementos Químicos e Sua OrganizaçãoDocument112 pagesQuímica 1 - Elementos Químicos e Sua Organizaçãopipa framosPas encore d'évaluation
- 01 Noções BásicasDocument3 pages01 Noções BásicasBruno FernandesPas encore d'évaluation
- Transporte I Nico e o Potencial de MembranaDocument14 pagesTransporte I Nico e o Potencial de MembranaGustavoPas encore d'évaluation
- 8 Radiações Parte IDocument15 pages8 Radiações Parte IFernando BritoPas encore d'évaluation
- Resumo Exame - FQDocument29 pagesResumo Exame - FQÍris SimõesPas encore d'évaluation
- Espectrofotometria PDFDocument36 pagesEspectrofotometria PDFLorena GuimarãesPas encore d'évaluation
- FAN2 - Espectrometria MassasDocument6 pagesFAN2 - Espectrometria MassasAgnes DayPas encore d'évaluation
- Sinais Eletricos No Corpo HumanoDocument26 pagesSinais Eletricos No Corpo HumanoFrancine HkPas encore d'évaluation
- APOSTILA DE CARACTERIZAÇÃO - MEV, DRX e An (1) - Química e Gran.Document36 pagesAPOSTILA DE CARACTERIZAÇÃO - MEV, DRX e An (1) - Química e Gran.José Carlos CaladoPas encore d'évaluation
- 004 Aula Semana 4Document37 pages004 Aula Semana 4Gabriella S. de SouzaPas encore d'évaluation
- Artigo Introducao A Sinalizacao CelularDocument10 pagesArtigo Introducao A Sinalizacao CelularCamila Rodrigues100% (1)
- Aula2 Cc3b3piaDocument41 pagesAula2 Cc3b3piaAndreia TrinoPas encore d'évaluation
- Seqüenciamento de PeptídeosDocument7 pagesSeqüenciamento de PeptídeosRomel VilelaPas encore d'évaluation
- Química Resumos-1ºpDocument11 pagesQuímica Resumos-1ºp13LY7Pas encore d'évaluation
- EspectrofotometriaDocument34 pagesEspectrofotometriaVICTOR RAUL MACEDO QUISPEPas encore d'évaluation
- Relatório MevDocument6 pagesRelatório MevRayla SáPas encore d'évaluation
- (2 VÍDEOCONFERÊNCIA) EletroforeseDocument48 pages(2 VÍDEOCONFERÊNCIA) EletroforeseRobertoBarbosa 170Pas encore d'évaluation
- Apostila de Espectorscopia CompletaDocument234 pagesApostila de Espectorscopia CompletaCamila De Jesus AndradePas encore d'évaluation
- Espectrometria de Massas v1.1.09 PDFDocument32 pagesEspectrometria de Massas v1.1.09 PDFGabrieli BernardiPas encore d'évaluation
- Aula Nº. 7 e 8 Da 10 Classe PDFDocument4 pagesAula Nº. 7 e 8 Da 10 Classe PDFJakendry 12Pas encore d'évaluation
- Espectrometria de massas para iniciantesD'EverandEspectrometria de massas para iniciantesÉvaluation : 4 sur 5 étoiles4/5 (1)
- Biologia Celular e Molecular: Um guia introdutório para aprendizagem de Biologia Celular e MolecularD'EverandBiologia Celular e Molecular: Um guia introdutório para aprendizagem de Biologia Celular e MolecularPas encore d'évaluation
- Kardex Matriz - TreinamentoDocument2 pagesKardex Matriz - TreinamentoFabricio MacedoPas encore d'évaluation
- Equilíbrio Químico - Reacoes QuimicasDocument29 pagesEquilíbrio Químico - Reacoes QuimicasDaniel ArrudaPas encore d'évaluation
- PropagacaoDocument4 pagesPropagacaoSilvania RochaPas encore d'évaluation
- Aula-Intrutoria RessonanciaDocument39 pagesAula-Intrutoria Ressonanciapatmo70Pas encore d'évaluation
- Lista 2Document3 pagesLista 2Raquel Reis MartellotiPas encore d'évaluation
- Trabalho Escrito AjustadoDocument14 pagesTrabalho Escrito AjustadopettersonbPas encore d'évaluation
- Ed Aula 01 2019 Processamento Primario de Petroleo PDFDocument17 pagesEd Aula 01 2019 Processamento Primario de Petroleo PDFMarilin SantosPas encore d'évaluation
- Métodos de Separação PDFDocument31 pagesMétodos de Separação PDFDébora GuimarãesPas encore d'évaluation
- Aula - GasesDocument48 pagesAula - Gasesisrael silvaPas encore d'évaluation
- Laudo de ÓleoDocument1 pageLaudo de ÓleoCaio Pereira100% (1)
- Sistema de Purificação de Biogás: ResumoDocument12 pagesSistema de Purificação de Biogás: ResumoDanny BoyPas encore d'évaluation
- 2a Lista de PHDocument2 pages2a Lista de PHMatheus TavaresPas encore d'évaluation
- Torres de ResfriamentoDocument36 pagesTorres de Resfriamentovagner_mec100% (2)
- IIGeracao II - Geracao TermoeletricaDocument35 pagesIIGeracao II - Geracao Termoeletricaroberio AlvesPas encore d'évaluation
- Volumetria de Precipitação - Métodos de Vollhard, Mohr e FajansDocument12 pagesVolumetria de Precipitação - Métodos de Vollhard, Mohr e FajansEvandro Serafim Morais100% (1)
- Parte 1 - Aula 2 - Química Orgânica Avançada PDFDocument8 pagesParte 1 - Aula 2 - Química Orgânica Avançada PDFCarlos DinizPas encore d'évaluation
- Química - Lista de Exercícios de Soluções e SolubilidadeDocument2 pagesQuímica - Lista de Exercícios de Soluções e SolubilidadeCELI ANTONIA DE DEUSPas encore d'évaluation
- 2008 Univ Fed Alagoas UFALDocument10 pages2008 Univ Fed Alagoas UFALCiro MeirelesPas encore d'évaluation
- APSAQ8 - Propriedades Qu - Micas Dos Elementos e Das Subst - Ncias Elementares - Corre - oDocument8 pagesAPSAQ8 - Propriedades Qu - Micas Dos Elementos e Das Subst - Ncias Elementares - Corre - oPimento TVPas encore d'évaluation
- Ácido NítricoDocument5 pagesÁcido NítricoFernando GiacominiPas encore d'évaluation
- Métodos Clássicos de Separação REVISADO 2016Document25 pagesMétodos Clássicos de Separação REVISADO 2016Santclair OliveiraPas encore d'évaluation
- Lei de Boyle e Lei de CharlesDocument4 pagesLei de Boyle e Lei de CharlesJanaina CostaPas encore d'évaluation
- Procedimento Solubilidade e MascaraçãoDocument2 pagesProcedimento Solubilidade e MascaraçãoRodrigoM.FraguasPas encore d'évaluation
- Relatório04 - QAEDocument7 pagesRelatório04 - QAEPedro WalaxPas encore d'évaluation
- Manual Branqueamento 17-11-2009Document76 pagesManual Branqueamento 17-11-2009thamirislopesPas encore d'évaluation
- QUÍMICA - Isomeria PlanaDocument20 pagesQUÍMICA - Isomeria PlanaVictor Lopes GonzagaPas encore d'évaluation
- Aula - 3 PMT3130 2017 NeivaDocument21 pagesAula - 3 PMT3130 2017 NeivaKalipse FerreiraPas encore d'évaluation
- Ime Quim 99Document2 pagesIme Quim 99Daniel BadianiPas encore d'évaluation
- Quimica Percurso 2019Document90 pagesQuimica Percurso 2019Eduardo LopesPas encore d'évaluation