Académique Documents
Professionnel Documents
Culture Documents
Diagrama de Fases Hierro-Carbono
Transféré par
oscarpinzon92Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Diagrama de Fases Hierro-Carbono
Transféré par
oscarpinzon92Droits d'auteur :
Formats disponibles
DIAGRA DE FASES DEL
HIERRO-CABONO
Samanta Len
Fernando Urrego
Camila Salgado
Edwin Vallejo
Oscar Pinzn
Sergio Bejarano
QUE SON?
Representaciones grficas de las fases que estn
presentes en un sistema de materiales a varias
temperaturas, presiones y composiciones. La mayora de
los diagramas de fase han sido construidos segn
condiciones de equilibrio (condiciones de enfriamiento
lento).
QUE SON?
Cuando en una de estas
representaciones todas las fases
corresponden a estados de agregacin
diferentes se suele denominar diagrama
de cambio de estado.
En el diagrama de equilibrio o de fases,
Fe-C se representa las transformaciones
que sufren los aceros al carbono con la
temperatura,
Los elementos qumicos y las
sustancias formadas por ellos salvo
algunas excepciones, pueden existir
en tres estados diferentes: slido,
lquido y gaseoso
QUE SON?
INFORMACION
- Conocer que fases estn presentes a diferentes composiciones y
temperaturas bajo condiciones de enfriamiento lento (equilibrio).
- Averiguar la solubilidad, en el estado slido y en el equilibrio, de un
elemento (o compuesto) en otro.
- Determinar la temperatura a la cual una aleacin enfriada bajo
condiciones de equilibrio comienza a solidificar y la temperatura a la
cual ocurre la solidificacin.
- Conocer la temperatura a la cual comienzan a fundirse diferentes
fases.
LIMITE DE SOLUBILIDAD
Para muchos sistemas y para
una determinada temperatura,
existe una Concentracin
mxima de tomos de soluto
que puede ser disuelta en el
solvente formando una
solucin slida.
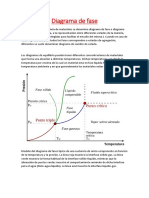
FIGURA GENERAL
FIGURA GENERAL
En los ejes estn representados los valores de
presin y temperatura y las tres curvas AB, BD y
BC, la frontera entre los diferentes estados.
PUNTO TRIPLE PUNTO CRITICO
En este punto en la sustancia
coexisten en equilibrio los tres
estados, est parcialmente
solida.
El punto C indica el valor
mximo de temperatura en el
que pueden coexistir en
equilibrio dos fases.
PUNTO EBULLICION
PUNTO DE FUSION
El punto de ebullicin de una
sustancia, es aquel valor de
temperatura para el cual coexisten
en equilibrio.
El punto de fusin de una sustancia,
es aquel valor de temperatura para
el cual coexisten en equilibrio.
SUSTACIA PURA
Las diagramas de fase ms sencillos son
los de presin - temperatura de una
sustancia pura, como puede ser el del
agua. En el eje de ordenadas se coloca
la presin y en el de abscisas la
temperatura.
LOS PARES
Que son(presin, temperatura) corresponden a
una transicin:
Dos fases solidas
Entre fase solida y liquida
Entre fase solida y de vapor
Entre fase liquida y de vapor
NOTA IMPORTANTE
Ms all del punto crtico, la materia se presenta
como un fluido supe crtico que tiene propiedades
tanto de los lquidos como de los gases.
Modificando la presin y temperatura en valores
alrededor del punto crtico se producen
reacciones que pueden tener inters industrial,
como por ejemplo las utilizadas para obtener caf
descafeinado.
DIAGRAMA DE FASE BINARIO
Cuando aparecen varias sustancias, la
representacin de los cambios de fase puede ser
ms compleja. Un caso particular, el ms sencillo,
corresponde a los diagramas de fase binarios.
Ahora las variables a tener en cuenta son la
temperatura y la concentracin, normalmente en
masa.
QUE SON?
Lnea de Liquido Lnea de solido
por encima de la cual solo
existen fases lquidas.
por debajo de la cual solo
existen fases slidas.
Lnea eutctica Lnea de solvus
Son lneas horizontales (isotermas)
en las que tienen lugar
transformaciones eutcticas y
eutectoides, respectivamente.
Indica las temperaturas para las
cuales una solucin slida ()de A y
B deja de ser soluble para
transformarse en ()+ sustancia pura
(A B).
Concentraciones definidas
En las que ocurren transformaciones a
temperatura constante:
Eutctica
Eutectoide
Peritctica Perictectoide
Monotctica
Sintctica
REGLA DE FASES GIBBS
Establece un criterio para definir el numero de
fases en equilibrio de un sistema
:
REGLA DE FASES GIBBS
P - nmero de fases en equilibrio
F - nmero de grados de libertad o variacin
C - nmero de componentes, y
N - nmero de variacin excepto las de composicin
(normalmente presin y temperatura)
REGLA DE FASES GIBBS
Para la mayora de los sistemas N=2 (presin y
temperatura) y en la mayora de los procesos la presin es
constante, as que N=1. Para un sistema de dos
componentes (binrio) esta regla queda:
As para F = 0, se tiene que el nmero mximo de fases en
equilibrio en un sistema binario, es:
REGLA DE FASES GIBBS
Las principales reacciones en sistemas binarios
involucrando 3 fases son:
REGLA DE LA PALANCA
Es usada para determinar las proporciones de las
fases en equilibrio en un campo de dos fases
DESARROLLO DE MICROESTRUCTURA EN
SISTEMAS BINARIOS
Solidificacin en condiciones de equilibrio
Solidificacin en condiciones fuera de equilibrio
Consecuencias de solidificacin
fuera de equilibrio
Segregacin
Reduccin en la T
Disminucin en las
propiedades
Necesidad en el recocido
DIAGRAMA DE FASES
HIERRO-CARBONO
El diagrama hierro carbono es de gran importancia en la ingeniera ya
que el hierro y sus aleaciones son materiales de gran uso en el campo
Tambin es necesario conocer las estructuras de las diferentes
aleaciones como herramienta de apoyo para entender y predecir su
comportamiento
El anlisis del diagrama de hierro metalestable representa la base para
identificar las fases y micro constituyentes estructurales
El diagrame de fe-c meta estable(con el paso del tiempo se
descompone)aporta las bases para la optimizacin del comportamiento
de las aleaciones frricas mediante tratamientos trmico.
FORMAS ALOTRPICAS DEL HIERRO
El hierro cristaliza en la variedad alfa hasta la temperatura de 768C. La red
espacial a la que pertenece es la red cbica centrada en el cuerpo (BCC). La
distancia entre tomos es de 2.86 . El hierro alfa no disuelve prcticamente
en carbono, no llegando al 0.008% a temperatura ambiente, teniendo como
punto de mxima solubilidad a T=723C (0,02%).
La variedad beta existe de 768C a 910C. Cristalogrficamente es igual a la
alfa, y nicamente la distancia entre tomos es algo mayor: 2.9 a 800C y
2905C a 900C.
FORMAS ALOTRPICAS DEL HIERRO
La variedad gamma se presenta de 910C a 1400C. Cristaliza en la estructura
FCC. El cubo de hierro gamma tiene ms volumen que el de hierro alfa. El hierro
gamma disuelve fcilmente en carbono, creciendo la solubilidad desde 0.85% a
723C hasta 1.76% a 1130C para decrecer hasta el 0.12% a 1487C. Esta
variedad de Fe es amagntico.
La variedad delta se inicia a los 1400C, observndose, entonces una reduccin en
el parmetro hasta 2.93, y un retorno a la estructura BCC. Su mxima solubilidad
de carbono es 0.007% a 1487C. Esta variedad es poco interesante desde el punto
de vista industrial. A partir de 1537C se inicia la fusin del Fe puro.
REACCIN EUTECTOIDE
Una Reaccin eutectoide es un proceso metalrgico que ocurre durante el
enfriamiento de aleaciones con determinada concentracin de los
aleantes.
Todas las fases involucradas en este proceso son slidas: durante el
enfriamiento, una fase se transforma en otras dos, por difusin en estado
slido. Esto se materializa en la diferente estructura que adoptan los tomos,
agrupndose en zonas en las cuales los aleantes estn claramente
diferenciados, como por franjas, las reacciones eutectoides se efecta
totalmente dentro del estado slido
se usa la reaccin eutectoide para controlar la estructura y propiedades de
los aceros, mediante tratamiento trmico y aleacin
TRANSFORMACIN EUTECTOIDE
Indica Que A La Temperatura De 723c
La Solida Gama Con 0.8% De
Carbono Se Transforma
Isotrmicamente En Solucin Solida
Alfa Con 0.0218% De Carbono Mas
Compuesto De Carburo De Hierro
REACCIN EUTCTICA
La reaccin eutctica constituye la transformacin de solidificacin
completa del lquido. Este tipo de reaccin corresponde a un punto fijo en
el diagrama de fases, es decir, ocurre a una temperatura y composicin
determinada, y dicho punto posee cero grados de libertad A partir de una
muestra slida, a cualquier composicin distinta de la eutctica, la muestra
no fundir completamente independientemente de la temperatura a la
que nos encontremos.
TRANSFORMACIN EUTECTICA
Indica que a la temperatura de 1129c el liquido
con 4.3% de carbono se transforma
isotrmicamente en solucin solida gama con
2.11% de carbono mas compuesto de carburo
de hierro. El producto da lugar a un
constituyente llamado ley de murita
REACCIN PERITECTICA
Es cuando un lquido y un slido reaccionan isotrmicamente para
formar un nuevo slido al enfriarse.
TRANSFORMACIN
PERITECTICA
Indica Que A La Temperatura De 1495c El
Liquido Con O.53% De Carbono, Mas La
Solucin Solida Delta Con 0.09 De Carbono
Se Transforma Isotrmicamente En
Solucin Solida Gama Con 0.17% De
Carbono
HIERRO
El hierro es un constituyente
fundamental de algunas de las
mas importante aleaciones de la
Ingeniera. En una forma casi pura,
conocida como hierro dulce, se
utiliza en alcantarillas para
drenaje, material para techos y
conductos, y como base para
sobre el esmaltar porcelana en
refrigeradores, estufas lavadoras
etc.
PROPIEDADES MECNICAS
Las propiedades mecnicas tpicas del hierro son:
Resistencia tensil 40 000 lb/pul2
Elongacin en 2 pulg 40%
Dureza rockwell B 30
CURVA DE ENFRIAMIENTO
ESTRUCTURAS DEL DIAGRAMA
AUSTENITA
Mxima solubilidad es de e
2% de C a 1130C
Resistencia tensil 150 000
lb/pul2
Elongacin 10% en 2 pulg
Dureza rockwell C 40
aproximadamente y
tenacidad alta.
FERRITA
Mxima solubilidad de
carbono es 0.007% a
1487C
Muy blanda.
Estructura cristalina BCC
Es magntica.
Muy poca posibilidad de
disolucin del carbono.
LEDEBURITA
De composicin alrededor del
4.3% de C
Formada por 52% de cementita
y 48% de austenita
No existe a temperatura
ambiente en las fundiciones
ordinarias
Microestructura interna de la
ledeburita.
GRAFITO
Es bastante duro, por lo que una cantidad
elevada de grafito hace que la aleacin sea
muy dura pero a la vez, muy frgil, adems los
copos de grafito imparten una buena
maquinabilidad actuando como rompe
virutas, y tambin presentan una buena
capacidad de amortiguacin.
El grafito se puede clasificar en varios tipos:
El grafito tipo A
El grafito tipo B:
El grafito tipo C:
Los grafitos tipo D y E:
FERRITA
FERRITA ALFA
Ferrita alfa (0 hasta 0,022%C)
Es el nombre dado a la solucin slida
. Su estructura cristalina es BCC con
una distancia interatmica de 2.86 .
Prcticamente no disuelve en
carbono, como se puede observar en
la Figura 5.4, donde se tiene un acero
con bajo porcentaje de carbono.
La mxima solubilidad es 0,022% de C
a 727C, y disuelve slo 0,008% de C a
temperatura ambiente.
Microestructura interna de la ferrita.
PROPIEDADES
Las ferritas son materiales cermicos ferromagnticos (slo la alfa),
compuestos por hierro, boro y bario, estroncio o molibdeno.
Las ferritas tienen una alta permeabilidad magntica, lo cual les permite
almacenar campos magnticos con ms fuerza que el hierro.
Las ferritas se producen a menudo en forma de polvo, con el cual se
pueden producir piezas de gran resistencia y dureza, previamente
moldeadas por presin y luego calentadas, sin llegar a la temperatura de
fusin, dentro de un proceso conocido como sinterizacin. Mediante este
procedimiento se fabrican ncleos
para transformadores, inductores/bobinas y otros elementos
elctricos o electrnicos.
USOS
Los primeros ordenadores estaban dotados de memorias que
almacenaban sus datos en forma de campo magntico en ncleos
de ferrita, los cuales estaban ensamblados en conjuntos de ncleos
de memoria.
El polvo de ferrita se usa tambin en la fabricacin de cintas para
grabacin; en este caso, el material es trixido de hierro. Otra
utilizacin comn de los ncleos de ferrita es su uso en multitud de
cables electrnicos para minimizar las interferencias
electromagnticas (EMI)
PERLITA
Por El Efecto De Borde De Grano Entre Los
Distintos Granos De Perlita Y Las Distintas
Laminas De La Microestructura
PROPIEDADES
Es la mezcla eutectoide que contiene 0,77 % de C y se forma a 727C a un
enfriamiento muy lento. Es una mezcla muy fina, tipo placa o laminar de
ferrita y cementita. Se le da este nombre porque tiene la apariencia de una
perla al observarse microscpicamente a pocos aumentos.
Cuando esta estructura laminar es muy fina la perlita se ve al microscopio
ptico como negra. Sin embargo ambas fases, ferrita y cementita en
condiciones normales de ataque son blancas. El color oscuro o negro lo
producen el gran nmero de lmites de grano existentes entre la matriz
ferrtica y las lminas de cementita. Se comprende que cuanto ms anchas
sean las lminas (se habla entonces de perlita abierta o basta) la tonalidad
se ir aclarando hasta poder distinguirse las distintas lminas, no por ello la
perlita pierde su carcter de microconstituyente.
TIPOS DE PERLITA
Perlita fina: dura y resistente.
Perlita gruesa: menos dura y ms
dctil.
La perlita gruesa es ms dctil que
la perlita fina a consecuencia de
la mayor restriccin de la perlita
fina a la deformacin plstica.
Mecnicamente las perlitas tienen
las propiedades intermedias entre
la blanda y dctil ferrita y la dura y
quebradiza cementita.
Micro-estructura interna de la perlita
USOS
La razn de este comportamiento radica en primer lugar, porque
hay un alto grado de adherencia entre las dos fases en el lmite. Por lo
tanto, la resistencia y la rigidez de la fase cementita restringe la
deformacin de la fase (ferrita), ms blanda, en las regiones
adyacentes al lmite; es decir, la cementita refuerza a la ferrita. Este
grado de reforzamiento es ms elevado en la perlita fina porque es
mayor la superficie de lmites de fases por unidad de volumen del
material.
La perlita gruesa es ms dctil que la perlita fina a consecuencia de
la mayor restriccin de la perlita fina a la deformacin plstica.
SOLUBILIDAD DE CARBONO EN HIERRO
25%
32%
TRANSFORMACIN DE LA
AUSTENITA
El diagrama de fases Fe-C muestra dos composiciones singulares:
Un eutctico (composicin para la cual el punto de fusin es mnimo) que
se denomina ledeburita y contiene un 4,3% de carbono (64,5 % de
cementita). La ledeburita aparece entre los constituyentes de la aleacin
cuando el contenido en carbono supera el 2% (regin del diagrama no
mostrada) y es la responsable de la mala forjabilidad de la aleacin
marcando la frontera entre los aceros con menos del 2% de C (forjables) y
las fundiciones con porcentajes de carbono superiores (no forjables y
fabricadas por moldeo). De este modo se observa que por encima de la
temperatura crtica A31 los aceros estn constituidos slo por austenita, una
solucin slida de carbono en hierro y su microestructura en condiciones
de enfriamiento lento depender por tanto de las transformaciones que
sufra sta.
Un eutectoide en la zona de los aceros, equivalente al eutctico pero en el
estado slido, donde la temperatura de transformacin de la austenita es
mnima. El eutectoide contiene un 0,80 %C (13,5% de cementita) y se
denomina perlita. Est constituido por capas alternas de ferrita y cementita,
siendo sus propiedades mecnicas intermedias entre las de la ferrita y la
cementita.
TRANSFORMACIN DE LA
AUSTENITA
Una de las principales transformaciones de la austenita a la martensita:
Si se enfra rpidamente la austenita a una velocidad mayor que la
velocidad crtica de temple la transformacin de la austenita tiene lugar
por debajo de los 250C.
La martensita es una solucin slida sobresaturada en carbono que
presenta una estructura tetragonal centrada en el cuerpo con los tomos
de carbono ocupando posiciones octadricas intersticiales a lo largo del
eje mayor de la celda.
La transformacin martenstica no depende del tiempo sino solo de la
temperatura. Enfriada la austenita por debajo de la temperatura a la que
esta transformacin comienza a producirse (M.), sta tiene lugar
instantneamente (la formacin de placas individuales de martensita
ocurre en tiempos del orden de los 10'7 s) y no progresa aunque
mantengamos constante la temperatura durante largos periodos de
tiempo.
TRANSFORMACIN DE LA
AUSTENITA
La transformacin de la austenita en martensita tiene lugar con un aumento
de volumen que depende ligeramente del contenido en carbono del
acero, pero que en trminos generales se sita en torno al 4%. Una
consecuencia de esta caracterstica es la creacin de un fuerte campo
local de tensiones residuales, que puede, en algunos casos, llegar a
producir el agrietamiento del acero.
La cantidad de austenita transformada en martensita aumenta al disminuir
la temperatura. Se denomina M. a la temperatura a la que se inicia esta
transformacin y Mf es la temperatura a la que toda la austenita se ha
transformado en martensita. Estas temperaturas dependen casi
exclusivamente de la composicin qumica del acero: cualquier elemento
qumico, a excepcin del cobalto y aluminio, disminuyen la temperatura M.,
pero la influencia de los elementos intersticiales (carbono y nitrgeno) es
mucho mayor.
TRANSFORMACIN DE LA
AUSTENITA
GRACIAS POR SU ATENCIN
Vous aimerez peut-être aussi
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSD'EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSÉvaluation : 4.5 sur 5 étoiles4.5/5 (7)
- Tesis en Ing Industrial BY Castro - VCDocument272 pagesTesis en Ing Industrial BY Castro - VCJohannes Aucaylle NietoPas encore d'évaluation
- Evaluación 3Document2 pagesEvaluación 3Dj MC100% (2)
- Diagrama de FaseDocument5 pagesDiagrama de FaseKevin Perez YallePas encore d'évaluation
- Trastornos MentalesDocument20 pagesTrastornos Mentalessamirs vilcapoma100% (2)
- ORACIÓN DE VÍSPERAS Ante El SantísimoDocument61 pagesORACIÓN DE VÍSPERAS Ante El Santísimo1985Víctor100% (4)
- Unidad 5 Transformacion EstructuralDocument17 pagesUnidad 5 Transformacion EstructuralDavid PalaciosPas encore d'évaluation
- Ingenieria de Materiales - Diagrama de FasesDocument48 pagesIngenieria de Materiales - Diagrama de FasesKatt Ramos0% (2)
- Diagramas de Fase 1Document23 pagesDiagramas de Fase 1elodulavallePas encore d'évaluation
- Fraccionamiento de GLPDocument46 pagesFraccionamiento de GLPannysmv100% (4)
- Demanda de Lo Contencioso AdministrativoDocument8 pagesDemanda de Lo Contencioso AdministrativoFernando MendozaPas encore d'évaluation
- Los Tres FiatDocument1 pageLos Tres FiatDácil Coello Cabrera100% (1)
- Planificacion Microemprendimiento EDIDocument19 pagesPlanificacion Microemprendimiento EDIclodiaok75% (4)
- Ciencia de Los Materiales. Diagrama de FasesDocument10 pagesCiencia de Los Materiales. Diagrama de FasesFelipe Balboa PolancoPas encore d'évaluation
- Lectura Letra ÑDocument3 pagesLectura Letra Ñwagner alva cotrina100% (1)
- Plan de TrabajoDocument12 pagesPlan de TrabajoMario Javier Cobeñas Balles100% (1)
- Diagrama de FaseDocument11 pagesDiagrama de FaseAnonymous o5FX4oqBPas encore d'évaluation
- DIAGRAMAS DE EQUILIBRIO y Ley de Las PalancasDocument12 pagesDIAGRAMAS DE EQUILIBRIO y Ley de Las PalancasMARIA CAMILA LEON DELGADOPas encore d'évaluation
- Cuestionario Diagrama de Fase Regla de La Palanca y DurezaDocument8 pagesCuestionario Diagrama de Fase Regla de La Palanca y DurezaJuan Diego Riano MurciaPas encore d'évaluation
- Sesion 3 (T)Document67 pagesSesion 3 (T)LOLI LEON SHIRLEY SHANTALPas encore d'évaluation
- Energía en Los Cambios QuímicosDocument12 pagesEnergía en Los Cambios QuímicossofiaPas encore d'évaluation
- Diagramas de FaseDocument15 pagesDiagramas de FaseDiego NogalesPas encore d'évaluation
- Informe Equilibrio Liquido VaporDocument25 pagesInforme Equilibrio Liquido VaporPaolo Guerra SteinPas encore d'évaluation
- Diagrama de Fase y FisicoquimicaDocument4 pagesDiagrama de Fase y FisicoquimicaRonal Vásquez BautistaPas encore d'évaluation
- Diagramas de FaseDocument40 pagesDiagramas de FasePaola PalaciosPas encore d'évaluation
- Trabajo de Metalografia Diagrama Cu Ni Regla de La Palanca y Regla de Fases de GibbsDocument16 pagesTrabajo de Metalografia Diagrama Cu Ni Regla de La Palanca y Regla de Fases de GibbsMartin MendozaPas encore d'évaluation
- El Diagrama de FasesDocument6 pagesEl Diagrama de FasesAriPas encore d'évaluation
- Diagramas de Equilibrio2Document41 pagesDiagramas de Equilibrio2Aaron AlmarzaPas encore d'évaluation
- Diagramas de FaseDocument27 pagesDiagramas de FaseDanniel BloomPas encore d'évaluation
- Dia2 1Document16 pagesDia2 1Ing Daniel GonzalezPas encore d'évaluation
- Transformacion Estructural MatmetDocument58 pagesTransformacion Estructural MatmetcdfftfPas encore d'évaluation
- Clasificacion Diagrama de FaseDocument16 pagesClasificacion Diagrama de FaseMaría Jose Aranza Morales PalafoxPas encore d'évaluation
- Clase 17 - Diagrama de Equilibrio Con Solubilidad TotalDocument17 pagesClase 17 - Diagrama de Equilibrio Con Solubilidad TotalJOSE VALENTIN FLORES RODRIGUEZPas encore d'évaluation
- Diagrama de FasesDocument12 pagesDiagrama de FasesJason Q. CruzPas encore d'évaluation
- Diagrama de FasesDocument1 pageDiagrama de FaseshunbertoPas encore d'évaluation
- Diagrama de FaseDocument24 pagesDiagrama de Fasejulio gomezPas encore d'évaluation
- Ciencia de Materiales Practica 3.3 Grupo "A" Estudiantes: Docente: Ing. Ivan AguirreDocument10 pagesCiencia de Materiales Practica 3.3 Grupo "A" Estudiantes: Docente: Ing. Ivan AguirreNEXUS OMGPas encore d'évaluation
- 3er Laboratorio de Fisicoquimica - Diagrama de FasesDocument64 pages3er Laboratorio de Fisicoquimica - Diagrama de FasesGhino Xavier Huertas Paico50% (2)
- Guía Diagramas de FaseDocument5 pagesGuía Diagramas de FaseFelipe Peña PeñaPas encore d'évaluation
- Actividad 10 Diagrama de FasesDocument8 pagesActividad 10 Diagrama de FasesCitlaly Montalvo100% (1)
- Informe de Diagrama de Fases U5 GjpsDocument16 pagesInforme de Diagrama de Fases U5 Gjpsjose jose prieto santanaPas encore d'évaluation
- Trabajo AutonomoDocument7 pagesTrabajo AutonomoJeremy Daniel Mendoza SegoviaPas encore d'évaluation
- 08 Metales y AleacionesDocument61 pages08 Metales y AleacionesDaniel Perez AguillonPas encore d'évaluation
- T2 - Diagramas - Equilibrio Del Hierro CarbonoDocument12 pagesT2 - Diagramas - Equilibrio Del Hierro Carbonojose2277Pas encore d'évaluation
- Práctica N°7-Construcción de Diagramas de Fases y Regla de La PalancaDocument44 pagesPráctica N°7-Construcción de Diagramas de Fases y Regla de La PalancaMattPas encore d'évaluation
- Diagramas de FasesDocument9 pagesDiagramas de FasesPaola Pallares ÁvilaPas encore d'évaluation
- DiagramadefasesDocument43 pagesDiagramadefasesquimicocad9891Pas encore d'évaluation
- Diagrama de Fases o Diagrama de Equilibrio 1 PDFDocument16 pagesDiagrama de Fases o Diagrama de Equilibrio 1 PDFSylvia RodriguezPas encore d'évaluation
- Diagrama de Fase PuraDocument6 pagesDiagrama de Fase Purajesus machinPas encore d'évaluation
- Traducción 1ciencias 2Document10 pagesTraducción 1ciencias 2Kevin ReascosPas encore d'évaluation
- Diagrama de FaseDocument25 pagesDiagrama de FasegilbertoPas encore d'évaluation
- Clase N°3 Solidificacion de Las Aleaciones PDFDocument223 pagesClase N°3 Solidificacion de Las Aleaciones PDFIgnacio FeijooPas encore d'évaluation
- 1 Diagrama de FasesDocument25 pages1 Diagrama de FasesJose Manayay SanchezPas encore d'évaluation
- Tarea Fisico QuimicaDocument22 pagesTarea Fisico QuimicaMiguel BermudezPas encore d'évaluation
- Diagrama de FasesDocument47 pagesDiagrama de FasesMartha RiosPas encore d'évaluation
- Diagramas de FacesDocument21 pagesDiagramas de FacesferminhernandezPas encore d'évaluation
- Diagramas de FasesDocument30 pagesDiagramas de FasesmonserrathPas encore d'évaluation
- Termodinámica de La TostaciónDocument25 pagesTermodinámica de La TostaciónMirka C. BauerPas encore d'évaluation
- Sistema de Aleacion Binario EutecticoDocument6 pagesSistema de Aleacion Binario EutecticoSergioPas encore d'évaluation
- Unidad 3 Ing de MaterialesDocument10 pagesUnidad 3 Ing de MaterialesIvan ReyesPas encore d'évaluation
- Diagrama de KellogDocument8 pagesDiagrama de KellogangeloPas encore d'évaluation
- Diagrama de FasesDocument66 pagesDiagrama de FasesEduardo Ortiz SPas encore d'évaluation
- Sistema de Aleacion Binario EutecticoDocument6 pagesSistema de Aleacion Binario EutecticoMatias AriasPas encore d'évaluation
- Ses 5 Equilibrio de Fases y Endurecimiento Por Solucion SolidaDocument40 pagesSes 5 Equilibrio de Fases y Endurecimiento Por Solucion SolidaMaria AquisePas encore d'évaluation
- Diagrama de FaceDocument8 pagesDiagrama de FaceLeonardo Daniel Toledo PresaPas encore d'évaluation
- Preguntas Examen 2011Document21 pagesPreguntas Examen 2011MNayeli Rosas ReyesPas encore d'évaluation
- Sem7 MF Diagrama de Fases de Aleaciones JRCL 202220Document24 pagesSem7 MF Diagrama de Fases de Aleaciones JRCL 202220José ZavalaPas encore d'évaluation
- Reglas de La Composición GraficaDocument3 pagesReglas de La Composición GraficaGerald UlatePas encore d'évaluation
- Lectura GAO y GAFDocument13 pagesLectura GAO y GAFARIANA SOFIAPas encore d'évaluation
- Querella FabianDocument4 pagesQuerella Fabiankaterin fredesPas encore d'évaluation
- Cuadros Comparativos de Las Principales Corrientes Pedagógicas - BLOGDocument7 pagesCuadros Comparativos de Las Principales Corrientes Pedagógicas - BLOGMark Antony Rojas Ronquillo0% (1)
- Manual de Comprensión LectoraDocument62 pagesManual de Comprensión LectoraJosé CastilloPas encore d'évaluation
- (Código de Ética de Los Arquitectos (Sólo Lectura) )Document13 pages(Código de Ética de Los Arquitectos (Sólo Lectura) )Jose GuillermoPas encore d'évaluation
- Tiende Tu Cama 3 H BalbinDocument6 pagesTiende Tu Cama 3 H BalbinEdith GuevaraPas encore d'évaluation
- Toxicomanias y PsicoanalisisDocument8 pagesToxicomanias y PsicoanalisisMariaPas encore d'évaluation
- Ficha TivoliDocument1 pageFicha TivoliMauricio Carvallo G.Pas encore d'évaluation
- 11o 3p Las Partes de Un EnsayoDocument3 pages11o 3p Las Partes de Un EnsayoMaoTseTPas encore d'évaluation
- Folleto Steven Paul JobsDocument2 pagesFolleto Steven Paul JobsNelson BlancoPas encore d'évaluation
- TP - Mito EdipoDocument2 pagesTP - Mito EdipoIvanaVicentePas encore d'évaluation
- Final 1.1v Mapa Mental Del Surgimiento de Ingenieria en SoftwareDocument3 pagesFinal 1.1v Mapa Mental Del Surgimiento de Ingenieria en SoftwareJovani MaytorenaPas encore d'évaluation
- Cronograma para La Campaã - ADocument4 pagesCronograma para La Campaã - AMiranda CorralesPas encore d'évaluation
- Unidad 2 Panoramica de Los Estados FinancierosabatinoDocument47 pagesUnidad 2 Panoramica de Los Estados FinancierosabatinoRoberto RamosPas encore d'évaluation
- Objetivos: Parte 1Document24 pagesObjetivos: Parte 1LuisPas encore d'évaluation
- Jornada Suelos Uy 2015 - II PDFDocument64 pagesJornada Suelos Uy 2015 - II PDFAlejandro AndradaPas encore d'évaluation
- GTA Febrero UndecimoDocument10 pagesGTA Febrero UndecimoWilmer Josué García PinedaPas encore d'évaluation
- Actividad 4 Empresa JL Suelas SasDocument14 pagesActividad 4 Empresa JL Suelas SasMiguel Angel MARIN GUTIERREZPas encore d'évaluation
- Magnitudes y MedidasDocument4 pagesMagnitudes y MedidasMargarita Salcido OlguinPas encore d'évaluation
- Receta Majarete VenezolanoDocument2 pagesReceta Majarete VenezolanoAleandro Arturo Zapata PetitPas encore d'évaluation