Académique Documents
Professionnel Documents
Culture Documents
Gases Reales
Transféré par
Marco Cisneros,Yheferson Maza,Diego Díaz,Jairo Giohayro,David Samamé,Gino Cuadros,Ricardo TrinidadTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Gases Reales
Transféré par
Marco Cisneros,Yheferson Maza,Diego Díaz,Jairo Giohayro,David Samamé,Gino Cuadros,Ricardo TrinidadDroits d'auteur :
Formats disponibles
Elementos que existen como gases a 25
0
C y 1 atmsfera
5.1
5.1
Unidades de presin
1 pascal (Pa) = 1 N/m
2
1 atm = 760 mmHg = 760 torr
1 atm = 101,325 Pa
Barmetro
Presin =
Fuerza
rea
Presin
atmosfrica
Nivel del mar 1 atm
6 km 0.5 atm
16 km 0.2 atm
5.2
Columna
de aire
7924
760 ( )
a
Pb e
=
Pb: presin atmosfrica en
mm Hg
a:altura sobre el nivel del
mar
Altitud(m) P at (mm Hg)
0 760
500 716
1000 674
3400 500
4000 462
5.2
Manmetros usados para medir las presiones de los gases
Gas Gas
Vaco
5.3
Como P (h) Aumenta V Disminuye
Aparato para estudiar la relacin
entre presin y volumen de un gas
P o 1/V
P x V = constante
P
1
x V
1
= P
2
x V
2
5.3
Ley de Boyle
A temperatura constante,
cantidad constante de
gas
Variacin del volumen de gas con la temperatura
a presin constante
5.3
V o T
V = constante x T
V
1
/T
1
= V
2
/T
2
T (K) = t (
0
C) + 273.15
Ley de
Charles y
Gay-Lussac
La temperatura ser
en escala Kelvin
Ley de Dalton de las presiones parciales
V y T son
constantes
P
1
P
2
P
total
= P
1
+ P
2
5.6
Combinacin
de gases
Considere un caso en que dos gases , A y B, estn en un
recipiente de volumen V.
P
A
=
n
A
RT
V
P
B
=
n
B
RT
V
n
A
es el nmero de moles de A
n
B
es el nmero de moles de B
P
T
= P
A
+ P
B
X
A
=
n
A
n
A
+ n
B
X
B
=
n
B
n
A
+ n
B
P
A
= X
A
P
T
P
B
= X
B
P
T
P
i
= X
i
P
T
5.6
2KClO
3
(s) 2KCl (s) + 3O
2
(g)
Botella llena de oxgeno
gaseoso y vapor de agua
P
T
= P
O
+ P
vapor agua
2 5.6
Botella llenndose con oxgeno
gaseoso
Botella llena de agua
lista para colocarse en la
tina de plstico
La ecuacin de estado de un gas ideal est basadas en
cumplir los supuestos de la teora cintica-molecular
de los gases, en relacin a que a bajas densidades las
molculas se consideran como masas puntuales de
volumen despreciables y a elevadas temperaturas, se
considera que las interacciones moleculares son
despreciables.
Sin embargo, el comportamiento de una sustancia real
es mucho ms complejo, debido a que muchas se
pueden trabajar con gases comprimidos y/o trabajar a
bajas temperaturas, de tal forma que el volumen
propio de las molculas y/o las interacciones
moleculares ya no llegan a ser despreciables.
Nobel 1910
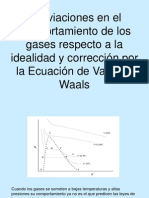
Las isotermas de un gas real tienen una forma ms compleja
que las isotermas de un gas ideal (hiprbolas), ya que deben
dar cuenta de los cambios de fase que puede experimentar,
con el incremento de la temperatura.
En la figura inferior se han representado las denominadas
isotermas de Andrews. Dichas isotermas fueron medidas
experimentalmente, y representan la presin en funcin del
volumen a distintas temperaturas.
1. Las molculas se pueden considerar masas puntuales de
volumen despreciable comparado con el volumen del
recipiente.
2. Las molculas obedecen las leyes de Newton, pero
individualmente se mueven en forma aleatoria, con
diferentes velocidades cada una, pero con una velocidad
promedio que no cambia con el tiempo, si la temperatura se
mantiene constante.
3. Las molculas realizan choques elsticos entre s, por lo
tanto se conserva tanto el momento lineal como la energa
cintica de las molculas.
4. El gas se encuentra en equilibrio trmico con las paredes
del envase.
5. El gas ejerce presin por choques moleculares de sus
unidades moleculares con las paredes del recipiente.
Consideremos N molculas movindose libremente en un
recipiente cbico de lado a, orientado a lo largo de los ejes
cartesianos. Al chocar una molcula con una pared
perpendicular al eje x cambia su momentum y el tiempo
que tarda de dar dos choques consecutivos es:
2
2
x x
x
p m
a
t
u
u
A =
A =
Por lo tanto, la fuerza ejercida por la molcula sobre la
pared, de acuerdo a la tercera Ley de Newton es:
2
/
x
p
F F m a
t
u
A
= =
A
Considerando N molculas, cuya velocidad a la largo del eje
x tiene una velocidad media de y que la presin es F/A,
llegamos a la siguiente relacin:
2
2
2
/
x
x
m a F
P PV mN
A
a
u
u
= = =
donde es el promedio del cuadrado de la componente x y
que en los otros ejes la velocidad cuadrtica promedio es la
misma. Dado que las molculas se mueven aleatoriamente, se
debe cumplir que:
2
x
u
2 2 2 2 2 2
1
3
y z
x x
u u u u u u = + + =
Donde es la velocidad cuadrtica media de una
molcula en el gas:
2
u
2
x
u
2
1
3
PV mNu =
Reescribiendo la ecuacin deducida anteriormente en
funcin de la velocidad cuadrtica media:
Reordenando este trmino:
2
2 1
( )
3 2
E
k
PV N mu =
Considerando que el teorema de la equiparticin de la
energa que considera que la contribucin a la energa de
un gas de cada grado de libertad de sus molculas es:
2 2 2
2
1 1 1 1
2 2 2 2
1 3
2 2
y
x
B
B B
z
m m m k T
R
m k T k
N
u u u
u
= = =
= =
Por tanto queda demostrado:
2
2 1 2 3
( ) ( )
3 2 3 2
B
PV N m N k T u = =
2 3 2 3
( ) ( )
3 2 3 2
B
A A
R N
PV N k T N T R T
N N
n
= = =
Considerando la relacin entre la constante y Bolltsman y con
constante unviersal de los gases tenemos:
Finalmente:
PV RTn =
Raz cuadrada de la Velocidad cuadrtica media:
2
3
1 3 3
2 2
B
B
A
M
k T
RT
m k T
m mN
u u u = = =
3RT
M
u =
Efusin y difusin molecular
A menor masa M, mayor rms.
Curvas de la distribucin de la energa cintica media a
distintas temperaturas y para la misma sustancia
Las interacciones moleculares atenan los impactos de la
molcula sobre la pared del recicipente y el resultado de estas
interacciones es una presin menor (presin de gas real) a la
presin que predice la ecuacin del gas ideal
1 mol de gas ideal
PV = nRT
n =
PV
RT
= 1.0
2
2 real
ideal
an
V
p p = +
Corrige las fuerzas de
interaccin molecular
Fuerzas de atraccin
Fuerzas de repulsin
0
o
C
( ) nRT nb V
V
an
p =
|
|
.
|
\
|
+
2
2
Donde a es una constante y n y V son el nmero de moles
y el volumen del recipiente, respectivamente.
Las molculas de gas si tienen volumen!
El volumen efectivo para el movimiento molecular es
menor al volumen del recipiente: V
ef
= V nb
2
2
nRT an
p
V nb V
=
( )
2
2
1 an
T p V nb
nR V
| |
= +
|
\ .
Constantes de van der Waals
Gas a (atmL
2
/mol
2
) b (L/mol)
He 0.034 0.0237
Ar 1.34 0.0322
H
2
0.244 0.0266
N
2
1.39 0.0391
O
2
1.36 0.0318
Reescribiendo la ecuacin de Van der Waals:
Gas T
c
(K) P
c
(atm) V
c
(L/mol)
He 5.19 2.24 0.0573
H
2
33.2 12.8 0.0650
N
2
126.2 33.5 0.0895
O
2
154.6 49.8 0.0734
Los parmetros de la ecuacin de Van der Waals, y son
obtenidos en general a partir de las condiciones de punto
crtico de un compuesto:
Estimar el volumen molar del dixido de
carbono a 500 K y 100 atm considerando un
tratamiento de gas ideal y gas real.
Dato: Las constantes de van der Waals del
CO
2
son: a=3.592 atm.L
2
.mol
-2
, b=4.26710
-2
L mol
-1
)
2
1 1
1
(8.206 10 . . . ) (500 )
0.410
100
RT L atmK mol K
Lmol
P atm
= =
2
m
m
RT a
P
V b
V
=
Rearreglando la ecuacin de Van der Waals
considerando 1 mol de gas despecamos una ecuacin
cbica para determinar el volumen molar
1
453 . 0
= + Lmol
P
RT
b
2 1 2
) ( 10 59 . 3
= Lmol
P
a
3
2
0
m
m
m
RT a ab
V b V V
P P P
| | | |
+ + =
| |
\ . \ .
Efectuando los clculos:
3 1 3
) ( 10 53 . 1
= Lmol
P
ab
0
2 3
=
|
.
|
\
|
+
|
.
|
\
|
+
P
ab
V
P
a
V
P
RT
b V
m m m
0 ) 10 53 . 1 ( ) 10 59 . 3 ( 453 . 0
3 2 2 3
= +
m m m
V V V
Usando calculadora se debe resolver la siguiente ecuacin:
1
0.366 .
m
V L mol
=
1
0.410 .
m
V L mol
=
Solucin:
Considerando gas ideal:
Recordemos el factor de compresibilidad:
El factor de compresibilidad es 1 para el gas ideal y se
aproxima a 1 cuando menor es la desviacin de las respecto al
comportamiento ideal. Podemos representar z como una serie
de potencias de la concentracin molar n/V = 1/V
m
:
Los coeficientes de esta expansin son funcin de T y se
llaman los coeficientes viriales.
B(T) es el segundo coeficiente virial y se puede calcular de
las fuerzas de interaccin entre pares. C(T) es el tercero e
implica la interaccin entre tres partculas
La ecuacin de Virial tiene limitaciones, en particular a altas
densidades o bajas temperaturas.
RT
pV
z
m
=
+
|
.
|
\
|
+
|
.
|
\
|
+
|
.
|
\
|
+ =
3 2
1
V
n
D
V
n
C
V
n
B z
Vous aimerez peut-être aussi
- Ingeniería química. Soluciones a los problemas del tomo ID'EverandIngeniería química. Soluciones a los problemas del tomo IPas encore d'évaluation
- Teoria Cinetica GasesDocument25 pagesTeoria Cinetica GasesEvelynsuyapaPas encore d'évaluation
- Guia Unidad 2 Gas Ideal Con Algunos Ejercicios ResueltosDocument11 pagesGuia Unidad 2 Gas Ideal Con Algunos Ejercicios ResueltosCristian MenePas encore d'évaluation
- Taller 2 FQ TCM y Gases RespuestasDocument7 pagesTaller 2 FQ TCM y Gases RespuestasBolaños Bolaños BolañosPas encore d'évaluation
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesD'EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesPas encore d'évaluation
- Practico1-Fis200simbologia y Seguridad y Medicion InformeDocument11 pagesPractico1-Fis200simbologia y Seguridad y Medicion InformeBeimar Miguel Ceron100% (4)
- Teoria Cinetica de Los GasesDocument11 pagesTeoria Cinetica de Los GasesEl Gato SsaleMPas encore d'évaluation
- Equipos de Medición de Fluidos y EnergeticosDocument15 pagesEquipos de Medición de Fluidos y Energeticosmiguel hernandez100% (2)
- Practica 2 Quimica ESIME ZacatencoDocument15 pagesPractica 2 Quimica ESIME ZacatencoDavid Vl100% (1)
- 02 Diapositiva de Modelo Cinético-Molecular Del Gas Ideal, Capacidades Caloríficas.Document20 pages02 Diapositiva de Modelo Cinético-Molecular Del Gas Ideal, Capacidades Caloríficas.EDINSON100% (1)
- Gases Reales PDFDocument30 pagesGases Reales PDFsara gamarraPas encore d'évaluation
- Termo 3Document36 pagesTermo 3José Emilio GuardiaPas encore d'évaluation
- Clase 1 2019-1 Gases IDEALES-REALESDocument39 pagesClase 1 2019-1 Gases IDEALES-REALESAlberto perez william100% (1)
- Clase 2 Gases RealesDocument74 pagesClase 2 Gases RealesPETER ANDRES JACOBO ABURTOPas encore d'évaluation
- Gases RealesDocument6 pagesGases RealesRenato EspinosaPas encore d'évaluation
- Gases Reales 20-IiDocument5 pagesGases Reales 20-IiDanny Palma AyalaPas encore d'évaluation
- Term Odin A MicaDocument16 pagesTerm Odin A Micaલિસા એન્ડ્રીયા એન્ડ્રીયાPas encore d'évaluation
- Taller Cálculos Con Ecuaciones Cúbicas de Estado para PetróleoDocument16 pagesTaller Cálculos Con Ecuaciones Cúbicas de Estado para PetróleoSantiagoVélezSPas encore d'évaluation
- Sesión 4 Gases Ideales y RealesDocument8 pagesSesión 4 Gases Ideales y RealesPaola Stefania Villarreal VeraPas encore d'évaluation
- Semana 9 - Estado Gaseoso Leyes GasesDocument14 pagesSemana 9 - Estado Gaseoso Leyes GasesKenny SantaanaPas encore d'évaluation
- Leyes de Los Gases y Teoria CineticaDocument12 pagesLeyes de Los Gases y Teoria CineticaJose LopezPas encore d'évaluation
- 01 Diapositiva de Gases IdealesDocument14 pages01 Diapositiva de Gases IdealesCarla Cruz RojasPas encore d'évaluation
- Semana 2 FQ Gases RealesDocument24 pagesSemana 2 FQ Gases RealesJacqueline Machón CamposPas encore d'évaluation
- Gases 2020-1Document10 pagesGases 2020-1Edward GilPas encore d'évaluation
- Ejercicios y Problemas 1 - Propiedades de Los GasesDocument5 pagesEjercicios y Problemas 1 - Propiedades de Los GasesHeather NielsenPas encore d'évaluation
- Unidad 1 Problemas ResueltosDocument9 pagesUnidad 1 Problemas ResueltosIver Samuel Medina BPas encore d'évaluation
- Parcial 1 ImprimirDocument19 pagesParcial 1 ImprimirLuis F. Estrada GutierrezPas encore d'évaluation
- Ley de Los GasesDocument7 pagesLey de Los Gasesjulio camposPas encore d'évaluation
- Teoria CineticaDocument54 pagesTeoria CineticaMyriam Hayde Montañez VegaPas encore d'évaluation
- GasesDocument13 pagesGasesDianaCalderónOyola100% (1)
- Primera Ley de TermodinamicaDocument70 pagesPrimera Ley de TermodinamicaMANUEL ANGEL ROMERO HERNANDEZPas encore d'évaluation
- GasesDocument14 pagesGasesagustin panichelliPas encore d'évaluation
- Practica 3 (Actualizada)Document5 pagesPractica 3 (Actualizada)basurac811Pas encore d'évaluation
- Folleto Gases y TermodinamicaDocument18 pagesFolleto Gases y TermodinamicaFaco QcoPas encore d'évaluation
- 1.gases 2013Document38 pages1.gases 2013Nico OrdenesPas encore d'évaluation
- T1 2008 4 Sistemas de Una FaseDocument29 pagesT1 2008 4 Sistemas de Una FaseEduardoLalo MamaniPas encore d'évaluation
- Segundo Trabajo de TermodinamicaDocument18 pagesSegundo Trabajo de TermodinamicaAlfonzo Antonio Natera OrtegaPas encore d'évaluation
- Teoria Cinetica de Los GasesDocument7 pagesTeoria Cinetica de Los GasesMax Blade ErosPas encore d'évaluation
- Problemario Termo IPN Septiembre 2015Document35 pagesProblemario Termo IPN Septiembre 2015Carol Sán0% (1)
- Gases Idea Les 2012Document12 pagesGases Idea Les 2012Fernando ToledoPas encore d'évaluation
- Lab N°3 (Van Der Waals)Document10 pagesLab N°3 (Van Der Waals)Luis Dani Torres GuerraPas encore d'évaluation
- Teoria de GasesDocument6 pagesTeoria de GasesClaudia Mabel FloresPas encore d'évaluation
- Tema No 5 Física ElectricaDocument9 pagesTema No 5 Física ElectricaRonald MirandaPas encore d'évaluation
- Taller Fisicoquimica 23401 Parte IDocument5 pagesTaller Fisicoquimica 23401 Parte IKevin PavaPas encore d'évaluation
- TermodinamicaDocument16 pagesTermodinamicaLUIS HERNANDEZPas encore d'évaluation
- TermodinamicaDocument17 pagesTermodinamicaManuel Lucio LópezPas encore d'évaluation
- Clase4 5VIRTFQIDocument40 pagesClase4 5VIRTFQIRichard Antony Alva RuizPas encore d'évaluation
- Problemario - Unidad - 5 Quimica AplicadaDocument16 pagesProblemario - Unidad - 5 Quimica AplicadauziePas encore d'évaluation
- Fisicoquimica Propiedades Moleculares de Los GasesDocument19 pagesFisicoquimica Propiedades Moleculares de Los GasesRosalia Pacheco CastroPas encore d'évaluation
- Cuestionario Primer ParcialDocument33 pagesCuestionario Primer ParcialJuan Silva LopezPas encore d'évaluation
- GasesDocument12 pagesGasesraor091Pas encore d'évaluation
- Romo Ejercicios Fisicoquimica 1Document24 pagesRomo Ejercicios Fisicoquimica 1Mafer VerdugaPas encore d'évaluation
- ExcelDocument16 pagesExcelruben romanPas encore d'évaluation
- Resumen Capítulo 18 y 19 Del Libro de Física UniversitariaDocument10 pagesResumen Capítulo 18 y 19 Del Libro de Física UniversitariaJuan Orias BarrantesPas encore d'évaluation
- Ec. Van Der WaalsDocument3 pagesEc. Van Der WaalsItzelCariPas encore d'évaluation
- GasesDocument6 pagesGasesJose Chavez TobarPas encore d'évaluation
- Química - Sem7 - Estado Gaseoso - Mezclas de GasesDocument5 pagesQuímica - Sem7 - Estado Gaseoso - Mezclas de GasesJuanjo Peña Santos100% (1)
- Monografia de Gases IdealesDocument17 pagesMonografia de Gases IdealesSandra PerezPas encore d'évaluation
- Seminario Nº7 - Gases - Problemas ResueltosDocument19 pagesSeminario Nº7 - Gases - Problemas ResueltosRANDOM GAMESPas encore d'évaluation
- Determinacion de La Masa MolarDocument13 pagesDeterminacion de La Masa MolarIncodecsa PerusacPas encore d'évaluation
- GUIA 2 Gráficas y Ajuste de CurvasDocument5 pagesGUIA 2 Gráficas y Ajuste de Curvasjossem CalderónPas encore d'évaluation
- Unidades de MedidaDocument3 pagesUnidades de MedidaFaviomisPas encore d'évaluation
- Clase CCNN 9noDocument10 pagesClase CCNN 9noKleber MejillonPas encore d'évaluation
- 2da Practica 2018-I - DF - Sección F PDFDocument2 pages2da Practica 2018-I - DF - Sección F PDFAdolfo Ricardo Piminchumo SausaPas encore d'évaluation
- F 053 LI 008-6 Perdidas Por Friccion - Mecanica de Fluidos Version 8-2017Document10 pagesF 053 LI 008-6 Perdidas Por Friccion - Mecanica de Fluidos Version 8-2017Camilo MujicaPas encore d'évaluation
- Tercer SeminarioDocument6 pagesTercer SeminarioEduardo L. Díaz50% (2)
- 43 - Quimica - Cuantitativa UNIDAD 2 Y 3Document124 pages43 - Quimica - Cuantitativa UNIDAD 2 Y 3Wilson RojasPas encore d'évaluation
- Trabajo Fisica TerminadoDocument15 pagesTrabajo Fisica TerminadoRobert OsorioPas encore d'évaluation
- Dinamica Clase2Document28 pagesDinamica Clase2mario garciaPas encore d'évaluation
- LAB N°2 Secado Directo - LOU2Document10 pagesLAB N°2 Secado Directo - LOU2YAJAIRA DAYANARA BRICE�O LOYOLAPas encore d'évaluation
- 5-Puente de WheatstoneDocument3 pages5-Puente de WheatstoneCristian MontoyaPas encore d'évaluation
- Inf - Lab.n2-Gen. Campo Transversal (Amplidina)Document13 pagesInf - Lab.n2-Gen. Campo Transversal (Amplidina)Aley MarquezPas encore d'évaluation
- Enunciado Producto Académico N3Document4 pagesEnunciado Producto Académico N3juan_orihuela_1Pas encore d'évaluation
- Equilibrio de Un Cuerpo Rígido. (Moreno Mariangel, Gómez Narlislex, Díaz MarialicDocument5 pagesEquilibrio de Un Cuerpo Rígido. (Moreno Mariangel, Gómez Narlislex, Díaz Marialicmariangel carolina moreno guanipaPas encore d'évaluation
- DME-DAT-002 00 Pruebas en Equipos de Transmisión 220 y 60 KVDocument7 pagesDME-DAT-002 00 Pruebas en Equipos de Transmisión 220 y 60 KVTZILA AREVALOPas encore d'évaluation
- Principio de Arquimides LaboratorioDocument11 pagesPrincipio de Arquimides LaboratorioCristian Arias ChavezPas encore d'évaluation
- 1 GERONIMO - ATALAYA - Mecanica de FluidosDocument8 pages1 GERONIMO - ATALAYA - Mecanica de FluidosGeronimo AtalayaPas encore d'évaluation
- Determinación de Viscosidad Por El Viscosimetro de BrookfieldDocument14 pagesDeterminación de Viscosidad Por El Viscosimetro de BrookfieldMIGUEL ANGEL AGIS AVELARPas encore d'évaluation
- Cinematica VFDocument63 pagesCinematica VFYahveh VehuiahPas encore d'évaluation
- MCU y EstaticaDocument2 pagesMCU y EstaticaMarco Cabrejos Yarleque100% (10)
- Leyes de NewtonDocument2 pagesLeyes de NewtonJuly CabralesPas encore d'évaluation
- ProblemaDocument2 pagesProblemaLuis Humberto Martinez PalmethPas encore d'évaluation
- Lavado de Pozo1Document4 pagesLavado de Pozo1JJulianPas encore d'évaluation
- Capa Limite 1Document14 pagesCapa Limite 1ANDRES HURTADO DELGADOPas encore d'évaluation
- Sesión 02.01 - Relaciones Volumétricas y Gravimétricas PDFDocument36 pagesSesión 02.01 - Relaciones Volumétricas y Gravimétricas PDFCiiroRiimskyPas encore d'évaluation
- Transformadores ExpoDocument61 pagesTransformadores ExpoCristopher RGPas encore d'évaluation
- LOU SecadoDocument21 pagesLOU SecadocarmenPas encore d'évaluation
- Colisiones Elasticas e InelasticasDocument3 pagesColisiones Elasticas e InelasticasAlexander GarciaPas encore d'évaluation