Académique Documents
Professionnel Documents
Culture Documents
Destilacion Fraccionada Por El Metodo de Entalpia-Concentracion
Transféré par
lupo57Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Destilacion Fraccionada Por El Metodo de Entalpia-Concentracion
Transféré par
lupo57Droits d'auteur :
Formats disponibles
DESTILACIN
FRACCIONADA
CON EL MTODO DE
ENTALPA-CONCENTRACIN
Cceres, Antonio; Colina, Claire; Jimnez, Hctor; Villalba, Julin.
Transferencia de Masa I
Ingeniera Qumica
Universidad de Cartagena
Destilacin fraccionada
La destilacin fraccionada es un
proceso de destilacin de mezclas muy
complejas y con componentes de
similar volatilidad. Consiste en que una
parte del destilado vuelve del
condensador y gotea por una larga
columna a una serie de placas, y que al
mismo tiempo el vapor que se dirige al
condensador hace burbujear al lquido
de esas placas. De esta forma, el vapor
y el lquido interaccionan de forma que
parte del vapor se condensa y parte del
lquido se evapora
Destilacin fraccionada
Destilacin fraccionada
Analogas y diferencias
McCabe-Thiele:
Asume calores latentes iguales.
Desprecia la diferencia entre calores sensibles.
Asume flujos molares constantes a travs de la torre.
Presume una condicin de equilibrio
entre cada etapa o plato.
Analogas y diferencias
Diagramas entalpia-concentracin:
Tiene en cuenta los calores latentes, de solucin o mezclado.
Toma los calores sensibles de la composicin de la mezcla.
Flujos molares a travs de la torre no son siempre constantes.
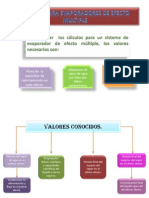
Se requieren los siguientes datos para construir dicho diagrama a
presin constante:
capacidad calorfica del lquido en funcin de la temperatura, la
composicin y la presin
Calor de disolucin en funcin de la temperatura y la composicin
Calores latentes de vaporizacin en funcin de la composicin y la
presin o la temperatura
Punto de ebullicin en funcin de la presin, la composicin y la
temperatura.
Datos de entalpa-concentracin
La lnea de lquido saturado en la entalpa h
, se
calcula por medio de la expresin:
=
0
+ 1
0
+
(1)
Donde:
es la fraccin mol o de peso de A.
T es el punto de ebullicin de la mezcla en K (F) o C.
0
es la temperatura de referencia (K)
es la capacidad calorfica del componente a en
es la capacidad calorfica de B.
y
es el calor de disolucin a
0
en
.
La lnea de entalpia del vapor saturado H
, de una
composicin de vapor
se calcula mediante:
=
0
+ + 1
0
+ (2)
Donde:
es la capacidad calorfica del vapor de A.
es la de B.
Los calores latentes
son los valores a la temperatura de
referencia
0
.
Generalmente el calor latente se da como
en el punto de ebullicin
normal
del componente puro A y
para B.
En la ecuacin (3) el lquido puro se calienta de
0
hasta
, se
vaporiza a
y luego se enfra como vapor a
0
. Del mismo modo en
la ecuacin (4). Por conveniencia la temperatura de referencia
0
se
suele tomar como igual al punto de ebullicin del componente de
menor punto de ebullicin, A. Esto significa que
por lo tanto
solo
se debe corregir a
0
+
0
(3)
0
+
0
(4)
Ejemplo:
Prepare una grafica de concentracin entalpa para el benceno y el tolueno a 1
atm de presin.
Componenten P. Ebullicion Cp Liquido Cp Vapor de Vaporizacin
Benceno (a) 80.1C 138.2 KJ/Kgmolk 96.3 KJ/Kgmolk
30820 KJ/Kgmolk
Tolueno(b) 110.6C 167.5 KJ/Kgmolk 138.2 KJ/Kgmolk
33330 KJ/Kgmolk
Solucion:
Se usa una temperatura de referencia
= 80.1
De esta manera que la entalpa de liquido de benceno puro en el punto
de ebullicin sea cero.
= 1.0
Para el primer punto elegimos el Tolueno puro
= 0
Para el Tolueno liquido en el punto de ebullicin de 110.6C y calor de
disociacin igual a cero se usa la ecuacin:
=
+ 1 +
Reemplazando los valores de la tabla y resolviendo tenemos:
= 0 138 110.6 80.1 + 1 +0 167.5 110.6 80.1 + 0
= /
Para la lnea de entalpa de vapor saturado se utiliza la siguiente
ecuacin:
=
+ 1
Pero se calcula primero
a 80.1C que es la temperatura de
referencia, por medio de la siguiente ecuacin:
= 167.5 110.6 80.1 + 33330 138.2 110.6 80.1
= 34224 /
Para calcular el calentamiento utilizamos la siguiente ecuacin y A = 0:
=
+ 1
0 30820 + 96.3 110.6 80.1 + 1.0 0 34224 + 138.2 110.6 80.1
= /
Ahora para el benceno puro
= 1.0
= 1.0 si se utiliza la siguiente
ecuacin:
=
+ 1 +
Y como =
entonces = /
Por lo cual el calentamiento ser:
=
+ 1
= 1.0 30820 +96.3 80.1 80.1 + (1 1.0)(33330 + 138.2 80.1 80.1 )
= /
Si ahora se elige
= 0.5 el punto de ebullicin es 92C y la temperatura de
vapor saturado para
= 0.5 es 98.8C.
Con estos datos y con los dados en la tabla del enunciado reemplazamos y
obtenemos la entalpa del liquido saturado en el punto de ebullicin:
=
+ 1 +
= 0.5(138.2) 92 80.1 + 1 + 0.5 (167.5) 92 80.1 + 0
= /
Ahora para un
= 0.5 la entalpa de vapor saturado a 98C ser:
=
+ 1
= 0.5 30820 + 96.3 98.8 80.1
+ 1 0.5 34224 + 138.2 98.8 80.1
= /
Si se repite el proceso y esta vez se elige
= 0.3 y
= 0.3 entonces
= /
= /
Y para
= 0.8 y
= 0.8
= /
= /
Estos y dems valores se ven en la siguiente tabla
Liquido Saturado Vapor Saturado
Fraccion molar
Entalpa h
(KJ/Kgmol)
Fraccion molar
Entalpa H
(KJ/Kgmol)
0 5109 1.00 38439
0.30 2920 0.80 36268
0.50 1820 0.50 34716
0.80 562 0.30 32380
1.00 0 0 30820
Datos de entalpa concentracin para mezclas de benceno tolueno a 1atm de presin total
Seccin de Enriquecimiento
Primeramente llevamos a cabo el
balance general de materia y de los
componentes en la figura:
+1
=
+1
+1
=
Despejando
+1
obtenemos la lnea
optativa de la seccin enriquecedora
+1
=
+1
+
+1
Realizando un balance de entalpa incluyendo el rendimiento del condensador.
+1
+1
=
Se realiza un balance de energa en el condensador
=
1
1
+
+1
+1
=
+
1
Seccin de Enriquecimiento
+1
+1
=
+1
+
1
+1
+1
=
+
1
Combinamos las ecuaciones para obtener
Seccin de Enriquecimiento
+1
=
+1
+
+1
+1
+1
=
+1
+
1
0
+ 1
0
+
1. Si se elige un valor de x
n
, se necesitar una solucin de prueba y error para obtener
H
n+1
.
2. Seleccione un valor de x
n
. Suponga que
+1
=
= + y =
3. Utilice esos valores para calcular un valor aproximado de y
n+1
.
4. Utilice el valor de y
n+1
para obtener H
n+1
y obtenga h
n
, usando x. Sustituya los valores
en la ecuacin adecuada y despeje Vn+1. Obtenga Ln.
5. Sustituya los valores obtenidos en la ecuacin
+1
+1
=
+1
+
1
y despeje y
n+1
.
Grafique la lnea operativa curva para la seccin enriquecedora. En general slo se
necesitan algunos cuantos valores de los flujos L
n
y V
n+1
para determinar la lnea
operativa, que es slo ligeramente curva.
Clculo de la lnea operativa
1
=
0
+ + 1
0
+
Balance total de materia
Seccin de Agotamiento
= +
+1
+
+1
+1
+1
=
+1
+1
+1
Balance de energas teniendo en cuenta el hervidor
Seccin de Agotamiento
+1
=
+1
+1
= +
+1
+1
Bibliografa
Geankoplis. Cap., 11: Procesos de Separacin Lquido - Vapor. Seccin
11.6 Destilacin Fraccionada por el Mtodo Entalpa-Concentracin.743
753 p. Tercera Edicin.
Treybal. Captulo 7, Seccin 9: Destilacin. Segunda edicin.
MUCHAS
GRACIAS
POR SU
ATENCIN
Vous aimerez peut-être aussi
- Entalpia ConcentracionDocument25 pagesEntalpia ConcentracionMaggyBalcazarPas encore d'évaluation
- EvaporacionDocument35 pagesEvaporacionJuan BottoPas encore d'évaluation
- Carta PsicrometricaDocument11 pagesCarta PsicrometricaESTHEFANI PAOLA FONSECA MENDOZAPas encore d'évaluation
- Virtual PlanDocument24 pagesVirtual PlanYAQUELYN ISIQUE LUISPas encore d'évaluation
- ConveccionDocument46 pagesConveccionJuan Carlos Fierro BautistaPas encore d'évaluation
- Rectificación de Una Mezcla de Benceno ToluenoDocument5 pagesRectificación de Una Mezcla de Benceno ToluenoamelizzzPas encore d'évaluation
- Ejercicios PropuestosDocument22 pagesEjercicios PropuestosAlexander Gutierrez ChirinosPas encore d'évaluation
- Itemes Unidad I.1Document9 pagesItemes Unidad I.1Flavio Chima NinaquispePas encore d'évaluation
- Volatilidad RelativaDocument2 pagesVolatilidad RelativaCelsa Núñez75% (4)
- Tarea1.2 Elaboracion de Curva de SaturacionDocument3 pagesTarea1.2 Elaboracion de Curva de SaturacionMariénAvilaPas encore d'évaluation
- Ejercicios 08-1 Guia Cap. 9.1 9.2 DifusionDocument4 pagesEjercicios 08-1 Guia Cap. 9.1 9.2 DifusionMike UlloaPas encore d'évaluation
- Balances de EnergíaDocument41 pagesBalances de EnergíaSharoom Hernández100% (1)
- Diagrama de DüringDocument6 pagesDiagrama de DüringAlan Contreras PauliniPas encore d'évaluation
- Practica No. 4 Análisis y Evaluación de Una Torre de Destilación Empleando Simuladores de Procesos. Trabajo Práctico Sistemas Multicomponente.Document26 pagesPractica No. 4 Análisis y Evaluación de Una Torre de Destilación Empleando Simuladores de Procesos. Trabajo Práctico Sistemas Multicomponente.Pablo CamejoPas encore d'évaluation
- Tarea de AdsorcionDocument4 pagesTarea de AdsorcionFernando GarciaPas encore d'évaluation
- Probl Res IADocument46 pagesProbl Res IArobertoam15100% (2)
- Ingenieria I EjerciciosDocument3 pagesIngenieria I EjerciciosAlex OblitasPas encore d'évaluation
- Evaporacion de Doble EfectoDocument25 pagesEvaporacion de Doble Efectopauloibarra100% (1)
- EJEMPLO 8.5-1 (Evaporadores)Document34 pagesEJEMPLO 8.5-1 (Evaporadores)Jesús Robles EscobarPas encore d'évaluation
- Absorción 1Document35 pagesAbsorción 1Cristhian CarrizalesPas encore d'évaluation
- QuimiostatoDocument33 pagesQuimiostatoMarco Antonio0% (1)
- Agitador Tanque Látex Viscosidad Velocidad MáximaDocument2 pagesAgitador Tanque Látex Viscosidad Velocidad MáximaRaul Quispe Pedraza0% (1)
- Parámetros de HumidificaciónDocument13 pagesParámetros de HumidificaciónBrayanHernandezRosasPas encore d'évaluation
- SecadoDocument7 pagesSecadojuanPas encore d'évaluation
- PSICROMETRIADocument8 pagesPSICROMETRIAJacky V. HerbasPas encore d'évaluation
- Usos y aplicaciones del capital de trabajoDocument5 pagesUsos y aplicaciones del capital de trabajoFatima Elena Jimenez CastilloPas encore d'évaluation
- U-3 PROBLEMAS INTERCAMBIADORES CALOR ADocument69 pagesU-3 PROBLEMAS INTERCAMBIADORES CALOR A20690431 TANIA GUADALUPE SANCHEZ MARTINEZPas encore d'évaluation
- Ejercicios Del Punto de Pliegue PDFDocument2 pagesEjercicios Del Punto de Pliegue PDFGilbert Rodriguez PalmaPas encore d'évaluation
- 1 DE2 - Equipo 4Document22 pages1 DE2 - Equipo 4Diego Alejandro Morales CortésPas encore d'évaluation
- Secado de Solidos Taller de Procesos I 2Document36 pagesSecado de Solidos Taller de Procesos I 2Lizet TincutaPas encore d'évaluation
- HARINAS DE MINATITlANDocument14 pagesHARINAS DE MINATITlANWILBER DE JESUS TORRES TORRESPas encore d'évaluation
- CP de Un CalorímetroDocument4 pagesCP de Un CalorímetroAuroraTrejoPas encore d'évaluation
- Guia Problemas Resueltos Cinetica Reactores 141210194618 Conversion Gate01 PDFDocument51 pagesGuia Problemas Resueltos Cinetica Reactores 141210194618 Conversion Gate01 PDFLiz MartínezPas encore d'évaluation
- Diseño de Reactor QuímicoDocument38 pagesDiseño de Reactor QuímicoUNEXPO_23Pas encore d'évaluation
- Taller Secado - Natalia MartinezDocument13 pagesTaller Secado - Natalia MartinezNathalia MartinezPas encore d'évaluation
- Marco Teorico Conveccion Natural y Conveccion ForzadaDocument9 pagesMarco Teorico Conveccion Natural y Conveccion ForzadaDiego Muñoz100% (1)
- Determinacion Eficiencia Platos TeóricosDocument7 pagesDeterminacion Eficiencia Platos TeóricosLizy Miñoz SanchezPas encore d'évaluation
- Procesos de transporte. Parte 2Document4 pagesProcesos de transporte. Parte 2Iza AlegríaPas encore d'évaluation
- Intercambiador de Calor de PlacasDocument17 pagesIntercambiador de Calor de PlacasVladimir Fernando Rebaza RamirezPas encore d'évaluation
- Pre-Informe FSC EvaporadorDocument13 pagesPre-Informe FSC EvaporadorTatiana AceroPas encore d'évaluation
- Carbohidratos-Ingenieria de AlimentosDocument43 pagesCarbohidratos-Ingenieria de AlimentosMeinardo Bautista RuizPas encore d'évaluation
- Ensayo DESARROLLO Y EVALUACIÓN DE UN POSTRE LÁCTEO CON FIBRA DE NARANJADocument2 pagesEnsayo DESARROLLO Y EVALUACIÓN DE UN POSTRE LÁCTEO CON FIBRA DE NARANJAAlejandra Rojas SanchezPas encore d'évaluation
- Metodo McCabe ThieleDocument12 pagesMetodo McCabe ThieleSantiago Villegas HdezPas encore d'évaluation
- 1.6 Destilación Con Rectificación-1Document17 pages1.6 Destilación Con Rectificación-1Jitzell Lupita Ruperto GarciaPas encore d'évaluation
- 3 Valor Presente y Evaluación de Costo CapitalizadoDocument4 pages3 Valor Presente y Evaluación de Costo CapitalizadoJavier ArcePas encore d'évaluation
- Practica 9 Difusividad Masica en GasesDocument33 pagesPractica 9 Difusividad Masica en GasesErick sequifjcnffkdbjcbfvjataPas encore d'évaluation
- Ecuaciones de Variación para Sistemas No IsotérmicosDocument33 pagesEcuaciones de Variación para Sistemas No IsotérmicosAnonymous mToOYXvcThPas encore d'évaluation
- Balance de Masa y Energia Modelo MatematicoDocument12 pagesBalance de Masa y Energia Modelo Matematicojhesus123Pas encore d'évaluation
- Bmye I 1Document67 pagesBmye I 1Daniel CordovaPas encore d'évaluation
- Práctica 2. Presión de Vapor en Función de La TemperaturaDocument3 pagesPráctica 2. Presión de Vapor en Función de La TemperaturaA L E J APas encore d'évaluation
- Balance de Energía Lab. PanificaciónDocument31 pagesBalance de Energía Lab. PanificaciónPaul LuquePas encore d'évaluation
- PRACTICA 6 Transferencia de CalorDocument12 pagesPRACTICA 6 Transferencia de CalorJorge Esteban Cuzco0% (1)
- Resistencia Interna DespreciableDocument5 pagesResistencia Interna DespreciableEduar Andres Orozco Cardenas50% (2)
- Curvas Velocidad SecadoDocument8 pagesCurvas Velocidad SecadoAlvaro AltafuyaPas encore d'évaluation
- Transferencia de MasaDocument11 pagesTransferencia de MasaWilliams Carlos Rojas QuiñonesPas encore d'évaluation
- Guía destilación binaria fraccionada balances entalpiaDocument4 pagesGuía destilación binaria fraccionada balances entalpiaXiime WalburgPas encore d'évaluation
- Problemas Resueltos Evaporacion Efecto SimpleDocument24 pagesProblemas Resueltos Evaporacion Efecto SimpleAlfonso C. Sapaico71% (14)
- Metodo de Poncho SavaritDocument20 pagesMetodo de Poncho SavaritPorfirio Houston I MPas encore d'évaluation
- Bou1 U4 Ea BeoeDocument6 pagesBou1 U4 Ea BeoeBerenice O EscalantePas encore d'évaluation
- Diagrama Benceno ToluenoDocument3 pagesDiagrama Benceno ToluenoDurvel de la Cruz100% (1)
- Capitulo IV - Evaporacion en Un Ingenio AzucareroDocument16 pagesCapitulo IV - Evaporacion en Un Ingenio Azucarerolupo57100% (7)
- Analisis Energetico y ExergeticoDocument12 pagesAnalisis Energetico y ExergeticoPedro Lopez SerranoPas encore d'évaluation
- DESTILACIÓNDocument16 pagesDESTILACIÓNlupo57100% (1)
- Conceptos Claves de FraccionamientoDocument30 pagesConceptos Claves de Fraccionamientolupo57Pas encore d'évaluation
- 1-Componentes Del Rendimiento y Su Relación Con La Producción de Azúcar Panela y EtanolDocument20 pages1-Componentes Del Rendimiento y Su Relación Con La Producción de Azúcar Panela y Etanollupo57Pas encore d'évaluation
- Ejemplo13 Mc3baltiples Entradas y Uno de Inyeccic3b3nDocument10 pagesEjemplo13 Mc3baltiples Entradas y Uno de Inyeccic3b3nDiana PradaPas encore d'évaluation
- Plataformas Educativas1Document11 pagesPlataformas Educativas1lupo57Pas encore d'évaluation
- Curso Ias 624-IDocument12 pagesCurso Ias 624-Ilupo57Pas encore d'évaluation
- Ejemplo13 Mc3baltiples Entradas y Uno de Inyeccic3b3nDocument10 pagesEjemplo13 Mc3baltiples Entradas y Uno de Inyeccic3b3nDiana PradaPas encore d'évaluation
- Dinamica SocialDocument3 pagesDinamica Sociallupo57Pas encore d'évaluation
- Manual para El Beneficio de SemillasDocument277 pagesManual para El Beneficio de SemillasJose RaulPas encore d'évaluation
- 15.08.05.folleto Bomba de Ariete 2 Pulgadas Con FittingsDocument16 pages15.08.05.folleto Bomba de Ariete 2 Pulgadas Con FittingsEnoc FrancisPas encore d'évaluation
- Ensayo de IdentidadDocument9 pagesEnsayo de Identidadlupo57Pas encore d'évaluation
- Plataformas Educativas1Document12 pagesPlataformas Educativas1lupo57Pas encore d'évaluation
- Propiedad IndustrialDocument11 pagesPropiedad Industriallupo57Pas encore d'évaluation
- Derecho Laboral y Seguridad Social Unidad 1Document106 pagesDerecho Laboral y Seguridad Social Unidad 1lupo5750% (2)
- Invent A RiosDocument8 pagesInvent A Rioslupo57Pas encore d'évaluation
- Dinamicasocialingenieria Engestión Empresarial-1Document77 pagesDinamicasocialingenieria Engestión Empresarial-1lupo57Pas encore d'évaluation
- Dinamica SocialDocument3 pagesDinamica Sociallupo57Pas encore d'évaluation
- Analisis Literario1Document4 pagesAnalisis Literario1lupo57Pas encore d'évaluation
- El Proceso EconomicoDocument57 pagesEl Proceso Economicolupo57Pas encore d'évaluation
- Unidad 2 Disolucion, Liquidacion, Fusion, EscisionDocument38 pagesUnidad 2 Disolucion, Liquidacion, Fusion, Escisionlupo57Pas encore d'évaluation
- Repaso Derecho MercantilDocument4 pagesRepaso Derecho Mercantillupo57Pas encore d'évaluation
- Analisis Literario1Document4 pagesAnalisis Literario1lupo57Pas encore d'évaluation
- ComunicaciÓn OrganizacionalDocument39 pagesComunicaciÓn Organizacionalapi-372906282% (11)
- DIAPOSITIVASUNIDAD1Y2Document13 pagesDIAPOSITIVASUNIDAD1Y2lupo57Pas encore d'évaluation
- ComunicaciÓn OrganizacionalDocument39 pagesComunicaciÓn Organizacionalapi-372906282% (11)
- Patrimonio y derechos enDocument45 pagesPatrimonio y derechos enlupo57100% (1)
- Unidad 1 Distribuciones de FrecuenciaDocument70 pagesUnidad 1 Distribuciones de Frecuencialupo57Pas encore d'évaluation
- Resumen Corto de La Cultura WariDocument38 pagesResumen Corto de La Cultura WariJames Steven Escobar50% (4)
- Tema 14 La Inglaterra VictorianaDocument8 pagesTema 14 La Inglaterra VictorianaMiguel RoldánPas encore d'évaluation
- Las 7P Del MarketingDocument17 pagesLas 7P Del MarketingDiego Javier ChungandroPas encore d'évaluation
- Tesis Final Ivvone Mejía CaballeroDocument138 pagesTesis Final Ivvone Mejía CaballeroDAVIDPas encore d'évaluation
- Fatolopías Rodrigo ParriniDocument95 pagesFatolopías Rodrigo ParriniOmar Escutia GirónPas encore d'évaluation
- Que Es Un Facturador MedicoDocument14 pagesQue Es Un Facturador MedicoNitza I. Cortes Vazquez100% (1)
- Los momentos de la prueba en el procesoDocument24 pagesLos momentos de la prueba en el procesoKristina Kundrotas APas encore d'évaluation
- Aumenta Tu Estatura Crece Hasta 10 CM en 6 MesesDocument43 pagesAumenta Tu Estatura Crece Hasta 10 CM en 6 MesesBaltazar Lopez96% (149)
- Los Heraldos NegrosDocument5 pagesLos Heraldos NegrosMarco Antonio Tejada Cardeña100% (1)
- Especialidad de Arte de Contar HistoriaDocument2 pagesEspecialidad de Arte de Contar HistoriaViviana CalderonPas encore d'évaluation
- El RomanticismoDocument5 pagesEl RomanticismoAraceli Mollo GuachallaPas encore d'évaluation
- PEDIDocument68 pagesPEDIclaudiaPas encore d'évaluation
- Clase 5-La-Gramatica-1Document30 pagesClase 5-La-Gramatica-1AaronPas encore d'évaluation
- Prueba Evaluación Diagnostica CCSS 2° GradoDocument5 pagesPrueba Evaluación Diagnostica CCSS 2° GradoReginalda Silva dazaPas encore d'évaluation
- Fisica Vol 3 Fundamentos Cuanticos EstadisticosDocument614 pagesFisica Vol 3 Fundamentos Cuanticos EstadisticosYeison LRPas encore d'évaluation
- Ciencia y FeDocument76 pagesCiencia y Fepablo201313Pas encore d'évaluation
- G.Jasiner - Los Grupos Centrados en Una TareaDocument3 pagesG.Jasiner - Los Grupos Centrados en Una TareaJulia PavonePas encore d'évaluation
- Informe Pericial Ejemplo en El Caso de Accidente de TráficoDocument2 pagesInforme Pericial Ejemplo en El Caso de Accidente de TráficoPaula Del Carmen Sotero Espinal100% (1)
- El Ministerio Pentecostal y La OrdenaciónDocument11 pagesEl Ministerio Pentecostal y La Ordenacióncazadordeherejias100% (1)
- Control de Calidad en La Pintura LíquidaDocument11 pagesControl de Calidad en La Pintura LíquidaENDERPas encore d'évaluation
- Oncologia y PsicologiaDocument8 pagesOncologia y PsicologiaTephi Gomez ImaraiPas encore d'évaluation
- 90 Lecciones de Algebra PDFDocument527 pages90 Lecciones de Algebra PDFLuis Enrique Bermudez100% (1)
- Preterito Pluscuamperfecto IndicativoDocument4 pagesPreterito Pluscuamperfecto Indicativocr_carlosPas encore d'évaluation
- Design Thinking-12-19Document8 pagesDesign Thinking-12-19Anabelen fsPas encore d'évaluation
- AnalisispersonajeDocument8 pagesAnalisispersonajeAbigail ZentenoPas encore d'évaluation
- Diagnosticar motivación universidad San AgustínDocument12 pagesDiagnosticar motivación universidad San AgustínSonia Elizabeth Uscca NoaPas encore d'évaluation
- Daniela Bassa - Revista Runa - La Defensa de La Identidad Provincial en Una Asociación Literaria - La Asociación Pampeana de Escritores de Santa Rosa, La PampaDocument10 pagesDaniela Bassa - Revista Runa - La Defensa de La Identidad Provincial en Una Asociación Literaria - La Asociación Pampeana de Escritores de Santa Rosa, La PampaLaura NuñezPas encore d'évaluation
- Cuestionario Watson ConductismoDocument4 pagesCuestionario Watson ConductismoMaria Jimena LgPas encore d'évaluation
- Examen Fisico Del Riñon e HigadoDocument11 pagesExamen Fisico Del Riñon e HigadoBalvina CruzPas encore d'évaluation
- Experiencia #3 y 4Document15 pagesExperiencia #3 y 4Ignacia ArancibiaPas encore d'évaluation