Académique Documents
Professionnel Documents
Culture Documents
FAMILIA DO CARBONO - Cópia
Transféré par
Walleria SantanaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
FAMILIA DO CARBONO - Cópia
Transféré par
Walleria SantanaDroits d'auteur :
Formats disponibles
FAMILIA DO CARBONO
Componentes:
Manoel da Conceicao
Rejane Maria
Walleria Santana
Famlia do Carbono
Famlia IV A Grupo 14
Carbono (C)
Silcio (Si)
Germnio (Ge)
Estanho (Sn)
Chumbo (Pb)
Ununquadium (Uuq) / Flervio (Fl)
Famlia IV A Grupo 14
Figura 1: Tabela Peridica atualizada em 01/06/2012.
Fonte: IUPAC
Propriedades Gerais
Tamanho dos tomos
Estado de oxidao e tipos de ligao
Energias de ionizao
Pontos de fuso
Carter metlico e no-metlico
Configurao eletrnica
Tamanho do tomo
T
A
M
A
N
H
O
D
O
A
T
O
M
O
Figura 2: Perfil atual da tabela peridica
Fonte: Instituto Cincia hoje
Estados de oxidao e tipos de ligao
O carbono difere dos demais elementos do grupo por
vrios motivos.
Catenao
O efeito do par inerte se mostra em carter crescente nos
elementos mais pesados do grupo. H um decrscimo da
estabilidade do estado de oxidao +4 e um aumento da
estabilidade do estado de oxidao +2.
Energias de Ionizao
Figura 3: A altura da barra proporcional a primeira energia de ionizao de cada elemento.
Pontos de fuso
PONTO DE FUSAO
Figura 4
Carbono = 3550C (3823,15K)
Silcio = 1.414 C(1687K)
Germnio = 938.3C (1211.4K)
Estanho = 232,65 C (505,8 K)
Chumbo = 327,46 C (600,61K)
Flervio = 66,85 C (340 K)
Carter Metlico e No-Metlico
Carbono e Silcio Ametais
Germnio Carter intermedirio
Estanho e Chumbo Metais
Flervio Desconhecida
10
CARBONO
Figura 5: Grafite, carvo e diamante.
Fonte: Brasil Escola..
11
Principais propriedades
Descobrimento: 3750 a.C.
Carbono - vem do latim carbo, que quer dizer carvo
Smbolo: C
Figura 6: tomo de Carbono.
Grupo: Ametal
Nmero atmico: 06
Massa Atmica: 12,011 u
Ponto de fuso e ebulio: Depender da forma alotrpica
Densidade: Depender da forma alotrpica
Estados de oxidao: +2 e +4
Configurao eletrnica: [He] 2s2 2p2
12
Ligaes Do Carbono
Figura 7: Quadro demonstrativo das ligaes do carbono.
13
Alotropia Do Carbono
Grafite
Diamante
Fulerenos
Nanotubos
14
Carbono Grafite
Arranjo Hexagonal Laminar
Carbono hibridizado sp2
Baixa dureza
Quebradio
Na forma de p usado como lubrificante
Conduz eletricidade
Figura 8: Carbono Grafite
Figura 9: Estrutura espacial do grafite.
15
Carbono Diamante
Figura 10: Diamante
Arranjo cubico de face centrada
Carbonos hibridizados sp3
Alta dureza
Quebradio
No conduz eletricidade
Figura 11: Estrutura espacial do diamante.
16
CARBONO Buckminsterfulereno
(Fulereno Ou Futeboleno)
Arranjo Geodsico (hexgonos e
pentgonos)
Carbono hibridizado sp2
Utilizado como fibra de carbono de
formula 1 e na medicina como
carregador de medicamentos
Figura 12: modelo para a molcula de C60
Figura 13: modelo para a molcula de C70.
17
Carbono Nanotubo (Tubuleno)
Figura 14: nanotubo de carbono.
18
Aplicaes
O principal uso industrial do carbono como componente
de hidrocarbonetos, especialmente os combustveis como petrleo e
gs natural
Outros usos so:
O istopo carbono-14 se usa na datao radiomtrica
O grafite para fabricar a parte interna dos lpis
O diamante empregado para a produo de joias e como
material de corte aproveitando sua dureza
Como elemento de liga principal dos aos (ligas de ferro).
Em varetas de proteo de reatores nucleares
As pastilhas de carbono so empregadas em medicina para
absorver as toxinas do sistema digestivo.
19
O carbono ativado se emprega em sistemas de filtrao e
purificao da gua
O Carbono-11, radioativo com emisso de psitron usado no
exame PET em medicina nuclear
O carvo muito utilizado nas indstrias siderrgicas, como
produtor de energia e na indstria farmacutica (na forma
de carvo ativado)
20
Istopos
C 98,89 %
13 C 1,11 %
14 C Radioistopo
12
21
xidos De Carbono
Monxido de carbono
Dixido de carbono
Subxido de carbono, C3O2
22
Monxido De Carbono
produzido pela queima em condies de pouco oxignio(combusto
incompleta) e/ou alta temperatura de carvo ou outros materiais ricos em
carbono, como derivados de petrleo
O CO txico porque forma um complexo com a hemoglobina do sangue,
impedindo-a de transportar oxignio para as clulas do organismo, por
isso, se uma pessoa intoxicada por CO voltar a um ambiente bem arejado,
ela volta a respirar normalmente. A reao, portanto, reversvel.
Dixido de carbono
O dixido de carbono foi descoberto pelo escocs Joseph Black em 1754
O dixido de carbono (CO2), um componente minoritrio da atmosfera
terrestre (na ordem de 0,04% em peso) produzido e usado pelos seres
vivos
O CO2 utilizado em bebidas
utilizado em extintores
23
Impacto Ambiental
Efeito Estufa e Ciclo do Carbono
24
Efeito Estufa
Figura 15: Esquema de do Efeito Estufa na atmosfera terrestre..
Fonte: S Biologia
25
Ciclo do Carbono
Figura 16: Ciclo do carbono.
Fonte: UENF
26
SILCIO
Figura 17: Elemento qumico Silcio
27
Principais Propriedades
Descobrimento: 1823, pelo qumico sueco Jns Jacob Berzelius
Silcio vem do latim slex, slex ou pedra dura
Figura 18: Silcio usado na
produo da maior parte
dos circuitos e chips
eletrnicos
Smbolo: Si
Nmero atmico: 14
Grupo: Metaloides
Massa Atmica: 28,086 u
Estado: Slido a 25C (298K)
Figura 19: tomo de Silcio
Ponto de fuso:1.414 C(1687K) e Ponto de ebulio: 2.900 C(3173K)
Densidade: 2,33 g/cm3
Estados de oxidao: +4
Configurao eletrnica: [Ne] 3s2 3p2.
28
O silcio um elemento altamente abundante. Ele se encontra
distribudo pela crosta terrestre em formas diversas de muitos
silicatos, sendo um dos principais compostos de silcio, a silicia,
SiO2 dixido de silcio.
Brilho prateado
Rede cristalina igual a do diamante
Inerte a temperatura ambiente
SiO2 forma uma estrutura solida, tridimensional, com grande
estabilidade.
29
Aplicaes
Figura 20:Transistores para chips.
Figura 21: Tijolos
Figura 23: Ligas de aos, lates e bronzes
Figura 22: Clulas solares
Figura 24: Silicones
30
Obteno do Silcio
Slica de alta pureza em fornos de arco eltrico
SiO2 (s)+ C(s) Si (l) + CO2 (g)
Triclorosilano (HSiCl3), o Tetracloreto de silcio (SiCl4) e o
Silano (SiH4).
31
Preocupaes
Figura 27: Pneumoconiose
Figura 25 e 26: O silcio afeta principalmente os
mineiros
32
GERMNIO
Figura 28: 5 grama 99.999% germnio " Metal " elemento puro 32 amostra
frasco de vidro
33
Principais Propriedades
Descobrimento: 1886 pelo qumico alemo Clemens Winkler
Germnio: Do latim "Germnia", nome antigo da Alemanha
Smbolo: Ge
Figura 29: Elemento qumico germnio
Nmero atmico: 32
Grupo: Metaloides
Massa Atmica: 72.61 u
Estado: Slido a 25C (298K)
Ponto de fuso: 938.3C (1211.4K) e Ponto de ebulio: 2820C (3093K)
Densidade: 5.323 g /cm3
Estados de oxidao: +2 e+4
Configurao eletrnica: [Ar] 3d10 4s2 4p2
Figura 30: tomo de Germnio.
34
Nas condies ambientes e solido, duro( dessa forma, quebradio)
de brilho intenso e colorao branco acinzentado. E, na
natureza( assim como outros metais) praticamente no e
encontrado sob forma elementar, mas como componentes de
minrios complexos (Cu13Fe2Ge2S16 (germanita), por exemplo).
Figura 31: Germanita , provavelmente a partir da
Mina de Tsumeb , Otjikoto Regio , Nambia .
Tamanho da amostra de 5 cm
35
Aplicaes
Figura 33: Espectroscpios
Figura 32: Fibra tica
Figura 34: Radares
Figura 35: Amplificadores de guitarras eltricas
36
Obteno de Germnio
Os nicos minerais rentveis para a extrao do germnio so
a germanita (Cu13Fe2Ge2S16 ) - 69% de germnio e ranierita (Cu,Ge, Fe,
Zn, As) - 7-8% do elemento.
A forma mais comum de obteno de germnio metlico atravs da
extrao via fuso fracionada ou pela remoo de via cloreto (GeCl4),
e, com a adio de hidrognio ou carvo, reduzido a germnio puro.
GeCl4 + 2H2O GeO2 + 4HCl (hidrlise)
GeO2 + 2H2 Ge + 2H2O
37
Propriedades Qumicas
Germanatos (GeO3-2), Dixido de germnio (GeO2) e
Monxido de germnio (GeO).
38
ESTANHO
Figura 36: Minrio de estanho
39
Principais Propriedades
Figura 37: Cubo metlico de estanho
Descobrimento : 3500 a.C. pelos Egpcios.
Estanho : vem do latim stagnun vulgarizado para stannun na Idade Mdia;
Smbolo: Sn
Grupo: Metal
Nmero atmico: 50
Massa Atmica: 118,7
Ponto de fuso : 232,65 C (505,8 K) e de ebulio: 2.601,85 C(2875 K)
Estado: Slido a 25C
Densidade: 7310 kg/m
Estados de oxidao: +2 e +4
Figura 38: tomo de estanho
Configurao eletrnica: [Kr] 4d10 5s 5p
40
Altropos
Estanho alfa ou forma cinzenta: estrutura cristalina cbica, como Si
ou Ge, em baixas temperaturas.
Estanho beta ou forma branca: estrutura cristalina tetragonal, quando
aquecido acima de 13,2 C.
Estanho rmbico ou forma gama: estrutura cristalina rmbica, que se
funde a 231,8C.
Figura 39: Transio alotrpica do estanho a 13,2 o C, com representao
esquemtica das estruturas cristalinas do estanho a e b.
Fonte: Qumica Nova Escola
Figura 40:Corte transversal de um lingote produzido com
uma liga de estanho contendo 0,5%, em massa, de cobre
mantido por -18 o C durante 1,5 ano.
Fonte: Qumica Nova na Escola.
41
Aplicaes
Figura 43: Ligas de estanho
Figura 41: Folhas de Flandres
Figura 42: Cloreto de Estanho (OSO)
2H2O P.A.-A.C.S.
42
Obteno
Minrio: O principal minrio do estanho a cassiterita (xido
de estanho) (SnO2)
Metal: Sn extrao do estanho metal a partir da reduo do
xido de estanho (mineral) com o C ou CO.
SnO2 (s) + C (s) Sn (l) + CO2 (g)
SnO2 (s) + 2CO (g) Sn (l) + 2CO2 (g)
43
CHUMBO
Figura 44: Mineral sulfeto de chumbo (PbS). A amostra do municpio de Adrianpolis na regio
nordeste do Estado.
44
Principais Propriedades
Descobrimento: 3.800 a.C. descoberto por arquelogos.
Chumbo: vem do latim plumbum;
Smbolo: Pb
Figura 45: tomo de chumbo.
Grupo: Metal
Nmero atmico: 82
Massa Atmica: 201,2
Ponto de fuso : 327,46 C (600,61K) e ebulio: 1748,85 C(2022 K)
Estado: Slido a 25C
Densidade: 11340 kg/m
Estados de oxidao: +2 e +4
Configurao eletrnica: [Xe] 4f14 5d10 6s2 6p2
Figura 46: Chumbo cinza metlico
45
Aplicacoes
Figura 47: Bateria de chumbo- cida
Figura 48: Ligas metlicas de chumbo
Figura 50: Nitreto de chumbo, Pb(N3)2
Figura 49: Silicatos de chumbo para a
fabricao de vidros
46
Obteno de Chumbo
Minrios:
Figura 53: Anglesita (sulfato de
chumbo PbSO4 )
Figura 51: Galena (sulfeto de
chumbo - PbS)
Figura 52: Cerusita (carbonato de
Chumbo PbCO3)
Metal: Pb - obtido a partir da transformao do mineral em xidos atravs
de ustulao oxidante e a reduo com o CO ou C.
PbS (s) + 3/2 O2 (g) PbO (s) + SO2 (g) (etapa 1)
PbO (s)+ CO (g) Pb (l) + CO2 (g) (etapa 2)
47
Chumbo e Toxicidade
O chumbo um dos mais perigosos metais txicos pela quantidade e
severidade dos seus efeitos. classicamente uma toxina crnica, sendo
observados poucos efeitos aps uma exposio aguda a nveis relativamente
baixos.
Em um passado no muito distante, a gasolina era a maior fonte de
exposio de Chumbo. Outras fontes comuns de Chumbo incluem o solo,
enlatados, plsticos, tabaco, soldas, tintas, brilho para cermica e at em
ambientes fechados para treinamento de tiro. Inclusive algumas plantas
importadas da China possuem Chumbo, podendo tambm conter Mercrio.
48
Precaues
Perturbao da biossntese da hemoglobina e anemia;
Aumento da presso sangunea;
Danos aos rins;
Abortos;
Alteraes no sistema nervoso;
Danos ao crebro;
Diminuio da fertilidade do homem atravs de danos ao esperma;
Diminuio da aprendizagem em crianas;
Modificaes no comportamento das crianas, como agresso, impulsividade e
hipersensibilidade.
49
Figura 55: Linha de Burton em uma intoxicao ocupacional
por chumbo.
Figura 54: Efeito do chumbo no corpo humano.
50
UNUNQUADIUM/FLERVIO
Figura 56: Elemento Qumico Ununquadium
Figura 57: Elemento Qumico Flervio
51
Principais Propriedades
Descobrimento: 1998, foi relatado informalmente pelos cientistas do Joint Institute
for Nuclear Research em Dubna, na Rssia;
Ununquadium: foi um nome sistemtico, temporrio, adotado pela IUPAC para o
elemento 114. Em 5/12/2011, foi adotado IUPAC, o nome Flervio.
Smbolo: Uuq/Fl
Grupo: desconhecido
Numero atmico : 114
Massa atmica: (289)u
Ponto de fuso: 66,85 C (340 K)
Ponto de ebulio : 420 K
Densidade: 22 000 kg/m3
Estado de oxidao: +2 e +4
Raio atmico: 160 pm
Configurao eletrnica: [Rn] 5f14 6d10 7s27p2
Figura 58: tomo de Flervio.
52
O nome Flervio foi dado em honra ao fundador do Laboratrio Flerov
da Rssia, o fsico nuclear Georgy Flyorov (1913-1990). Assim, aps a
adeso tabela peridica, estes nomes foram aprovados definitivamente
e anunciados em 31 de maio de 2012 pela IUPAC.
A descoberta do elemento 114 foi alvo de muita divulgao na imprensa,
principalmente no meio cientfico. A razo desta euforia o fato de na
primeira experincia, obter-se um istopo com a extraordinria durao
de 30 segundos, o que no ocorria h 30 anos.
Num primeiro momento foi obtido um nico tomo do istopo
Uuq289 atravs do bombardeamento do plutnio com istopos de clcio.
Portanto, trs istopos diferentes do ununquadium j foram obtidos, por
decaimento alfa:
289 = 30 segundos
114Uuq
288 = 2 segundos
114Uuq
285 = 0,58 segundos
114Uuq
53
OBRIGADO PELA
ATENO!
Vous aimerez peut-être aussi
- Produtos NotáveisDocument30 pagesProdutos NotáveisAlessandro WerneckPas encore d'évaluation
- Questões de Lógica - Verdades e MentirasDocument16 pagesQuestões de Lógica - Verdades e MentirasPaulo HenriquePas encore d'évaluation
- Questao Ifce 100 QuestoesDocument46 pagesQuestao Ifce 100 QuestoesPaulo André100% (1)
- Apostila Radiciação e Inicio de Equação 2º Grau 9° AnoDocument12 pagesApostila Radiciação e Inicio de Equação 2º Grau 9° AnoMarcos Silva100% (2)
- Exercícios Log e ExponencialDocument12 pagesExercícios Log e ExponencialD Chaves ChavesPas encore d'évaluation
- Geometria Espacial I: Prof. Gilberto Santos JRDocument11 pagesGeometria Espacial I: Prof. Gilberto Santos JRDjalan NunesPas encore d'évaluation
- Geometria Espacial PDFDocument8 pagesGeometria Espacial PDFMarceloPas encore d'évaluation
- A Excelente Apostila de A 2 GrauDocument138 pagesA Excelente Apostila de A 2 GrauRafa_MonyPas encore d'évaluation
- Pré-Cálculo - FURG - Completo - 2019 - Alessandro Da Silva Saadi & Felipe Morais Da Silva - 2019Document220 pagesPré-Cálculo - FURG - Completo - 2019 - Alessandro Da Silva Saadi & Felipe Morais Da Silva - 2019André RanulfoPas encore d'évaluation
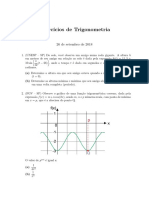
- Exercicios de TrigonometriaDocument106 pagesExercicios de TrigonometriaBruno KogaPas encore d'évaluation
- 8⺠Ano1Document88 pages8⺠Ano1Orlando CawendePas encore d'évaluation
- QUESTAO Qustoes Matrizes1Document12 pagesQUESTAO Qustoes Matrizes1profSalsichaPas encore d'évaluation
- GeometriaDocument25 pagesGeometriapangIoss100% (1)
- P.A. - P.G. (Aprofundamento de Estudo)Document4 pagesP.A. - P.G. (Aprofundamento de Estudo)RenataPas encore d'évaluation
- Slide Produtos Notaveis e FatoraçãoDocument23 pagesSlide Produtos Notaveis e Fatoraçãomarcos rodrigues100% (1)
- Razão, Proporção, Porcentagem e Regra de TrêsDocument24 pagesRazão, Proporção, Porcentagem e Regra de TrêsAnonymous ouzYGW8yPas encore d'évaluation
- 19-Aula 3 - 8 Ano - Expressoes AlgebricasDocument16 pages19-Aula 3 - 8 Ano - Expressoes AlgebricasDeígerson CostaPas encore d'évaluation
- Apostila de Matemática, Funções, Derivadas E IntegraisDocument32 pagesApostila de Matemática, Funções, Derivadas E IntegraisMarcus BertoldoPas encore d'évaluation
- Cad C1 Exercicios 3serie 1opcao 1bim Matematica PDFDocument64 pagesCad C1 Exercicios 3serie 1opcao 1bim Matematica PDFJose Amaury AméricoPas encore d'évaluation
- Potenciacao OtimaDocument24 pagesPotenciacao OtimaJosé Santos da SilvaPas encore d'évaluation
- Geometria Completo.2017Document36 pagesGeometria Completo.2017maria silvaPas encore d'évaluation
- 200 Questões Propostas de MatemáticaDocument8 pages200 Questões Propostas de MatemáticaElder Andrade AmaralPas encore d'évaluation
- Aula 5-Aplicaçao Das Matrizes (EIM)Document6 pagesAula 5-Aplicaçao Das Matrizes (EIM)Mantorras NeloPas encore d'évaluation
- 17 Aulas de Ime Ita ProfdouglasoliveiraDocument84 pages17 Aulas de Ime Ita ProfdouglasoliveiraDiego MartinsPas encore d'évaluation
- QUESTAO Matriz Determinantes Sistemas LinearesDocument21 pagesQUESTAO Matriz Determinantes Sistemas LinearesprofSalsichaPas encore d'évaluation
- Matemática - Resumos Vestibular - Logaritmos Teoria Gabarito IIDocument32 pagesMatemática - Resumos Vestibular - Logaritmos Teoria Gabarito IIMatemática Mathclassy100% (4)
- 4.3. Matemática - Exercícios Propostos - Volume 4 PDFDocument48 pages4.3. Matemática - Exercícios Propostos - Volume 4 PDFkira1234Pas encore d'évaluation
- Exercícios ConjuntosDocument22 pagesExercícios ConjuntosAlcides OlintoPas encore d'évaluation
- AL Questões e AulasDocument232 pagesAL Questões e AulasAngela Queiroz100% (1)
- 017-Matemática-1-LOGARITMO-PROPRIEDADES E EXERCÍCIOS PDFDocument4 pages017-Matemática-1-LOGARITMO-PROPRIEDADES E EXERCÍCIOS PDFDavid J.CPas encore d'évaluation
- Lista 15maisimportantesDocument48 pagesLista 15maisimportantesAlex AquinoPas encore d'évaluation
- Análise Combinatória - Cap 5Document39 pagesAnálise Combinatória - Cap 5Wagner LeodoroPas encore d'évaluation
- Lista Matemática - ProbabilidadeDocument3 pagesLista Matemática - ProbabilidadeRafaelo Almiro Da CruzPas encore d'évaluation
- Equações Exponenciais - ExercíciosDocument5 pagesEquações Exponenciais - ExercíciosrayssaPas encore d'évaluation
- Matemática - Volume 1 - Frente 1Document68 pagesMatemática - Volume 1 - Frente 1Mariana SilveiraPas encore d'évaluation
- Matemática Básica - ApostilaDocument158 pagesMatemática Básica - ApostilaLallybookPas encore d'évaluation
- Apostila de Geometria Analítica I (12 Páginas, 88 Questões, Com Gabarito)Document12 pagesApostila de Geometria Analítica I (12 Páginas, 88 Questões, Com Gabarito)Elias Dos Santos Silva100% (1)
- Apostila Matematica 2Document8 pagesApostila Matematica 2SugowoPas encore d'évaluation
- Matemática 7, 8 e 9Document76 pagesMatemática 7, 8 e 9Constâncio CumbaPas encore d'évaluation
- Polinômios AtualizadoDocument18 pagesPolinômios AtualizadoJackison NascimentoPas encore d'évaluation
- Lista Logaritmos 2010 GABARITODocument5 pagesLista Logaritmos 2010 GABARITOBárbara NascimentoPas encore d'évaluation
- Cad C2 Exercicios 3serie 1opcao 2bim MatematicaDocument72 pagesCad C2 Exercicios 3serie 1opcao 2bim MatematicaRenato Severo0% (1)
- 008-Matemática-1-Função Do 2 Grau-CONCAVIDADE, DISCRIMINANTE, RAÍZES E FORMA FATORADADocument6 pages008-Matemática-1-Função Do 2 Grau-CONCAVIDADE, DISCRIMINANTE, RAÍZES E FORMA FATORADADavid J.CPas encore d'évaluation
- Lista 36 - Frente A - Arco Duplo e Arco MetadeDocument6 pagesLista 36 - Frente A - Arco Duplo e Arco MetadeLucas AmorimjsPas encore d'évaluation
- CalculosDocument7 pagesCalculosbemedeiros9250% (4)
- Matematica Exercicios Progressao Aritmetica GeometricaDocument9 pagesMatematica Exercicios Progressao Aritmetica GeometricaFabioBogadoPas encore d'évaluation
- FISV484 A 114Document29 pagesFISV484 A 114Luiz SantosPas encore d'évaluation
- Pacote Exercicios Raciocinio Logico Matematico Daniel ColaresDocument636 pagesPacote Exercicios Raciocinio Logico Matematico Daniel ColaresJônatas Paixão100% (1)
- Geometria PDFDocument63 pagesGeometria PDFNelson Bantene0% (1)
- Simulado 1 Saeb Matemc3a1tica emDocument5 pagesSimulado 1 Saeb Matemc3a1tica emMary MaryPas encore d'évaluation
- Exerc Campo Eletrico Com RespDocument7 pagesExerc Campo Eletrico Com RespLara SiqueiraPas encore d'évaluation
- Controlador de Fator de Potencia RPCF3 SamrelloDocument11 pagesControlador de Fator de Potencia RPCF3 SamrelloJoao Luis RossiPas encore d'évaluation
- 9 - Escoamentos Variáveis Sob PressãoDocument27 pages9 - Escoamentos Variáveis Sob PressãoWanda FranciscoPas encore d'évaluation
- PVC Propriedades CaracteristicasDocument2 pagesPVC Propriedades CaracteristicasadrbimPas encore d'évaluation
- Hpge8 - Lista de Exercícios - 1a ParteDocument22 pagesHpge8 - Lista de Exercícios - 1a ParteOribeiro SilvaPas encore d'évaluation
- Dinâmica Dos OceanosDocument77 pagesDinâmica Dos OceanosAna Cristina Ribeiro PaivaPas encore d'évaluation
- Dilatação TérmicaDocument5 pagesDilatação TérmicadennysrochaPas encore d'évaluation
- (F429) Experimento 3 - RelatórioDocument4 pages(F429) Experimento 3 - RelatórioGabriela ShimaPas encore d'évaluation
- Artigo - Leis de NewtonDocument6 pagesArtigo - Leis de NewtontiagovestibularPas encore d'évaluation
- Nomeclatura IUPACDocument11 pagesNomeclatura IUPACMahira AdnaPas encore d'évaluation
- Apostila Perspectiva ConicaDocument19 pagesApostila Perspectiva ConicaPatrícia Generoso100% (1)
- Unidades de Medidas - ExercíciosDocument7 pagesUnidades de Medidas - ExercíciosAlan BaloniPas encore d'évaluation
- Capitulo 3b - Diagrama Nyquist PDFDocument32 pagesCapitulo 3b - Diagrama Nyquist PDFJoão Paulo PereiraPas encore d'évaluation
- ABNT NBR 6120-2000 Cargas para o Cálculo de Estruturas de EdificaçõesDocument10 pagesABNT NBR 6120-2000 Cargas para o Cálculo de Estruturas de EdificaçõesigorPas encore d'évaluation
- Apresentação CIP em CervejariasDocument31 pagesApresentação CIP em CervejariasFelipe RomoliniPas encore d'évaluation
- UFCD 6410 - 01 Instalações ElétricasDocument45 pagesUFCD 6410 - 01 Instalações ElétricasDenisa Maia100% (2)
- Exercício - EletrostáticaDocument1 pageExercício - EletrostáticaAnderson Duarte Monte100% (1)
- RecristalizaçãoDocument3 pagesRecristalizaçãoJucelia Luz BarrosPas encore d'évaluation
- Trabalho de FenomenosDocument5 pagesTrabalho de FenomenosLeandro de QueirozPas encore d'évaluation
- 04-A Locomotiva em Freio DinâmicoDocument5 pages04-A Locomotiva em Freio DinâmicoLocomotiva Bb36100% (4)
- Raios Catodicos e Raios CanaisDocument23 pagesRaios Catodicos e Raios CanaisCesar Franco100% (1)
- Plataforma ProfessionalDocument19 pagesPlataforma Professionalrocker067Pas encore d'évaluation
- Mecanica - FisicaDocument170 pagesMecanica - FisicaJotaro KujoPas encore d'évaluation
- Fazer Teste - Avaliação On-Line 2 (AOL 2) - Eletricidade e MagnetismoDocument3 pagesFazer Teste - Avaliação On-Line 2 (AOL 2) - Eletricidade e MagnetismoKlayton LimaPas encore d'évaluation
- Ficha Trabalho CFQ 9 Ano em TransitoDocument3 pagesFicha Trabalho CFQ 9 Ano em Transitoneb79Pas encore d'évaluation
- Soluções para Defeitos em PlásticosDocument5 pagesSoluções para Defeitos em PlásticosElemento AndeonPas encore d'évaluation
- Parametrização Relé SecundárioDocument13 pagesParametrização Relé SecundárioJoao Silva100% (2)
- Introdução, PH e TampõesDocument49 pagesIntrodução, PH e TampõesAndré LuizPas encore d'évaluation
- Equação de TorricelliDocument4 pagesEquação de TorricelliAlexandre BonfimPas encore d'évaluation