Académique Documents
Professionnel Documents
Culture Documents
Les Voies Métaboliques Revu
Transféré par
lord47Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Les Voies Métaboliques Revu
Transféré par
lord47Droits d'auteur :
Formats disponibles
Les principales voies mtaboliques
en biochimie humaine
Facults Universitaires Notre-Dame
de la Paix de Namur
Facult de Mdecine
Pr. Jean-Michel Dogn
Pr. Bernard Masereel
Avril 2009
Principes de base du mtabolisme
Ractions cls en biochimie
Principales voies mtaboliques
Mtabolisme glucidique
Mtabolisme lipidique
Mtabolisme protique
Phosphorylation oxydative
Les principales voies
mtaboliques en biochimie
humaine
Principes de base du mtabolisme
Ractions cls en biochimie
Principales voies mtaboliques
Mtabolisme glucidique
Mtabolisme lipidique
Mtabolisme protique
Phosphorylation oxydative
Les principales voies
mtaboliques en biochimie
humaine
Le mtabolisme: cest lensemble des ractions chimiques,
catalyses par des enzymes, qui se produisent chez les tres vivants.
Lanabolisme regroupe les ractions de synthse des matriaux dont
les organismes ont besoin. Les ractions danabolisme sont
endergoniques, non spontanes. Elles requirent un apport
dnergie.
Le catabolisme est lensemble des ractions de dgradation des
biomolcules. Les ractions de catabolisme sont exergoniques,
spontanes et productrices dnergie. Cette nergie doit tre stocke
sous une forme utilisable par lorganisme.
Principes de base du mtabolisme
Ractions cls en biochimie
Principales voies mtaboliques
Mtabolisme glucidique
Mtabolisme lipidique
Mtabolisme protique
Phosphorylation oxydative
Les principales voies
mtaboliques en biochimie
humaine
A C
-
A
-
C
A
-
C-B
A-B C
-
Mtabolisme: ractions cls
La plupart des ractions du mtabolisme sont des ractions de
transfert. Il est soit un lectron (oxydo-rduction), soit un groupement
fonctionnel (B+).
Ces ractions sont catalyses par des enzymes. Pour rappel, lenzyme est un
catalyseur spcifique qui augmente la vitesse de raction; il participe la
raction mais il ne fait ni partie des produits, ni des ractifs, il est rgnr la fin
de la raction.
Certains enzymes ncessitent aussi pour fonctionner des composantes chimiques
supplmentaires appeles co-facteurs.
Un co-facteur peut tre inorganique, tels que le sont les ions Fe
2+
, Mn
2+
, Zn
2+
ou
Mg
2+
, co-facteurs frquents. Il peut aussi tre de nature organique, comme la biotine
ou le coenzyme A. La plupart des vitamines sont des co-facteurs enzymatiques.
Quand un co-facteur est une molcule organique complexe, il porte le nom de
coenzyme. La partie protique de l'enzyme, elle, s'appelle apoenzyme et l'union de
l'apoenzyme et de son coenzyme (ou de son cofacteur) est un holoenzyme.
Le co-facteur, qu'il soit petit comme un ion ou complexe comme un coenzyme, peut
tre attach : de faon transitoire l'apoenzyme ou de faon covalente; c'est alors un
groupement prosthtique (co-facteur li de faon covalente lenzyme: ex. Cyt C.)
Les transporteurs dlectrons
Co-facteurs de transport dlectrons:
Nicotinamide adnine dinuclotide (NAD
+
/NADH,H
+
) ;
Nicotinamide adnine dinuclotide phosphate (NADP
+
/NADPH,H
+
) ;
Flavine mononuclotide (FMN/FMNH
2
) ;
Flavine adnine dinuclotide (FAD/FADH
2
) ;
Coenzyme Q (CoQ/CoQH
2
)
Les hmoprotines: cytochromes (Cyt[Fe
2+
]/Cyt[Fe
3+
]).
Acide lipoque
Les vitamines K (K1, K2 et K3)
La vitamine E
Nicotinamide adnine dinuclotide (NAD
+
/NADH,H
+
) ;
Nicotinamide adnine dinuclotide phosphate (NADP
+
/NADPH,H
+
)
NADP
+
NAD
+
+ +
O=P-O
-
O=P-O-
O=P-O- O=P-O-
O=P-O-
N
N
N
N
NH
2
O
O
N
N
N
N
N
NH
2
O
O
N
O
-
OH HO
H
2
C
H
2
C
HO O
CO-NH
2
O
O
-
O
-
O
-
O
-
O
CO-NH
2
OH HO
H
2
C
H
2
C
HO OH
Ces nuclotides contiennent :
une base purique l'adnine
une base pyridinique le nicotinamide
(vitamine B
3
ou vitamine PP)
deux pentoses deux riboses
deux phosphates dans le NAD
+
et trois
phosphates dans le NADP
+
.
Ce coenzyme n'est pas fix sur l'apoenzyme.
Le coenzyme fixe rversiblement 1 ion H
+
et
un lectron sur le noyau nicotinamide en
prsence d'une enzyme de la classe des
oxydorductases.
NAD(P)H + H
+
NAD(P)
+
+ 2H
+
+ 2e
-
+ H
+
+ 2H
+
+ 2e
-
+
N
N
H
H H
CO-NH
2
R
R
CO-NH
2
Les flaovonodes:
Flavine mononuclotide (FMN/FMNH
2
) ;
Flavine adnine dinuclotide (FAD/FADH
2
) ;
Coenzyme d'oxydo-rduction drivant de la
vitamine B
2
(riboflavine). Ces coenzymes sont
associs aux enzymes de la classe des
oxydorductases auxquelles il est li par une
liaison covalente : c'est un groupement
prosthtique.
Le coenzyme fixe rversiblement 2 ions H
+
et
2 lectrons sur le noyau 6,7 dimthyl-
isoalloxazine en prsence d'une enzyme de
la classe des oxydorductases.
riboflavine ou vitamine B
2
FMN
AMP
O=P-O-
O=P-O-CH
2
-(CHOH)
3
-CH
2
N
N
N
N
NH
2
O
NH
N N
N
H
3
C
H
3
C
O
O
OH HO
H
2
C
O
O
-
O
-
FAD
+ 2H
+
+ 2e
-
NH
N N
N
NH
H
N N
N
H
H
3
C
H
3
C
O
O
R R
O
O
H
3
C
H
3
C
FMNH
2
FMN + 2H
+
+ 2e-
FADH
2
FAD + 2H
+
+ 2e
-
Les quinones: les ubiquinones
La prsence de deux fonctions de type
phnol en position ortho ou para permet,
par oxydation d'obtenir une quinone.
Les ubiquinones ou coenzymes Q sont
des transporteurs d'lectrons situs dans
la mitochondrie (n compris entre 6 et 10).
L'ubiquinone ou coenzyme Q
10
(n= 10)
diffuse librement dans la bicouche
lipidique car il s'agit d'une benzoquinone
qui est soluble dans les lipides avec une
longue chaine isoprnode.
+ 2 H
+
+ 2e
-
+ 2 H
+
+ 2e
-
O
O
HO
OH
OH
OH
O
O
isoprne
(CH
2
-CH=C-CH
2
)
n
H
CH
3
CH
3
CH
3
O
CH
3
O
O
O
Les hmoprotines
Ce sont des protines qui possdent un
hme . Ce groupement peut tre li de
manire covalente. C'est alors un
groupement prosphtique. Il s'agit d'une
porphyrine coordinnes avec un ion
mtallique. Les positions 3 et 4 des noyaux
pyrroles sont diversement substitues.
Lion mtallique est souvent Fe
2+
, Fe
3+
,
Cu+,.
N
N
N
N
H
3
C
CH
H
2
C
CH
3
CH
CH
2
CH
3
CH
3
H
2
C H
2
C
CH
2
COO
-
CH
2
COO
-
Fe
Les hmoprotines
Potentiellement, les hmoprotines sont des transporteurs mono-lectroniques
qui agissent selon l'quation suivante :
Hme-Fe
3+
+ 1 e
-
Hme-Fe
2+
Ils fonctionnent soit uniquement l'tat rduit (ex : Fe
2+
), c'est le cas des
hmoglobines. En effet, seul la forme Hb
2+
est capable de transporter l'oxygne
ou le CO. D'autres hmoprotines peuvent fonctionner soit sous forme oxyde
(ex: Fe
3+
), soit sous forme rduite (ex : Fe
2+
).
Les hmoprotines et cytochromes (Cyt[Fe
2+
]/Cyt[Fe
3+
]).
Les cytochromes sont des hmoprotines qui
agissent comme transporteur d'lectrons
(capteur) en passant de l'tat ferrique l'tat
ferreux.
Les formes rduites des cytochromes
possdent des bandes d'absorption
caractristiques dans l'ultraviolet. Ces bandes
sont souvent au nombre de trois : , et (ou
bande de Soret), et permettent de les classer:
Cytochrome a
Cytochrome a
3
Cytochrome b (hmoglobine et myoglobine)
Cytochrome c
Cytochrome c
1
Exemple: cytochrome C
Les cytochromes a et b font partie intgrante de la membrane mitochondriale et
sont donc insolubles. Ils sont galement bloqus par le CN et le CO. Tandis que le
cytochrome C est soluble et largement rparti dans l'ensemble des cellules.
Les hmoprotines et cytochromes (Cyt[Fe
2+
]/Cyt[Fe
3+
]).
Les formes rduites des cytochromes possdent des bandes
dabsorption caractristiques dans lultraviolet. Ces bandes sont
souvent au nombre de trois: o, | et (ou bande de Soret), et
permettent de les classer :
Les hmoprotines et cytochromes (Cyt[Fe
2+
]/Cyt[Fe
3+
]).
N
N
N
N
H
3
C
CH
H
2
C
CH
3
CH
CH
2
CH
3
CH
3
H
2
C H
2
C
CH
2
COO
-
CH
2
COO
-
Fe
N
N
N
N
H
3
C
CH
H
2
C
CH
3
CHOH
(CH
2
-CH=C-CH
2
)
3
-H
CH
3
C
H
2
C H
2
C
CH
2
COO
-
CH
2
COO
-
O
H
CH
3
Fe
Cytochrome b
(in hmoglobine, myoglobine)
Cytochrome a
(in hmoglobine, myoglobine)
Le cytochrome C
Cytochrome C est un co-facteur soluble ( l'inverse des autres cytochromes) et
est un composant essentiel de la chane respiratoire. Il transfre les lectrons
entre les complexes III et IV.
Il peut prendre une part active dans l'apotose
La ncrose est considre comme une mort cellulaire "dsordonne". En effet
au cours de la ncrose, les cellules vont se gorger d'eau au point que cela va
entraner la lyse de leur membrane plasmique. Cette vritable explosion
cellulaire conduit au relargage dans le milieu environnant du contenu
cytoplasmique. Les organelles vont elles aussi avoir tendance gonfler. L'ADN
nuclaire va tre dgrad de manire "alatoire" par des endonuclases
actives notamment par des srines protases.
Ncrose vs apoptose
Par opposition la ncrose, l'apoptose est considre comme une mort
cellulaire "ordonne", procdant par diffrentes phases.
Tout d'abord les cellules en apoptose vont s'isoler des autres cellules (perte des
contacts entre les cellules).
La mitochondrie de la cellule apoptotique va subir plusieurs modifications majeures :
relargage du cytochrome c dans le cytoplasme, diminution du potentiel
membranaire et de la transition de la permabilit mitochondriale (PT) qui permet
l'ouverture de pores PT spcialiss.
Le noyau se condense, puis la chromatine est clive en fragments rguliers
d'environ 180 pdb.
La membrane plasmique va bourgeonner et conduire la formation de corps
apoptotiques renfermant une partie du cytoplasme de la cellule. Afin de faciliter la
reconnaissance des corps apoptotiques par les phagocytes, la cellule va
signaler son tat apoptotique son environnement notamment grce au
changement de localisation des molcules de phosphatidylsrines qui passent
d'une orientation cytoplasmique vers une orientation extracellulaire qui permettront sa
phagocytose par les globules blancs.
L'un des points majeurs de l'apoptose est que l'intgrit de la membrane
plasmique n'est jamais altre au cours du processus, ce qui permet d'viter tout
dversement du contenu cellulaire et ainsi prvenir tout dommage inflig aux tissus
alentours. Linflammation est donc absente de ce processus!
Le cytochrome C et apoptose
L'apoptose passe par plusieurs voies de signalisation. Deux d'entre-elles sont
schmatiquement impliques, en priorit dans le dclenchement du processus
apoptotique :
une 1
re
voie intracellulaire fait suite l'activation d'un rcepteur dit de mort
cellulaire ou death receptors (par exemple CD
95
activ par son ligand CD
95
L,
TNFo, etc.) qui induit l'agrgation de molcules "d'adaptation" puis de
nombreuses molcules de procaspase-8 (protases inactives) qui, en se clivant
mutuellement, permettent leur activation en caspase-8. Cette dernire induit la
transformation de la procaspase-3 en caspase-3, enzyme protolytique terminale
majeure conduisant la cellule vers sa mort programme.
Le cytochrome C et apoptose
une 2me voie implique un dsquilibre entre des membres de la famille des
protines Bcl-2 (anti-apoptotiques) au profit des protines pro-apoptotiques
(Bax ou Bak, par exemple). L'augmentation de Bax entrane une libration accrue
de cytochrome C par la mitochondrie. Ainsi, la mitochondrie joue un rle cl dans
la rgulation de l'apoptose. En effet, la phase effectrice de l'apoptose (par diffrents
inducteurs. EX. activation des rcepteurs au TNF) comporte:
L'ouverture des pores de transition de permabilit (pores PT) des mitochondries
et la libration de molcules apoptognes telle que le cytochrome c. La phase de
libration du cytochrome C par les pores de la mitochondrie est sous le
contrle de membres de la famille Bcl-2. Si l'on se rfre leur fonctions
biologiques, on peut classer les membres de la famille Bcl-2 en deux sous-familles,
des membres anti-apoptotiques tel que Bcl-2 et des membres pro-apoptotiques
comme Bax, Bak, Bcl XS, Bok, Bad, Bik, Bid etc. Ainsi, Bcl-2 est capable de bloquer
la sortie du cytochrome c alors que Bax peut l'induire.
Dans le cytosol, le cytochrome c peut se lier lApoptosis Activation Factor 1
(Apaf-1). Protine adaptatrice laquelle se fixe le cytochrome C libr par les
mitochondries pour constituer lapoptosome. Au niveau de cet apoptosome
sassemblent et sactivent les molcules de procaspase 9, responsables de
lactivation dautres caspases dont la caspase 3, enzyme protolytique terminale
majeure conduisant la cellule vers sa mort programme.
Acide lipoque
C'est un co-facteur dont la forme rduite est constitue de l'acide 6,8-dithio-
octanoque. Il est li de faon covalente son enzyme.
1. Il peut servir d'accepteur d'lectron:
(CH
2
)
4
-COOH (CH
2
)
4
-COOH
+ H
2
SH S S HS
2. Il peut servir dans les ractions de dcarboxylation (transporteur de groupe):
R-C-COO
-
+ E-L + H
+
R-C-S-L-SH + CO
2
E
E
R-C-S-L-SH + H
2
O R-C-OH + E-L
S
S
SH
SH
O
O
O
O
o-ctocarboxylique
Vitamine K, vitamine E et vitamine C
vitamine K
1
CH
2
-CH=C-(CH
2
CH
2
-CH
2
-CH)
3
-CH
3
O
O
CH
3
CH
3
CH
3
Rle essentiel dans la
coagulation
O
vitamine E (o-tocopherol)
CH
3
CH
2
-(CH
2
-CH
2
-CH-CH
2
)
3
H
CH
3
CH
3
CH
3
CH
3
HO
Antioxydant
O
O
HOH
2
C-HOHC
OH
HO
acide ascorbique (vitamine C)
Antioxydant
Les transporteurs de groupe
Co-facteurs de transport de groupe:
Les nuclotides
Le coenzyme A
Lacide lipoque
La carnitine
La biotine (vit. B
8
ou vit. H)
La thiamine (vit. B
1
)
Le pyridoxal (vit. B
6
)
Les transporteurs de groupe
Le transfert de groupes est trs souvent le transfert dun
groupe cationique (X
+
) vers un accepteur de type anionique
A-X
+
+ CH AH + C-X
+
Les groupements changs sont en gnral :
acyl : R-C +
alkyl : R-(CH
2
)
n
+
osyl : sucre
+
O
Selon la nature de C
-
, lenzyme responsable sera une:
phosphorylase : C
-
= phosphate
pyrophosphorylase : C
-
= pyrophosphate
thiolase : C
-
= thiolate
Les nuclotides
Uridine triphosphate
(UTP)
Cytidine monophosphate
(CMP)
Guanosine diphosphate
(GDP)
Adnosine triphosphate
(ATP)
N
N
N
N
O
HN
N
N
N
O
N
N
O
HN
N
O
1
2
3
4
5
6
7
8
9
-
O-P-O-P-O-P-O-H
2
C
O O O
O
-
O
-
O
-
O
HO OH
O
O
-
O
-
O-P-O-H
2
C
OH HO
O
NH
2
NH
2
O
HO OH
-
O-P-O-P-O-H
2
C
O O
O
-
O
-
O
-
O
-
O
-
O O O
-
O-P-O-P-O-P-O-H
2
C
OH HO
NH
2
base
2
: attaque distale
1
: attaque distale
|
2
: attaque frquente
libration de pyrophosphate
|
1
: attaque distale
o
2
: attaque proximale
libration de phopshate
o
1
: attaque distale frquente
libration de phosphoryl
Type d'hydrolyse
|
o
-
O - P - O - P - O - P - O - sucre
O
-
O
-
O
-
O O
O
Le coenzyme A
-mercapto
thylamine
acide pantothnique
(vitamine B
5
)
ADP
+ 3'-phosphate
N
N
N
N
O
pantthine
CH
3
CH
3
OH
O
HS-CH
2
-CH
2
-NH-C-CH
2
-CH
2
-NH-C-CH-C-CH
2
-
O-P-O
O
O
-
O
-
O
-
O O O
-O-P-O-P-O-H
2
C
OH
NH
2
Le coenzyme A (CoA-SH)
est un transporteur de
groupes acyles. Sa
structure contient l'acide
pantothnique (vitamine
B
5
).
CH
3
C
O
COOH CoA SH + CH
3
C
O
S CoA
ac. pyruvique
Ex. Raction catalyse par la pyruvate dshydrognase
La fonction thiol
assure le transport des
groupes acyles en
formant une liaison
thioester
La carnitine
matrice mitochondriale
espace
intermembranaire
+
CH
3
CH
2
CH
2
C (CH
2
)
n
O
CoA-SH
+
CH
3
CH
2
CH
2
C (CH
2
)
n
O
O
+
CH
3
CH
2
CH
2
C
O
S-CoA (CH
2
)
n
CoA-SH
O
carnitine acyltransfrase I
carnitine
acyltransfrase II
CH
3
CH
2
CH
2
C
O
S-CoA (CH
2
)
n
acyl-CoA
L-carnitine
+
*
acylcarnitine
carnitine : acylcarnitine
translocase
CH
3
-N-CH
2
-CH-CH
2
-C-O
-
CH
3
CH
3 O
CH
3
-N-CH
2
-CH-CH
2
-C-O
-
CH
3
CH
3 O
OH CH
3
CH
3
O
CH
3
-N-CH
2
-CH-CH
2
-C-O
-
OH CH
3
CH
3
O
CH
3
-N-CH
2
-CH-CH
2
-C-O
-
La carnitine joue un rle
de navette des
groupements acyle au
travers des membranes
mitochondriales
La biotine (vitamine B
8
ou vitamine H)
La biotine est un transporteur
de groupement carboxyle.
biotine
(CH
2
)
5
-CO-NH-(CH
2
)
4
-CH
HN NH
S
O
NH
CO
pyruvate
carboxylase
-
Pi
ADP ATP
HN NH
O-C-N NH
O
HOOC-CH
2
-C-COOH
O
CH
3
-C-COOH
O
O
O
-
O
O
-
O-P-O-C-O
-
O
HCO
3
-
Elle intervient entre autre
comme co-facteur de la
pyruvate carboxylase qui
transforme le pyruvate
en oxaloactate.
Le pyridoxal (vitamine B
6
)
Dans le cas de
transaminases
possdant le pyridoxal
(vitamine B
6
) comme co-
facteur, il sagit dun
change simultan de
groupes.
+
+
+
+
NH-Lys
+
c-NH
2
-Lys
phosphate
de pyridoxal
(PLP)
+
N
H
N
H
N
H
N
H
CH
2
OH
CH
3
-
O-P-O-CH
2
O
O
-
H
2
O
O
R-C-COOH
NH
2
O
-
O
-
O-P-O-CH
2
CH
3
OH
R-CH-COOH
CH
NH
R-CH-COOH
CH
OH
CH
3
-
O-P-O-CH
2
O
O
- O
-
O
-
O-P-O-CH
2
CH
3
OH
O
CH
NH
2
Principes de base du mtabolisme
Ractions cls en biochimie
Principales voies mtaboliques
Mtabolisme glucidique
Mtabolisme lipidique
Mtabolisme protique
Phosphorylation oxydative
Les principales voies
mtaboliques en biochimie
humaine
PROTEINES POLYSACCHARIDES LIPIDES
(amidon, glycogne)
Monosaccharides
Acides Amins Ac. gras
Cholesterol
Glycrol
amylases
amylo-glucosidase
|-oxydation
damination
Glycolyse
Cto-acides
Actyl
CoA
Cycle de Krebs
Phosphorylation
oxydative
t
r
a
c
t
u
s
g
a
s
t
r
o
-
i
n
t
e
s
t
i
n
a
l
ATP
lipases
Disaccharides
invertase
maltase...
H
+
, pepsine,
chymotrypsine...
FADH
2
, NADH
NH
3
ure
CO
2
O
2
H
2
O
Les aliments contiennent
trois types de substances,
les protines, les sucres
et les lipides auxquels il
convient d'ajouter les
vitamines et les minraux.
Distribution dans des conditions physiologiques normales des
oses, acides gras et acides amins libr dans lintestin
Les principales voies mtaboliques
Principes de base du mtabolisme
Ractions cls en biochimie
Principales voies mtaboliques
Mtabolisme glucidique
Mtabolisme lipidique
Mtabolisme protique
Phosphorylation oxydative
Mtabolisme glucidique
Introduction
La glycolyse
La fermentation alcoolique
La fermentation lactique
Le cycle de Krebs
La voie des pentoses phosphates
Le mtabolisme du glycogne
La noglucogense
Introduction
Cette section montre tout ce que lorganisme peut faire partir des glucides et plus
particulirement du glucose:
Dune part, parce quil constitue le glucide le plus abondant dans lalimentation,
Dautre part, parce que tous les glucides se convertissent en glucose dans lorganisme;
Enfin, parce quil est un substrat nergtique indispensable pour certaines cellules et
tissus comme les globules rouges et le cerveau!
Structure du glucose
La fonction aldhyde du
glucose s'hydrate pour
former une fonction alcool
qui va ragir avec la une
autre fonction alcool (celle
du carbone 5). Le glucose
devient alors cyclique, il
drive du pyrane
Introduction:
Principaux glucides mtaboliss
Pour le mtabolisme nergtique, les
monosaccharides importants sont les
hexoses: le glucose, le plus important, le
fructose et le galactose.
H
CHO
OH
H HO
OH H
OH H
CH
2
OH
D-glucose
Reprsentation de Fischer
1
2
3
4
5
6
O
OH
OH
OH
CH
2
OH
OH
o-D-glucopyranose
1
2 3
4
5
6
H
CHO
OH
H HO
H HO
OH H
CH
2
OH
O
OH
OH
CH
2
OH
OH
1
2 3
4
5
6
D-galactose
OH
4
o-D-galactopyranose
CH
2
OH
O
H HO
OH H
OH H
CH
2
OH
D-fructose
1
2
3
4
5
6
O
CH
2
OH
OH
1
2
3
OH
OH
CH
2
OH
4
5
o-D-fructofuranose
Introduction: utilisation des glucides par la cellules
Seulement quelques-unes des diverses voies mtaboliques que peut emprunter le
glucose fonctionnent dans toutes les cellules de lorganisme. Toutes les voies
mtaboliques du glucose fonctionnent cependant dans les cellules du foie: on doit
sinterroger sur les organes o ces voies fonctionnent!
Fondamentalement, une cellule hpatique peut:
-Dgrader le glucose (glycolyse: toutes les cellules)
Buts: fournir de lATP, du NADH/H
+
(source dnergie) et le pyruvate. Le pyruvate peut-tre transform en
actyl-coA en conditions arobies. Lactyl-coA peut soit emprunter la voie des citrates (cycle de Krebs),
coupl la chane respiratoire, soit servir de matriau de biosynthse aux acides gras et cholestrol.
-Synthtiser le glucose (noglucogense: le foie et un peu les reins et intestin)
Buts: maintien du glucose sanguin entre les repas, la nuit et en priode de jene (les globules rouges et le
cerveau ne peuvent utiliser que le glucose comme source dnergie).
-Mettre en rserve le glucose (glycognogense: le foie et les muscles)
Buts: mise en rserve du glucose en excs aprs un repas riche en glucides!
-Une autre voie, la voie des pentoses-phosphates: toutes les cellules.
Buts: fournir le ribose pour la synthse des nuclotides et fournir le NADPH/H
+
pour la biosynthse des
acides gras, du cholestrol et des strodes ainsi que pour les ractions de biotransformation dans le foie et
llimination de peroxydes toxique dans les globules rouges (rythrocytes).
Actyl-CoA
Cholestrol
Acides gras
Triglycrides
(adipocytes)
Phospholipides
(membranes)
cycle de Krebs
O
OH
OH
OH
CH
2
OH
OH
1
2 3
4
5
6
NADH/H
+
FAD/FADH
2
Phosphorylation
oxydative
ATP
Vitamine D
Hormones sexuelles
Sels biliares
Pyruvate
arobie
Lacate
anarobie
corps ctoniqes
Glycogne
glycolyse noglucogense
Ribose
NADPH/H
+
voie des pentoses-phosphates
glycogenolyse glycognognse
Introduction: Sources de glucose
La principale source de glucose est exogne: elle provient de lalimentation et des
glucides qui sy retrouvent:
-Disaccharides: saccharose, lactose, maltose
-Polysaccharides: amidon (vgtaux), glycogne, etc.
Le glycogne constitue la source de stockage du glucose dans lorganisme des
mammifres. Il constitue ds lors une source endogne de glucose.
H
O
OH
H
H
OH H
OH
CH
2
OH
H
CH
2
OH
CH
2
OH
H
OH
H
H OH
O
O
Saccharose ou sucrose
o-D-glucopyranosyl- (1-2)-|-D-fructofuranose
OH
O
H
H
OH H
OH
CH
2
OH
H
H
O
OH
H
OH H
OH
CH
2
OH
H
H
H
O
Lactose
|-D-galactopyranosyl-(1-4)-o-D-glucopyranose o-lactose
|-D-galactopyranosyl-(1-4)-|-D-glucopyranose |-lactose
Glucose + frucose
galactose +
glucose
H
O
OH
H
H
OH H
OH
CH
2
OH
H
H
O H
H
OH H
OH
CH
2
OH
H
OH O
Maltose
o-D-glucopyranosyl-(1-4)-o-D-glucopyranose o-maltose
o-D-glucopyranosyl-(1-4)-|-D-glucopyranose |-maltose
glucose + glucose
invertase ou sucrase
(intestin)
La maltase
(les cellules epithliales de l'intestin grle)
Lactase
Sources exognes
de glucose:
Sources exognes de glucose:
Amidon: un polymre de D-glucose prsent uniquement
chez les vgtaux.
C est un polymre linaire de o-D-maltose (ou a-D-glucose) uni par des liaisons
o14.
Amylose (20%)
H
O H
H
OH H
OH
CH
2
OH
H
H
O H
H
OH H
OH
CH
2
OH
H
H
O H
H
OH H
OH
CH
2
OH
H
H
O H
H
OH H
OH
CH
2
OH
H
O
1o
4
O
O O
Amylopectine (80%)
C est un polymre ramifi de o-D-maltose. Environ tous les 25 rsidus, une chane
de 15-25 oses est branche par une liaison o-(16)
H
O H
H
OH H
OH
CH
2
OH
H
H
O H
H
OH H
OH
CH
2
OH
H
H
O H
H
OH H
OH
CH
2
H
H
O H
H
OH H
OH
CH
2
OH
H
O
H
O H
H
OH H
OH
CH
2
OH
H
H
O H
H
OH H
OH
CH
2
OH
H
1o
6
O
O
O
O
O
Sources exognes de glucose:
La |-amylase (exoglycosidase)
dbite des units de maltose partir
des extrmits non-rductrices
(liens o-14).
L o-amylase scinde au hasard
(endoglycosidase) les liaisons o-
14 jusqu la formation de
dextrines limites (3 x 12 oses).
Lamylo-o-(16)-glucosidase
coupe les liaisons responsables de la
ramification.
Ces enzymes sont prsentes dans la
salive et dans le suc pancratique
|-amylase
o-amylase
amylo-o(1->6)-glucosidase
OH
Sources exognes de glucose:
Glycogne: un polymre de D-glucose prsent chez les
animaux pour stocker le glucose
Il est prsent dans le foie et le muscle chez lHomme
(Mise en rserve et source endogne).
C est un polymre ramifi de o-D-maltose. Environ
tous les 15 rsidus, une chane de 10-18 oses est
branche par une liaison o-16. Les rsidus des
chanes linaires sont relis entre-eux par un lien de
type o-14.
Le glycogne est beaucoup plus ramifi que
lamylopectine.
Le glycogne alimentaire est dit exogne.
Le glycogne hpatique ou musculaire est dit
endogne.
La digestion du glycogne alimentaire est
similaire celle de lamidon.
Introduction: comment les sucres sont absorbs au niveau intestinal?
Seuls les monosaccharides peuvent tre absorbs dans lintestin car il existe
des mcanismes spcifiques de transport dans les cellules intestinales.
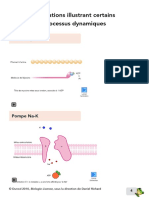
Labsorption du glucose est effectu par un transporteur dpendant du
sodium fonctionnant de faon active secondairement appel SGLT1 ou
sodium/glucose transporteur
1. Le glucose est transport conjointement au sodium dans lentrocyte
sans utilisation dATP!
2. Ceci est possible une condition: le sodium est expuls de lautre ct
de la cellule (ct basal) de faon maintenir le gradient! Cette
expulsion a lieu grce lATPase, Na
+
/K
+
-ATPase qui expulse le
sodium (3 Na
+
) et fait rentrer du potassium (2 K
+
), qui utilise de lATP!
Cest ce qui explique la qualification active secondairement
3. Le glucose passe de lentrocyte dans le sang grce au transporteur
GLUT-2
NB. Ce sodium/glucose transporteur (SGLT1) intestinal fonctionne dune faon analogue
un transporteur SGLT2 rnal qui a aussi pour rle dabsorber le glucose partir du milieu
extrieur vers lintrieur de lorganisme (rabsorption tubulaire rnale de glucose).
Entrocyte Intestin Sang
Na
+
glucose
Entrocyte Intestin
Sang
glucose
Na
+
/K
+
ATPase
GLUT-2
3 Na
+
2 K
+
Le glucose est transport conjointement
au sodium dans lentrocyte sans
utilisation dATP!
Ceci est possible une condition: le sodium
est expuls de lautre ct de la cellule (ct
basal) de faon maintenir le gradient! Cette
expulsion a lieu grce lATPase, Na+/K+-
ATPase qui expulse le sodium (3 Na+) et fait
rentrer du potassium (2 K+), qui utilise de
lATP! Cest ce qui explique la qualification
active secondairement
Le glucose passe de lentrocyte dans le
sang grce au transporteur GLUT-2
Introduction: Transport sanguin du glucose
Comme tous les ose sont hydrosolubles, ils se solubilisent bien dans le
sang aprs leur sortie des cellules intestinales.
Ils parviennent ainsi sans problme aux cellules cibles.
La glycmie jeun varie dans des limites troites de 0.7 0.9 g/l, soit 3.8 5.1
mmol/l.
Introduction: Pntration des oses dans la cellule
Arrivs au niveau des cellules, les oses doivent dabord traverser la membrane
cellulaire. La bicouche lipidique des membranes nest pas compltement
impermable au glucose, mais elle constitue un frein. Cest pourquoi se sont
dvelopps des transporteurs spciaux au glucose: GLUT
GLUT
Il sagit de protines qui transfrent le glucose suivant un gradient de
concentration lintrieur des cellules. Cest un processus de diffusion facilite!
La diffusion facilite implique que la concentration de glucose se maintienne un
niveau rduit dans la cellule afin que le glucose puisse y pntrer constamment!
La cellule rsout ce problme en estrifiant le glucose par un phosphate
immdiatement aprs son entre (transformation en glucose-6-phosphate:
premire tape de la glycolyse!). Ainsi, le glucose est emprisonn dans la
cellule puisque le glucose-6-phosphate est plus hydrophile et ne peut sortir
de la cellule!
GLUT
Sang
Cellule priphrique
Glucose Glucose
Glucose-6-Phosphate
En prsence d'insuline Permanente
Fourniture permanente
du glucose aux cellules
Fourniture du glucose
aux cellules en prsence
d'insuline
GLUT-1 et GLUT-3
Responsable de la fourniture de base en
glucose de nombreux tissus dont
-cerveau
-rythrocyte
Par consquent, GLUT-1 et GLUT-3 fonctionnent
sans arrt, avec une forte affinit pour le glucose
GLUT-2
Se trouve dans les membrane du
-foie
-cellules | pancras
-membrane basale de l'intestin
Prsente une faible affinit pour le glucose:
Il sert de "senseur" au glucose! En cas
d' Excs de glucose, il pntre dans les cellules
| pancratiques qui librent l'insuline.
Au niveau de foie, glucose est
transform en glycogne.
GLUT-4
Se trouve au niveau:
-muscles
-adipocytes
Il est stock dans des vsicules au niveau du
cytoplasme!
En priode post-prandiale, la concentration
en glucose sanguin est leve. C'est dtect
(via GLUT-2) au niveau des cellules
|-pancratiques qui librent l'insuline.
Celle-ci induit la translocation des
vsicules contenant GLUT-4 vers la
membrane cellulaire o le transporteur
devient fonctionnel!
Il permet ainsi la pntration du glucose et
son "stockage" sous forme de glycogne
(muscles) ou de triglycrides (tissus
adipeux).
GLUT-4
Introduction: Maintien des oses dans la cellule
Arrivs dans les cellules, les hexoses sont phosphoryls, cest--dire estrifis par
un rsidu phosphate. Le phosphate rend lhexose si polaire quil ne peut plus
sortir de la cellule!
Le glucose-6-phosphate provient du glucose grce laction de lenzyme
hexokinase. LATP sert de donneur de phosphate. Il sagit de la premire
raction de la glycolyse (mais aussi de la voie de synthse du glycogne et
des pentoses phosphates).
O
OH
OH
OH
CH
2
OH
OH
1
2 3
4
5
6
O
OH
OH
OH
CH
2
O
OH
1
2 3
4
5
6
P
O
O
-
O
-
ATP
ADP
Hexokinase
Glucose Glucose-6-phosphate
Glycogne
glycolyse
pentoses-
phosphate
Introduction: Maintien des oses dans la cellule
Il existe diffrentes isoenzymes de lhexokinase en fonction des tissus:
Lhexokinase IV ou glucokinase
Prsente dans le foie et le pancras
(cellules |-pancratiques)
Rles:
-Senseur et tampon au glucose
-Faible affinit pour le glucose; au cours
du jene, elle utilise peu de glucose (utilis
majoritairement par les tissus et
lhexokinase). Aprs un repas, glycmie
leve: elle utilise le glucose dans le
pancras (stimulation de libration
dinsuline) et dans le foie (transformation en
glycogne)
-Phosphoryle le glucose uniquement
Lhexokinase classique (I):
Tous les tissus
Rles:
-Fourniture de base de glucose aux
cellules
-Consquence: haute affinit pour le
glucose
-Phosphoryle glucose, fructose et
galactose.
NB. Au niveau hpatique existent galement la fructokinase et la galactokinase, spcifiques du fructose et du
galactose, respectivement qui jouent le mme rle de senseur pour ces sucres.
Conclusions GLUT et hexokinase/glucokinase
GLUT-1, GLUT-3 et GLUT-4 ainsi que lhexokinase sont les pourvoyeurs de sucre de
base aux cellules. Ils fonctionnent avec une forte affinit pour le glucose et se
trouvent dans les cellules qui dpendent du glucose comme fournisseur dnergie.
Mme en cas de faible concentration sanguine en glucose, ce systme fonctionne
encore dbit maximum et assure au cellules un dbit constant de glucose.
GLUT-2 et la glucokinase se trouvent dans le foie et les cellules | du pancras. Ils ont
une faible affinit pour le glucose et servent de senseur au glucose:
Dans le foie: Le foie constitue le premier organe qui recevra le sang contenant les
produits rsorbs dans lintestin par le systme porte (premier passage). Aprs un
repas, le glucose superflu est emmagasin sous forme de glycogne ou dacides gras
(envoys sous forme de triglycrides dans les cellules adipeuses). Au cours du jene,
la glucokinase ne fonctionne que trs peu et laisse le glucose aux autres cellules qui
en ont besoin. Si lhexokinase tait prsent au niveau du foie, tout le glucose serait
introduit dans les hpatocytes et mtabolis. Seules des quantits insuffisantes de
glucose parviendraient aux cellules qui en ont un besoin vital (rythrocytes et
cerveau!)
Dans le pancras (qui rgule la glycmie via linsuline et le glucagon), la glucokinase
permet dadapter la production dinsuline la concentration de glucose. En cas de
glycmie trop importante, le glucose rentre dans les cellules | du pancras endocrine
qui ragissent en librant linsuline. Si ctait lhexokinase qui fonctionnait dans le
pancras, elle fonctionnerait de faon permanente ce qui se traduirait par une
scrtion permanente dinsuline!
Foie
GLUT-2
Glucose
Glucose-6-phosphate
Glycogne Aides gras
glucokinase (affinit <<)
Sang
Glucose
GLUT-1
GLUT-3
Glucose
Glucose-6-phosphate
hexokinase (affinit >>)
* sauf dans les rythrocytes (pas de mitochondries)
Glucose
Tissus priphriques
Rserve:
Glycolyse
Cycle de Krebs*
Phosphorylation oxydative*
Energie:
Principe
gnral:
Foie
GLUT-2
Glucose
Glucose-6-phosphate
Glycogne Aides gras
glucokinase (affinit <<)
Sang
Glucose
GLUT-1
GLUT-3
GLUT-4
Glucose
Glucose-6-phosphate
hexokinase (affinit >>)
* sauf dans les rythrocytes (pas de mitochondries)
Glucose
Adipocytes et cellules musculaires
Rserve:
Insuline
(cellules
| pancras)
Glycogne Aides gras Rserve:
GLUT-4
Hyperglycmie
(aprs un repas)
Mtabolisme glucidique
Introduction
La glycolyse
La fermentation alcoolique
La fermentation lactique
Le cycle de Krebs
La voie des pentoses phosphates
Le mtabolisme du glycogne
La noglucogense
Glycolyse
La glycolyse est une squence
de dix ractions enzymatiques
par lesquelles le glucose est
transform en deux molcules
de pyruvate avec production de
deux molcules dATP et de
deux molcules de co-enzyme
NADH/H
+
et une molcule deau.
Le devenir de cet acide
pyruvique en milieu anarobie
est sa transformation en lactate
et, en milieu arobie, en actyl-
CoA. Ce dernier est le carrefour
mtabolique des diffrentes
voies danabolisme et de
catabolisme, notamment des
acides gras.
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphopsphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
ATP
ADP
ATP
ADP
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
ADP
ATP
hexokinase
glucose-6-phosphate isomrase
phosphofructokinase-1
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
pyruvate kinase
X 2
Mg
2+
Mg
2+
H
2
O
Lactose
Maltose
Sacharose
Amidon
Glycogne exogne
sang
Intestin
Cytosol de toutes les
cellules
Etapes de la glycolyse: Synthse du Glucose-6-phosphate
O
OH
OH
HO
HOCH
2
O
OH
OH
HO
CH
2
O
P O
O
-
O
-
O
-
P O P O P O Ado
O O O
-
O O
-
O
-
Mg
O
-
P O P O Ado
O O
-
O O
-
Mg
hexokinase
glucokinase
o |
o-D-glucose
G6P
glucose-6-P
(= rtro-inhibition)
-
ATP
ADP
OH OH
++
++
Etapes de la glycolyse: Synthse du Glucose-6-phosphate
Hexokinase (hexokinase I) :
- non-spcifique du glucose
- affinit leve (K
M
= 0,05 mM)
- absente du foie et pancras
Glucokinase (hexokinase IV) :
- spcifique du glucose
- affinit faible (K
M
= 10 mM)
- spcifique du foie et du pancras
Etapes de la glycolyse: Synthse du Glucose-6-phosphate
Glucose-6-phosphate
Glycolyse
Production de NADPH
(voie des pentoses-phosphates)
Synthse de glycogne
(foie & muscle)
Noglucogense
(foie & rein)
Etapes de la glycolyse: Synthse du Fructose-6-phosphate
O
OH
OH
HO
CH
2
O
P O
O
-
O
-
O
CH
2
OH
OH
HO
OH
CH
2
O
P O
O
-
O
-
glucose-6-phosphate
isomrase
G6P
OH
o
F6P
Cest une raction qui se droule dans des conditions proches de lquilibre.
Seul lanomre o du glucose est transform fructose-6-phosphate (F6P).
Lisomrisation du G6P, passe par la forme ouverte, la formation du F6P ouvert, puis la cyclisation.
Etapes de la glycolyse: Synthse du Fructose-1,6-biphosphate
O
H
2
C
OH
HO
OH
CH
2
O
P O
O
-
O
-
phosphofructokinase-1
F1,6BP
O
CH
2
OH
OH
HO
OH
CH
2
O
P O
O
-
O
-
O P O
-
O
O
-
(PFK-1)
ATP ADP
ADP
AMP
F-2,6BP
ATP
citrate
ac. gras
-
+
F6P
Cet enzyme est commun la plupart des cellules animales normales.
Lion Mg
2+
intervient comme dans la premire tape.
La raction est pratiquement irrversible (AG
P
= - 3,4 kcal/mol).
Etapes de la glycolyse: Synthse des trioses phosphates
O
H
2
C
OH
HO
OH
CH
2
O
P O
O
-
O
-
F1,6BP
O P O
-
O
O
-
CH
2
OPO
3
2-
C
CH
2
OH
O
CH
2
OPO
3
2-
O H
OH H
1
2
3
4
5
6
1
2
3
4
5
6
DHAP
G3P
aldolase
Laldolase, une lyase, catalyse la scission de F1,6BP en 1,3-dihydroxyactone-
phosphate (DHAP) et 3-phosphate-D-glycraldhyde (G3P) (AG
P
= + 5,7
kcal/mol).
Etapes de la glycolyse: Interconversion des trioses phosphates
La raction dinterconversion est proche de lquilibre (AG
P
=
+ 1,8 kcal/mol). La triose-phosphate isomrase convertit un
ctose en aldose qui seul peut tre engag dans la glycolyse.
CH
2
OPO
3
2-
C
CH
2
OH
O
CH
2
OPO
3
2-
O H
OH H
1
2
3
4
5
6
DHAP
G3P
triose phosphate
isomrase
A partir dune molcule de D-glucose, on obtient donc deux
molcules de glycraldhyde-3-phosphate.
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphopsphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
ATP
ADP
ATP
ADP
hexokinase
glucose-6-isomrase
phosphofructokinase-1
aldolase
triose phosphate
isomrase
Mg
2+
Mg
2+
Etapes de la glycolyse: Synthse du 1,3-biphosphoglycrate
CH
2
OPO
3
=
O H
OH H
CH
2
OPO
3
=
O
=
O
3
PO
OH H
1,3-bisphospho
glycrate
NAD
+
NADH + H
+
HPO
4
=
(Pi)
glycraldhyde
3-phosphate
dshydrognase
glycraldhyde-3-phosphate
(AsO
4
3-
)
(As)
Lenzyme est un homottramre (PM = 4 x 150 kDa) qui catalyse une raction
proche de lquilibre, (AG
P
= + 1,5 kcal/mol) et forme une liaison phosphate riche
en nergie qui contribuera la formation dATP.
Lanion arsniate peut entrer en comptition avec le phosphate inorganique pour
former le 1-arsnio-3-phosphoglycrate.
Etapes de la glycolyse: Synthse du 3-phosphoglycrate
Lenzyme transfre de manire catalytique un groupe phosphate
lATP. Il y a formation dune liaison riche en nergie, et libration de
4,5 kcal/mol (AG
P
< 0). Les ions Mg
2+
sont indispensables au bon
fonctionnement de la raction.
CH
2
OPO
3
=
O
=
O
3
PO
OH H
1,3-bisphospho
glycrate
CH
2
OPO
3
=
O
-
O
OH H
3-phosphoglycrate
ADP ATP
phosphoglycrate
kinase
Etapes de la glycolyse: Synthse du 2-phosphoglycrate
Lenzyme catalyse le transfert intramolculaire dun
phosphate.
La phosphoglycrate mutase musculaire est un dimre dont le
mcanisme se caractrise par la formation dun intermdiaire
2,3-bisphosphoglycrate. Le mcanisme daction de la
phosphoglycrate mutase est reprsent la page suivante.
CH
2
OPO
3
=
O
-
O
OH H
3-phosphoglycrate
CH
2
OH
O
-
O
OPO
3
=
H
2-phosphoglycrate
phosphoglycrate
mutase
Etapes de la glycolyse: Synthse du phosphonol pyruvate
CH
2
OH
O
-
O
OPO
3
=
H
2-phosphoglycrate
CH
2
O
-
O
OPO
3
=
phosphonolpyruvate
nolase
Mg
2+
, Mn
2+
H
2
O
Lnolase catalyse la dshydratation de la molcule et redistribue lnergie
au sein de la molcule. La liaison phosphate est alors riche en nergie. En
effet, lnergie dhydrolyse du 2-phosphoglycrate est de 4,18 kcal/mol,
tandis que lhydrolyse du phospho-nolpyruvate libre 14,5 kcal/mol.
Les ions Mg
2+
et Mn
2+
sont indispensables la raction.
Etapes de la glycolyse: Synthse du pyruvate
CH
2
O
-
O
OPO
3
=
phosphonolpyruvate
CH
3
O
-
O
O
pyruvate
ADP
ATP
ATP
F1,6BP
+
-
Mg
2+
La pyruvate kinase permet la formation dun ATP par
rupture de la liaison nergtique. du
phosphonolpyruvate. Cet enzyme allostrique est rgul
positivement par le F1,6BP et ngativement par un
rapport lev dATP/ADP.
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphopsphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
ATP
ADP
ATP
ADP
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
ADP
ATP
hexokinase
glucose-6-phosphate isomrase
phosphofructokinase-1
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
pyruvate kinase
X 2
Mg
2+
Mg
2+
H
2
O
Lactose
Maltose
Sacharose
Amidon
Glycogne exogne
sang
Intestin
Cytosol de toutes les
cellules
C
6
H
12
O
6
+ 2 ADP + 2 P
i
+ 2 NAD
+
2 CH
3
COCOOH + 2 ATP + 2 NADH + 2 H
2
O + 2 H
+
Bilan de la glycolyse
Le NADH produit dans le cytosol rejoindra la matrice
mitochondriale grce un systme de transport utilisant le
malate et loxaloactate. Cest dans la mitochondrie et sous
laction de la phosphorylation oxydative que le NADH sera
oxyd en NAD+ avec production dATP.
Glycolyse et enzymes-cls
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphopsphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
ATP
ADP
ATP
ADP
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
ADP
ATP
hexokinase
glucose-6-phosphate isomrase
phosphofructokinase-1
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
pyruvate kinase
X 2
Mg
2+
Mg
2+
H
2
O
Lactose
Maltose
Sacharose
Amidon
Glycogne exogne
sang
Intestin
Cytosol de toutes les
cellules
Dans une voie mtabolique
complexe, comme la glycolyse, il
existe des enzymes-cls.
Ces enzymes catalysent une raction
fortement exergonique, qui, dans les
conditions intracellulaires est
irrversible.
Ce sont des tapes lentes et
limitantes catalyses par ces
enzymes. Il sagit:
-lhexokinase
-la phosphofructokinase
-la pyruvate kinase
Ces tapes sont particulirement
rgules
Glycolyse et rgulation
Principe gnral de la rgulation dune voie mtabolique:
Les capacits rgulatrices existent diffrents niveaux:
1. au niveau des cellules
2. au niveau des organes
3. au niveau de lorganisme
Glycolyse et rgulation
Principe gnral de la rgulation dune voie mtabolique:
1. Capacits rgulatrices de chaque cellule: Rgulation allostrique
Chaque cellule peut dans une certaine mesure rguler ses voies mtaboliques
de faon autonome par rapport lensemble de lorganisme. Pour cela, les
enzymes-cls sont rguls par des substances dtermines qui sont produites
lintrieur de la cellule et qui signalent diffrents tats critiques (par exemple:
un manque dnergie ou un surplus en nergie).
Il sagit de la rgulation allostrique.
Les buts de cette rgulation intracellulaire sont doubles:
1. Assurer quil se forme autant de produit que ncessaire. Elle
contribue ainsi lhomostasie intracellulaire.
2. Assurer que la cellule ne travaille pas au-del de ses possibilits
malgr les besoin en organisme. Cela constitue une fonction de
protection.
Glycolyse et rgulation
Principe gnral de la rgulation dune voie mtabolique:
2. Capacits rgulatrices des organes
Les voies mtaboliques peuvent remplir diffrentes fonctions selon lorgane
considr. Ces diffrences se remarquent aussi par leurs rgulations
particulires.
Ainsi, le foie joue un rle tout fait spcifique dans la rgulation mtabolique
Dabord il assure la fourniture de glucose dautres organes (par
exemple, le cerveau, les rytrocytes et le muscle).
Ensuite, il dtecte les fortes concentrations de glucose conscutives
un repas et utilise le glucose pour fabriquer le glycogne et des
acides gras, pour les adipocytes.
Glycolyse et rgulation
Principe gnral de la rgulation dune voie mtabolique:
3. Capacits rgulatrices de lorganisme
Comme nous le verrons de manire dtaille au prochain chapitre, lorganisme
produit des hormones pour rguler le mtabolisme. Ces substances parviennent
tous les organes par voie sanguine et transmettent leur information par des
rcepteurs.
Dans le cas dune hormone agissant sur le mtabolisme, les cellules cibles
seront celles qui jouent un rle dans le mtabolisme nergtique, commencer
par le foie. Ce message est transmis la cellule par lintermdiaire dun
messager intracellulaire. Pour les hormones du mtabolisme, il sagit de
lAMPc (adnosine monophosphate cyclique). LAMPc est un activateur
allostrique de la protine kinase A qui phosphoryle une srie denzyme
spcifiques. Cette phosphorylation active ou inactive les enzymes en fonction de
leurs tches.
Un niveau dAMPc lev dans la cellule constitue un signal de faim qui
tmoigne dune glycmie relativement basse! Le glucagon (hormone de
lhypoglycmie et donc de faim) et linsuline (hormone de stress) modifient les
taux dAMPc!
Glycolyse et rgulation allostrique
Principe
Les substances qui tmoignent dune bonne fourniture en nergie
seront des inhibiteurs de la glycolyse: ATP, NADH/H
+
, citrate.
Les substances comme lADP et lAMP, en revanche, servent
dactivateurs de la glycolyse car ils tmoignent dun dficit en nergie
de la cellule
Rgulation de la phosphofructokinase-1 Rgulation de la pyruvate kinase
Exemples de rgulation de 2 enzymes-cls de la glycolyse
Glycolyse et rgulation allostrique et hormonale
Cas particulier: phophofructokinase-1
Comme il sagit de la premire enzyme-cl appartenant la glycolyse
(lhexokinase appartient 4 autres voies mtaboliques), cest le point de contrle le
plus important (enzyme limitante) de toute la voie mtabolique!
Do son nom de chas daiguille de la glycolyse!
En plus de linhibition par lATP, le citrate, lAMP et lADP, il existe dans le foie et
dans le muscle une rgulation spciale, dpendante des hormones, par le
fructose-2,6-biphosphate!
Le fructose-2,6-biphosphate nest observ que dans le foie et dans le muscle.
Il y remplit un rle important comme activateur allostrique puissant de la PFK-1 et
de ce fait acclrateur de la glycolyse.
Cas particulier: phophofructokinase-1
Il sagit dune enzyme bifonctionnelle:
Une partie de lenzyme est la PFK-2
qui catalyse la production de
fructose-2,6-biphosphate
Une autre partie de la mme enzyme,
la fructose-2,6-biphosphatase
rgnre le fructose-6-phosphate
partir dur fructose-2,6-biphosphate.
Cette enzyme bifonctionnelle est
rgule de manire diffrente dans le
foie et les muscles.
La rgulation hormonale et
allostrique est particulirement lie!
O
CH
2
OH
OH
1
2
3
OH
OH
CHOH
4
5
PO
4
--
Fructose-6-phosphate
O
H
2
C
OH
1
2
3
OH
OH
CH
2
4
5
PO
4
--
Fructose-1,6-phosphate
PO
4
--
PFK-1
O
CH
2
OH
PO
4
--
1
2
3
OH
OH
CH
2
4
5
PO
4
--
Glucose-6-phosphate
PFK-2
Fru-2,6-biphosphatase
+
Fructose-2,6-phosphate
Glycolyse et rgulation allostrique et hormonale
Cas particulier: phophofructokinase-1
1.En cas de jene ou de stress
Production de glucagon (jene) ou dadrnaline
(stress)
Augmentation dAMPc
Phosphorylation de lenzyme bifonctionnelle.
A. Foie:
PFK-2 est inactive et fru-2,6-biP active
fructose-2,6-biP diminu et la glycolyse nest
pas acclre
Foie libre le glucose dans le sang pour les
muscles
B. Muscles:
PFK-2 est active et fru-2,6- inactive
fructose-2,6-biP stimule PFK-1 et la glycolyse
Les muscles peuvent utiliser le glucose
O
CH
2
OH
OH
1
2
3
OH
OH
CHOH
4
5
PO
4
--
Fructose-6-phosphate
O
H
2
C
OH
1
2
3
OH
OH
CH
2
4
5
PO
4
--
Fructose-1,6-phosphate
PO
4
--
PFK-1
O
CH
2
OH
PO
4
--
1
2
3
OH
OH
CH
2
4
5
PO
4
--
Glucose-6-phosphate
PFK-2
Fru-2,6-biphosphatase
+
Fructose-2,6-phosphate
Glycolyse et rgulation allostrique et hormonale
Cas particulier: phophofructokinase-1
2. Aprs un repas (plthore de glucose)
Production dinsuline
Baisse dAMPc
Dphosphorylation de lenzyme bifonctionnelle.
A. Foie:
PFK-2 est active et fru-2,6-biP inactive
Glycolyse est acclre
Synthse de glycogne stimule
Production dactyl Co-A et transformation en
acides gras et stockage sous forme de graisses
B. Muscles:
PFK-2 est inactive et fru-2,6-biP active
Le muscle se repose (glycolyse freine)
Le muscle met en rserve le glucose sous
forme de glycogne
O
CH
2
OH
OH
1
2
3
OH
OH
CHOH
4
5
PO
4
--
Fructose-6-phosphate
O
H
2
C
OH
1
2
3
OH
OH
CH
2
4
5
PO
4
--
Fructose-1,6-phosphate
PO
4
--
PFK-1
O
CH
2
OH
PO
4
--
1
2
3
OH
OH
CH
2
4
5
PO
4
--
Glucose-6-phosphate
PFK-2
Fru-2,6-biphosphatase
+
Fructose-2,6-phosphate
Glycolyse et rgulation allostrique et hormonale
Comme nous lavons vu, deux hormones principales rgulent la glycolyse: le
glucagon et linsuline. Comme ces hormones fonctionnent dans lensemble de
lorganisme, il est important de distinguer les organes cibles.
Rgulation hormonale
Le glucagon
est scrt en cas dhypoglycmie ( ltat de jene)
par les cellules alpha des lots de Langerhans du
pancras.
Augmente lAMPc (= signal de faim) dans le foie!
Phosphorylation des enzymes-cls (PFK-2,
pyruvate-kinase)
Inhibition de la glycolyse
Arrt du catabolisme du glucose
Conservation du glucose qui sera mtabolis
par les organes et cellules qui en ont besoins:
cerveau, rythrocytes et le muscle
Le glucagon agit au
niveau du foie!
Comme nous lavons vu, deux hormones principales rgulent la glycolyse: le
glucagon et linsuline. Comme ces hormones fonctionnent dans lensemble de
lorganisme, il est important de distinguer les organes cibles.
Rgulation hormonale
Linsuline
est scrte en cas dhyperglycmie (post-prandiale)
par les cellules | des lots de Langerhans du
pancras.
Diminution de lAMPc dans le foie, les muscles et
les adipocytes!
Dphosphorylation des enzymes-cls.
Activation de la glycolyse dans le foie et les
adipocytes ou le glucose est transform en substances
de rserve (glycogne et triglycrides)
Le muscle reste au repos et synthtise du glycogne
mais nutilise que peu la glycolyse.
Rgulation hormonale: conclusion
Le rle du glucagon est
llvation de la glycmie.
Comme cette lvation ne peut
provenir que dune production
hpatique, le glucagon agit
principalement sur cet organe
Linsuline fait baisser la glycmie
grce son action sur un grand
nombre de tissus-cibles: foie,
muscle, adipocytes
Incorporation des autres sucres dans la glycolyse: fructose
Le fructose est absorb tel quel ou
provient de l'hydrolyse du
saccharose par l'invertase. Grce
un transporteur (GLUT-5) spcifique
du fructose et indpendant de
linsuline, la majorit du fructose
pntre dans la cellule hpatique.
Sa rsorption ne ncessite donc
pas la prsence dinsuline. Aprs
rsorption, il peut tre incorpor
dans la glycolyse par l'action d'une
hexokinase qui le transforme en
fructose-6-phosphate (F6P) au
dpend d'ATP.
Dans le foie, l'hexokinase n'est pas
prsente, et la glucosidase ne peut
utiliser le fructose. Il y a alors
intervention d'une fructokinase et
d'une fructose-1-phosphate
aldolase.
O
CH
2
OH
OH
HO
OH
CH
2
O
P O
O
-
O
-
O
CH
2
OH
OH
HO
OH
HOH
2
C
fructose
O
CH
2
OH
HO
OH
HOH
2
C
O P O
-
O
O
-
ATP ADP
fructokinase
(foie)
hexokinase
CH
2
OPO
3
2-
C
CH
2
OH
O
CH
2
OPO
3
2-
O H
OH H
4
5
6
DHAP
G3P
F1P aldolase
CH
2
OH
O H
OH H
triose
kinase
ATP
ADP
1
2
3
4
5
6
1
2
3
glycraldhyde
glycolyse
triose-P
isomrase
ATP
ADP
F6P
F1P
Mg
2+
Incorporation des autres sucres dans la glycolyse: galactose
La lactase intestinale
hydrolyse le lactose en D-
glucose et en D-galactose
qui sont rsorbs et
vhiculs vers la
circulation sanguine.
Au niveau du foie, le
galactose est phosphoryl,
puis transform en
glucose-1-phosphate sous
l'action d'une transfrase
en prsence de glucose-
UDP. La
phosphoglucomutase
permet la formation de
glucose-6-phosphate
(G6P) qui est incorpor
dans la glycolyse. Le
galactose-UDP est ensuite
recycl par une pimrase.
O
OH
OH
OH
HOCH
2
|-D-galactose
O
OH
OH
HO
=
O
3
POH
2
C
OH
G6P
HO
O
OPO
3
=
OH
OH
HOCH
2
HO
O
O-UDP
OH
OH
HOCH
2
HO
O
OPO
3
=
OH
OH
HOCH
2
HO
O
O-UDP
OH
OH
HOCH
2
HO ATP
ADP
galactokinase
(foie)
galactose
1-phosphate
uridyltransfrase
UDP-glucose
4'-pimrase
phosphoglucomutase
G1P
La galactosmie est une maladie gntique caractrise par des dficiences
enzymatiques dans le mtabolisme du galactose et notamment celle de la
galactose-1-phosphate uridyl transfrase (GALT). Il y a accumulation de
galactose-1-phosphate qui se transforme en D-galacticol (ou D-dulcitol) qui
provoque des troubles de la vue et une atteinte hpatique parfois fatale.
Bilan complet de la glycolyse
Le bilan de la glycolyse est le mme quel que soit la nature de l'hexose mtabolis.
Bilan complet de la glycolyse
Lors de la glycolyse, il y a consommation d'un hexose (glucose,
fructose ou galactose), de deux ATP et de deux NAD+. Par contre, il y
a synthse de quatre molcules d'ATP et de deux pyruvates.
Le G
P
de la glycolyse est de -8,7 kcal.mol
-1
C'est donc une raction
irrversible.
Le G rel mesur dans les rythrocytes est de -17,3 kcal.mol
-1
Mtabolisme glucidique
Introduction
La glycolyse
La fermentation alcoolique
La fermentation lactique
Le cycle de Krebs
La voie des pentoses phosphates
Le mtabolisme du glycogne
La noglucogense
En absence d'oxygne
(anarobiose), la levure
(champignon unicellulaire apte
provoquer la fermentation) transforme
le pyruvate en thanol.
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphopsphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
ATP
ADP
ATP
ADP
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
ADP
ATP
hexokinase
glucose-6-phosphate isomrase
phosphofructokinase-1
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
pyruvate kinase
Mg
2+
Mg
2+
H
2
O
Lactose
Maltose
Sacharose
Amidon
Glycogne exogne
sang
Intestin
Cytosol de toutes les
cellules
Ethanol
Fermentation lactique
Par molcule de glucose, il y a reformation de deux NAD+ qui
avaient t consomms lors de la formation du 1,3-
bisphosphoglycrate.
Le mcanisme d'action de la pyruvate dcarboxylase est complexe.
Au del d'une certaine concentration, l'alcool produit a un effet ltal
sur la souche de levure.
Il est clair que la fermentation alcoolique est absente chez les
mammifres !
Mtabolisme glucidique
Introduction
La glycolyse
La fermentation alcoolique
La fermentation lactique
Le cycle de Krebs
La voie des pentoses phosphate
Le mtabolisme du glycogne
La noglucogense
La plupart des espces ne possdent
pas de pyruvate dcarboxylase. En
anarobiose, le pyruvate sera
converti en lactate.
Cette situation se rencontre par
exemple dans la corne et lors de
contractions musculaires rapides qui
puisent rapidement l'oxygne
disponible (ou dans les cellules o il
ny a pas de mitochondrie).
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphopsphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
ATP
ADP
ATP
ADP
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
ADP
ATP
hexokinase
glucose-6-phosphate isomrase
phosphofructokinase-1
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
pyruvate kinase
Mg
2+
Mg
2+
H
2
O
Lactose
Maltose
Sacharose
Amidon
Glycogne exogne
sang
Intestin
Cytosol de toutes les
cellules
Ac lactique
Fermentation lactique
Par molcule de glucose, il y a reformation de deux NAD+ qui
avaient t consomms lors de la formation du 1,3-
bisphosphoglycrate.
Le lactate gagne ensuite le foie o il sera retransform en pyruvate
par la LDH hpatique. Le pyruvate sera ensuite dgrad avec
libration de CO
2
(voir cycle de Krebs), transform en alanine pour
servir de prcurseur la synthse des protines ou utilis lors de la
gluconogense
Principaux producteurs de lactate:
Ne possdent pas de
mitochondries!
La glycolyse anarobie est la
seule possibilit de produire
de lnergie.
Les rythrocytes gagnent
donc seulement deux ATP
par glucose
Effort physique intense:
Si la consommation de sucre
devient suprieure l'apport
en oxygne
Ces cellules ne savent lutiliser et librent ensuite le lactate dans la
circulation sanguine!
Lactate dshydrognase se prsente sous diffrentes formes molculaires dans les
diffrents organes: 5 isoenzymes.
La molcule de LDH est constitue de 2 diffrentes sous units de type M (muscle) ou H
(Heart). Une enzyme est compose de 4 sous-units.
Lisoenzyme du muscle: LDH-5: catalyse une rduction rapide du pyruvate en lactate
Lisoenzyme du cur: LDH-1: catalyse une oxydation rapide du lactate en pyruvate
La raction catalyse par la
lactate dshydrognase
conduit une impasse mais
elle nest pas sens unique!
Le foie et le cur sont en
mesure de roxyder le lactate
en pyruvate par la LDH. Le
pyruvate est ensuite
transform en glucose
(rutilisable par les cellules)
ou en glycogne au niveau
hpatique.
H
3
C C
O
COOH
H
3
C C
OH
COOH
Glucose
LDH
Cycle de Krebs
ATP
Glycogne
Le lacate est gnr au sein de cellules
musclulaires et des rythrocytes puis
libr dans le sang (il ne sait rien en
faire).
Au sein du foie, le lactate est converti en
pyruvate qui suit la voie de la
noglucogense qui aboutit:
Soit la formation de glycogne
(rserve).
Soit la formation de glucose qui peut
tre utilis par les cellules musculaires (si
elles sont en plein travail).
Ce cycle de transfert du lactate du muscle
du foie pour y tre transform en glucose
et transfert du glucose en retour vers le
muscle est dsign comme le cycle des
Corti en lhonneur de Gerty et Carl Cori.
Glucose
lactate
Glucose
lactate
Cycle de corti
Bien que la lactate dshydrognase soit une enzyme intracellulaire, on en trouve
dans le sang en quantit non ngligeable. La raison est quil se produit en
permanence un turn-over des cellules comme les globules rouges qui libre leur
lactate dshydrognase. En cas de quantit trop importante de LDH sanguine, il faut
recherche une pathologie responsable de la destruction de cellule.
Lyse cellulaire
LDH
sanguine
Comme la LDH est abondante dans les globules rouges, elle peut servir de
marqueur de l'hmolyse. Un chantillon sanguin qui aurait t trait de faon
incorrecte peut avoir des actvits leves faussement-positives de LDH cause
des dommages aux rythrocytes.
LDH et biologie clinique
D'autres applications du dosage de l'activit de la LDH concernent la destruction des
tissus en gnral ; cela est possible s'il n'y a pas d'autres indices d'hmolyse.
On l'utilise pour le suivi des patients cancreux (en particulier en cas de lymphome),
vu que les cellules cancreuses se renouvellent rapidement, ce qui fait que les cellules
dtruites entranent un taux lev de LDH.
Les LDH sont augmentes dans
Les affections musculaires et cardiaques (notamment LDH-1) (l'infarctus de myocarde
(comme les CPK et les transaminases), les myocardites, les tats de choc
prolongs,
Les maladies musculaires (dermato/polymyosites, dystrophies musculaires)
Les affections hpatiques
Les maladies pulmonaires (embolie pulmonaire, infections pulmonaires diffuses(
tuberculose, pneumocystose, toxoplasmose,..)
Les maladies hmatologiques (toutes les anmies hmolytiques, etc)
LDH et biologie clinique
Mtabolisme glucidique
Introduction
La glycolyse
La fermentation alcoolique
La fermentation lactique
Le cycle de Krebs
La voie des pentoses phosphates
Le mtabolisme du glycogne
La noglucogense
Dans les cellules fonctionnant en
milieu arobie, le pyruvate peut tre
compltement oxyd en CO
2
et H
2
O
par plusieurs tapes enzymatiques au
cours desquelles l'nergie sera
rcupre sous forme de composs
hautement nergtiques (NADH/H
+
,
ATP, FADH
2
).
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphopsphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
ATP
ADP
ATP
ADP
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
ADP
ATP
hexokinase
glucose-6-phosphate isomrase
phosphofructokinase-1
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
pyruvate kinase
Mg
2+
Mg
2+
H
2
O
Lactose
Maltose
Sacharose
Amidon
Glycogne exogne
sang
Intestin
Cytosol de toutes les
cellules
Cycle de
krebs
Mitochondrie
La glycolyse s'effectue dans le cytosol, tandis que le cycle de krebs se droule
dans la mitochondrie. Le pyruvate va traverser la membrane mitochondriale
externe qui est permable aux molcules dont le PM < 10.000. Ensuite, par un
symport, le pyruvate va traverser la membrane mitochondriale interne en prsence
d'un proton.
pyruvate
CoA-SH
CoA-S-CO-CH
3
H
+
+ NADH
NAD
+
oxaloactate
citrate
isocitrate
o-ctoglutarate succinyl-CoA
succinate
fumarate
L-malate
NAD+
NADH + H
+
CoA-SH
NAD
+
H
+
+ NADH
GDP
GTP
Pi
CoA-SH
FADH
2
NAD
+
NADH + H
+
citrate
synthase
aconitase
isocitrate
dshydrognase
o-ctoglutarate
dshydrognase
succinyl-CoA
synthtase
succinate
dshydrognase
fumarase
malate
dshydrognase
pyruvate
dshydrognase
ADP
ATP
CoA-SH
CO
2
CO
2
FAD
H
2
O
CO
2
H
2
O
Chaque molcule de glucose fournit deux molcules de pyruvate qui produiront
chacune un ATP, un FADH
2
et 4 molcules de NADH/H
+
qui seront rgnres par
la phosphorylation oxydative qui produira d'importantes quantits d'ATP.
Etapes du cycle de Krebs: Synthse de l'actyl-CoA
La dcarboxylation du pyruvate et sa transformation en
actyl-CoA est ralise par un complexe
multienzymatique appel pyruvate dshydrognase qui,
pour E. Coli, contient 3 protines enzymatiques
5 co-enzymes!
Etapes du cycle de Krebs: Synthse de l'actyl-CoA
Enzyme rgul par:
Rgulation allostrique
ADP, NAD et CoA activent
ATP, NADPH et Actyl-CoA inhibent
Phosphorylation
PDH kinase phosphoryle la PDH et linactive
PDH phosphatase dphosphoryle la PDH
phosphoryle
Pyruvate dshydrognase: rgulation
PDH-P PDH
Active
Inactive
PDH kinase
PDH phosphatase
+
Ca
2+
+ ATP
NADH/H
Actyl-CoA
- Pyruvate
Etapes du cycle de Krebs: Synthse du citrate
La synthse du citrate
est ralise partir de
l'actyl-CoA et de
l'oxaloactate par la
citrate synthtase.
L'oxaloactate se fixe
d'abord sur l'enzyme,
l'arrive de l'actyl-
CoA provoque alors
une modification de la
conformation qui
permet la raction.
Cette raction est
assiste par un
catalyseur basique qui
enlve un proton de
l'actyle.
Etapes du cycle de Krebs: Synthse de l'isocitrate
Le citrate est convertit en isocitrate par une raction daddition/limination
rversible ralise par l'aconitase.
La premire tape consiste en l'limination d'une molcule d'H
2
O du citrate
pour former le cis-aconitate, ensuite ce dernier est transform en citrate.
Le site actif de l'aconitase est asymtrique, et permet de diffrentier les deux
groupements CH
2
-COO. C'est l'isomre 2R, 3S qui est form.
Etapes du cycle de Krebs: Synthse de l'-ctoglutarate
L'isocitrate dshydrognase catalyse l'oxydation de l'isocitrate en
oxalosuccinate, puis la libration de CO
2
. Cette raction est biphasique et
ncessite l'intervention du NAD
+
.
La premire tape est la rduction de la fonction alcool en ctone. La
deuxime tape est une dcarboxylation non-enzymatique.
Etapes du cycle de Krebs: Synthse du succinyl-CoA
L'-ctoglutarate est transform en succinyl-CoA par un complexe multi-
enzymatique appel -ctoglutarate dshydrognase. Le mcanisme est
analogue celui qui assure la transformation du pyruvate en actyl-CoA
(voir la synthse de l'actyl-CoA).
Il s'agit de la deuxime tape de dcarboxylation qui s'accompagne
galement de la production de NADH.
Cette raction est irrversible d'un point de vue mtabolique (G
P
= 8,82
kcal.mol
-1
).
Etapes du cycle de Krebs: Synthse du succinyl-CoA
Le complexe de l'-ctoglutarate dshydrognase ressemble fortement au
complexe de pyruvate dshydrognase. En effet, les dihydrolipoamide-
deshydrognases sont similaires.
Etapes du cycle de Krebs: Synthse du succinate
La succinyl-CoA synthtase va permettre la rcupration de l'nergie du lien
thioester par formation d'un nuclotide triphosphate qui est gnralement de
GTP chez les mammifres et l'ATP chez les plantes et bactries.
Etapes du cycle de Krebs: Synthse du fumarate
La succinate dshydrognase catalyse l'oxydation du succinate en fumarate
avec rduction concomitante du FAD. Le FAD est li par covalence
l'enzyme qui est lui-mme intgr dans la membrane interne de la
mitochondrie. Les autres enzymes du cycle du citrate sont solubles dans la
matrice mitochondriale.
Etapes du cycle de Krebs: Synthse du L-malate
La fumarase catalyse l'addition strospcifique d'une molcule d'H
2
O sur la
double liaison du succinate pour obtenir du L-malate (configuration S).
Etapes du cycle de Krebs: Synthse de l'oxaloactate
La malate dshydrognase catalyse l'oxydation du L-malate en oxaloactate
avec intervention du NAD
+
.
Bilan de la glycolyse
et du cycle de Krebs
Le bilan chimique dune molcule de D-glucose qui subit la glycolyse et dont
le pyruvate est engag dans le cycle de Krebs prsente le bilan ractionnel
suivant :
Pour que la glycolyse et le cycle de Krebs se poursuivent, il sera ncessaire
de rgnrer le FAD et la NAD+. Cette oxydation aura lieu par une chane
transporteuse d'lectrons qui permettra la synthse d'ATP supplmentaire.
Mtabolisme glucidique
Introduction
La glycolyse
La fermentation alcoolique
La fermentation lactique
Le cycle de Krebs
La voie des pentoses phosphates
Le mtabolisme du glycogne
La noglucogense
La voie des pentoses phosphates
est troitement imbrique dans la
glycolyse et remplit deux rles
importants:
1. Elle libre le ribose-5-phosphate:
matriau de base de la synthse
de tous les nuclotides
2. Elle produit des quivalents
rduits sous forme de NADPH/H
+
,
ncessaires pour
1. la biosynthse des acides
gras du cholestrol,
hormones, acides gras;
2. pour les biotransformation
dans le foie (cyt P450);
3. dtoxification des peroxydes
dans les rythrocytes.
Elle se droule dans le cytosol de
toutes les cellules
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphopsphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
ATP
ADP
ATP
ADP
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
ADP
ATP
hexokinase
glucose-6-phosphate isomrase
phosphofructokinase-1
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
pyruvate kinase
X 2
Mg
2+
Mg
2+
H
2
O
Lactose
Maltose
Sacharose
Amidon
Glycogne exogne
sang
Intestin
Cytosol de toutes les
cellules
2 NADP 2 NADPH
ribulose-5-phosphate
ribose-5-phosphate
Rles du NADPH/H
+
dans les
biosynthses rductrices
5 organes utilisent le NADPH/H
+
pour
leur biosynthse:
Foie: biosynthse du cholestrol et des
acides gras.
Tissus adipeux: biosynthse des
acides gras.
Glandes mammaires: biosynthse des
acides gras constituant du lait
Glandes surrnales: biosynthse des
strodes (glucocorticode, aldostrone
et hormones sexuelles) partir du
cholestrol.
Testicules et ovaires: biosynthse des
hormones sexuelles partir du
cholestrol.
Rles du NADPH/H
+
dans les
processus de protection et
dlimination
Dans les rythrocytes:
restauration (rduction) du
glutathion et donc la
protection contre les
oxydations.
Dans le foie:
Participation aux ractions dhydroxylations
dans le cadre des biotransformations
permettant llimination de substances non
solubles endognes (bilirubine, sels biliaires,
hormones strodiennes) ou exognes
(mdicaments)
Le glutathion et les rythrocytes
Protection des rythrocytes: altration du systme
Exemple:
Dficit en glucose-6-phosphate
dshydrognase
O
CH
2
OH
OH
OH
OH
--
O
4
P
Glucose-6-phosphate
glucose-6-phosphate
dshydrognase
O
CH
2
OH
OH
OH
--
O
4
P
6-phospho-gluconolactone O
NADP
+
NADPH/H
+
OH
CH
2
OH
OH
OH
--
O
4
P
6-phospho-glucononate
O
OH
H
2
O
H
+
gluconolactonase
6-phospho-gluconate
dshydrognase
NADP
+
NADPH/H
+
H
2
C PO
4
--
HC OH
HC OH
C O
H
2
C OH
ribulose-5-phosphate
Une des maladies hrditaires les plus frquentes
100 millions de personne (40% en Sardaigne!)
NADPH/H
+
Pas de rgnration de la forme rduite de
glutathion
Lsions des membranes des rythrocytes par les
radicaux libres
Anmie hmolytique svre
Relativement inoffensive en conditions normales
En cas de stress oxydant (infection, certains
mdicaments comme laspirine) => crise hmolytique
svre: Douleur, fatigue (asthnie), fivre, frissons,
chute de lhmatocrite.
Le glutathion et les rythrocytes
Protection des rythrocytes: altration du systme
Exemple:
Dficit en glucose-6-phosphate
dshydrognase
Le favisme
Prise alimentaire de fve
Les personnes atteintes de favisme prsentent un dficit
en glucose-6-phosphate dshydrognase (G6PD), une
affection des globules rouges. Elles sont en rgle gnrale
en bonne sant, mais une anmie hmolytique
(destruction rapide des globules rouges) peut apparatre
chez elles suite lingestion de certaines substances
dclenchantes. Ces dernires sont essentiellement des
mdicaments, mais les fves en font galement partie,
do le nom de favisme. Le dficit en G6PD est rare en
Europe du Nord, mais plus frquent dans les pays qui
bordent la mer Mditerrane (sardaigne).
=> Il est recommand toute personne prsentant un
dficit en G6PD dapprendre reconnatre les fves et de
les supprimer sous toutes leurs formes (fraches, sches,
en farine ...).
Mtabolisme glucidique
Introduction
La glycolyse
La fermentation alcoolique
La fermentation lactique
Le cycle de Krebs
La voie des pentoses phosphates
Le mtabolisme du glycogne
La noglucogense
Glycogne: Gnralits
polymre de D-glucose prsent chez les animaux. Il constitue la forme de
stockage le glucose
Il est prsent dans le foie et le muscle chez lHomme.
C est un polymre ramifi de o-D-maltose. Environ tous les 15 rsidus, une
chane de 10-18 oses est branche par une liaison o-16. Les rsidus des
chanes linaires sont relis entre-eux par un lien de type o-14.
Le glycogne est beaucoup plus ramifi que lamylopectine.
Le glycogne alimentaire est dit exogne.
Le glycogne hpatique ou musculaire est dit endogne.
La digestion du glycogne alimentaire est similaire celle de lamidon
Digestion alimentaire du glycogne:
La |-amylase (exoglycosidase)
dbite des units de maltose partir
des extrmits non-rductrices
(liens o-14).
L o-amylase scinde au hasard
(endoglycosidase) les liaisons o-
14 jusqu la formation de
dextrines limites (3 x 12 oses).
Lamylo-o-(16)-glucosidase
coupe les liaisons responsables de la
ramification.
Ces enzymes sont prsentes dans la
salive et dans le suc pancratique
|-amylase
o-amylase
amylo-o(1->6)-glucosidase
OH
Source endogne de glucose:
Le corps humain peut emmagasiner 400g de glucose,
essentiellement sous forme de glycogne au niveau des
muscles et du foie
(concentration de glucose dans le sang est de 0.7 0.9g/l
pour 5 litres de sang, ce qui correspond 5g circulant, ce
qui ridicule par rapport aux 400g.
150 g stocks 250-300 g stocks
Le corps humain utilise 160g de glucose/jour
(dont 120g pour le cerveau). Les rserves sont
donc pratiquement puises en 24h.
Biosynthse du glycogne
La synthse du glycogne sopre partir du glucose-1-phosphate. Celui-ci
provient de la transformation du glucose-6-phosphate (G6P) sous laction de
la phosphoglucomutase.
Le glucose-1-phosphate (G1P) ragira avec lUTP pour former de lUDP-
glucose et du pyrophosphate (PPi). Ce dernier sera hydrolys par la
pyrophosphatase. La glycogne synthtase assurera le transfert du glucose
sur une amorce de glycogne.
La glycogne synthtase est ltape limitante de la synthse. Cet enzyme
ajoute des rsidus de glucose (liaison ,14), tandis que la phosphorylase
dbite les rsidus glucose au mme endroit.
Les chanes linaires
Biosynthse du glycogne
Les ramifications
Il existe une enzyme spcifique, lamylo-(1,41,6)-glucosyltransfrase qui
branche des parties de 6 7 molcules de glucose et la lie au C-6 dun glucose
situ plus avant sur la chaine.
Catabolisme du glycogne
Le catabolisme du glycogne emprunte
une autre voie que la biosynthse!
Il fournit directement le glucose-1-
phosphate.
Sous laction de la
phosphoglucomutase, le glucose-1-
phosphate synthtis est transform
dans le cytosol en glucose-6-
phosphate. Ce dernier rejoint alors la
glycolyse.
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphopsphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
ATP
ADP
ATP
ADP
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
ADP
ATP
hexokinase
glucose-6-phosphate isomrase
phosphofructokinase-1
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
pyruvate kinase
X 2
Mg
2+
Mg
2+
H
2
O
Lactose
Maltose
Sacharose
Amidon
Glycogne exogne
Glucose-1-phosphate
UDP-glucose
Glycogne
phosphoglucomutase
glycogne
synthtase
glycogne
phosphorylase
Rgulation du mtabolisme du glycogne
Parmi les enzymes participant au mtabolisme du glycogne,
deux seulement sont rguls:
1. La glycogne synthase (anabolisme)
2. La glycogne phosphorylase (catabolisme)
La rgulation peut seffectuer
de manire allostrique (au niveau musculaire)
de manire hormonale (au niveau du foie et des muscles)
Rgulation du mtabolisme du glycogne
La rgulation allostrique au niveau musculaire
Augmentation de lAMP active la phosphorylase
Situation qui correspond un dficit en ATP qui est
compens par une augmentation du catabolisme du
glycogne
Augmentation de lATP et de G6P inhibe la phosphorylase
Situation qui tmoigne de la quantit suffisante dnergie et de
glucose
Le calcium peut aussi stimuler la dgradation du glycogne: quand le
muscle travaille, le calcium y augmente. Le glucose est ncessaire. Le
complex calcium-calmoduline active la glycogne phosphorylase
Rgulation du mtabolisme du glycogne
La rgulation hormonale
Insuline
Glucagon
Adrnaline
AMPc
= signal de dtresse:
faim ou fuite
Qui phosphoryle diffrents enzymes
Le glucagon (pour le foie) et ladrnaline (pour les muscles) augmentent
la concentration dAMP cyclique (AMPc) qui par une cascade
dvnements active la glycogne phosphorylase, inactive la glycogne
synthtase et donc favorise llvation de la glycmie.
Linsuline diminue la concentration dAMP cyclique (AMPc) qui assure une
dphosphorylation des enzymes cls:
La glycogne synthase est active par dphosphorylation et fabrique du
glycogne.
La phosphorylase est au contraire inhibe.
Mtabolisme glucidique
Introduction
La glycolyse
La fermentation alcoolique
La fermentation lactique
Le cycle de Krebs
La voie des pentoses phosphate
Le mtabolisme du glycogne
La noglucogense
Noglucogense
Biosynthse endogne de glucose partir de composs non
glucidiques
Bien quelle consomme de lnergie, elle est ncessaire dans le cerveau
et les rythrocytes qui consomment 160g de glucose par jour! Le
cerveau consomme 120g.
Aprs une absence dapport nergtique de 18 heures environ,
lorganisme a puis une grande partie de la rserve de glycogne. Il se
met produire du glucose partir de prcurseurs non glucidiques tels
que le pyruvate, le lactate, le glycrol ou certains acides amins.
Noglucogense
Biosynthse endogne de glucose partir de composs non
glucidiques
Trois organes sont le sige de la noglucogense: foie (90%), reins (10%)
(cortical rnale) (et intestin: cellules pithliales de lintestin grle).
Les 3 organes sont les seuls possder la glucose-6-phosphatase, seul
moyen pour une cellule de librer le glucose partir du glucose-6-
phosphate.
La plupart des ractions
de la glycolyse sont
rversibles et
fonctionnent au cours
de la noglucogense
Les trois ractions cls
de la glycolyse sont
irrversibles:
-hexokinase
-phosphofructokinase
-pyruvate kinase
Noglucogense
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphopsphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
ATP
ADP
ATP
ADP
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
ADP
ATP
hexokinase
glucose-6-phosphate isomrase
phosphofructokinase-1
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
pyruvate kinase
X 2
Mg
2+
Mg
2+
H
2
O
Lactose
Maltose
Sacharose
Amidon
Glycogne exogne
Glucose-1-phosphate
UDP-glucose
Glycogne
phosphoglucomutase
glycogne
synthtase
glycogne
phosphorylase
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphosphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
Pi
P
i
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
GDP
GTP
glucose-6-phosphatase
glucose-6-phosphate
isomrase
fructose 1,6-bisphosphatase
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
PEP carboxykinase
X 2
Oxaloactate
ATP
ADP + P
i
Pyruvate
carboxylase
H
2
O
H
2
O
Mg
2+
Mg
2+
H
2
O
CO
2
CO
2
H
2
O
Navette de l oxaloactate
La conversion du pyruvate en oxaloactate lieu dans la mitochondrie. Les autres
enzymes ncessaires la gluconogense sont cependant prsentes dans le cytosol.
Une fois dans le cytosol, loxaloactate est utilis dans la gluconogense. Le
NADH/H
+
produit dans le cytosol est recycl lors de la transformation du 1,3-
bisphosphoglycrate en glycraldhyde-3-phosphate.
-
OOC-CH
2
-CO-COO
-
NADH + H
+
-
OOC-CH
2
-CHOH-COO
-
NAD
+
-
OOC-CH
2
-CHOH-COO
-
-
OOC-CH
2
-CO-COO
-
NAD
+
NADH + H
+
CYTOSOL
MITOCHONDRIE
malate
dshydrognase
malate
dshydrognase
Bilan de la noglucogense
partir du pyruvate
(pyruvate)
C
6
H
12
O
6
+ 4 ADP + 2 GDP + 6 P
i
+ 2 NAD
+
(glucose)
AG = - 9,0 kcal/mol
2 CH
3
COCOOH + 4 ATP + 2 GTP + 2 NADH + 2 H
+
Substrats de la noglucogense
Lactate: provenant du mtabolisme
des rythrocytes et du mtabolisme
anarobie
Alanine et autres acides amins:
substrats de jene, provenant du
muscle
Glycrol: provenant de la
dgradation des graisses
Substrats de la noglucogense
Lactate
Alanine
Glycrol
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphosphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
Pi
P
i
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
GDP
GTP
glucose-6-phosphatase
glucose-6-phosphate
isomrase
fructose 1,6-bisphosphatase
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
PEP carboxykinase
X 2
Oxaloactate
ATP
ADP + P
i
Pyruvate
carboxylase
H
2
O
H
2
O
Mg
2+
Mg
2+
H
2
O
CO
2
CO
2
H
2
O
LDH
Noglucogense
partir du lactate
Dans le cytosol, le lactate est converti en pyruvate sous laction de
la LDH. Le pyruvate est ensuite transport vers la matrice
mitochondriale o il peut subir la gluconogense expose plus
haut. Le NADH/H
+
form est utilis lors de la transformation du
1,3-bisphosphoglycrate en glycraldhyde-3-phosphate.
NAD
+
NADH + H
+
lactate
pyruvate
lactate
dshydrognase
CH
3
-CHOH -COO
-
CH
3
-CO- COO
-
Noglucogense
partir du glycrol
Le glycrol est
phosphoryl par une
kinase en glycrol-1-
phosphate. Il subit
ensuite une oxydation en
dihydroxyactone
phosphate (DHAP) soit
par une dshydrognase
cytosolique qui utilise le
NAD
+
, soit par une
dshydrognase flavine
intgre dans la
membrane interne de la
mitochondrie.
CH
2
OH
CHOH
CH
2
OH
CH
2
OH
CHOH
CH
2
OPO
3
=
CH
2
OH
C
CH
2
OPO
3
=
O
NAD
+
NADH + H
+
FADH
2
P
i
MATRICE
MITOCHONDRIALE
CYTOSOL
glycrol
kinase
glycrol-3-phosphate
dshydrognase
glycrol
DHAP
FAD
Noglucogense
partir des acides amins
Chez les mammifres, lalanine et la glutamine sont les principaux
acides amins qui servent de substrat la noglucogense. Les
transaminases jouent un rle essentiel dans le processus.
CH
3
-CH-COOH HOOC-CH
2
-CH
2
-C-COOH
CH
3
-C-COOH HOOC-CH
2
-CH
2
-CH-COOH
glutamate-alanine
transaminase
GLUCONEOGENESE
NH
2
O
NH
2
O
Rgulation de la noglucogense
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphosphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
Pi
P
i
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
GDP
GTP
glucose-6-phosphatase
glucose-6-phosphate
isomrase
fructose 1,6-bisphosphatase
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
PEP carboxykinase
X 2
Oxaloactate
ATP
ADP + P
i
Pyruvate
carboxylase
H
2
O
H
2
O
Mg
2+
Mg
2+
H
2
O
CO
2
CO
2
H
2
O
La noglucogense est rgule au
niveau de ses trois enzymes-cls:
-la pyruvate carboxylase
-la phospho-nol-pyruvate
carboxykinase (PEPCK)
-la fructose 1,6-biphosphatase
Rgulation de la noglucogense
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphosphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
Pi
P
i
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
GDP
GTP
glucose-6-phosphatase
glucose-6-phosphate
isomrase
fructose 1,6-bisphosphatase
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
PEP carboxykinase
X 2
Oxaloactate
ATP
ADP + P
i
Pyruvate
carboxylase
H
2
O
H
2
O
Mg
2+
Mg
2+
H
2
O
CO
2
CO
2
H
2
O
Rgulation allostrique:
La pyruvate carboxylase travaille
en prsence dactyl-CoA
uniquement!
Les cellules hpatiques ne
sengagent dans la
noglucogense que sil y a
suffisamment dnergie, sous
forme dactyl-CoA.
Rgulation de la noglucogense
Glucose
Glucose-6-phosphate
Fructose-6-phosphate
Fructose-1,6-bisphosphate
Dihydroxyactone
phosphate
D-Glycraldhyde
-3-phosphate
Pi
P
i
1,3-Bisphosphoglycrate
3-Phosphoglycrate
2-Phosphoglycrate
Phosphonolpyruvate
Pyruvate
Pi
NAD
+
NADH + H
+
ATP
ADP
GDP
GTP
glucose-6-phosphatase
glucose-6-phosphate
isomrase
fructose 1,6-bisphosphatase
aldolase
triose phosphate
isomrase
glycraldhyde-3-P
dshydrognase
phosphoglycrate kinase
phosphoglycrate mutase
nolase
PEP carboxykinase
X 2
Oxaloactate
ATP
ADP + P
i
Pyruvate
carboxylase
H
2
O
H
2
O
Mg
2+
Mg
2+
H
2
O
CO
2
CO
2
H
2
O
Rgulation hormonale:
Glucagon (signal de jene et faim)
par lintermdiaire de lAMPc
entrane une phosphorylation de la
pyruvate kinase qui devient
inactive, ce qui inhibe la glycolyse.
La fructose-1,6-biphosphatase est
active .
Le cortisol induit aussi la
biosynthse de toutes les enzymes
cls.
Ladrnaline (signal de stress) agit
de faon analogue au glucagon
(augmentation de lAMPc)
Linsuline entrane une rduction de
la biosynthse des enzymes cls de
la noglucogense
Principes de base du mtabolisme
Ractions cls en biochimie
Principales voies mtaboliques
Mtabolisme glucidique
Mtabolisme lipidique
Mtabolisme protique
Phosphorylation oxydative
Les principales voies
mtaboliques en biochimie
humaine
Mtabolisme lipidique
Rappels
Digestion
Transport
Dgradation des acides gras
Synthse des acides gras
Synthse et dgradation des triglycrides
Les corps ctoniques
Le cholestrol
Rappels
Les matires grasses (graisses et huiles) sont des
pourvoyeurs dnergie, dacides gras essentiels et
servent de rservoir aux vitamines liposolubles (A, D, E,
K).
Ils constituent une rserve nergtique trs
importante!
Contrairement aux protines et aux sucres, ces
substances ne sont pas solubles dans leau.
Hormis les esters de cholestrol, la plupart des graisses
prises dans lalimentation se trouvent sous forme de
triglycrides ou de phospholipides.
Rappels
On retrouve principalement:
1. Les acides gras (saturs ou insaturs)
2. Les triglycrides (TAG): glycrol fix trois acides gras
3. Les phospholipides: principaux constituants des membranes
cellulaires
4. Les isoprnodes (drivent de lisoprne)
1. Les terpnes: vitamine A, E et K et ubiquinone
2. Le cholestrol prcurseur des hormones strodes,
calcitriol et des acides biliaires
5. Les sphingolipides
Les acides gras saturs
ac. myristique (n = 12)
COOH
CH
3
e
|
o
16
3
2
1
ac. palmitique (n = 14)
ac. starique (n = 16)
ac. arachidique (n = 18)
COOH
CH
3
CH
3
COOH
COOH
CH
3
Les acides gras saturs
Les acides gras insaturs
La position de la double liaison est indique par le symbole A
n
, o lexposant
indique la position du premier carbone portant la double liaison. Pour rappel, la
numrotation seffectue partir du carbone de la fonction carboxylique.
H
3
C COOH
H
3
C
COOH
COOH H
3
C
COOH H
3
C
COOH
CH
3
acide linolque (C18, A
9,12
)
acide olque (C18, A
9
)
acide o-linolnique (C18, A
9, 12, 15
)
9
9
9
acide e-linolnique (C18, A
6, 9, 12
)
9
12
12
12
15
6
acide arachidonique (C20, A
5, 8, 11, 14
)
5 8
11 14
La prsence dune insaturation de type cis introduit un coude dans la
molcule.
Les acides gras insaturs
Certains acides gras sont essentiels (*) : cest le cas de lacide linolique et de
lacide linolnique, car nous ne sommes pas capable de raliser une insaturation au
del du C9. Lacide arachidonique est synthtis partir de lacide linolique ou
linolnique, il est donc semi-essentiel. Lacide olique est synthtis par oxydation
de lacide starique.
Les acides gras omega-3
COOH
CH
3
EPA
CH
3
COOH
DHA
Les acides gras de type omega-3 (e-3) et de type omega-6 (e-6)
sont des acides gras polyinsaturs porteurs de dune double liaison
sur le 3
me
et le 6
me
carbone compter du carbone omega. Cest le
cas de lacide icosapentanoque (EPA) et de lacide
docosahxnoque (DHA) prsents en quantit dans certaines
huiles de poisson.
Triglycrides et phospholipides
Lipophiles
Amphiphiles
(membranes)
H
2
C
C
CH
3
C
H
CH
2 isoprne
1,4-butadine
C
5
Terpnes
Cholestrol
Ester de cholestrol (acide
gras, acide cholique, etc)
HO
OH
O
HO
Vitamine A (rtinol)
Vitamine E (|-tocophrol)
Isoprnodes
Cholestrol
- sa structure est base sur celle du noyau strane :
-les molcules portant ce noyau sont des strodes
-le cholestrol est un prcurseur de la synthse des strodes
hormonaux
Les sphingolipides
Une catgorie moins rpandue de lipides est celle des
sphingolipides. Leur structure est base sur un amino-alcool
insatur (sphingosine). Associ par une liaison amide un acide
gras, il forme un cramide.
Lassociation dun cramide un phosphate porteur dun
groupement non sucr : ce sont les sphingophosphatides dont fait
partie la sphingomyline (= cramide + P + choline).
Par contre, lassociation dun cramide un sucre simple porte le
nom de crbroside, tandis que le couplage un polysaccharide
gnre les gangliosides. Le terme gnrique est ds lors
glycolipide.
Les sphingolipides
Acide gras
Gaine de myline
neurones
Membrane des
cellules nerveuses
choline
Mtabolisme lipidique
Rappels
Digestion
Transport
Dgradation des acides gras
Synthse des acide gras
Synthse et dgradation des triglycrides
Les corps ctoniques
Le cholestrol
Digestion et rsorption
1. La digestion des graisses commence au
niveau du duodnum lorsque les sels
biliaires amens par le canal choldoque
provoquent une mulsion de type huile
dans eau: les enzymes (lipases et
phospholipases) sont des protines
hydrosolubles qui fonctionnent en milieu
aqueux. Il faut donc une mulsion pour avoir
le contact de lenzyme avec les graisses et
leau .
2. Le suc pancratique va librer des
lipases et phospholipases qui vont
entraner une hydrolyse.
3. Grce au travail des enzymes, les
produits de dgradation forment des
micelles avec les acides biliaires et sont
finalement rsorbs par les cellules
intestinales
Sels biliaires
La digestion des graisses commence au niveau du duodnum
lorsque les sels biliaires amens par le canal choldoque provoquent
une mulsion huile dans eau. Les sels biliaires sont drivs du
cholestrol et possdent une structure amphiphile.
Le suc pancratique
Le suc pancratique va
galement librer dans le
duodnum des lipases qui
hydrolyseront les liaisons
esters en C1 et en C3 des
glycrides pour donner du 2-
monoacylglycrol. Les acides
gras libres longue chane
hydrocarbones (> C
10
), les
monoacylglycrols et les sels
biliaires sont ensuite rsorbs
sous forme de micelles au
niveau de lintestin. Le
glycrol et les acides gras
chanes courtes (C
2
C
10
)
sont rsorbs tels quels par la
bordure en brosse de
lintestin.
Les phospholipases
Le suc pancratique dverse
galement des phospholipases
capables dhydrolyser les glycro-
phospholipides. Les rserves plus
ou moins importantes desters
dacides gras contenues dans les
adipocytes sont galement
mobilises sous laction
dhormones telles que ladrnaline.
Cest sous laction de lipases
hormono-sensibles que le glycrol
et les acides gras endognes seront
librs dans la circulation sanguine.
Le glycrol sera utilis pour former
du glucose via la gluconogense.
En raison de leur faible solubilit,
les acides gras se lieront aux
protines pour tre distribus aux
diffrents tissus.
Mtabolisme lipidique
Rappels
Digestion
Transport
Dgradation des acides gras
Synthse des acides gras
Synthse et dgradation des triglycrides
Les corps ctoniques
Le cholestrol
Transport des lipides dans le sang
Lipides = substances lipophiles, insolubles dans le plasma
Deux moyens de transport:
1. Liaison lalbumine
2. Triglycrides et les esters de cholestrol: lipoprotines: Elles sont
constitues dun noyau hydrophobe constitus essentiellement de
triglycrides et desters de cholestrol (lipides hydrophobes)
entour dune enveloppe constitue de phospholipides, de
cholestrol (lipides amphiphiles) et de protines (apolipoprotines).
TG= triglycrides
CE= cholesterol ester
Transport des lipides dans le sang
On classe les diffrentes lipoprotines et on les dnomme daprs leur densit. Le
contenu en apolipoprotine (qui solubilise) est dcisif pour la densit du complexe
lipidique:
Plus il y a dapolipoprotines, moins il y a de lipides la priphrie
=>plus le complexe est dense (les lipides ont une densit < protines)
=>plus la taille diminue
Les quatre groupes principaux sont ainsi, dans lordre de densit croissante:
-les chylomicrons (100-1000nm)
-les VLDL (very low density lipoproteins) (30-70nm)
-les LDL (low density lipoproteins) (15-25nm)
-les HDL (low density lipoproteins) (7.5-10nm)
Taille Densit
Leur composition et rles prcis seront dtaills dans le chapitre du sang
consacr la structure et mtabolisme des lipoprotines plasmatiques
Transport des lipides dans le sang
Brivement, les diffrents groupes de lipoprotines remplissent des fonctions
diverses dans lorganisme:
Les chylomicrons: transportent les lipides absorbs dans lintestin directement
vers la priphrie. Les chylomicrons font partie des lipoprotines dites riches en
triglycrides en raison de leur fort contenu en triglycrides et de leur contenu
relativement faible en cholestrolIls vhiculent les lipides dorigine exogne Les
restes (remnants) sont achemins vers le foie.
Les VLDL sapparentent au chylomicrons. Elles contiennent une forte proportion
de triglycrides. Le foie produit les lipides et les organise en VLDL qui sont
envoyes la priphrie.
Lhydrolyse continue des triglycrides des VLDL en circulation rduit leur contenu
lipidique ce qui a pour effet de rduire le diamtre et daugmenter la densit des
VLDL. Lorsque les VLDL atteignent une certaine taille (environ 300 ), elles sont
alors considres comme des lipoprotines de densit intermdiaire ou IDL
(intermediate density lipoproteins. Lhydrolyse subsquente des IDL, par laction
conjointe de la lipase lipoprotique et de la lipase hpatique, mne la formation
de lipoprotines de taille encore plus rduite appeles lipoprotines de faible
densit ou LDL (diamtre infrieur 270 )
Transport des lipides dans le sang
Les LDL: se caractrisent par un contenu relativement lev en cholestrol
comparativement leur teneur en triglycrides. De ce fait, la classe lipoprotique
des LDL est celle qui vhicule la majeure partie du cholestrol se trouvant dans la
circulation sanguine.
-Ils sont transports la priphrie o le cholestrol quils contiennent peut servir
de base la synthse des hormones sexuelles et de la vitamine D au niveau de la
peau.
-Il est depuis longtemps reconnu que le cholestrol des LDL joue un rle important
dans le dveloppement de lathrosclrose et de la maladie cardiovasculaire, do
son surnom de mauvais cholestrol dans la littrature populaire
Les HDL: ramassent le cholestrol libre dans le sang et le transporte dans le
foie, do son nom de bon cholestrol.
NB. Les taux de cholestrol sanguins sont mesurs couramment en biologie clinique (cfr chapitre
athrosclrose)
Ainsi, le taux sanguin normal de cholestrol total idal est 2 g/litre (valeurs limites: 1,60 2,40 g/l ).
Le taux sanguin normal de cholestrol LDL est 1.2 g/litre (1 1,6 g/l).
Le taux sanguin normal de cholestrol HDL est 0.45 g/l (0,35 0,75 g/l). En dessous de 0,35 g/l (mesur plusieurs reprises)
le risque cardiovasculaire existe. Si le rapport Cholestrol Total/HDL > 5 : le risque relatif coronarien est multipli par 20.
Le taux sanguin normal de triglycrides est 1.25 g/litre (0,35 1,25 g/l) .
Mtabolisme lipidique
Rappels
Digestion
Transport
Dgradation des acides gras
Synthse des acides gras
Synthse et dgradation des triglycrides
Les corps ctoniques
Le cholestrol
Dgradation des acides gras: |-oxydation
Triglycrides
(tissus adipeux)
Phospholipides
(membranes)
Acides gras
Actyl-CoA
Cholestrol
Acides gras
Triglycrides
Phospholipides
icosanodes
corps ctonique
(foie)
cycle de Krebs
ATP
En cas de besoin
nergtique: La |-oxydation
sert de dgradation des
acides gras en units actyl-
CoA. Elle se droule dans la
mitochondrie des cellules.
Cette dgradation joue un
rle majeur dans la
fourniture dnergie, dans le
foie, le muscle squelettique
et le muscle cardiaque.
Dans les rythrocytes, il ny
a pas de |-oxydation
puisquil ny a pas de
mitochondries
Oxydation des acides gras
Activation dans le cytosol acyl-CoA
Transfert vers la matrice mitochondriale
.|-oxydation actyl-CoA cycle de
Krebs ATP
Le processus de dgradation cellulaire des acides gras comprend trois tapes
principales : lactivation dans le cytosol, le transfert dans la matrice mitochondriale
et llagage par bloc de deux carbones.
Activation des acides gras
Ds lentre dans le cytosol, les
acides gras sont activs par formation
dun thioester avec le coenzyme A.
La raction passe par un
intermdiaire acyl-adnylate.
La liaison thioester est hautement
nergtique, elle puise son nergie
dans lhydrolyse de lATP et du
pyrophosphate.
LAMP form sera transform en ADP
en prsence dATP
Lactivation dun acide gras consomme donc deux molcules dATP.
Transfert de lacyl-S-CoA
La membrane mitochondriale
interne est impermable lacyl-
CoA. Pour gagner la matrice
mitochondriale, lacyl-CoA se lie
la L-carnitine. Le complexe
form peut ds lors traverser la
membrane mitochondriale interne
laide de la carnitine
acylcarnitine translocase.
Arriv dans la matrice
mitochondriale, lacyl-CoA est
libr du complexe o il subira la
-oxydation.
|-oxydation
Les acides gras activs (acyl-co A)
sont dgrads dans la mitochondrie
de telle faon que chaque fois, deux
atomes de carbone sont dtachs
sous forme dactyl-CoA.
Pour cela, 4 ractions se succdent:
1.Une oxydation sous forme de
dshydrognation (2H en moins)
2.Une hydratation
3.Une oxydation sous forme de
dshydrognation (2H en moins)
4.Une thiolyse: hydrolyse par le SH
dun nouvel Co-enzyme A.
Lacyl-CoA raccourci de deux atomes de carbone peut sengager
nouveau dans un autre cycle de |-oxydation
Lactyl-CoA peut passer dans le cycle de Krebs.
Bilan de la |-oxydation
Au cours dun cycle de -oxydation, il y a production dun FADH
2
, dun NADH/H
+
et dun actyl-CoA. Par phosphorylation oxydative, le FADH
2
et le NADH/H
+
vont
produire respectivement 2 et 3 molcules dATP. Lactyl-CoA sera entran
dans le cycle de Krebs, et sera responsable de la formation de 12 ATP. Un cycle
complet de -oxydation produit donc 17 molcules dATP (et en consomme
deux).
A titre dexemple, La dgradation de lacide palmitique permettra de gnrer 129
molcules dATP!
Mtabolisme lipidique
Rappels
Digestion
Transport
Dgradation des acides gras
Synthse des acides gras
Synthse et dgradation des triglycrides
Les corps ctoniques
Le cholestrol
La biosynthse des acides gras
Triglycrides
(tissus adipeux)
Phospholipides
(membranes)
Acides gras
Actyl-CoA
Cholestrol
Acides gras
Triglycrides
Phospholipides
icosanodes
corps ctonique
(foie)
cycle de Krebs
ATP
Glucose
Repas
La biosynthse des acides gras se
droule dans le cytoplasme de
toutes les cellules, sauf des
rythrocytes.
Elle est majoritairement ralise
dans le foie.
La biosynthse aboutit lacide
palmitique partir de huit actyl-
CoA; cet acide palmitique (C16)
pourra tre allong ou dsatur.
Elle permet notamment de
transformer le glucose en excs
(glycolyse -> Actyl-CoA) en acides
gras. Ceux-ci peuvent tre stocks
au niveau des tissus adipeux sous
forme de TG.
Cytoplasme
Biosynthse des acides gras
Chez les Mammifres, la synthse d'acides gras a lieu essentiellement dans le
foie (et les adipocytes). Cette synthse se passe dans le cytosol tandis que
l'oxydation se droule dans les mitochondries. L'enzyme clef est la synthtase
d'acide gras, un complexe multienzymatique qui renferme plusieurs enzymes.
Lors de la premire tape, l'actyl-CoA est transport de la mitochondrie vers le
cytosol par un transporteur de citrate.
Biosynthse des acides gras
Chez les Mammifres, la synthse
d'acides gras a lieu essentiellement dans
le foie (et les adipocytes). Cette synthse
se passe dans le cytosol tandis que
l'oxydation se droule dans les
mitochondries. L'enzyme clef est la
synthtase d'acide gras, un complexe
multienzymatique qui renferme plusieurs
enzymes.
Lors de la premire tape, l'actyl-CoA
est transport de la mitochondrie vers le
cytosol par un transporteur de citrate.
Biosynthse des acides gras
2 molcules dactyl-CoA ne
peuvent pas simplement ragir
entre elles. Lune est active sous
forme de malonyl-CoA grce
une enzyme, lactyl-CoA
carboxylase. Le groupement acyle
est soit fix au coenzyme A soit la
protine transporteuse d'acyle
(ACP) dont le cofacteur est la
phosphopantthine fixe une
srine.
Le malonyl-ACP est condens avec
l'actyl-ACP pour former
l'oxaloactate-ACP. Ce dernier est
transform en butyryl-ACP.
C16: Acide palmitique
Voie des
pentose
phosphate
Rgulation de la biosynthse des acides gras
C16: Ac palmitique
Rgulation allostrique:
Activateur:
citrate (glycolyse
importante tmoigne dun
taux de sucre lev =>
synthse dacides gras)
Inhibiteur:
AMP (tmoin dune pnurie
dnergie)
Actyl-CoA carboxylase
Rgulation de la biosynthse des acides gras
C16: Ac palmitique
Rgulation hormonale:
Activation:
Insuline (hormone de
lanabolisme): diminution de la
concentration en AMPc
Inhibition:
Adrnaline et glucagon
(hormone du catabolisme):
augmentation de la
concentration en AMPc
Actyl-CoA carboxylase
Mtabolisme lipidique
Rappels
Digestion
Transport
Dgradation des acides gras
Synthse dacide gras
Synthse et dgradation des triglycrides
Les corps ctoniques
Le cholestrol
La biosynthse des triglycrides
Triglycrides
(tissus adipeux)
Phospholipides
(membranes)
Acides gras
Actyl-CoA
Cholestrol
Acides gras
Triglycrides
Phospholipides
icosanodes
corps ctonique
(foie)
cycle de Krebs
ATP
Glucose
Repas
glycrol-3-P
DHAP
glycolyse
Une destine importante des acides
gras est leur incorporation en
composs de rserve: les
triglycrides (TAG) principalement
stocks dans les tissus adipeux.
Ces rserves nergtiques
reprsentent 12% du poids
corporel, ce qui permet de tenir le
coup pendant les priodes
maigres (nuit, jene, famine).
La biosynthse des triglycrides
Le prcurseur de la synthse des
triglycrides et des phospholipides
est l'acide phosphatidique ou
phosphatidate. Il est obtenu partir
du glycrol-3-phosphate, lui-mme
provenant du dihydroxyactone
phosphate (DHAP) produit lors de la
glycolyse.
Le phosphatidate obtenu pourra tre
transform en triglycride ou en
glycrophospholipides (phosphatidylcholine,
phosphatidylthanolamine ou phosphatidylsrine).
La dgradation des triglycrides: lipolyse
Triglycrides
(tissus adipeux)
Phospholipides
(membranes)
Acides gras
Actyl-CoA
Cholestrol
Acides gras
Triglycrides
Phospholipides
icosanodes
corps ctonique
(foie)
cycle de Krebs
ATP
Glucose
Repas
Les TAG sont prsents au niveau
de lintestin (exogne) du sang et
des adipocytes.
Dans les adipocytes, ils sont
dgrads en acides gras et glycrol
par la TAG lipase hormono-
dpendante.
Contrle de la synthse et dgradation des triglycrides
Triglycrides
(tissus adipeux)
Phospholipides
(membranes)
Acides gras
Actyl-CoA
Cholestrol
Acides gras
Triglycrides
Phospholipides
icosanodes
corps ctonique
(foie)
cycle de Krebs
ATP
Glucose
Repas
Glycmie:
En cas de glycmie leve, la
glycolyse fonctionne dans les
adipocytes. La lipogense peut
alors seffectuer librement partir
de glycrol-3-phosphate qui
provient du DHAP.
En cas de glycmie abaisse, la
vitesse de la lipogense diminue
car la DHAP manque!
Hormones:
Adrnaline et glucagon active la
lipolyse par lvation dAMPc qui
active la TAG lipase en la
phosphorylant.
Linsuline stimule la biosynthse
des TAG partir de glucide.
Mtabolisme lipidique
Rappels
Digestion
Transport
Dgradation des acides gras
Synthse dacide gras
Synthse et dgradation des triglycrides
Les corps ctoniques
Le cholestrol
On regroupe sous le nom de corps ctoniques des petites molcules trs
diffusibles dans le sang et les tissus priphriques: ce sont de vritables
lipides hydrosolubles (4 carbones ou 3 carbones):
|-hydroxybutyrate
Actoactate
Actone (normalement dimportance secondaire)
Principe:
La synthse des corps ctoniques a lieu dans les mitochondries du foie
Ils sont envoys dans le sang
Leur utilisation a lieu dans les mitochondries des tissus priphriques qui les
utilisent comme carburants relais du glucose (en situation de jene ou le glucose
est prserv pour les GR et le cerveau).
Principe
Lors d'un jene, d'un diabte mal contrl, d'un dficit en glucose, d'un excs
de graisses, l'nergie est puise dans l'oxydation des acides gras. La
surproduction d'actyl-CoA dborde alors la capacit de mtabolisation par
cycle de Krebs.
En cas de production augmente dactyl-CoA, le foie peut le convertir en corps
ctoniques quil peut expdier aux autres tissus o ils sont retransforms en actyl-
CoA: ils servent donc de relais de source nergtique la place du glucose
Principe
Actyl-CoA
Autres tissus
(muscle
squelettique,
cur)
|-hydroxybutyrate
Actoactate
Actone
Actyl-CoA
Les corps ctoniques sont seulement une forme de
transport de lacetyl-CoA
actoactate
actoactylCoA
Lorsque les taux en corps ctoniques sont peu important (jene court), le
muscle oxyde lessentiel des corps ctoniques.
Inversement, lorsque le jene se prolonge, la concentration en corps
ctonique augmente progressivement pour atteindre un seuil leur permettant
dtre utiliss par le cerveau. Ca permet dpargner le glucose pour dautres
cellules gluco-dpendantes comme les globules rouges.
=> Les corps ctoniques sont extrmement importants pour notre cerveau,
qui puise son nergie en grande partie des corps ctoniques aprs quelques
jours de jene: le cerveau se contente alors de 40g de glucose au lieu de
120g.
Importance pour le cerveau
Actyl-CoA
|-hydroxybutyrate
Actoactate
Actone
Actyl-CoA
Lactoactate peut se transformer spontanment en actone qui passe dans
le sang et est limin par les poumons: confre lair expir une odeur de
vernis ongle!
Actose sanguine et urinaire / actone pulmonaire :
indice diagnostique
actone
Une accumulation de corps ctonique dans le sang ralise une actose .
En dehors du jene, labsorption excessive dalcool (dgradation en actyl Co-
A) et le diabte sucr dcompens en sont les causes les plus frquentes.
En cas de jene prolong
Diabte sucr dcompens
Excs de corps ctoniques:
coma acido-ctonique
Lipolyse massive
Augmentation massive de corps ctoniques acides dans le sang
(le rein ne peut plus les liminer)
Coma acido-ctonique
Risque: Coma acido-ctonique
Mtabolisme lipidique
Rappels
Digestion
Transport
Dgradation des acides gras
Synthse dacide gras
Synthse et dgradation des triglycrides
Les corps ctoniques
Le cholestrol
Biosynthse du cholestrol
Le cholestrol est une des molcules les plus
connues en biochimie.
Pour nos cellules, le cholestrol est vital.
Comme nous pouvons fabriquer nous mme
le cholestrol, nous ne sommes pas
dpendants de lalimentation!
Le cholestrol est important pour nos cellules et
la synthse de nombreuses hormones,
notamment, mais est aussi important pour le
mdecin et le pharmacien dans sa pratique
quotidienne:
La cause la plus frquent de dcs dans les
pays industrialiss est reprsent par les
maladies cardiovasculaires, dont
lathrosclrose en tte de liste. Le cholestrol
joue un rle majeur dans le dveloppement de
cette pathologie.
HO
Le cholestrol appartient au
groupe des strodes et
comprend 27 atomes de
carbones.
Biosynthse du cholestrol
Notre organisme a besoin
quotidiennement denviron 1000mg de
cholestrol. Presque la mme quantit
est perdue quotidiennement par voie
intestinale, sous forme dacides
biliaires. Moins de 500mg sont apports
par lalimentation (majoritairement les
produits dorigine animale).
La plus grande partie est synthtise
de faon endogne.
La biosynthse du cholestrol s'opre
essentiellement dans le cytosol des
hpatocytes. Tous les atomes de
carbone du cholestrol proviennent de
l'actyl-CoA. L'enzyme d'engagement
qui dtermine la vitesse de synthse du
cholestrol est la "HMG-CoA
rductase (cible des statines).
Triglycrides
(tissus adipeux)
Phospholipides
(membranes)
Acides gras
Actyl-CoA
Cholestrol
Acides gras
Triglycrides
Phospholipides
icosanodes
corps ctonique
(foie)
cycle de Krebs
ATP
Glucose
Repas
Biosynthse du cholestrol
Voie des
pentoses
phosphates
On peut diviser la synthse du
cholestrol en 5 grandes tapes:
-A partir de 3 molcules dactyl-CoA
se forme le |-hydroxy-|-methylglutaryl-
CoA ou |-HMG-CoA.
-La |-HMG-CoA rductase (enzyme-
cl) catalyse la rduction du |-HMG-
CoA en mvalonate, laide du
NADPH/H
+
(voie des pentoses
phosphates)
-A partir du mvalonate se forme un
isoprne actif, lisopentnyl-PP (5C)
-Six isoprnes sassocient pour former
le squalne (30C)
-Finalement, le squalne va donner le
cholestrol (27C)
Rgulation de la biosynthse du cholestrol
Rgulation allostrique:
|-HMG-CoA rductase inhibe de
faon allostrique par:
-son produit directe: le mvalonate.
-le produit final: le cholestrol.
Enzyme-cl: |-HMG-CoA rductase
Rgulation de la biosynthse du cholestrol
Rgulation Hormonale:
Le glucagon inhibe la syntse de
cholestrol: par phosphorylation de la
HMG-CoA rductase via lAMPc.
Linsuline stimule la biosynthse du
cholestrol.
NB. Au niveau de lADN, la biosynthse
du cholestrol est galement rgule de
faon trs prcise.
Enzyme-cl: |-HMG-CoA rductase
Estrification du cholestrol
Sil y a beaucoup de cholestrol libre, la cellule
peut en emmagasiner une partie dans le
cytoplasme.
Or, le cholestrol se stocke difficilement en
raison de sa structure: Il est amphiphile (-OH
polaire et partie lipophile importante). Il narrive
pas former des micelles ni tre stock dans
des gouttes lipidiques: (le OH forme des ponts
hydrogne avec leau).
La solution est lestrification du OH:
Lester de cholestrol compltement apolaire
peut ainsi tre stock dans des gouttelettes
dans le cytoplasme.
Le transport du cholestrol pose aussi
problme! Lestrification permet de
transporter lester de cholestrol lintrieur
des lipoprotines, avec les triglycrides.
HO
Estrification
amphiphile
O (CH
2
)n
H
3
C
O
Estrification du cholestrol
Le cholestrol est estrifi par deux enzymes:
LACAT dans les cellules et la LCAT dans le sang.
LACAT: acyl-CoA-cholestrol-acyltransfrase
-Se trouve dans le rticulum endoplasmique.
-Estrifie le cholestrol en transfrant un
groupement acyl dun acyl-CoA, en gnral un
staryl-CoA.
LCAT: lecitine-cholestrol-acyltransfrase
-Estrification du cholestrol dans le sang
-Transfert dun acide gras dune lcitine
(phosphatidyl-choline) sur le cholestrol.
Lcithine
S (CH
2
)n
H
3
C
O
CoA
Acyl-CoA
Transformation du cholestrol
Le cholestrol et certains de ses prcurseurs sont des intermdiaires cls de la
biosynthse de nombreuses substances dont les strodes.
Trois rles reviennent ainsi au cholestrol:
1.Contribution la structure et la fluidit de la membrane.
2.Sa transformation en acides biliaires.
3.Son utilisation pour la synthse des hormones strodes (dans les ovaires,
testicules et corticornales).
Principes de base du mtabolisme
Ractions cls en biochimie
Principales voies mtaboliques
Mtabolisme glucidique
Mtabolisme lipidique
Mtabolisme protique
Phosphorylation oxydative
Les principales voies
mtaboliques en biochimie
humaine
Protines et acides amins: Rappels
Les protines sont constitues dun enchanement dacides o-amins
(AA) dont la structure gnrale est :
H
2
N CH COOH
R
1 2
o
La dsignation numrique est effectue partir de latome de
carbone de la fonction carboxylique (COOH). La dsignation
alphabtique commence par le carbonne adjacent cette fonction
carboxylique. Les acides amins se diffrencient par la nature du
rsidu R.
Protines et acides amins: Rappels
Ces acides amins sont relis entre eux par des liaisons amides,
appeles liaisons peptidiques. Ces liaisons sont le rsultat de la
condensation de la fonction carboxylique avec la fonction a-amino dun
autre acide amin. Il subsiste ds lors un seul acide amin avec un a-NH
2
libre (= acide amin N-terminal) et un seul acide amin avec le COOH libr
(= acide amin C-terminal). Par convention, lcriture (de gauche droite)
va de lacide amin N-terminal vers lacide amin C-terminal.
H
2
N CH COOH
R
H
2
N CH COOH
R'
H
2
N CH COOH
"R
H
3
N CH C
R
N
H
H
C C N
H
O
R'
O
H
C C
O
O
-
R"
+
- H
2
O
- H
2
O
Protines et acides amins: Rappels
Parmi les centaines dacides amins naturels existant, 20 seulement
entrent dans la composition des protines humaines. Ils sont dits
protinognes Ils peuvent tre classs en fonction la nature chimique
de la chane latrale R.
Chacun dentre eux possde un code trois et une lettre qui les
dsigne.
Certains acides amins ne peuvent tre synthtiss par lHomme, ils
sont qualifis d acides amins essentiels . Cest le cas de Val, Leu, Ile,
Thr, Met, Lys, Phe, Trp (*).
Au cours de la croissance, larginine (Arg) et lhistidine (His) sont
essentiels. La tyrosine (Tyr) et la cystine (Cys) sont synthtises partir
de la phnylalanine (Phe) et de la mthionine (Met) respectivement, deux
acides amins essentiels.
Protines et acides amins: Rappels
Acides amins aliphatiques :
COO
-
C H
3
N H
H
+
glycine
Gly
G
COO
-
C H
3
N H
CH
3
+
alanine
Ala
A
COO
-
C H
3
N H
CH
+
valine
Val *
V
H
3
C CH
3
COO
-
C H
3
N H
CH
2
+
leucine
Leu *
L
CH
H
3
C CH
3
COO
-
C H
3
N H
CH
+
isoleucine
Ile *
I
H
2
C CH
3
H
3
C
COO
-
C
H
2
N
H
2
C
CH
2
CH
2
H
+
proline
Pro
P
Protines et acides amins: Rappels
Acides amins hydroxyls :
COO
-
C H
3
N H
CH
2
OH
+
srine
Ser
S
COO
-
C H
3
N H
CHOH
+
thronine
Thr *
T
CH
3
Protines et acides amins: Rappels
Acides amins soufrs :
COO
-
C H
3
N H
CH
2
SH
+
cystine
Cys
C
COO
-
C H
3
N H
CH
2
+
mthionine
Met *
M
CH
2
S
CH
3
COO
-
CH H
3
N
CH
2
SH
+
COO
-
CH H
3
N
CH
2
SH
+
COO
-
CH H
3
N
CH
2
S
+
SCH
2
CH NH
3
COO
-
+
O
2
H
2
O
2
Le groupement SH de Cys est un acide faible (pKa = 8.4). Par oxydation, la cystine
forme avec une autre Cys un pont disulfure. Lacide amin obtenu sappelle la cystine :
Protines et acides amins: Rappels
Acides amins acides et drivs :
A pH neutre, le Glu et lAsp sont chargs ngativement en raison de lionisation de la
fonction carboxylique de la chane latrale. La chane latrale de Asn et Gln est neutre et
non-ionisable. Lasparagine et la glutamine sont donc des acides amins neutres !
COO
-
C H
3
N H
CH
2
+
COO
-
aspartate
Asp
D
COO
-
C H
3
N H
CH
2
+
CONH
2
asparagine
Asn
N
COO
-
C H
3
N H
CH
2
+
CH
2
glutamate
Glu
E
COO
-
COO
-
C H
3
N H
CH
2
+
CH
2
glutamine
Gln
Q
CONH
2
Protines et acides amins: Rappels
Acides amins basiques :
La fonction amine de la Lys et la guanidine de lArg est protone au pH physiologique
(pH = 7,4). Le noyau imidazole de His possde un caractre basique.
COO
-
C H
3
N H
CH
2
+
CH
2
lysine
Lys *
K
CH
2
CH
2
NH
3
COO
-
C H
3
N H
CH
2
+
CH
2
arginine
Arg
R
CH
2
NH
C
NH
2
NH
2
COO
-
C H
3
N H
CH
2
+
histidine
His
H
N
NH
+ +
Protines et acides amins: Rappels
Acides amins aromatiques :
Seul les acides amins aromatiques sont capables dabsorber le rayonnement
ultraviolet. A pH neutre, Tyr et Trp absorbent 280 nm, tandis que Phe absorbe 260
nm. Le groupement OH de Tyr est de nature phnolique. Cest une fonction acide faible
(pKa = 10,5).
COO
-
C H
3
N H
CH
2
+
phnylalanine
Phe *
F
COO
-
C H
3
N H
CH
2
+
tyrosine
Tyr
Y
OH
COO
-
C H
3
N H
CH
2
+
tryptophane
Trp*
W
NH
Protines et acides amins: Rappels
Acides amins non-protinognes :
Outre les vingt acides amins constituant la structure des protines, il existe dautres
acides amins intervenant comme mtabolites ou comme constituant dautres
biomolcules :
COO
-
C H
3
N H
CH
2
+
ornithine
COO
-
CH
2
CH
2
NH
3
+
CH
2
CH
2
NH
3
+
|-alanine
COO
-
C H
3
N H
CH
2
+
SeH
slnocystine
Lornithine est en effet un mtabolite du cycle de lure, tandis que la b-alanine est un
constituant du coenzyme A, molcule majeure dans le mtabolisme. La slnocystine
devrait tre considr comme un acide amin protinogne. Il intervient notamment
dans la structure de la glutathion peroxydase, une enzyme.
Protines et acides amins: Rappels
Ionisation des acides amins :
Les acides amins sont des molcules amphotres
Rappel :
Une fonction acide est une fonction capable de donner un proton :
R-COOH R-COO
-
+ H
+
Une fonction basique est une fonction capable daccepter un
proton :
R-NH
2
+ H
+
R-NH
3
+
Protines et acides amins: Rappels
Ionisation des acides amins :
On peut appliquer ces fonctions lquation de Henderson-
Hasselbach des formes conjugues
Pour les acides et les bases faibles conjugues :
pH = pKa + log {forme basique}
{forme acide}
Pour la fonction carboxylique, lquation devient : pH = pKa + log ([COO
-
]/[COOH])
Cette quation est applicable aux fonctions basiques : pH = pKa + log ([NH
2
]/[NH
3
+
])
Protines et acides amins: Rappels
Ionisation des acides amins :
Au pH physiologique, (7.4), les acides amins sont des zwitterions
H
3
N CH COO
R
H
2
N CH COO
-
R
+
-
H
3
N CH COOH
R
+
milieu acide milieu neutre milieu alcalin
Par convention, le pK
1
est celui de o-COOH
le pK
2
celui de o-NH
3
+
le pK
3
celui de la chane latrale
Protines et acides amins: Rappels
Ionisation des acides amins :
Les fonctions carboxylique (COOH) et NH
2
non substitues sont
susceptibles dtres ionises ainsi que les groupements guanidine et
phnol.
Ionisation du NH
2
terminal : 8.80 < pKa
2
< 10.78.
pH = pKa
2
+ log ([NH
2
]/[NH
3
+
])
Ionisation du COOH terminal : 1,7 < pKa
1
< 2,6.
pH = pKa
1
+ log ([COO
-
]/[COOH])
Protines et acides amins: Rappels
Ionisation des acides amins :
Certains acides amins ont une deuxime fonction acide :
Asp : pK3 = 3.96 (|-COOH)
Glu : pK3 = 4.32 (-COOH)
Cys : pK3 = 8.4 (-SH)
Tyr : pK3 = 10.11 (phnol)
Protines et acides amins: Rappels
Ionisation des acides amins :
Certains acides amins ont une deuxime fonction acide :
H
2
N
H
C COOH
CH
2
COO
-
H
2
N
H
C COOH
CH
2
COOH
pKa = 3.96
H
2
N
H
C COOH
(CH
2
)
2
COO
-
H
2
N
H
C COOH
(CH
2
)
2
COOH
pKa = 4.32
H
2
N
H
C COOH
CH
2
S
-
H
2
N
H
C COOH
CH
2
SH
pKa = 8.4
H
2
N
H
C COOH
CH
2
H
2
N
H
C COOH
CH
2
pKa = 10.11
OH
O
-
Acides
forts
Acides
faibles
Protines et acides amins: Rappels
Ionisation des acides amins :
Dautres, une deuxime fonction basique :
H
2
N
H
C COOH
(CH
2
)
4
NH
2
H
2
N
H
C COOH
(CH
2
)
4
NH
3
+ pKa = 10.8
H
2
N
H
C COOH
(CH
2
)
3
NH pKa = 12.48
C
NH
2
NH
2
+
H
2
N
H
C COOH
(CH
2
)
3
NH
C
NH
2
NH
H
2
N
H
C COOH
CH
2
HN NH
+
pKa = 6.00
H
2
N
H
C COOH
CH
2
N NH
Lys : pK3 = 10.80 (e-NH3+)
Arg : pK3 = 12.48 (guanidinium)
His : pK3 = 6.00 (imidazolium)
Protines et acides amins: Rappels
Ionisation des acides amins :
Acide amin pK
1
(o-COOH) pK
2
(o-NH
2
) pK
3
(R)
Gly 2.35 9.78
Ala 2.35 9.87
Val 2.29 9.72
Leu 2.33 9.74
Ile 2.32 9.76
Pro 1.95 10.64
Ser 2.19 9.44
Thr 2.09 9.10
Cys 1.86 10.78 8.33
Met 2.17 9.27
Asp 1.99 10.00 3.96
Asn 2.02 8.80
Glu 2.13 9.95 4.32
Gln 2.17 9.13
Lys 2.16 9.20 10.80
Arg 1.82 8.99 12.48
His 1.81 9.15 6.00
Phe 2.58 9.24
Tyr 2.20 9.11 10.11
Trp 2.43 9.44
Protines et acides amins: Rappels
Strochimie des acides amins :
A lexception de la glycine, les acides amins possdent
tous un carbone asymtrique
Selon la nomenclature de Ficher, les acides amins
naturels sont de la srie L
O
C
O
C
R
H
3
N H
O
C
-
O
C
R
NH
3
H
-
L
+
+
D
Protines et acides amins: Rappels
Strochimie des acides amins :
Reprsentation de FISHER
Le groupement COOH vers le haut, la chane latrale vers
le bas, et le C-o vers le lecteur.
Dans ces conditions, lorsque le groupement NH
2
se trouve
gauche, lAA est de type L. Lorsque le NH
2
est positionn
droite lAA appartient la srie D.
O
C
O
C
R
H
3
N H
-
+
Protines et acides amins: Rappels
Strochimie des acides amins :
Configuration absolue R S de Cahn Ingold Prelog
Le systme de configuration absolue (systme de Cahn-Ingold-Prelog)
utilise la notation R (rectus) ou S (sinister). Il se base sur
ltablissement dun ordre de priorit des substituants du carbone
asymtrique
Protines et acides amins: Rappels
Strochimie des acides amins :
Configuration absolue R S de Cahn Ingold Prelog
1 les atomes fixs sur le carbone asymtrique sont classs par ordre dcroissant
de leur nombre atomique : H = 1 ; C = 6 ; N = 7 ; O = 8 ; S = 16
2 en cas dgalit de deux atomes, on additionne le nombre atomique des
lments fixs sur cet atome. Les atomes sont ensuite classs par ordre
dcroissant.
3 si lgalit subsiste, le nombre atomique dun lment fix par une double
liaison est comptabilis deux fois.
4 la molcule est ensuite regarde dans le sens carbone asymtrique (C*) vers
llment class dernier.
5 Les trois autres substituants sont ensuite regards par ordre dcroissant de
priorit. Si la rotation est effectue dans le sens des aiguilles dune montre, le
carbone asymtrique possde la configuration absolue de type R, dans le cas
contraire, il est de type S.
Mtabolisme protique
Absorption digestive
Transport
Mtabolisme des protines
Mtabolisme des acides amins
Cycle de lure
Amines biognes
Absorption digestive
Parmi les 20 acides amins protinognes, 8 sont essentiels et doivent tre
apports par lalimentation. Tous les autres peuvent tre synthtiss par nos
cellules.
Aprs leur ingestion, les protines ne vont pas loin dans le tube digestif. Dj
dans lestomac, la chane peptidique est coupe plusieurs endroits. Dans
lintestin, est compltement hydrolyse en acides amins qui vont tre absorbs
par les cellules intestinales.
Cette digestion est effectue par les protases: chymotrypsine, pepsine,
trypsine, lastase, carboxypeptidase.
Les acides amins sont ensuite absorbs par les cellules intestinales suivant un
mcanisme de transport actif secondaire (comme pour le glucose, via la
Na
+
/K
+
ATPase qui tablit un gradient de sodium et permet le fonctionnement du
transporteur de sodium)
Mtabolisme protique
Absorption digestive
Transport
Mtabolisme des protines
Mtabolisme des acides amins
Cycle de lure
Amines biognes
Transport des protines et acides amins dans le sang
Il nexiste pas proprement parl de rserve des acides amins (comme il
existe le glycogne pour le glucose et les triglycrides pour les acides gras).
Les seuls rserves sont les protines.
Aussi bien les acides amins que les protines sont gnralement
hydrosolubles. Ils peuvent tre transports sans problme dans le plasma
sanguin ltat libre.
-Les protines circulant dans le plasma sont appeles les protines
plasmatiques (ex. albumine, o1-, o-2, | et -globulines). Elles ont des rles
trs important qui seront rediscuts par la suite (chapitre consacr au sang)
-Les acides amins les plus frquents dans le plasma sanguin sont la
glutamine et lalanine qui ont des fonctions particulires dans le mtabolisme
gnral.
+
H
3
N C C
CH
2
O
-
O
CH
2
C
NH
2
O
H
+
H
3
N C C
CH
3
O
-
O H
Mtabolisme protique
Absorption digestive
Transport
Mtabolisme des protines
Mtabolisme des acides amins
Cycle de lure
Amines biognes
Mtabolisme des protines
Biosynthse des protines
400 g de protines sont forms chaque jour.
La biosynthse des protines seffectue au niveau des ribosomes: Traduction.
LARN messager pntre dans le cytoplasme par les pores du noyau et se lie aux
ribosomes o se fait la synthse protique (initiation-longation-terminaison).
Les protines qui restent lintrieur de la cellule (enzymes, etc.) sont
synthtises jusqu la fin sur les ribosomes libres (voie cytoplasmique).
Les protines qui sont intgres dans la membrane cellulaire ou destines
lexportation (voie scrtoire), sont introduites dans le rticulum endoplasmique
au cours de la synthse (rticulum endoplasmique granuleux).
-Au sein du rticulum endoplasmique, les protines sont gnralement
modifies (glycosyles).
-Les protines sont ensuite envoyes vers lappareil de Golgi o elles
peuvent encore tre modifies (glycosylation supplmentaire).
-Les protines sont ensuite intgres dans la membrane (ex. protines
antigniques glycosyles des globules rouges qui constituent les groupes
sanguins) ou scrtes (insuline, etc.).
Mtabolisme des protines
Dgradation des protines
Les protines sont dgrades presque exclusivement lintrieur des cellules
par des peptidases (coupent les peptides) et protases (coupent les protines)
qui appartiennent la famille des hydrolases
Catabolisme intracellulaire des protines:
Il y a deux possibilits:
1. Les protasomes: dgradent les protines marques par une protine
spciale (ubiquitine), par un mcanisme ATP-dpendant. Il sagit dun
complexe multienzymatique qui possde une activit protase non spcifique.
2. Les lysosomes: dgradent les protines par un mcanisme ATP-
indpendant. Ils possdent une srie denzymes hydrolytiques appeles
cathepsines. Ils dgradent non seulement des protines isoles, mais
galement des organelles entiers.
Mtabolisme des protines
Dgradation des protines extracellulaire
Les protines extracellulaires sont majoritairement les protines plasmatiques
dont la dgradation est diffrente suivant quil sagit des glycoprotines ou de
lalbumine.
1. Les glycoprotines (la majorit des protines plasmatique)
-Sont captes partir du plasma par les cellules hpatiques grce des
rcepteurs dendocytose.
-Les vsicules dendocytose fusionnent avec les lysosomes qui dgradent les
glycoprotines.
2. Lalbumine (non glycosyle)
- Dgradation par la voie rnale
- Lors du passage du sang dans les reins, une faible fraction de lalbumine
plasmatique est filtre par le glomrule, puis rabsorbe par les cellules
pithliales tubulaires. Dans ces cellules tubulaires:
soit lalbumine est rachemine intacte vers la circulation.
soit elle est dgrade dans les lysosomes
Mtabolisme protique
Absorption digestive
Transport
Mtabolisme des protines
Mtabolisme des acides amins
Cycle de lure
Amines biognes
Mtabolisme des acides amines
Importance du foie
Le plus grand problme du
mtabolisme des acides amins et
des protines est d lazote
provenant des groupements amins.
Au cours du catabolisme, il est
transform en ammoniac, trs
toxique pour lorganisme. Pour
dtoxifier les cellules et le sang, le
foie utilise lammoniac pour former de
lure grce au cycle mtabolique
de lure.
Le transport de lammoniac form
partir de la dgradation des acides
amins la priphrie se fait sous
forme de glutamine dans le plasma.
Cest pourquoi la concentration de la
glutamine dans le plasma est la plus
leve des acides amins.
organes priphries
Glutamine
ure
transformation
dgradation
Mtabolisme des acides amines
Importance des muscles
Seul tissu qui puisse, pour une
priode limite, exporter des
protines ou des acides amins en
cas de besoin (jene) pour la
noglucogense hpatique.
Les protines des muscles sont alors
dgrades et les acides amins dans
le foie sont convertis en alanine,
laquelle est libre dans la circulation
pou atteindre le foie et y tre
transforme en glucose.
Ceci explique que sa concentration
plasmatique soit la plus leve aprs
la glutamine
alanine
noglucogense
glucose
sang
Mtabolisme des acides amines
Les acides amins sont particulirement importants pour lorganisme (source de
synthse des protines. Aprs un repas, une certaine quantit dacides amins
est apporte lorganisme. La proportion des acides amins nest pas forcment
celle dont lorganisme a besoin. Il doit y avoir des conversion possible de ces
acides amins:
Lors de chaque raction de dgradation ou de transformation des acides
amins, se pose toujours le problme du devenir du groupe amin. Ce problme
est rsolu par deux types de raction:
1. La raction de transamination: le groupement amin est transfr sur une
autre molcule.
2. La raction de dsamination: le groupement amin est dtach pour former de
lammoniac qui sera ensuite transform en ure.
Le PALP ou pyridoxal-phosphate qui drive de la vitamine B
6
, la pyridoxine, doit
tre apporte par lalimentation.
Le catabolisme des acides amins va aboutir la production dammoniaque et de
o-ctoacides. Ces derniers seront transforms en intermdiaires du cycle de
Krebs, et lammoniaque sera limin sous forme dure par voie urinaire.
La transamination est un processus au cours duquel le groupement amin est
transfr dun acide amin qui nest pas actuellement utilisable vers un acide o-
ctonique. Ceci permet la formation dun nouvel acide amin qui est
indispensable.
Transamination des acides amins
Les transaminases utilisent comme cofacteur le phosphate de pyridoxal
(PALP) ou vitamine B
6
. Les transminases sont prsentes dans le cytosol et
les mitochondries.
+H
3
N C
COO
-
R
1
H
O C
COO
-
R
2
acide amin (inutile)
acide ctonique
+H
3
N C
COO
-
R
12
H
O C
COO
-
R
2
acide amin (ncessaire)
Les ractions de transamination permettent aux diffrents acides amins de se
convertir en o-ctoacides en permettant la formation de glutamate (ou
daspartate). Ces derniers permettent la formation de lure. Les o-ctoacides
sont des intermdiaires du cycle de Krebs.
Intrt de la transamination des acides amins
R
NH
2
COOH
R
O
COOH
NH
2
COOH CH
2
CH
2
HOOC
O
COOH CH
2
CH
2
HOOC
transaminase vit B
6
acide amin
Glutamate
ure
o-ctoacide
cycle de Krebs
o-ctoglutarate
Les o-ctoacides de la
glycolyse et du cycle de Krebs
sont:
le pyruvate,
lo-ctoglutarate,
le succinyl-CoA,
loxaloactate
lactoactyl-CoA (synthse
des corps ctoniques).
Le fumarate est galement un
point dentre.
Ala
Cys
Gly pyruvate
Ser
Thr
Leu
Lys actoactyl-CoA
Trp
Arg
Gln
His o-ctoglutarate
Pro
Glu
Ile
Met succinyl-CoA
Val
Tyr
Phe
Asp
Asn
fumarate oxaloactate
Transaminations et importance en biochimie humaine
Les deux aminotransfrases les plus importantes en biochimie humaine sont:
COO
-
C +H
3
N H
CH
2
COO
-
+
COO
-
C
CH
2
CH
2
O
COO
-
Aspartate o-ctoglutarate
ASAT
COO
-
C O
CH
2
COO
-
+
COO
-
HC
CH
2
CH
2
COO
-
Oxalo-actate
Glutamate
NH
3
+
Laspartate aminotransfrase
(ASAT)
Lalanine aminotransfrase
(ALAT)
Catalyse le transfert dun groupement amin
de laspartate sur lo-ctoglutarate pour former
loxalo-actate et le glutamate
COO
-
C +H
3
N H
CH
3
+
COO
-
C
CH
2
CH
2
O
COO
-
Alanine o-ctoglutarate
ALAT
COO
-
C O
CH
3
+
COO
-
HC
CH
2
CH
2
COO
-
Pyruvate
Glutamate
NH
3
+
Catalyse le transfert dun groupement amin
de lalaninee sur lo-ctoglutarate pour former
Le pyruvate et le glutamate
Transaminations et importance en biochimie humaine
Laspartate aminotransfrase (ASAT) et lalanine aminotransfrase (ALAT)
sont utilises pour le diagnostic des lsions hpatiques.
Les diffrences de localisation de ces deux enzymes (ASAT prdominante
dans la mitochondrie et ALAT, prdominante dans le cytoplasme) permettent
une certaine valuation de la gravit des lsions cellulaires.
Si on trouve seulement une augmentation dALAT dans le plasma, les
mitochondries sont encore pargnes.
Si les mitochondries sont lses, lASAT augmente aussi dans le plasma.
NH
2
COOH CH
2
CH
2
H
2
NOC
NH
2
COOH CH
2
H
2
NCO
NH
2
COOH CH
2
CH
2
HOOC
NH
2
COOH CH
2
HOOC
Asparagine
Glu Asp
glutaminase
asparaginase
NH
3
H
2
O
NH
3
H
2
O
Glutamate
Glutamine
Aspartate
Dans la dsamination, le groupement amin est dtach avec formation
dammoniac libre. Ces ractions sont irrversibles.
La glutamine et l'asparagine seront d'abord transformes en glutamate et en
aspartate respectivement avec libration d'ammoniaque
Dsamination de lasparagine et de la glutamine
Une dsamination importante est la dsamination oxydative. Nous avons vu
que lors des ractions de transamination et de dsamination, le glutamate tait
le produit de dgradation de nombreux acides amins.
Le glutamate est soumis l'action de la glutamate dshydrognase (GLDH)
responsable de la dsamination qui permet de rgner lo-ctoglutarate (qui
pourra re-servir pour dautres transamination).
La dsamination oxydative
C
NH
3
+
COO
-
CH
2
CH
2
OOC
-
H
NAD(P)
+
NAD(P)H + H
+
C
O
COO
-
CH
2
CH
2
OOC
o-ctoglutarate
-
glutamate
dshydrognase
H
2
O NH
4
+
glutamate
transamination dsamination
cycle de l'ure
Mtabolisme protique
Absorption digestive
Transport
Mtabolisme des protines
Mtabolisme des acides amins
Cycle de lure
Amines biognes
Le cycle de lure dcrit la biosynthse de lure, principale forme dlimination de
lazote.
Lure est synthtise uniquement dans le foie.
Elle est ensuite limine par les reins.
Cycle de lure
organes priphries
Glutamine
glutamine
NH
3
glutamate
NH
3
1
2
1. dsamination (glutaminase)
2. dsamination oxydative
3. transaminase (autres acides amins)
o-ctoglutarate
3
a.a.
H
2
N C
O
NH
2
Le glutamate est lacide amin pivot
des transformations
La biosynthse de lure est
consommatrice dnergie: 3 molcule
dATP par molcule dure.
Les deux premires ractions seffectuent
dans la mitochondrie:
1. Formation dun carbamoyl-phosphate
en prsence dATP, NH
3
et CO
2
.
2. Raction avec lornithine pour former la
citrulline qui peut tre transporte dans le
cytosol.
Les trois suivantes dans le cytoplasme.
3. Le deuxime atome dazote est
incorpor sous forme daspartate qui
ragit avec la citrulline pour former
larginosuccinate.
4. Clivage en fumarate et arginine
5. Lure est libre de larginine.
Lornithine est rgnre
Ainsi,un azote vient de lure et lautre de
laspartate.
Cycle de lure
Cycle de lure
Synthse du carbamoyl phosphate
Cycle de lure
Synthse de la citrulline
Cycle de lure
Synthse de l'argininosuccinate
Cycle de lure
Synthse de l'arginine
Cycle de lure
Synthse de lure
Cycle de lure
Bilan du cycle de lure
Mtabolisme protique
Absorption digestive
Transport
Mtabolisme des protines
Mtabolisme des acides amins
Cycle de lure
Amines biognes
Amines biognes
Presque tous les acides amins peuvent tre dcarboxyls en amines.
Celles-ci sont dsignes comme amines biognes. Elles ont une activit
biologique remarquable.
H
2
N C
R
H
COOH
H
2
N CH
2
CO
2
R
Activit biologique
Leur dgradation est assure par des amines oxydases. Il sagit de
flavonodes qui oxydent les amines en imines.
H
2
N CH
2
R
HN
CH
R
2H
H
2
O
2
amine imine
Suivant que l amine de dpart possde une ou deux fonctions amines,
lenzyme actif est une monoamine oxydase (MAO) ou une diamine oxydase.
Amines biognes
Principales amines biognes qui seront dcrites par la suite:
Le GABA (-amino-butyric acid):neurotransmetteur provenant du glutamate.
Lhistamine: hormone scrtion locale provenant de lhistidine.
La dopamine: catcholamine neurotransmetteur qui provient de la L-DOPA. Ses
mtabolites sont la noradrnaline et ladrnaline (galement des catcholamines).
La srotonine: hormone action locale et neurotransmetteur. Elle provient du 5-
hydroxytryptophane. Elle peut donner naissance la mlatonine, produit de
lpiphyse qui intervient dans le rythme nycthmral.
Lthanolamine: Provient de la srine. Constituant important des phospholipides
membranaires.
La taurine: Provient de la cystine dans le foie. Rle important dans la
conjugaison hpatique (biotransformation) pour augmenter la solubilit et
llimination de composs liposolubles.
Ces diffrents exemples sont vus en dtail dans le chapitre suivant consacr aux
communications intracellulaires.
Adrnaline: biosynthse
Le substrat de dpart de la voie de biosynthse de ladrnaline est la tyrosine
qui se convertit successivement en L-DOPA, dopamine, noradrnaline et
finalement en adrnaline.
OH
OH
C H OH
CH
2
NH
CH
3
Adrnaline
OH
CH
2
CH
NH
2
HOOC
Tyrosine
OH
CH
2
CH
NH
2
HOOC
OH
L-Dopa
OH
OH
C H OH
CH
2
NH
2
Noradrnaline
OH
CH
2
CH
2
NH
2
OH
Dopamine
1
2 3
4
1
Tyrosine hydroxylase (NADPH/H
+
);
2
L-aminoacide dcarboxylase;
3
|-hydroxylase (O
2
, vitamine C);
4
N-mthyltansfrase (S-adnosylmthionine)
Le GABA
Le GABA (acide -aminobutyrique) a une fonction inhibitrice au niveau du SNC.
Une augmentation de GABA a un effet calmant et relaxant sur la musculature
squelettique et diminue lexcitabilit et les troubles du comportement.
Important pour la classe de mdicaments que sont les benzodiazpines
Le GABA: biosynthse
Le GABA est une amine biogne provenant du glutamate
grce laction du glutamate dcarboxylase.
COO-
C H +H
3
N
CH
2
CH
2
COO-
H
C H +H
3
N
CH
2
CH
2
COO-
CO
2
Glutamate GABA
Le GABA: rcepteurs
Le GABA exerce ses effets par l'intermdiaire de deux types de rcepteurs :
le rcepteur GABA-A, le plus connu, et le rcepteur GABA-B.
Des rcepteurs GABA-C ont t dcrits rcemment.
GABA-A et GABA-C sont des rcepteurs ionotropiques
GABA-B est un rcepteur mtabotropique
Le rcepteur GABA-A
Sous la dnomination de
rcepteur GABA-A, on dsigne
un complexe macromolculaire
qui, en plus des sites de fixation
du GABA, comporte des sites de
fixation des benzodiazpines,
des barbituriques, de certains
strodes.
Il s'agit d'un rcepteur-canal,
permable prfrentiellement aux
ions Cl
-
et accessoirement aux
ions Br
-
.
La fixation de molcules de
GABA entrane son ouverture, la
pntration des ions Cl
-
et une
hyperpolarisation cellulaire.
Le rcepteur GABA-A
Au niveau du systme nerveux, l'augmentation de la frquence d'ouverture du
canal chlorure, laissant entrer des ions Cl- est l'origine d'effets inhibiteurs, et sa
diminution, l'origine d'effets opposs. Les consquences de cette modulation de
l'entre des ions chlorure sont rsums dans le tableau suivant.
ouverture :
fermeture :
entre de Cl
-
inhibition d'entre de Cl
-
Anxiolytique Anxiogne
Sdatif hypnotique Stimulant
Anticonvulsivant Proconvulsivant
Amnsiant Promnsiant
Myorelaxant
Le GABA: rcepteur GABA-A et thrapeutique
Ainsi, une particularit du rcepteur GABA-
A est d'tre modul allostriquement par
d'autres rcepteurs qui favorisent ou
inhibent l'effet du GABA.
Ces agents modulateurs changent
l'efficacit du GABA en induisant une
modification de l'architecture protique du
complexe GABA-A.
Ce changement transforme la taille du
canal ce qui modifie la permabilit au
chlore.
Ces rcepteurs sont situs auprs des sites
de fixation du GABA.
Il s'agit des rcepteurs aux
benzodiazpines, aux barbituriques et
certains strodes. Ces substances
favorisent l'effet du GABA, mais sont sans
effet en absence de GABA.
Le rcepteur GABA-B
Il existe deux types de rcepteurs
GABA-B, GABA-B R
1
et GABA-B R
2
,
prsents sous forme de dimres et lis
aux protines G. Ils sont
prsynaptiques et postsynaptiques.
L'activation des rcepteurs GABA-B
prsynaptiques modre la libration du
GABA et de divers autres mdiateurs.
L'activation des rcepteurs GABA-B
postsynaptiques module l'ouverture de
canaux potassium, ce qui entrane
une sortie de potassium intracellulaire
et par consquent une
hyperpolarisation membranaire. Leur
rle en physiologie et pathologie est
assez mal connu mais leur stimulation
entrane une relaxation des muscles
squelettiques
Structure dun rcepteur GABA-B
Principes de base du mtabolisme
Ractions cls en biochimie
Principales voies mtaboliques
Mtabolisme glucidique
Mtabolisme lipidique
Mtabolisme protique
Phosphorylation oxydative
Les principales voies
mtaboliques en biochimie
humaine
Srotonine
La srotonine ou 5-hydroxytryptamine
(5-HT) est une amine connue depuis
une cinquantaine d'annes.
On la trouve:
Dans tout le SNC.
Dans les cellules entro-chromaffines
du tube digestif.
Dans les plaquettes.
5-hydroxytryptamine
N
H
H
2
N
HO
Srotonine: biosynthse
La srotonine ou 5-hydroxytryptamine est
synthtise partir du L-tryptophane.
La transformation du tryptophane en
srotonine comporte deux tapes :
Hydroxylation en 5-hydroxytryptophane
sous l'influence de la tryptophane
hydroxylase qui est l'tape limitante de la
synthse. Le fonctionnement de l'enzyme
ncessite la prsence de
ttrahydrobioptrine, d'oxygne, du
NADPH
2
et d'un mtal, fer ou cuivre.
Dcarboxylation du 5-hydroxytryptophane
en srotonine sous l'influence de la
dcarboxylase des acides amins L-
aromatiques, en prsence de pyridoxal-
phosphate.
N
H
Tryptophane
Indole
5-hydroxytryptophane
Tryptophane hydroxylase
5-hydroxytryptamine
5-hydroxytryptophane
dcarboxylase CO
2
C
NH
3
+
COO
-
H
N
H
C
NH
3
+
COO
-
H
HO
N
H
CH
2
NH
2
HO
Srotonine et mlatonine: biosynthse
La transformation de la srotonine en
mlatonine, s'effectue essentiellement
dans la glande pinale ou piphyse. Elle
comporte aussi deux tapes :
1. Actylation de la fonction amine par la N-
actyl transfrase qui conduit la N-actyl-
srotonine.
2. Mthylation du groupe OH en 5 par
l'hydroxyindol-O-mthyltransfrase. On
obtient ainsi l'actyl-5-mthoxytryptamine
ou mlatonine.
La concentration de mlatonine dans la
glande pinale prsente des variations
circadiennes : elle suit les variations de
l'activit N-actyl transfrase, augmente
pendant la nuit et s'abaisse pendant la
journe. La lumire du jour inhibe la
biosynthse de mlatonine.
5-hydroxytryptamine
N
H
H
2
N
HO
N-actyl-5-hydroxytryptamine
N
H
HN
HO
H
3
C
O
N
H
HN
H
3
CO
H
3
C
O
Mlatonine
Phosphorylation oxydative
Principe
Transport dlectrons
Gradient de protons et production dATP
Dcouplage
Principe
Au cours du cycle de Krebs, il y a production de coenzymes rduits
potentiellement riches en nergie : le NADH
2
et le FADH
2
.
Chez les Eucaryotes, loxydation de ces coenzymes se droule dans la
mitochondrie et saccompagne dune production dATP : cest la
phosphorylation oxydative avec consommation doxygne (chane
respiratoire).
Principe:
Transport des lectrons par 5 complexes situs au sein des crtes de la
membrane interne des mitochondries.
Laccepteur final est loxygne qui sera consomm (respiration!)
Formation dun gradient de proton qui permet la synthse dATP
Phosphorylation oxydative
Principe
Transport dlectrons
Gradient de protons et production dATP
Dcouplage
Transport dlectrons
Il existe 5 ensembles de protines et de coenzymes impliqus dans les
oxydations phosphorylantes de la chane respiratoire. Les 4 premiers
complexes (I, II, III et IV) interviennent dans le transport des lectrons et le
cinquime (V) intervient dans la synthse d'ATP (figure 2). Ces complexes
diffusent de faon indpendante au sein de la membrane interne et connects
par un transporteur liposoluble mobile le coenzyme Q (CoQ) et le cytochrome
C fix la membrane.
Complexe I : NADH-ubiquinone rductase ;
Complexe II : Succinate-ubiquinone rductase ;
Complexe III : Ubiquinone-cytochrome C rductase ;
Complexe IV : Cytochrome oxydase ;
Complexe V : ATP synthtase.
Transport dlectrons
Complexe I : NADH dshydrognase
ou NADH-ubiquinone rductase
NADH
H
+
NAD
+
FMN
MATRICE
ESPACE INTERMEMBRANAIRE
2e
-
AE
p
= -0,22 V
AE
p
= -0,32 V
AE
p
= +0,10 V
FMNH
2
2 Fe
2+
-S
2H
+
Q
QH
2
2 Fe
3+
-S
2H
+
HN NH
O
O O
C
2
H
5
CH
3
CH
3
Amobarbital:
Inhibiteur
NADH + H
+
+ Q NAD
+
+ QH
2
2 atomes dhydrogne sont transports vers lubiquinone
Catalyse le transport de lhydrogne du NADH/H
+
vers lubiquinone par
lintermdiaire du FMN puis des complexes fer-souffre.
Complexe qui participe la formation du gradient de proton!
Complexe II
succinate-ubiquinone rductase
succinate fumarate
FADH
2
2e
-
MATRICE
ESPACE INTERMEMBRANAIRE
b
560
FAD
2 Fe
2+
-S
Q
QH
2
2 Fe
3+
-S
2H
+
2H
+
FADH
2
+ Q FAD + QH
2
Complexe qui ne participe pas la formation du gradient de proton!
Les lectrons du succinate sont accepts par le FAD qui les transfre
aux centres Fe3+-S, puis lubiquinone (Q).
Lubiquinone est la station centrale du transit des lectrons: des
complexes I et II vers le complexe III
Complexe III
ubiquinol-cytochrome c rductase
QH
2
4 H
+
2 Fe
3+
-S
2 Fe
2+
-S
Q
Q
2 H
+
2 QH
2
2Q.
-
2 cyt c
1
-Fe
3+
2 cyt c
1
-Fe
2+
2 cyt b
566
-Fe
3+
2 cyt b
566
-Fe
2+
2 cyt b
560
-Fe
2+
2 cyt b
560
-Fe
3+
Q (vers complexes I et II)
QH
2
(venant des complexes I et II)
(vers le
complexe IV)
MATRICE
ESPACE INTERMEMBRANAIRE
2 cyt c
-Fe
3+
2 cyt c
-Fe
2+
2 e
-
2 e
-
Complexe qui participe la formation du gradient de proton!
Le trajet des lectrons au sein du complexe III porte le nom de cycle Q.
Dabord, cest un cytochrome de type b qui est rduit, puis un complexe
fer-souffre; ensuite cest un cytochrome c1 qui finalement va rduire le
cytochrome c: transporteur SOLUBLE dlectrons.
Rle important du cytochrome c dans lapoptose!
O
O
O
H
O
O
H
3
C
O
CH
3
CH
3
O CH
3
CH
3
O
OH
antimycine A
3
H
2
C
CH
H
2
C
SH
HS
OH
BAL
(British Anti-Lewisite)
Lantimycine A et le dimercaprol
(BAL) bloquent le complexe III entre
le cyt b560 et Q
Complexe IV
cytochrome c oxydase
2 cyt c-Fe
2+
+ 1/2 O
2
+ 2 H
+
2 cyt c-Fe
3+
+ H
2
O
2 cyt c
-Fe
3+
2 cyt c
-Fe
2+
2 cyt a
-Fe
3+
2 cyt a
-Fe
2+
2 cyt a
3
-Fe
3+
2 cyt a
3
-Fe
2+
1/2 O
2
(vient du
complexe III)
MATRICE
ESPACE INTERMEMBRANAIRE
2 Cu
2+
2 Cu
+
2 Cu
2+
2 Cu
+
H
2
O
2 H
+
Complexe qui participe la formation du gradient de proton!
Dernire tape de la raction respiratoire: rduction de
loxygne molculaire en eau!
Un cytochrome a et un cytochrome a3 y sont associs. Le
complexe IV possde galement deux ions cuivriques qui
participent au transfert dlectrons
Complexe IV
cytochrome c oxydase
Le CO (monoxyde dazote Inodore!) produit lors de combustion incomplte
se lie latome de fer de la cytochrome c oxydase et la bloque.
LH
2
S inhibe galement la cytochrome oxydase, mais ne conduit que rarement
des empoisonnements en raison de son odeur!
Les ions cyanures (HCN gaz et KCN per os). Inhibe le fer trivalent de la
cytochrome oxydase. La cellule meurt rapidement par manque dATP. En
dehors des suicides, lintoxication survient lors dincendie o des matires
plastiques sont consumes. Ladministration de thiosulfate sodique est utilis
en traitement. Il permet la conversion du cyanure libre en thiocyanate qui nest
pas toxique et est limin par voie rnale.
Phosphorylation oxydative
Principe
Transport dlectrons
Gradient de protons et production dATP
Dcouplage
Gradient de proton et production dATP
Thorie chimiosmotique
La thorie chimiosmotique renferme trois postulats :
Grce lnergie libre, les complexes I, III et IV assurent le
transfert vers lespace intermembranaire de respectivement 3, 4 et
4 protons lors de lcoulement des lectrons vers le complexe IV:
gradient de protons!
La membrane mitochondriale interne est impermable aux H
+
et
aux OH
-
.
Le gradient de protons est utilis comme source nergtique par
lATP synthase.
Les deux premiers postulats provoquent lalcalinisation de la
matrice et participent ltablissement dun potentiel de
membrane. Les protons regagnent la matrice.
Thorie chimiosmotique
Complexe V :ATP synthase F
0
F
1
Ce complexe appel ATP synthtase ne participe pas ltablissement du
gradient de protons, mais au contraire, il lutilise comme source
dnergie pour la synthse dATP. Il possde deux sous-units : F
0
et F
1
.
La sous-unit F
0
constitue le canal
permettant le passage des H
+
.
la sous-unit F
1
se trouve sur la face
interne de la membrane
mitochondriale interne et dborde
dans la matrice. Elle est responsable
de la synthse de lATP.
ADP
ATP
Le transfert dlectrons de NADH loxygne permet la production de 3 ATP
environ (2.5 selon dautres thories).
1/2 O
2
+ NADH + H
+
H
2
O + NAD
+
3 ADP
+
3 P
i
3 ATP
Le transfert dlectrons du succinate loxygne via le FAD
(complexe II) ne permet la synthse que de deux ATP.
1/2 O
2
+ FADH
2
H
2
O + FAD
2 ADP + 2 P
i
2 ATP
LATP produit dans la mitochondrie est chang contre
un ADP par un antiport lectrognique qui lexpulse vers
le cytosol o il sera utilis. Cet change est favoris par
laccumulation de charges ngatives dans lespace
intermembranaire.
P
i
-
MATRICE
ESPACE INTERMEMBRANAIRE
ATP
4-
ADP
3-
H
+
Bilan de la phosphorylation
oxydative
C
6
H
12
O
6
+ 4 Pi + 4 ADP + 2 H
2
O + 2 FAD + 10 NAD
+
6 CO
2
+ 4 ATP + 2 FADH
2
+ 10 NADH + 10 H
+
4 ATP 30 ATP
Une molcule de glucose produira donc 38 molcules dATP.
Phosphorylation oxydative
Principe
Transport dlectrons
Gradient de protons et production dATP
Dcouplage
OH
NO
2
NO
2
O O
OH OH
O O
Dcouplage et nouveaux-ns
Il existe galement des
dcouplantssagit gnralement
dacides faibles tels que
le 2,4-dinitrophnol ou le
dicoumarol.
Les deux phnomnes: transport lectronique et
oxydation phosphorylante, fonctionnent normalement
ensemble! Dans les mitochondries de certains tissus
(tissu adipeux brun), il est possible de dcoupler ces deux
voies, ce qui permet de produire de la chaleur la place
de lATP form!
Ainsi, les nouveaux-ns sont pourvus du tissu adipeux
brun (couleur brune en raison de la richesse en
mitochondries dont les cyt. absorbent beaucoup de
lumire). Il y existe un dcouplage contrl de la chane
respiratoire qui permet au nouveau-n de maintenir sa
temprature corporelle
OH
NO
2
NO
2
O O
OH OH
O O
Dcouplage et thermognie
Il existe galement des dcouplants
chimiques.
sagit gnralement dacides faibles
tels que le 2,4-dinitrophnol ou le
dicoumarol.
Le dgagement de chaleur est rendu
possible grce la thermognine, protine
de dcouplage situe dans la membrane
interne de la mitochondrie.
Elle fonctionne comme canal protons o
sengagent les protons afin de rejoindre la
matrice mitochondriale. Lnergie est libre
sous forme de chaleur!
Mtabolisme:
Priode alimentaire vs situation de jene
Priode alimentaire
Priode de jene
Vous aimerez peut-être aussi
- Biochimie MetaboliqueDocument360 pagesBiochimie MetaboliqueMafankoloPas encore d'évaluation
- Métabolisme Des Glucides Fiche PDFDocument7 pagesMétabolisme Des Glucides Fiche PDFNaïs LABBADIPas encore d'évaluation
- Metabolisme LipidesDocument49 pagesMetabolisme LipidespartiraretirapasPas encore d'évaluation
- TD 3 Corrigé Regulation SABRINA.2019Document5 pagesTD 3 Corrigé Regulation SABRINA.2019axelPas encore d'évaluation
- La NéoglucogenèseDocument34 pagesLa Néoglucogenèsevague2000Pas encore d'évaluation
- Bioch Méta Questions-ReponsesDocument5 pagesBioch Méta Questions-ReponsesNicoleta ChivuPas encore d'évaluation
- Cycle de Krebs - Biochimie Métabolique - Hader HaidousDocument13 pagesCycle de Krebs - Biochimie Métabolique - Hader Haidousrobbihad100% (3)
- Le Cycle de KrebsDocument19 pagesLe Cycle de KrebsLandry RimbaybarPas encore d'évaluation
- GlycolyseDocument45 pagesGlycolysecepPas encore d'évaluation
- Biochimie Approfondie Cours 1Document36 pagesBiochimie Approfondie Cours 1OnautshuPas encore d'évaluation
- Métabolisme Des LipidesDocument17 pagesMétabolisme Des LipidesMei Wan100% (1)
- CH3.Lipogénèse PFDocument25 pagesCH3.Lipogénèse PFkhammar hichemPas encore d'évaluation
- Cycle de Krebs PDFDocument9 pagesCycle de Krebs PDFMa RyPas encore d'évaluation
- TD Métabolisme 2005-2006Document4 pagesTD Métabolisme 2005-2006Hana Zidi100% (1)
- Métabolisme Lipidique PDFDocument22 pagesMétabolisme Lipidique PDFMampianina Villa TolojanaharyPas encore d'évaluation
- Corrige Biochmeta Sv4 Snp14Document8 pagesCorrige Biochmeta Sv4 Snp14Aziz0% (1)
- Syllabus Neurophysiologie Corrige-1Document131 pagesSyllabus Neurophysiologie Corrige-1Diawara Oumar100% (1)
- Metabolisme LipidesDocument49 pagesMetabolisme LipidesMohamed Ali MtibaaPas encore d'évaluation
- Sujet BiochimieDocument5 pagesSujet BiochimieEmmanuella AssaPas encore d'évaluation
- Metabolisme Des Glucides PDFDocument157 pagesMetabolisme Des Glucides PDFMariemBoujmal33% (3)
- BiochimieDocument60 pagesBiochimieLAMINE DEGUISTARPas encore d'évaluation
- TechniqDocument54 pagesTechniqkhaisse0% (1)
- TD Enzymo Biochimie Met 1Document31 pagesTD Enzymo Biochimie Met 1Saminat RidjaliPas encore d'évaluation
- 1ere S2 Biochimie - Vitamine Et Coenzyme-2Document70 pages1ere S2 Biochimie - Vitamine Et Coenzyme-2Majd Mahfoudh100% (1)
- BiochimieDocument42 pagesBiochimieAchwak Belfadel100% (1)
- Biochimie 2004 - ConcoursDocument16 pagesBiochimie 2004 - ConcoursOumarou KontaPas encore d'évaluation
- Annatut' UE1-Biochimie 2012-2013Document54 pagesAnnatut' UE1-Biochimie 2012-2013oumnia maireche100% (1)
- Correction Du TD de Biochimie 2021-2022Document22 pagesCorrection Du TD de Biochimie 2021-2022Issouf Berthe100% (1)
- Cours Lipides - Part 1Document74 pagesCours Lipides - Part 1AhmedPas encore d'évaluation
- Metabolisme Des Acides AminesDocument12 pagesMetabolisme Des Acides AminesWissal ElbarPas encore d'évaluation
- 003 - Cours Métabolisme Des Corps Cétoniques PDFDocument5 pages003 - Cours Métabolisme Des Corps Cétoniques PDFBlueskyindan100% (1)
- Cours de Physiopathologie 2021 VERSION FINALEDocument266 pagesCours de Physiopathologie 2021 VERSION FINALEespoir luizi100% (2)
- Chapitre Voies MétaboliquesDocument57 pagesChapitre Voies MétaboliquesMBAÏADOUM NGARGUINAM RodriguePas encore d'évaluation
- Ok Jeu 5 ELAT S4 Examen Semestriel Cardio-Neuro-Digestif Aout 2011Document2 pagesOk Jeu 5 ELAT S4 Examen Semestriel Cardio-Neuro-Digestif Aout 2011safemind100% (1)
- Collagene PDFDocument10 pagesCollagene PDFmoane8Pas encore d'évaluation
- Cahier Dexercices de Biochimie 5 MetabolismeDocument15 pagesCahier Dexercices de Biochimie 5 Metabolismeيحيى بورغدةPas encore d'évaluation
- Syllabus Physiologie Endocrinienne 2017-18Document58 pagesSyllabus Physiologie Endocrinienne 2017-18Johnathan ILUNGA100% (1)
- L' HemoglobineDocument33 pagesL' HemoglobineYacine KataloniPas encore d'évaluation
- Physiologie 1ere AnnéeDocument48 pagesPhysiologie 1ere AnnéeZino ZefiPas encore d'évaluation
- Voie Des Pentoses PhosphatesDocument26 pagesVoie Des Pentoses Phosphatescep100% (1)
- 3 Glucides Et Lipides 2012 13Document13 pages3 Glucides Et Lipides 2012 13Mohamed Ali Mtibaa100% (1)
- TD Physiologie EntierDocument66 pagesTD Physiologie EntierAxel Junior OuedraogoPas encore d'évaluation
- Exploration Du Métabolisme Glucidique Et Maladies DiabétiquesDocument78 pagesExploration Du Métabolisme Glucidique Et Maladies DiabétiquesFiston KabambaPas encore d'évaluation
- Serie Les Glucides CorrectionDocument30 pagesSerie Les Glucides CorrectionHabib DarouichePas encore d'évaluation
- Biochimie - GlucidesDocument51 pagesBiochimie - GlucidesmimiPas encore d'évaluation
- TDN10 PDFDocument5 pagesTDN10 PDFJules TiyoumPas encore d'évaluation
- 2 - Le Métabolisme Des GlucidesDocument12 pages2 - Le Métabolisme Des GlucidesFanny Groux100% (2)
- Poly Biochimie Purpan 2007-2008Document79 pagesPoly Biochimie Purpan 2007-2008Hassen Bens100% (2)
- TD Glucide Medecine 2020 2021 (Série)Document4 pagesTD Glucide Medecine 2020 2021 (Série)Sarah BelbachirPas encore d'évaluation
- La Pathologie Métabolique PPT Complétée - Copie - CopieDocument22 pagesLa Pathologie Métabolique PPT Complétée - Copie - CopieRomulus Grefus100% (2)
- Fma1s1-Biochimie Structurale PR Balouch V-08092018Document105 pagesFma1s1-Biochimie Structurale PR Balouch V-08092018Féz EyPas encore d'évaluation
- GlucidesDocument34 pagesGlucidesRémi Cechia100% (1)
- Compl Biologie Etudiant S-1Document43 pagesCompl Biologie Etudiant S-1aloys NdziePas encore d'évaluation
- Métabolisme Des Acides AminésDocument87 pagesMétabolisme Des Acides AminésBlueskyindan100% (1)
- Metabolisme Des Lipides 2011 2012Document13 pagesMetabolisme Des Lipides 2011 2012Ka TiaPas encore d'évaluation
- CM Regulation Metabolique 2 Enzymes Et Allosterie 2019 ModDocument31 pagesCM Regulation Metabolique 2 Enzymes Et Allosterie 2019 ModSirina LadjPas encore d'évaluation
- CoenzymesDocument11 pagesCoenzymesCedric arold Sidje tchomguiPas encore d'évaluation
- Cours de Biochimie MétaboliqueDocument108 pagesCours de Biochimie MétaboliqueMBAÏADOUM NGARGUINAM Rodrigue100% (1)
- Biochimie Métabolique Généralité Et AutresDocument35 pagesBiochimie Métabolique Généralité Et AutresMBAÏADOUM NGARGUINAM RodriguePas encore d'évaluation
- Les Acides AminesDocument8 pagesLes Acides Aminesjoseminka8Pas encore d'évaluation
- 2020-L1SV-Fascicule-Bio MolDocument8 pages2020-L1SV-Fascicule-Bio Molkirito 83Pas encore d'évaluation
- Vitalys Pemf Brochure DetailleeDocument28 pagesVitalys Pemf Brochure Detailleefranklin kaband100% (1)
- Les Bactéries Pour Les Technologies de L'environnementDocument798 pagesLes Bactéries Pour Les Technologies de L'environnementmondelibre100% (3)
- TD Lipides Mtabo 07Document4 pagesTD Lipides Mtabo 07Abdel Redhat67% (6)
- Physiologie Du SPORTDocument29 pagesPhysiologie Du SPORTAbdessamad NfissiPas encore d'évaluation
- Cours de Toxicologie Analytique en Environnement Et Santé - 13-1Document11 pagesCours de Toxicologie Analytique en Environnement Et Santé - 13-1Mebtouche ZianePas encore d'évaluation
- PhotosynthèseDocument22 pagesPhotosynthèseAyoub Lakhdari0% (1)
- La Glycolyse 1Document29 pagesLa Glycolyse 1Zakaria MftPas encore d'évaluation
- 16 Spe Bacblanc1Document3 pages16 Spe Bacblanc1Karima LmrPas encore d'évaluation
- Cours Bioch Métab Version CP 2 Agro IAV Partie 2Document135 pagesCours Bioch Métab Version CP 2 Agro IAV Partie 2Your fav Aya100% (1)
- Nutrition Et Metabolisme Bacterien1Document27 pagesNutrition Et Metabolisme Bacterien1Kenz L'AïdPas encore d'évaluation
- Biologie Et Géologie BCPST 1 Et 2 - Tout-En-fichesDocument359 pagesBiologie Et Géologie BCPST 1 Et 2 - Tout-En-fichescha ChaPas encore d'évaluation
- Guide-De Supplémentation en Iode 2015Document23 pagesGuide-De Supplémentation en Iode 2015John DoePas encore d'évaluation
- Devoir PDFDocument9 pagesDevoir PDFChristavie MboungouPas encore d'évaluation
- 2.bioener Metab RegulDocument140 pages2.bioener Metab RegulKenza Kassab100% (1)
- Bioremédiation PDFDocument31 pagesBioremédiation PDFmekaekPas encore d'évaluation
- 02 MetabolismeDocument5 pages02 MetabolismeYassine SabekPas encore d'évaluation
- Liberation de L Energie Emmagasinee Dans La Matiere Organique Corriges D Activites 1 PDFDocument14 pagesLiberation de L Energie Emmagasinee Dans La Matiere Organique Corriges D Activites 1 PDFpdf67% (3)
- Cours 2 BM ZianeDocument57 pagesCours 2 BM ZianeÉLi NePas encore d'évaluation
- Notes de Cours BIOL 3633Document228 pagesNotes de Cours BIOL 3633OhomonPas encore d'évaluation
- Cours de Biologie Générale Pour Étudiant Version Finale 1Document208 pagesCours de Biologie Générale Pour Étudiant Version Finale 1Nzuzi100% (1)
- 1 1-Introduction PDFDocument21 pages1 1-Introduction PDFحامدي يعقوبPas encore d'évaluation
- Biochimie 2022 9 6Document97 pagesBiochimie 2022 9 6Amina MnPas encore d'évaluation
- Metabolisme Energetique Et Regulationm1baDocument65 pagesMetabolisme Energetique Et Regulationm1baŽdn ÂśšiaPas encore d'évaluation
- Bac Blanc Svt Corrige Sujet Svt Tle c 2024 Dren Abidjan 3Document3 pagesBac Blanc Svt Corrige Sujet Svt Tle c 2024 Dren Abidjan 346682504.isPas encore d'évaluation
- Rouxeville Yves - Abrégé de Physiologie À L'usage Des Acupuncteurs Et Des RéflexothérapeutesDocument225 pagesRouxeville Yves - Abrégé de Physiologie À L'usage Des Acupuncteurs Et Des RéflexothérapeutesMélody Nelson80% (5)
- Cours-Microbio Industr-Ghellai-3emA-convertiDocument41 pagesCours-Microbio Industr-Ghellai-3emA-convertiL'impératrice Britannique100% (1)
- THEME 2 Bilan Thermique Et Corps HumainDocument4 pagesTHEME 2 Bilan Thermique Et Corps Humainandri.enzo6Pas encore d'évaluation
- TD Physiologie Végétale Du 24-11-2021Document2 pagesTD Physiologie Végétale Du 24-11-2021chenjfkekskPas encore d'évaluation
- A2 RedemittelDocument5 pagesA2 RedemittelBrayane KegnePas encore d'évaluation