Académique Documents
Professionnel Documents
Culture Documents
4sc Physique DC
Transféré par
torkitaher0 évaluation0% ont trouvé ce document utile (0 vote)
60 vues2 pagesbac
Titre original
4sc Physique Dc
Copyright
© © All Rights Reserved
Formats disponibles
PDF ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentbac
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
60 vues2 pages4sc Physique DC
Transféré par
torkitaherbac
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
i | —_ a
T
Ministére de éducation et de la formation
Devoir de'contrélen®3 | Classe: 4°
Lycée Korba En Durée : 2heurs
sciences physiques | commun I
MIE (7pts)
Exercice n°1
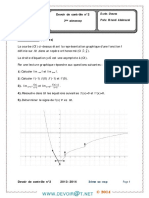
Sur un volume Vb=10mL d'une solution basique S; de base B on verse mL par mL. une solution Se dacide
chlorhydrique de concentration Ca=10™mol.L~*,
- Pour chaque versement on préléve le PH du mélange et on
trace la courbe ci-contre.
1) Ecrire l'équation de la réaction de dosage,
2) La courbe présente 5 zones distinctes dont
[e deux assimilables a des segments de droite :
IAN et PQ, Préciser la signification de chacune
de ces deux zones.
3) Déterminer & partir de la courbe :
«-les coordonnées du point déquivalence.
b-le pKa de la base utilisée, en justifiant la
la méthode.
4) Calculer la concentration de la base.
5) Choisir pormi les indicateurs suivant celui le
plus adopté a ce dosage.
Bleu de bromothymol. de phénol
6 a 76 6 4 68 a8:
- 6) On refait le dosage de la méme base mais en
ajoutant 4 Vb un volume x d'eau pure. On constate que la valeur de pHe a 'équivalence différe de 0,3
unité de la valeur précédente. Indiquer si cette variation de pH est une augmentation ou une dimigution.
Calculer x. On donne la concentration de tacide conjuguée BH" de B a I’équivalence : C= 10%*-7#
Exercice°2
° 5 rs 6
‘Votan vere t.)
Une pile est symbolisée par : Co /Co™(10"™'mol.L“) //Ni*(10°mol.L)/Ni
1) Schématiser cette pile.
2) Ecrire téquation associée de cette pile
3) La f.e.m de cette pile est E = -0,04V
a-Donner les polarités des bornes et le seris du courant dans le circuit extérieur,
b-Ecrine les Equations des transformations qui se produisent aux électrodes, en déduire 'équation de
la réaction spontanée.
¢-Caleulerla valeur de la f.e.m standard E° et celle de la constante d'équilibre de Equation associée,
4) calculer les concentrations des ions se trouvant dans la pile lorsquielle est usée.
PHYSIQUE
Exercice n°1
A/ Une cuve a onde remplie d'eau partagée en trois zones
(Zi, Zz, Zs) de profondeurs différentes. Vibreur
S; et S; deux surfaces de séparation qui
séparent les zones.
Une lame vibrante L produit dans fa zonel
une onde plane qui se propage vers S; et qui
Jui sont paralléles avec une longueur d’onde Ay= 2cm
jpow is bes
1) a-L’onde qui se propage de Z; & Zz subit-Elle un‘changement.
b-De quel phénomane s‘agit-il
2) onde qui se propage dans la zone Z; a une longueur donde A3=1/2. Ai !
-Que se passe-t-il pour onde lorsquelle passe de Zz & Zs.
b-Calculer langle de réfraction de onde dans Zs.
On donne : o=45° , 42=3/4. A, et la loi de décarte : Aysin(r)= Ay.sin(i)
c- Repreduire la figuret.b et représenter les ondes dans les trois zones, ( on respecte les
variations des valeurs des A).
3) En variant la fréquence N du vibreur on constate que le produit A.N change
a- la vitesse dépend-t-elle uniquement des propriétés du milieu de propagation
b-Definir un milieu dipersif et calculer la vitesse de fonde dans chaque zone pour N=25Hz.
4) Le coté AB du cuve ne comporte pas un dispositif d'amortissement, Quel phénoméne peut-il se
produire pour londe se propageant dans Zs au niveau de AB.
B/ Entre une source monochromatique de longueurs donde A et un écran, on place dune distance D=2m
de ce dernier, une fente rectangulaire de largeur a=0,tmm
1) Quappelle-t-on lumi&re monochromatique.
2) Décrire la figure observée sur l'écran et donner son nom.
3) Quel caractére de la lumigre met-il en évidence ce phénoméne ?
4) Calculer la largeur L du frange central, on donne : A #676nm. Comment varie L si a diminue.
Exercice n°2
On donne: h= 6,62.10"5.s , C=3.10'm.S* , teV= 1,6.10F
Les niveaux d'énergie d'un atome sont quantifiés. Pour 'atome d'hydrogéne ces énergies sont données
par la relation : B38 avec :E, en eV et n entier positif.
1) a-Representer le diagramme des niveaux d'énergies de latome de 'hydragéne (On se limite aux
niveaux n=6 et on indiquera la valeur de l'énergie de chaque niveau).
b-Justifier la quantification de énergie d'un atome.
¢-Quiappelle-t-on le niveau d'énergie le plus bas et celui pour E=OeV.
d-Quiappelle-t-on transition.
2) Quel est le comportement d'un atome dhydrogéne pris a état fondamental lorsquil recoit un photons
d'énergie :
1) 13,06 eV, ag)1BeV, as) 12, 75eV
b-On éclaire du gaz hydrogéne dont ses atomes sont d'état fondamentale par une lumiére de quatre
radiations At, Az, As, As d'énergie respectives : 10,2eV , 12,6eV , 12,75eV , 12,2eV. Quelles sont parmi
ces radiations celles qui elle absorbées. Combien des raies contient le spectre d'absorption dans cette
expérience.
3) Un mélange datomes dhydrogéne a l'état excités sont a des niveaux déénergies comprises entre
4 et 6, Au cours des retours sur le niveau2, ces atomes émettent des énergies.
‘a-sous quelle forme cette énergie est émise : est-elle quantifiée ou continues
b-Calculer les nombres et les longueurs donde des radiations émises.
c-Ces radiations émises sont elles visibles ( limite du spectre visible : 400nm ¢ A « 800nm)
Vous aimerez peut-être aussi
- Combinepdf (2) WatermarkDocument11 pagesCombinepdf (2) WatermarktorkitaherPas encore d'évaluation
- B 81 B 1 ADocument2 pagesB 81 B 1 AtorkitaherPas encore d'évaluation
- All Lim ContinuiteDocument4 pagesAll Lim ContinuitetorkitaherPas encore d'évaluation
- Série D'exercices - Math Continuité Et Limites - Bac Sciences Exp (2010-2011) MR FalehDocument4 pagesSérie D'exercices - Math Continuité Et Limites - Bac Sciences Exp (2010-2011) MR FalehtorkitaherPas encore d'évaluation
- 4° R - Primitives SMDocument2 pages4° R - Primitives SMtorkitaherPas encore d'évaluation
- Dc3 2014 2015 4mathDocument5 pagesDc3 2014 2015 4mathtorkitaherPas encore d'évaluation
- 4.Sc.s.2.07 WWW - Tunisie Etudes - InfoDocument2 pages4.Sc.s.2.07 WWW - Tunisie Etudes - InfotorkitaherPas encore d'évaluation
- Calcul IntegralDocument2 pagesCalcul IntegraltorkitaherPas encore d'évaluation
- 4.Sc.s.2.07 WWW - Tunisie Etudes - InfoDocument2 pages4.Sc.s.2.07 WWW - Tunisie Etudes - InfotorkitaherPas encore d'évaluation
- Devoir de Contrôle N°3 - Français - Bac Mathématiques (2011-2012) Mme Laâbidi BesmaDocument2 pagesDevoir de Contrôle N°3 - Français - Bac Mathématiques (2011-2012) Mme Laâbidi BesmatorkitaherPas encore d'évaluation
- Devoir de Contrôle N°2 - Math - 3ème Sciences Exp (2015-2016) MR Bouzouraa - AnisDocument3 pagesDevoir de Contrôle N°2 - Math - 3ème Sciences Exp (2015-2016) MR Bouzouraa - Anistorkitaher100% (1)
- Devoir de Contrôle N°2 Avec Correction - Math Dérivabilité-Trigonometrie - 3ème Sciences Exp (2013-2014) MR Mhamdi AbderrazekDocument4 pagesDevoir de Contrôle N°2 Avec Correction - Math Dérivabilité-Trigonometrie - 3ème Sciences Exp (2013-2014) MR Mhamdi Abderrazektorkitaher100% (1)
- Controle 2 GastliDocument2 pagesControle 2 GastlitorkitaherPas encore d'évaluation
- Devoir de Contrôle N°3 Lycée Pilote - Français - Bac Sciences Exp (2010-2011) MR YahyaouiDocument2 pagesDevoir de Contrôle N°3 Lycée Pilote - Français - Bac Sciences Exp (2010-2011) MR YahyaouitorkitaherPas encore d'évaluation
- Dev Syn 2 MathsDocument2 pagesDev Syn 2 MathstorkitaherPas encore d'évaluation
- Devoir de Contrôle N°3 Lycée Pilote Avec Correction - Français - Bac Toutes Sections (2012-2013) MR Marouane YahyaouiDocument4 pagesDevoir de Contrôle N°3 Lycée Pilote Avec Correction - Français - Bac Toutes Sections (2012-2013) MR Marouane Yahyaouitorkitaher100% (1)
- Exercices Primitives CorrigésDocument11 pagesExercices Primitives CorrigéstorkitaherPas encore d'évaluation
- Devoir de Contrôle N°3 - Français - Bac SC Exp (2009-2010) Mme Rania HassineDocument5 pagesDevoir de Contrôle N°3 - Français - Bac SC Exp (2009-2010) Mme Rania HassinetorkitaherPas encore d'évaluation
- Devoir de Contrôle N°1 - Physique - 3ème Informatique (2010-2011) MR YOUNSI DhaouiDocument3 pagesDevoir de Contrôle N°1 - Physique - 3ème Informatique (2010-2011) MR YOUNSI Dhaouitorkitaher80% (5)
- Devoir de Contrôle N°1 - Physique - 3ème Info (2009-2010) MR Z.MakremDocument1 pageDevoir de Contrôle N°1 - Physique - 3ème Info (2009-2010) MR Z.MakremtorkitaherPas encore d'évaluation
- Serie de Revision Bac 2011 - Math - Bac Mathématiques (2010-2011) MR Youssef BoulilaDocument6 pagesSerie de Revision Bac 2011 - Math - Bac Mathématiques (2010-2011) MR Youssef BoulilatorkitaherPas encore d'évaluation
- Similitude PDFDocument20 pagesSimilitude PDFtorkitaher100% (2)
- Devoir de Contrôle N°1 - Physique - 3ème Informatique (2007-2008) MR Boussaidi FayçalDocument2 pagesDevoir de Contrôle N°1 - Physique - 3ème Informatique (2007-2008) MR Boussaidi FayçaltorkitaherPas encore d'évaluation
- Devoir de Synthese N°2: Ecole Sadiki TunisDocument4 pagesDevoir de Synthese N°2: Ecole Sadiki TunistorkitaherPas encore d'évaluation