Académique Documents
Professionnel Documents
Culture Documents
Corriges Equilibres de Phases Liquide Solide Des Melanges Binaires
Corriges Equilibres de Phases Liquide Solide Des Melanges Binaires
Transféré par
oumayma afdhal100%(1)100% ont trouvé ce document utile (1 vote)
74 vues6 pagesTitre original
corriges-equilibres-de-phases-liquide-solide-des-melanges-binaires
Copyright
© © All Rights Reserved
Formats disponibles
PDF ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF ou lisez en ligne sur Scribd
100%(1)100% ont trouvé ce document utile (1 vote)
74 vues6 pagesCorriges Equilibres de Phases Liquide Solide Des Melanges Binaires
Corriges Equilibres de Phases Liquide Solide Des Melanges Binaires
Transféré par
oumayma afdhalDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 6
TD TSW Etude des 6
bres liquide-solide des mélanges binaires 1
Corrigé du TD T5B
Etude des équilibres liquide-solide des mélanges binaires
(QCM bE cours
41/ Faux : i faut pour cela que la pression soit constante. 2/ Veal
3/ Faux : Cest le cas de tous les points correspondant a des mélanges & la température de leutectique.
4/Vrat 5/ Faux : elle Indique la présence d'un composé définl
6/ Faux {I se décompose en fondant (certes & température constante sila pression est fxée) 7/Vrai
EXERCICES DE COMPETENCES
VERS MELANGES METALLIQUE:
1a/ —I:une phaseliquide (1) (mélange Cu + NI) UL: une solution solide (s) (mélange Cu + NI)
1: phase liquide (1) + phase solide (s)
1.b/ Pour ce mélange M, le théoréme de Fhorizontale fournit a fraction massique de la phase liquide en Nicwy = wy = 33%
52%, Dapris le théoréme des moments : Sham ME = Mi = 2 or, mt + mt
cet celle de la phase solide : wh, = Ww.
110 kg. Avec ces deus: équations,on trouve finalement: mt» 0,7 kgetm! m 0,63 kg
+ dans la phase solide, on trouve donc m*xcwg, = 0,19 kg de nickel et 018 kg de cuivre
~ dans la phase liquide, on trouve m'xwly ~ 021 kg de nickel et O42 kg de cure.
4Le/ A aucun moment ne coexistent trols phases, de sorte qu'll n'y a aucun paller de température |
lors du refroidissement du mélange. Voici la courbe d’analyse thermique (en fonction du temps) : —-}——————->_
2a/ Is une phase liquide (J) (mélange Pb + As) IV : deux phases solides (53) (Pb pur) et (s:) (As pur)
11: phase liquide (1) + phase solide (s:) IL: phase liquide (1) + phase solide (3:)
2.b/ Ona des mélanges liquides homogénes, mais des mélanges hétérogenes 4 1'état solide.
2e/ Ce mélange dit eutectique fond en produisant un liquide de méme composition que le
Sollde hétérogene initial, et ce température constante sla pression est fixée.
La courbe d’analyse thermique correspondante est présentée ci-contre. Le changement
d'etat se fait 3 température constante comme le montre un caleul de varianee : le nombre
de degrés de liberté est de 0.
Nombre de parametres intensifs de description :6 (P,7, wh, Whe, w9, w32
Relations a I'équilibre liquide /solide : 5 (wb, + wh, = Lwpl = Lw3? = Let deux
relations de Guldberg et Waage pour les équilibres de phase Pb(,) = Pb(1) et
As) = As()
Relation supplémentaire : 1 (P = 1 bar).
3.a/ Tune phase liquide (1) (mélange Sn + Pb) IV : solution solide (ss) (Sn dans Pb)
V solution solide (s,) (Pb dans Sn) II: phase liquide (1) + solution solide (s:)
LiL: phase liquide (1) + solution solide (s:) VI : solution solide (s:) + solution solide (52)
Ces deux solidesne sont done que partiellement miscibles.
3.b/ A150 °C, le mélange eutectique de fraction massique en étain ws, = 60% se trouve sousla forme d'un solide hétérogéne
avec deux phases (s:) et (s:), de compositions respectives ws? = 19% et w32 = 94%. D'aprés le théoréme des moments :
i _ wli-vee . 083. on en déduit qu’ ya environ 45 % de solution solide (s,) &t 5 % de solution solide (53)
PG-Lyeée Baimbridge Janvier 2017 “&. MOMIN
TD TSW Etude des 6
bres liquide-solide des mélanges binaires 2
3.c/ Le mélange eutectique est le mélange solide qui fond a la plus basse température, ici 185 °C. En pratique, ce mélange
précis sert pour la soudure des métaux au fer souder!
EXERcICE 2 : CONSTRUCTION DU DIAGRAMME BINAIRE D'UN OLEUM
1/Cesmélanges présentent deux uniques changements de
pente, délimitant un palier de changement d'état isobare
la transition liquide/solide se fait a température
constante.
Pour w = 0,19 et w= 0,60, on retrouve ce palier de
changement & basse température lors du refroidissement
des autres mélanges de composition voisine : c'est un
paller eutectique. Les mélanges désignés sont done des
mélanges eutectiques.
Pour w = 0,45, le palier se fait A « haute température » et
n'est observé pour aucun autre mélange. On a done a faire
aun composé défin.
2G
fini C = ($0,}, (1,50,), en cours de cristallisation
Le composé défini est en équilibre avec $03(1) et Hy $04(1).
Nombre de paramétres intensifs de description
(PID): 5 (P,7.x2,x50,-*H,50,):
Nombre de relations a Téquilibre entre PID : 3
(22 = Lalo, + shso, = 1 relation de Guldberg
et Waage pour Téquilibre de fusion
604), (H950.}, 6) = 0 5050) + b He50,(1))
Nombre de relations particuliéres :2(P = 1 baret
Taso
Le nombre de degrés de liberté est L = 5 —3 —
estbien observe,
Ainsi, le composé défini change d'état température constante, ce qui
BY 0 = RE er 2500, Le composé atin est done
60,},H2804},6)
4/ voir ci-dessus.
ES NICKEL-BORE
41/Lescompasés définis ont pour formule brute Zn, As, tel que 2 = =,
Pour xy. =) = 0,40,
donc ila pour formule Zn, As
Dowrsriz—x, $42 = Edoncil apourformule ZnAs,
2/Q):2n+As (51) :2nsAsy (52) : 20s, (s):As (s):20
Domaine [1 z 3 a 3 6 7 a a
Phases 0 [oe oe) om | Om | Om [eames |e
3/ Dour C: composé défini ZnyAs, en changement i’état, Le composé défini est en équilibre avec Zn(0) et As().
Nombre de paramétres intensifs de description (PID) :5 (P,7,*3),asy-%hy» TAs):
Nombre de relations a Yequilibre entre PID : 3 (Xfh.gs, = Lxby + the = 1 relation de Guldberg et Waage pour
équilibre de fusion :ZngAs,(5,) = 3 Zn) + 2As(D)
a
Nombre de relations particulidres :2 (P = 1 bar et
PG-Lyeée Baimbridge Janvier 2017 “&. MOMIN
‘TD TSR Etude des équilibres liquide-solide des mélanges binaires a
Le nombre de degrés de liberté est L = 5-3-2 = 0.
Pour E: ZnAs,(s) et ZnyAs,(s) sont en équilibre avec Zn(I) et As(1).
Nombre de paramatres intensifs de description (PID) : 6 (P,T, 88 ,4.,*¥Eaup thar ha):
Nombre de relations & V'équilibre entre PID : 5 (¥#5,asq = 1,XFbas, = 1.¥hy + *h, = 1 relations de Guldberg et
Waage pour les équilibres de fusion :Zn,Ass(6) = 3 ZnQ)+ 2 As(D et ZnAss(3) = ZnQ) +2 As()))
Nombrede relations particulitves : 1 (P = 1 bar).
Le nombre de degrésde liberté est L = 6-5 —1=0.
3/ Caleulons d’abord Ia fraction motaire en arsenic correspondant & Was = 087 + Xas=
wasMas
etwas = 08S:
perpen,
a rue +5 C3
GCA)
>t
4/ Le composé defini solide s'échaulffe jusqu’’ la température de fusion, voisine de 1010 °C: ily a alors deux phases en
présence (phase solide du composé défini et phase liquide mélange de As et Zn). Le changement d'état se fait a cette
température avant quele liquide qui en résulte se réchautfle.
EXERCICE 4 : LES ALLIAGES TITANE-VANADIUM
41/ A: phase liguide homogéne (I) (mélange Ti+ V) Bet C: (1) + solution solide (s) (mélange Ti+ V)
2/ Une solution solide est un mélange de deux solides miscibles qui forment une unique phase homogene,
3/Ce mélange est dit « indifférent ». Il fond a température constante sous pression fixée, et 8 composition des phases solide
cet liquide égales et constantes,
4/ Pour le mélange indifférent en changement d'état
= Nombre de paramétres intensifs de description ; 6
(Tawi wh whew)
- Nombre de relations indépendantes a 'équilibre © 4 (wg +
wi = Lud + wh, = 1, relations de Guldberg et Waage pour
les équilibres de phase V{S} = VA) et TI) = TiC)
- Relations supplémentaires : 2(P estfixée A11 ar et wih = wh
lors du changement d'état)
Cela donne un nombre de degrés de liberté nul : ta
température est forcément fixée lors du changement d'état.
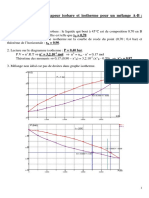
5/ La température d’apparition du premier cristal se lit sur le liquidus : 1620 °C environ. A /horlzontale sur le solidus, om lit
la composition du premier cristal qui apparait : w5(1620 °C) = 0,04.
6/Lemélange étudié a pour fraction massique en vanadium : wy = 1,100. A 1600 °C, on se trouve en présence d'un
0,06, et d’un liquide de composition wea horizontale
solide de composition ue ahorizontale surle solidus: w{ (1600 °C
sur le liquidus : w}(1600 °C) = 0,16.
Diaprds te théortme des moments chimiques : 2 = 4="E ~ 0,67. De plus, m+ m* = 1000kg, En combinant ces deux
010? kg etm
Equations, on trouve :m! 0% 10? kg. Avec es fractions massiques dans les deux phases, on en déduit
mj =w)xm!~ 644g mb =m! =m) ~BAx10% kg mh = wyxm* = 36kg my = m*— mj ~ 5.6x107 kg
PG-Lyeée Baimbridge Janvier 2017 “&. MOMIN
‘TD TSR Etude des équilibres liquide-solide des mélanges binaires 4
EXERCICES DE REFLEXION
PG-Lyeée Baimbridge Janvier 2017 “&. MOMIN
‘TD TSR Etude des équilibres liquide-solide des mélanges binaires 5
PG-Lyeée Baimbridge Janvier 2017 “&. MOMIN
ihe +e
Te
a
“&. MOMIN
Vous aimerez peut-être aussi
- Test 1 Diagramme de Phases SMC3Document17 pagesTest 1 Diagramme de Phases SMC3oumayma afdhal100% (1)
- Cours Equilibres de Phases Liquide Vapeur Des Melanges BinairesDocument23 pagesCours Equilibres de Phases Liquide Vapeur Des Melanges Binairesoumayma afdhalPas encore d'évaluation
- Polycopié CristallographieDocument69 pagesPolycopié Cristallographieاجي تقرىPas encore d'évaluation
- O2 - Binaires G2D CorrigeDocument8 pagesO2 - Binaires G2D Corrigeoumayma afdhalPas encore d'évaluation
- Exercices Equilibres de Phases Liquide Vapeur Des Melanges BinairesDocument8 pagesExercices Equilibres de Phases Liquide Vapeur Des Melanges Binairesoumayma afdhal100% (1)