Académique Documents
Professionnel Documents
Culture Documents
Ab DS3 2007
Transféré par
la physique selon le programme FrançaisTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Ab DS3 2007
Transféré par
la physique selon le programme FrançaisDroits d'auteur :
Formats disponibles
Le 26/11/2007 Page : 1 / 6 Devoir n°3 (2h) Tale S5
I. Etat final d’un système chimique : étude par spectrophotométrie et titrage (8,5 points)
•Les ions iodure (I-) réagissent avec les ions peroxodisulfate (S2O82-). L’équation associée à la réaction s’écrit :
2I-(aq) + S2O82-(aq) = I2(aq) + 2SO42-(aq) (1)
•En présence d’ions iodure, le diiode se transforme en ions triiodure (I3-) de couleur brune. Pour simplifier
l’écriture, on raisonnera à partir de l’équation (1) sans tenir compte de la formation des ions triiodure.
•A un instant pris pour origine des dates (t = 0 min), on réalise un mélange réactionnel S à partir d’un volume
V1 = 10,0 mL de solution aqueuse d’iodure de potassium (K+(aq) + I-(aq)) de concentration molaire en soluté apporté c1
= 5,0×10-1 mol.L-1 et d’un volume V2 = 10,0 mL de solution aqueuse de peroxodisulfate de sodium
(2Na+(aq) + S2O82-(aq)) de concentration molaire en soluté apporté c2 = 5,0×10-3 mol.L-1.
1. Suivi spectrophotométrique de la transformation chimique.
• On souhaite étudier la formation du diiode au cours du temps par spectrophotométrie.
• Un prélèvement du mélange réactionnel S est introduit rapidement dans la cuve d’un spectrophotomètre
dont la longueur d’onde est réglée sur une valeur adaptée à l’absorption par le diiode. On admettra que le
diiode est la seule espèce colorée présente dans le mélange et qu’au cours de l’expérience la température
de la solution reste constante.
• Les résultats des mesures d’absorbance en fonction du temps sont rassemblés dans le tableau ci-
dessous :
t (min) 1 2 4 6 8 10 12 14 16 18 20 30 40 50 60 90
A 0,08 0,13 0,23 0,31 0,39 0,45 0,50 0,55 0,59 0,62 0,65 0,74 0,77 0,79 0,79 0,79
1) La spectrophotométrie est une méthode non destructive pour suivre l’évolution d’un système chimique.
Proposer une autre méthode de suivi cinétique non destructive.
• La mesure de l’absorbance A de solutions aqueuses de diiode de différentes concentrations molaires c
montre que A est proportionnelle à c. On détermine le coefficient de proportionnalité k à partir du couple
de valeurs (c = 5,0×10-3 mol.L-1 ; A = 1,70).
2) Montrer que la valeur du coefficient de proportionnalité k vaut 3,4×102 et préciser son unité.
3) Montrer, que pour que le mélange réactionnel S réalisé au début de l’étude, la quantité de matière de
A(t )
diiode formé à l’instant t s’exprime sous la forme : nI 2 (t ) = (V1 + V2 )
k
4) Calculer la quantité de matière de diiode formé à l’instant de date t = 90 min.
• On note x l’avancement de la réaction à l’instant de date t. A cet instant, la quantité de diiode formé est
égale à x.
• En utilisant les valeurs expérimentales et la relation donnée à la question 3), on obtient la courbe
traduisant l’évolution de x en fonction du temps ; cette courbe est représentée sur la feuille réponse à
RENDRE AVEC LA COPIE.
• La vitesse volumique de réaction est définie par v = × où VS correspond au volume de la solution.
5) En précisant la méthode utilisée, décrire l’évolution de cette vitesse au cours du temps.
6) Justifier l’évolution de cette vitesse d’après les connaissances du cours.
7) Donner une méthode qui permettrait d’obtenir plus rapidement la même quantité finale de diiode à partir
du même mélange réactionnel S.
jj/11/aa 2654496.doc 1/6
2. Titrage du diiode formé après 90 minutes de réaction.
• On veut vérifier par un titrage la quantité de matière de diiode formé à l’instant de date t = 90 min. Pour
cela, à cet instant, on introduit dans un erlenmeyer contenant de l’eau glacée un échantillon de volume
V = 5,0 mL du mélange réactionnel S. A l’aide d’une solution étalon de thiosulfate de sodium
(2Na+(aq) + S2O32-(aq)) de concentration molaire en soluté apporté c’ = 2,5×10-3 mol.L-1, on titre le diiode
présent dans l’échantillon en présence d’un indicateur de fin de réaction. L’équivalence est atteinte pour
un volume V’E = 9,2 mL.
• L’équation associée à la réaction support du titrage est :
I2(aq) + 2S2O32-(aq) = 2 I-(aq) + S4O62-(aq)
8) Représenter sur la copie le schéma du dispositif de titrage en précisant le nom du matériel et la nature
des solutions.
9) Définir l’équivalence du titrage.
• Exploitation du titrage.
10)En exploitant le résultat du titrage, exprimer littéralement en fonction de c’ et de V’E la quantité de
matière de diiode formé, à l’instant de date t = 90 min, dans le mélange réactionnel décrit au début de
l’exercice.
Le candidat s’il le souhaite, pourra compléter et exploiter le tableau d’avancement figurant sur la feuille
réponse A RENDRE AVEC LA COPIE.
11) Calculer la valeur de cette quantité de diiode formé.
12)Cette valeur est-elle compatible avec celle trouvée au A.4) ? Aucun calcul d’écart relatif n’est demandé.
jj/11/aa 2654496.doc 2/6
II. Radioactivité et datation au carbone 14 (8 points)
A. Équation de désintégration nucléaire, diagramme (Z, N)
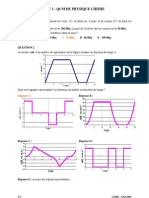
• Le diagramme ci-dessous est un diagramme (Z, N) très simplifié et schématique
(Z : nombre de protons, N : nombre de neutrons).
150
N>Z
100
émission
β– N=Z
50 N<Z
émission
β+
20 40 60 80 100 Z
Figure 1.
1) Que représente la zone grisée dans le diagramme (Z, N), Figure 1 ?
• Soit la réaction nucléaire de transmutation indiquée par la flèche ci-contre entre un noyau père et son
noyau fils.
2) Sachant qu'une seule particule est émise en plus du noyau fils, écrire cette réaction de désintégration
nucléaire et indiquer les deux lois de conservation (lois de Soddy) qui régissent toute réaction nucléaire.
3) Quel type de radioactivité concerne la réaction précédente (celle du 2) ?
jj/11/aa 2654496.doc 3/6
De toutes les méthodes radio chronologiques (basées la loi de décroissance radioactive), celle de la datation du
carbone 14 est la plus connue. Dans la haute atmosphère, soumis au RCG (rayonnement cosmique galactique
constitué de protons), des neutrons secondaires interagissent avec des noyaux d'azote 14. Cette réaction forme un
isotope X du carbone : le fameux carbone 14.
Immédiatement formé, le carbone 14 s'oxyde en se combinant à l'oxygène pour former du dioxyde de carbone qui se
mélange avec le reste de l'atmosphère. Or le carbone 14 est radioactif. Williard Franck Libby (physicien et chimiste
américain 1908 - 1980) a montré que la teneur en carbone 14 est constante dans le monde (dans l'atmosphère
comme dans chaque organisme vivant).
Cela est dû à un équilibre entre la désintégration et la production de carbone 14. Chaque gramme de carbone contient
des atomes de carbone 14. On enregistre en moyenne 13,5 désintégrations par minute et par gramme de carbone.
Lorsqu'un arbre, par exemple, est abattu, le bois cesse de vivre, le processus de photosynthèse s'arrête et il n'y a
plus absorption de dioxyde de carbone. Le carbone 14 est alors libre de se désintégrer sans compensation. On
peut donc dater l'âge de la mort de l'organisme (au moment où cesse tout échange de CO2 avec l'atmosphère).
2. Formation du carbone 14 dans la haute atmosphère
Données : Z (C) = 6, Z (N) = 7.
4) L'azote 14 et le carbone 14 sont-ils isotopes ? Justifier.
5) Dans la haute atmosphère, l'équation de la réaction qui a lieu entre un neutron secondaire et un noyau
d'azote 14 s'écrit : N + n → X + p
Vérifier, en justifiant avec les lois de conservation, que X est bien du carbone 14.
3. Décroissance du carbone 14
• L'étude de l'évolution de la population moyenne d'un ensemble de noyaux radioactifs permet d'écrire :
∆N = - λ N ∆t où N est le nombre de noyaux à la date t et ∆N est la variation du nombre de noyaux
pendant la durée ∆t (entre t et t + ∆t).
• Cette relation conduit à la loi de décroissance radioactive N(t) = N0 × e–λt dans laquelle N0 est le nombre
de noyaux à la date t = 0.
6) Dans l'expression de la loi de décroissance radioactive, comment se nomme λ ?
• D'après les travaux de Libby, la demi-vie ou période t1/2 du carbone 14 est t1/2 = 5730 ans.
7) Donner la définition de la demi-vie ou période t1/2 du carbone 14.
8) En utilisant la loi de décroissance radioactive et en s'aidant de la définition de la demi-vie demandée
au 7), montrer que λ, est liée à la demi-vie t1/2 par la relation λ = .
9) Par une analyse dimensionnelle, déterminer l'unité de λ.
10)Rappeler la définition de l'activité A d'un échantillon radioactif.
A partir de cette définition, montrer que l'activité A à l'instant t et le nombre N de noyaux présents
dans l'échantillon à l'instant t sont liés par la relation A = λ N.
11) En utilisant l'expression obtenue au 10), calculer, en faisant apparaître l'application numérique, le
nombre N d'atomes de carbone 14 dans 1 g de carbone tel que A = 13,5 désintégrations par minute pour
ce gramme de carbone.
Donnée : 1 an = 5,26×10 5 min
jj/11/aa 2654496.doc 4/6
NOM : ................................................ Prénom : ................................................ Classe : TS 5
A RENDRE AVEC LA COPIE
Question A.5)
Question B.3)
•Rappel: le candidat pourra, s'il le souhaite compléter et exploiter le tableau donné ci-dessous:
équation-bilan I2(aq) + 2S2O32–(aq) = 2 I–(aq) + S4O62–(aq)
État du système Avancement Quantité de matière en mol
Etat initial
au cours de la transformation
Etat final
jj/11/aa 2654496.doc 5/6
NOM : ................................................ Prénom : ................................................ Classe : TS 5
III.Ondes en question (3,5 points)
•Les questions sont indépendantes. Répondre aux questions suivantes en justifiant, si besoin, vos réponses.
Question 1 : On excite l’extrémité d’une corde à une fréquence f = 50 Hz. Les vibrations se propagent
le long de la corde avec une célérité v = 10 m.s-1. Quelle est la longueur d’onde λ ?
Réponse avec justification :
Question 2 : Un faisceau de lumière, parallèle monochromatique, de longueur d’onde λ, arrive sur une fente
horizontale de largeur a (a est de l’ordre du dixième de millimètre). Quelle figure de diffraction parmi celles
proposées ci-dessous, observe-t-on sur l’écran situé à une distance D, grande devant a ?
Réponse avec justification :
Question 3 : Ces affirmations sont-elles vraies ou fausses ?
a) La fréquence d’une radiation lumineuse monochromatique, qui passe d’un milieu transparent à un autre milieu
d’indice plus élevé, ne change pas. Réponse sans justification : ............
b) La longueur d’onde d’une radiation lumineuse monochromatique, qui passe d’un milieu transparent à un autre
milieu d’indice plus élevé, ne change pas. Réponse sans justification : ............
Questions 4 : La célérité du son dans l’air est v = où T est la température absolue (en kelvin) et M la masse molaire
du gaz ; k est une constante.
Répondre sans justifier.
a) La célérité du son diminue-t-elle quand la température augmente ? Réponse : ................................................
b) La célérité du son varie-t-elle avec la fréquence ? Réponse : ................................................
c) La célérité du son dans l’air est-elle de l’ordre de 1000 km.s-1 ? Réponse : ................................................
Question 5 : Un pêcheur à la ligne est au bord d’un lac tranquille. Soudain un enfant vient perturber la surface de
l’eau en jetant un caillou à quelques mètres du flotteur. Le flotteur se déplace-t-il à la célérité v de l’onde ?
Réponse sans justification : ............
Question 6 : Deux ébranlements se propagent en sens contraire sur une corde tendue. On a plusieurs situations
possibles après leur point de rencontre. Choisir celle qui est physiquement possible.
Réponse sans justification : ............
jj/11/aa 2654496.doc 6/6
Vous aimerez peut-être aussi
- ENI GEIPI Physique 2010 ReponseDocument8 pagesENI GEIPI Physique 2010 Reponsela physique selon le programme FrançaisPas encore d'évaluation
- Tagemage AnnalesDocument32 pagesTagemage AnnalespfservantPas encore d'évaluation
- Geipi Physique 2008Document11 pagesGeipi Physique 2008la physique selon le programme FrançaisPas encore d'évaluation
- Geipi Eni PhysiqueDocument5 pagesGeipi Eni Physiquela physique selon le programme FrançaisPas encore d'évaluation
- ENI GEIPI Physique 2010Document9 pagesENI GEIPI Physique 2010la physique selon le programme FrançaisPas encore d'évaluation
- STI2007PDocument18 pagesSTI2007Pla physique selon le programme FrançaisPas encore d'évaluation
- Corrige GEIPI PHYSIQUE 2008Document9 pagesCorrige GEIPI PHYSIQUE 2008la physique selon le programme FrançaisPas encore d'évaluation
- Eni Geipi Physique 2008Document9 pagesEni Geipi Physique 2008la physique selon le programme FrançaisPas encore d'évaluation
- Eni Geipi Physique 2009Document9 pagesEni Geipi Physique 2009la physique selon le programme FrançaisPas encore d'évaluation
- Corrige Geipi QCM 2006Document7 pagesCorrige Geipi QCM 2006la physique selon le programme FrançaisPas encore d'évaluation
- CS069974Document4 pagesCS069974la physique selon le programme FrançaisPas encore d'évaluation
- Corrige Exercices Conductimetrie Feuille Travaux DirigesDocument3 pagesCorrige Exercices Conductimetrie Feuille Travaux Dirigesla physique selon le programme Français89% (9)
- Eni Geipi Physique 2009Document9 pagesEni Geipi Physique 2009la physique selon le programme FrançaisPas encore d'évaluation
- Corrige GEIPI Sujet 1Document9 pagesCorrige GEIPI Sujet 1la physique selon le programme FrançaisPas encore d'évaluation
- Dusa 2 Dspe 2 Dsujet 2 Dtitragechlorureconductimetrie 2 D 4 PtsDocument3 pagesDusa 2 Dspe 2 Dsujet 2 Dtitragechlorureconductimetrie 2 D 4 Ptsla physique selon le programme FrançaisPas encore d'évaluation
- Corrige ENI GEIPI Physique 2009Document8 pagesCorrige ENI GEIPI Physique 2009la physique selon le programme FrançaisPas encore d'évaluation
- Corrige Eni Geipi Sujet 1Document7 pagesCorrige Eni Geipi Sujet 1la physique selon le programme FrançaisPas encore d'évaluation
- 08 PhysMPDocument8 pages08 PhysMPla physique selon le programme FrançaisPas encore d'évaluation
- Epreuve de Physique 2005 Concours D Admission Al ESSADocument4 pagesEpreuve de Physique 2005 Concours D Admission Al ESSAla physique selon le programme FrançaisPas encore d'évaluation
- Concours Physique-ENSAT Juillet 2009Document6 pagesConcours Physique-ENSAT Juillet 2009la physique selon le programme FrançaisPas encore d'évaluation
- Cond 02Document17 pagesCond 02la physique selon le programme FrançaisPas encore d'évaluation
- en Raisonnant Sur Un Ion I, de Concentration C V: F Où F Est Le Faraday e 9, 65.10Document3 pagesen Raisonnant Sur Un Ion I, de Concentration C V: F Où F Est Le Faraday e 9, 65.10la physique selon le programme FrançaisPas encore d'évaluation
- Cours ConductimetrieDocument8 pagesCours Conductimetrienico21du13Pas encore d'évaluation
- Corrige ENI GEIPI Physique 2009Document8 pagesCorrige ENI GEIPI Physique 2009la physique selon le programme FrançaisPas encore d'évaluation
- DS de Physique-Chimie N°3 Mercredi 10 Novembre 2010Document4 pagesDS de Physique-Chimie N°3 Mercredi 10 Novembre 2010la physique selon le programme Français100% (1)
- Corrige Exercices Conductimetrie Feuille Travaux DirigesDocument3 pagesCorrige Exercices Conductimetrie Feuille Travaux Dirigesla physique selon le programme Français89% (9)
- DS 3 SujetDocument2 pagesDS 3 Sujetla physique selon le programme FrançaisPas encore d'évaluation
- 1s DST 3Document4 pages1s DST 3la physique selon le programme FrançaisPas encore d'évaluation
- 2004 Specialite SujetsDocument54 pages2004 Specialite Sujetsla physique selon le programme FrançaisPas encore d'évaluation
- Devoir Commun 1S 2005 Exercice 1:: SO (Aq) + I (Aq) + 2 H O SO (Aq) + 2 I (Aq) + 4 H (Aq)Document2 pagesDevoir Commun 1S 2005 Exercice 1:: SO (Aq) + I (Aq) + 2 H O SO (Aq) + 2 I (Aq) + 4 H (Aq)la physique selon le programme FrançaisPas encore d'évaluation
- Formation - PDF - Robotique - Mécatronique PDFDocument9 pagesFormation - PDF - Robotique - Mécatronique PDFHachicha SaberPas encore d'évaluation
- 2M120 TD 2016 ch1 Codes CorrecteursDocument2 pages2M120 TD 2016 ch1 Codes CorrecteurskokiPas encore d'évaluation
- Brochure Nissan Urvan N350 15 PlacesDocument14 pagesBrochure Nissan Urvan N350 15 PlaceskonePas encore d'évaluation
- Exercice 3Document1 pageExercice 3test lili100% (1)
- Cevap AnahtarıDocument1 pageCevap AnahtarıVeliPas encore d'évaluation
- CH1 (Introduction Au SI) PDFDocument17 pagesCH1 (Introduction Au SI) PDFEL OUAZZANI PRINTPas encore d'évaluation
- Secours en Cours de RouteDocument32 pagesSecours en Cours de Routeantonio59100Pas encore d'évaluation
- 5-Focales-Episode-2-Planification Et RégulationDocument42 pages5-Focales-Episode-2-Planification Et RégulationTaffyd MaertinsPas encore d'évaluation
- RapportDocument125 pagesRapportKawtar L AzaarPas encore d'évaluation
- Laddition Des Nombres Entiers CM2Document8 pagesLaddition Des Nombres Entiers CM2chantal.aboujaoudehPas encore d'évaluation
- Phrases À Remettre Dans L'ordreDocument9 pagesPhrases À Remettre Dans L'ordreSylvie DinisPas encore d'évaluation
- Transformateurs MonophasésDocument51 pagesTransformateurs MonophasésDo OuPas encore d'évaluation
- TP Controle Optimal PDFDocument29 pagesTP Controle Optimal PDFHamza El-houariPas encore d'évaluation
- Laboratoire Biolab Bamako - Recherche GoogleDocument1 pageLaboratoire Biolab Bamako - Recherche GoogleAlou CoulibalyPas encore d'évaluation
- 1 - Cours2 Hydraulique Et Pneumatique (2éme Année Électromécanique)Document16 pages1 - Cours2 Hydraulique Et Pneumatique (2éme Année Électromécanique)Mohamed Hechmi JERIDIPas encore d'évaluation
- Método de Violino - CajatiDocument41 pagesMétodo de Violino - CajatiWalmir PaiãoPas encore d'évaluation
- MicrobiologieDocument5 pagesMicrobiologieInes FirasPas encore d'évaluation
- Corrige Serie5Document4 pagesCorrige Serie5Chef FatimaPas encore d'évaluation
- Chapitre 3 Ressources Réserves PlanificationDocument10 pagesChapitre 3 Ressources Réserves PlanificationAdlanePas encore d'évaluation
- Les Approches Managériales Basées Sur Les Parties PrenantesDocument4 pagesLes Approches Managériales Basées Sur Les Parties PrenantesNohaila BencherquiPas encore d'évaluation
- Catalogue OKOFEN 2018 2019Document68 pagesCatalogue OKOFEN 2018 2019joseph38Pas encore d'évaluation
- EKIP360 PrestationsTarifications LFRDocument30 pagesEKIP360 PrestationsTarifications LFRtouzanimahdiPas encore d'évaluation
- DRAFT - Cours OCO - Part1Document32 pagesDRAFT - Cours OCO - Part1Khennoune WissamPas encore d'évaluation
- Examen Corrigé Marketing - Questionnaire À Choix Multiple (QCM)Document7 pagesExamen Corrigé Marketing - Questionnaire À Choix Multiple (QCM)Mar IemPas encore d'évaluation
- Programme Maths cm2Document1 pageProgramme Maths cm2gorguy100% (1)
- Les Corriges Essai District Kanel Jan 2024 - 061004Document8 pagesLes Corriges Essai District Kanel Jan 2024 - 061004souleymanehousnaPas encore d'évaluation
- ProjetDocument4 pagesProjetEya AwadiPas encore d'évaluation
- ContexteDocument2 pagesContextehibaouafi502Pas encore d'évaluation
- QP1C General 1 PDFDocument5 pagesQP1C General 1 PDFSamson KlouganPas encore d'évaluation
- World of Warcraft - Wrath of The Lich King - Arthas, My SonDocument4 pagesWorld of Warcraft - Wrath of The Lich King - Arthas, My SonAdrian Angel LagrecaPas encore d'évaluation