Académique Documents
Professionnel Documents
Culture Documents
Titrage 1
Titrage 1
Transféré par
Meryem Maatallah0 évaluation0% ont trouvé ce document utile (0 vote)
11 vues1 pageTitre original
titrage1
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
11 vues1 pageTitrage 1
Titrage 1
Transféré par
Meryem MaatallahDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 1
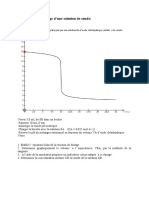
TP1:Titrage d'une solution d'acide éthanoique
On place dans un bécher, un volume VA=20ml de solution d’acide éthanoïque de
concentration CA, On y ajoute progressivement à l’aide d’un burette graduée une solution de
soude de concentration CB=2.10-2mol/L. À l’aide d’un pH-mètre , on suit les variation du
pH de la solution contenue dans le bécher . Les valeurs du pH de la solution après chaque
ajout de solution de la soude figurent dans le tableau suivant:
pH 0 1 2 4 6 8 9 10 11 12 12,2 12,4 12,6 13 13,5 14 15 16
Ve(m 3,3 3, 4,1 4,4 4,7 5 5,2 5,4 5,6 6,2 6.5 8,3 10,1 10,6 10,8 11 11,2 11,3
L) 8
1.Écrire l’équation chimique support du titrage. Tracer la courbe pH = f(VB) sur
papier millimétré. Déterminer les coordonnées du point
2.d'équivalence E (VBE ; pHE ) En déduire la valeur de la concentration en
3.acide éthanoïque de la solution S Parmi les indicateurs colorés de tableau,
lequel doit-on choisir pour réaliser le titrage?
Hélianthine Rouge de crésol Phénolphtaléine
Jaune orangé 3,1 – 4,4 rouge Jaune 7,2-8,8 Rouge Incolore 8,2 – 10 rose
Vous aimerez peut-être aussi
- Titrage 3Document1 pageTitrage 3Meryem MaatallahPas encore d'évaluation
- Titrage 2Document1 pageTitrage 2Meryem MaatallahPas encore d'évaluation
- Reaction Oxydoreduction Groupe 7Document30 pagesReaction Oxydoreduction Groupe 7Meryem MaatallahPas encore d'évaluation
- Oxydo ReductionDocument55 pagesOxydo ReductionMeryem MaatallahPas encore d'évaluation
- Les Réactions D'oxydoréductionDocument30 pagesLes Réactions D'oxydoréductionMeryem MaatallahPas encore d'évaluation
- Cours 3 - Conductivité Des Solutions AqueusesDocument24 pagesCours 3 - Conductivité Des Solutions AqueusesMeryem MaatallahPas encore d'évaluation
- Acido-Base CoursDocument21 pagesAcido-Base CoursMeryem MaatallahPas encore d'évaluation
- Optique 1Document27 pagesOptique 1Meryem MaatallahPas encore d'évaluation