Académique Documents
Professionnel Documents
Culture Documents
Chimie Generale-140331 UE1 CHIMIE P0 Corr - Copier PDF
Chimie Generale-140331 UE1 CHIMIE P0 Corr - Copier PDF
Transféré par
Benjamin Boublil0 évaluation0% ont trouvé ce document utile (0 vote)
64 vues8 pagesTitre original
Chimie generale-140331 UE1 CHIMIE P0 corr- - Copier.pdf
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
64 vues8 pagesChimie Generale-140331 UE1 CHIMIE P0 Corr - Copier PDF
Chimie Generale-140331 UE1 CHIMIE P0 Corr - Copier PDF
Transféré par
Benjamin BoublilDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 8
Anne : 2013-2014
Matire : UE1 Chimie
Fac :P0 Excosup - CB5
UE - Concours Blanc de Chimie Gnrale
P0 Excosup
CONSIGNES
Ce cahier comporte 6 pages.
Veuillez vrifier que cet exemplaire est complet. Sil est incomplet, veuillez le signaler des le dbut de
lpreuve. Aucune rclamation ne sera admise par la suite.
Les rponses doivent tre donnes uniquement sur la page suivante. Il peut y avoir une ou plusieurs
plusieurs rponses par question.
Cette preuve comporte 20 QCM portant sur le programme du 1er Semestre
Lusage de la calculatrice est autoris
/ 1 8
Anne : 2013-2014
Matire : UE1 Chimie
Fac :P0 Excosup - CB5
NOM Prnom Note/20
/ 2 8
Anne : 2013-2014
Matire : UE1 Chimie
Fac :P0 Excosup - CB5
QCM 1 : Combien dlectrons peut contenir au maximum une sous-couche d ?
A. 2
B. 6
C. 10
D. 14
E. 18
Une sous-couche s = 2
Une sous-couche p = 6
Une sous-couche d = 10
Une sous-couche f = 14
Rponse C
QCM 2 : Quelle est la configuration lectronique de lion Ti
4+
dans son tat fondamental ?
A. 1s
2
2s
2
2p
6
3s
1
3p
6
3d
2
4s
2
B. 1s
2
2s
2
2p
6
3s
2
3p
6
3d
4
4s
0
C. 1s
2
2s
2
2p
6
3s
2
3p
6
3d
0
4s
0
D. 1s
2
2s
2
2p
6
3s
2
3p
4
3d
0
4s
2
4p
0
E. 1s
2
2s
2
2p
6
3s
2
3p
4
3d
2
4s
0
4p
0
Ti
4+
(Z=22) donc 18 lectrons soit 1s
2
2s
2
2p
6
3s
2
3p
6
3d
0
4s
0
Rponse C
QCM 3 : Indiquez la (ou les rponses exactes).
A. Une fonction donde reprsente la probabilit de trouver llectron dans un lment de volume.
Faux: Le carr de la fonction donde donne la probabilit.
B. Chaque type dorbitale est caractris par une gomtrie dans lespace Vrai
C. Dans lquation de Schrdinger, on applique lnergie E loprateur Hamiltonien Faux: H! = E!
D. Plus la vitesse dun objet est grande et plus la longueur donde qui lui est associe est grande Faux :
" = h /m.v
E. Deux isotopes ont le mme nombre de masses Faux : Deux isotopes ont des nombre de masses
diffrents et un mme numro atomique
Rponse B
QCM 4 : Indiquer la(ou les) rponse(s) exacte(s)
A. Dans le modle V.S.E.P.R les paires dlectron # sont comptes non-liants Faux : elles ne sont pas
comptes
B. Dans le modle V.S.E.P.R on associe un doublet chaque liaison dune liaison multiple Faux
C. La molcule CO3
2-
est de type AX3 et plane Vrai : On ne compte pas les charges
D. Le modle V.S.E.P.R est bas sur la diffrence dlectrongativit des atomes Faux : Gomtrie
identique avec des atomes diffrents
E. Aucune des propositions nest juste
Rponse C
/ 3 8
Anne : 2013-2014
Matire : UE1 Chimie
Fac :P0 Excosup - CB5
QCM 5 : Le fragment molculaire dessin entre parenthses ci-dessous correspond lunit de
rptition du sulfate de 6-chondrotine, un polysaccharide rentrant dans la composition de la matrice
du cartilage :
Dterminez le nombre doxydation des atomes A et B indiqus par une flche. A partir des ces calculs,
quelle(s) est (sont) la (les) proposition(s) exacte(s) ?
A. Le nombre doxydation de latome de Carbone A est gal +3
B. Le nombre doxydation de latome de Carbone A est gal +4
C. Le nombre doxydation de latome de Soufre B est gal +4
D. Le nombre doxydation de latome de Soufre B est gal +5
E. Le nombre doxydation de latome de Soufre B est gal +6
Le Carbone A possde 1 lectrons autour de lui au lieu de 4 donc n.o. = +3
Le Soufre B possde 0 lectrons autour de lui au lieu de 6 donc n.o. = +6
Rponse A et E
QCM 6 : Dterminer le nombre doxydation de lazote dans HNO2
A. -III
B. -II
C. -I
D. +II
E. +III
Pour HNO2 : n.o(H) + n.o(N) + 2n.o(O) = 0 soit (+I) + n.o(N) + 2.(-II) = 0
n.o(N) = +III
Rponse E
QCM 7 8 : Considrons les couples MnO4
-
/Mn
2+
(E = 1,50V) et NO3
-
/NO(g) (E = 1,00V):
QCM 7 : Quelle(s) est(sont) la(les) proposition(s) justes:
A. MnO4
-
oxyde NO3
-
Faux : NO3
-
est un oxydant
B. MnO4
-
oxyde NO(g) Vrai
C. La raction prpondrante est MnO4
-
+ NO3
-
" Mn
2+
+ NO(g) Faux
D. La raction prpondrante est MnO4
-
+ NO
" Mn
2+
+ NO3
-
Faux
E. Aucune des propositions nest juste
La raction prpondrante est : 3MnO4
-
+ 5NO(g) + 4H
+
" 3Mn
2+
+ 5NO3
- +
2H2O
Rponse B
QCM 8: Considrons la raction doxydorduction prcdente une temprature de 298 K :
Donnes: F = 96500 C et R = 8 J"K
-1
"mol
-1
A. -724 kJ
B. -22 kJ
C. +22 KJ
D. +724 kJ
E. Aucune rponse nest correcte
#G = -nF#E = -15.96500.0,5 = -724
Rponse A
/ 4 8
Anne : 2013-2014
Matire : UE1 Chimie
Fac :P0 Excosup - CB5
QCM 9 10 : Soit la raction suivante :
CH4(g) + 2 O2(g)
2 H
2
O
(g)
+ CO
2(g)
On donne 298 K : $
f
H(CH
4(g)
) = -74,9 kJ.mol
-1
; $
f
H(H
2
O
(g)
) = -241,8 kJ.mol
-1
QCM 9 : Lenthalpie standard de la raction 298 K vaut -802,2 kJ.mol
-1
. Lenthalpie standard de
formation de CO
2(g)
est de : (valeur la plus proche)
A. -1211 kJ.mol
-1
B. 1211 kJ.mol
-1
C. -285 kJ.mol
-1
D. -393 kJ.mol
-1
E. 393 kJ.mol
-1
$fH(CO2(g)) = $rH + $fH(CH4(g)) 2x $fH(H2O(g))
$fH(CO2(g)) = -802,2 74,9 + 2x 241,8 = -393,5 kJ.mol
-1
.
$rH < 0 donc la raction est exothermique, il y a libration de chaleur.
Rponse D
QCM 10 : Lentropie standard de la raction 298 K vaut -4,5 J.mol
-1
.K
-1
. Lenthalpie libre standard de
la raction 298K vaut (valeur la plus proche)
A. 410 J.mol
-1
B. 801 kJ.mol
-1
C. 539 J.mol
-1
D. -539 kJ.mol
-1
E. -801 kJ.mol
-1
$rG = $rH - T$rS = -802,2 x 10
3
+ 298 x 4,5 = -800,9 kJ.mol
-1
Rponse E
QCM 11 : Soit la raction suivante dont lenthalpie standard de raction 298K vaut -950kJ.mol-1:
2 C2H4
(g) + 4 O2(g)
2 H
2
O
(g)
+ 3 CO
2(g) +
CH4(g)
On donne les nergies de liaison suivantes 298 K : DC=O = 730 kJ.mol
-1
; DO-H = 464 kJ.mol
-1
; DO=O
= 502 kJ.mol
-1
; DC-H = 414 kJ.mol
-1
.
Quelle est, 298 K, la valeur de la liaison DC=C (valeur la plus proche)
A. 811 kJ.mol
-1
B. 327,8 kJ.mol
-1
C. 1622 kJ.mol
-1
D. 1761 kJ.mol
-1
E. 649 kJ.mol
-1
Attention: Les nergies de liaisons tant positives il sagit de la dissociation de la liaison (on apporte
lnergie ncessaire pour la rompre). Les ractifs se dissocient (compter positivement) et les produits
forment les liaisons (compter ngativement).
$rH = 4*DO=O + 8*DC-H + 2*DC=C - 4*DC-H - 6*DC=O - 4*DO-H
$rH = 4*DO=O + 4*DC-H + 2*DC=C - 6*DC=O - 4*DO-H
Do 2*DC=C = $rH + 6*DC=O + 4*DO-H - 4*DO=O - 4*DC-H
Ainsi DC=C = (-950 + 6*730 + 4*464 - 4*502 - 4*414) / 2
DC=C = 811 kJ.mol
-1
.
Rponse A
/ 5 8
Anne : 2013-2014
Matire : UE1 Chimie
Fac :P0 Excosup - CB5
QCM 12 : Soit la raction suivante sous P = 1bar dont l'enthalpie de raction vaut -10,9 kJ.mol
-1
:
FeO(s) + CO(g) Fe(s) + CO2(g)
On donne 298K : $fH(FeO(s)) = -272 kJ.mol
-1
; $fH(CO2(g)) = -393,5 kJ.mol
-1
.
L'enthalpie standard de formation de $fH(CO(g)) 298K vaut (valeur la plus proche) :
A. - 427,3 kJ.mol
-1
B. - 256,7 kJ.mol
-1
C. - 345,8 kJ.mol
-1
D. - 132,4 kJ.mol
-1
E. - 110,6 kJ.mol
-1
On utilise la loi de Hess :
$rH = $fH(CO2(g)) + $fH(Fe(s)) - $fH(FeO(s)) - $fH(CO(g))
$fH(CO(g)) = $fH(CO2(g)) + $fH(Fe(s)) - $fH(FeO(s)) - $rH
$fH(CO(g)) = -393,5 + 0 - (-272) - (-10,9)
$fH(CO(g)) = - 110,6 kJ.mol
-1
Rponse E
QCM 13 14: Soit la raction A + B " C . La vitesse de raction t = 0, v0 est mesure pour
diffrentes concentrations initiales de A et de B :
QCM 13: Calculez lordre partiel de A et B.
A. A a un ordre partiel de 1 et B, de 2.
B. A a un ordre partiel de 0 et B,de 2.
C. A a un ordre partiel de 2 et B, de 2.
D. A a un ordre partiel de 1 et B, de 2.
E. A a un ordre partiel de 2 et B, de 1.
Exp 1 et 3: [B]3 = 2.[B]1 et [A] = constante, la vitesse est multiplie par 4 soit 2
2
. Lordre partiel par
rapport B est 2
Exp 2 et 3: [A]2 = 2.[A]3 et [B] = constante, la vitesse est inchange soit 2
0
. Lordre partiel par rapport
A est 0
Rponse B
QCM 14. En dduire la constante de vitesse de la raction.
A. 2,1.10
-3
L.mol
-1
.s
-1
B. 2,1 L
2
.mol
-2
.s
-1
C. 0,5 mol" L
-1
"s
-1
D. 0,5 L.mol
-1
.s
-1
E. 1 L.mol
-1
.s
-1
v = k. [B]
2
donc k = v / [B]
2
= 2/4
2
= 1/8 = 0,125 L.mol
-1
.min
-1
= 2,1.10
-3
L.mol
-1
.s
-1
Rponse A
Expriences [A] [B]
V
0
1 4 4 2
2 8 8 8
3 4 8 8
/ 6 8
Anne : 2013-2014
Matire : UE1 Chimie
Fac :P0 Excosup - CB5
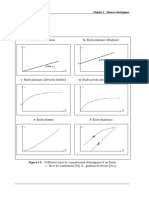
QCM 15. Quel(s) est(sont) le(s) graphique(s) reprsentant une cintique dordre 1 ?
A. Ordre 0
C. Ordre 1
E. Ordre 2
Rponse C
QCM 16. On considre la raction A + B " P dont les concentrations en ractifs sont identiques. Quel
est lordre de cette raction si t1/2 est multipli par 3 lorsque la concentration initiale est triple ?
A. Ordre 0 t1/2 =C0/2k Vrai
B. Ordre 1 t1/2 =ln 2 /k
C. Ordre 2 t1/2 =1/kC0
D. Ordre variable
E. Impossible dterminer
Rponse A
QCM 17. Quel est le pH dune solution dacide actique (pKa = 4,75) de concentration C = 4.10
-3
mol.L
-1
?
A. pH = 8
B. pH = 3,6
C. pH = 2,2
D. pH = 10,5
E. pH = 2,4
Lacide actique (pKa = 4,75)est acide faible: pH = 1/2 (pKa - logC) = 1/2 (4,75 - log (4.10
-3
)) = 3,6
Rponse B
QCM 18. Quel est le pH dune solution de morphine base (pKa = 8,2) de concentration C = 4.10
-3
mol.L
-1
?
A. pH = 10,3
B. pH = 4,9
C. pH = 11
D. pH = 9,9
E. pH = 8,2
La morphine base (pKa = 8,2) est une base faible: pH = 1/2 (14 + pKa + logC) = 1/2 (14 + 8,2 + log
(4.10
-3
)) = 9,9
Rponse D
QCM 19. Soit une solution dun acide fort (pKa = -9) de concentration C = 0.3*10
-2
mol/L. Quel est le
pH de cette solution ?
A. pH = 2,5
B. pH = 2,7
C. pH = 5,5
D. pH = 5,6
E. pH = 5,7
Acide fort: pH = - logC = - log (0.3*10
-2
) = 2,5
Rponse A
/ 7 8
Anne : 2013-2014
Matire : UE1 Chimie
Fac :P0 Excosup - CB5
QCM 20. Soit une solution dacide actique et de sa base conjugue (pKa = 4,75) de concentrations
respectives C1 = 2 mol/L et C2 = 4 mol/L. Calculer le pH de la solution.
A. pH = 7,5
B. pH = 2,3
C. pH = 9
D. pH = 5,0
E. pH = 6,2
Mlange Acide faible / Base faible : pH = pKa + log B/A = 4,75 + log (2) = 5,0
Rponse D
/ 8 8
Vous aimerez peut-être aussi
- C2 PH EAM TCDocument6 pagesC2 PH EAM TCcoulbybeh2023Pas encore d'évaluation
- Cours Transferts de Chaleur Et de Matière FPN Master Ch. Matériaux S2Document69 pagesCours Transferts de Chaleur Et de Matière FPN Master Ch. Matériaux S2zinebPas encore d'évaluation
- R Sum Ondes Et Vibrations FRDocument2 pagesR Sum Ondes Et Vibrations FRahmed ahmadPas encore d'évaluation
- Cours Regulation Industrielle p2Document35 pagesCours Regulation Industrielle p2Zakaria BencherkiPas encore d'évaluation
- p1 2s Mouvement Vitesse 2018Document2 pagesp1 2s Mouvement Vitesse 2018Yazine ZeidPas encore d'évaluation
- Poutres MixtesDocument47 pagesPoutres MixtesElias El HachemPas encore d'évaluation
- Examen CO 2018 19Document2 pagesExamen CO 2018 19AhmedPas encore d'évaluation
- Calcul SismiqueDocument107 pagesCalcul SismiqueCorbuserap Roi Makoko100% (1)
- PC Casa Settat 2019 FR (WWW - Pc1.ma)Document3 pagesPC Casa Settat 2019 FR (WWW - Pc1.ma)Mohamed FLPas encore d'évaluation
- Note de Calcul Charpente Métallique 2Document42 pagesNote de Calcul Charpente Métallique 2Saad El Bouazizi100% (9)
- Energie MecaniqueDocument3 pagesEnergie MecaniqueSYLVAIN KOUADIOPas encore d'évaluation
- Révision Génie Éléctrique Classes PrepaDocument14 pagesRévision Génie Éléctrique Classes Prepayassine safraouiPas encore d'évaluation
- Cours Méca Sols2 DS Fev 2023Document42 pagesCours Méca Sols2 DS Fev 2023Amine SaidiPas encore d'évaluation
- TP Mouvementplan InclineDocument2 pagesTP Mouvementplan InclineJean LeonardoPas encore d'évaluation
- Chap 5 Généralités Sur Les Systèmes OscillantsDocument8 pagesChap 5 Généralités Sur Les Systèmes OscillantsNjiasse Maazou100% (1)
- Gravitation CourDocument17 pagesGravitation CourHuuusPas encore d'évaluation
- JNGG CPTu RevisedDocument9 pagesJNGG CPTu Revisedfatima ezzahraa latifiPas encore d'évaluation
- TD3+Sol TCELMDocument6 pagesTD3+Sol TCELMTizzaoui AnisPas encore d'évaluation
- Chap B I FigDocument7 pagesChap B I FiglahcenPas encore d'évaluation
- Examen Normal MPM SMC 2017 2018Document3 pagesExamen Normal MPM SMC 2017 2018ZAKARIA AHAHSALPas encore d'évaluation
- Cálcul Civil: Aller Au Contenu PrincipalDocument8 pagesCálcul Civil: Aller Au Contenu PrincipalOlivier Rack RoyalPas encore d'évaluation
- MementoDocument4 pagesMementosoufianPas encore d'évaluation
- Inpl T 1995 Bertrand F PDFDocument163 pagesInpl T 1995 Bertrand F PDFSoufiane El AoumariePas encore d'évaluation
- Calcul de Hertz V3Document27 pagesCalcul de Hertz V3Farid TataPas encore d'évaluation
- 2015 07 12 ATS Mecanique 2009 ATSDocument32 pages2015 07 12 ATS Mecanique 2009 ATSAFADPas encore d'évaluation
- Rapport TP Pertes de Charges-1Document9 pagesRapport TP Pertes de Charges-1Salma YokataPas encore d'évaluation
- Serie N02 - 2019-2020Document4 pagesSerie N02 - 2019-2020abir balaPas encore d'évaluation
- Mur CantileverDocument11 pagesMur CantileverHilary ParkerPas encore d'évaluation
- 15.chap 2Document19 pages15.chap 2madjid tighiltPas encore d'évaluation
- TP Du Viscosité Et Detection Ds FuitesDocument7 pagesTP Du Viscosité Et Detection Ds FuitesZAAIRA HAMZAPas encore d'évaluation