Académique Documents
Professionnel Documents
Culture Documents
Du Chlore Dans L'eau Labolycée
Transféré par
ALIENN 51Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Du Chlore Dans L'eau Labolycée
Transféré par
ALIENN 51Droits d'auteur :
Formats disponibles
Labolycée
Rechercher
Du chlore dans l'eau
! 7 points
Bac S 2003-2012 Tronc commun Chimie
La transformation d'un système chimique est-elle toujours rapide ?
Bac S 2003-2012 Tronc commun Physique
Transformations nucléaires
" 1 heure 31 minutes
09/2004 Métropole
Radioactivité: isotopes, énergie de liaison, t1/2,
constante radioactive, activité, loi de décroissance,
datation
Chimie: Dilution, Cinétique de la décomposition de
l'eau de Javel suivie avec une mesure de pression, loi
des gaz parfaits
Sujet #
Télécharger DOC Télécharger PDF
ancien programme
National 09/2004 Exercice 3 DU CHLORE DANS L’ EAU (7 POINTS)
http://labolycee.org
Les parties 1 et 2 sont indépendantes.
1. Du chlore dans les eaux souterraines
Il existe deux principaux isotopes stables du chlore (dont les nombres de masse sont 35 et 37) trouvés
dans les proportions respectives de 3 pour 1 et qui donnent aux atomes en vrac une masse molaire
-1
atomique apparente de 35,5 g.mol .
Le chlore a 9 isotopes avec des nombres de masse étendant
s’ de 32 à 40. Seulement trois de ces isotope
s
existent à l’état naturel : le Cl-35 stable (75,77
%), le Cl-37 stable (24,23 %) et le Cl-36 radioactif. Le
rapport du nombre de noyaux de Cl-36 au nombre ltota de noyaux de Cl présents dans l’environnement
est de 7,0×10 –13 actuellement.
Le «chlore 36» (Cl-36) se désintègre essentiellement en « argon 36 » (Ar-36). La demi-vie du Cl-36 est de
301×10 3 ans. Cette valeur le rend approprié pour dater logiquement
géo les eaux souterraines sur une
durée de soixante mille à un million d’années.
D’après un article d’encyclopédie
Données :
ln 2
- Relation entre le temps de demi-vie 1/2
t et la constante radioactiveλ : t 1/2 =
λ
- Relation entre l’activité A d’un échantillon ete lnombre moyen de noyaux N présent dans cet
échantillon, à une date t donnée : A(t) λ=. N(t)
- 1 an = 3,156×10 7 s
8 -1
- Célérité de la lumière dans le vide : c = 2,998×10 m.s
g -1
- Masse molaire atomique du chlore : M(Cl) = 35,5.mol
23
- Constante d’Avogadro : N A = 6,02×10 mol -1
- Masse et numéro atomique (ou nombre de charge) quelques
de particules et noyaux:
Particule ou noyau proton neutron chlore 36 argon 36
–27
Masse (10 kg) 1,672 62 1,674 92 59,711 28
Z 1 0 17 18
1.1. Dans l’article, l’auteur indique des valeurs 35 37
et pour les isotopes stables du chlore.
Que désignent plus précisément ces valeurs pour un noyau de chlore ?
1.2. Définir le terme « isotopes ».
1.3. Donner le symbole complet du noyau de « chlore 36
» et sa composition.
1.4 . Calculer, en MeV, l’énergie de liaisonEL1 d’un noyau de « chlore 36 ». Exprimer le résultat
final
avec quatre chiffres significatifs.
– 19
On rappelle que 1 eV = 1,602×10 J.
1.5. Le texte évoque la réaction de désintégration d’un
noyau de « chlore 36 ».
Écrire l’équation de cette réaction, en indiquant :
- les lois utilisées ;
- le type de radioactivité mise en jeu.
1.6 . Donner la définition du temps de « demi-vie »t1/2 du « chlore 36 ».
ancien programme
1.7. Constante radioactive
1.7.1. Déterminer, par analyse dimensionnelle, l’unité de
la constante radioactive λ dans le
système international.
1.7.2. Calculer la constante radioactive de l’isotope de
« chlore 36 » en respectant l’unité de base
du système international.
1.8. Une bouteille contient un volume V= 1,5 L d’eau min érale. Sa teneur en ions chlorure est indiquée
sur l’étiquette et vaut cm = 13,5 mg.L - 1 .
1.8.1. Calculer la quantité d’ions chlorure, en mol, dans
l’eau de cette bouteille.
1.8.2. On suppose que le rapport du nombre de noyaux dechlore « 36 » au nombre total de
noyaux de chlore présents dans cette eau minérale
st ecelui donné dans l’article.
Montrer que le nombre N de noyaux de « chlore 36 présents » dans cette bouteille est
N = 2,4×10 8.
1.8.3. En déduire la valeur de l’activité en « chlore 36de
» l’eau que contient cette bouteille.
1.8.4. En déduire la valeur du nombre de désintégrations
de noyaux de « chlore 36 » par jour.
1.9. Datation d’une eau souterraine
L’étude des isotopes radioactifs apporte des inform ations concernant la durée du transit
-
souterrain d’une eau c'est-à-dire l’âge de la nappe phréatique. Les ions chlorure Cl (aq) sont
presque toujours présents dans les eaux minéralesaturelles
n et ne sont que rarement impliqués
dans les interactions eaux - rochers.Dans les eaux de surface, le « chlore 36 » est reno uvelé et
la teneur en « chlore 36 » peut être supposée const ante , ce qui n’est pas le cas dans les eaux
souterraines des nappes phréatiques. Le « chlore 36 », de demi vie 3,01×10 5 ans, est donc un
traceur particulièrement adapté à l’étude des eauxsouterraines anciennes.
3
Pour dater des eaux plus récentes, on peut utiliserle « carbone 14 », de demi-vie 5,73×10 ans,
présent dans les ions carbonate CO32- (aq) dissous par exemple.
1.9.1. Loi de décroissance radioactive.
On considère un échantillon, de volume V donné, d’e au issue d’une nappe phréatique.
On note :
- N 0 le nombre moyen de noyaux de « chlore 36 » présent s dans cet échantillon à l’instant
de date t0 = 0 s de la constitution de la nappe.
- N(t) le nombre moyen de noyaux de « chlore 36 »ans d l’eau extraite aujourd’hui de cette
nappe et donc non renouvelée en « chlore 36 ».
), N 0 et t1/2 .
Écrire la loi de décroissance radioactive liant N(t
1.9.2. Datation d’une eau souterraine.
On admet que N 0 est égal au nombre moyen de noyaux de «chlore 36 présents » dans un
échantillon de même volume V d’eau de surface.
Déduire de la loi de décroissance écrite précédemme nt l’âge d’une nappe phréatique dont l’eau
non renouvelée ne contient plus que 38 % du nombre de noyaux de « chlore 36 » trouvée dans les
eaux de surface.
Pourquoi ne pas avoir utilisé le « carbone 14 » pou
r dater cette nappe phréatique ?
2. Du chlore dans l’eau de Javel
L’eau de Javel, produit courant et bon marché, une est solution aqueuse contenant entre autres
– –
des ions hypochlorite ClO (aq) et des ions chlorure Cl(aq). Outre ses propriétés désinfectantes (c’est un
bactéricide puissant), l’eau de javel est utilisée
pour son pouvoir «blanchissant», lié à l’action oxy
dante
de l’ion hypochlorite sur de nombreux colorants.
L’eau de Javel se décompose lentement selon une tra nsformation totale modélisée par la réaction
d’équation :
– –
2ClO (aq) = 2 Cl (aq) + O 2 (g) réaction (1)
ancien programme
On se propose d’étudier la décomposition d’une eau de Javel.
Pour suivre l’évolution de cette transformation, on dilue une solution commerciale S0 afin d’obtenir un
volume V = 250 mL d’une solution S1 d’eau de Javel dix fois moins concentrée que S0.
On verse V 1 = 20,0 mL de la solution S 1 dans un ballon.
À l’instant de date t0 = 0 s où l’on déclenche le chronomètre, on ajoute,sans variation de volume, une
sol et on bouche le ballon. L’ion cobalt Co2+ (aq) est
pointe de spatule de chlorure de cobalt dans la ution
un catalyseur de la réaction (1).
Pour suivre l’évolution de la transformation qui déroule,
se on mesure, avec un dispositif adapté, la
pression p du gaz dans le ballon. On néglige la qua ntité de dioxygène dissoute dans l’eau par rapport à
la quantité de dioxygène produite. La températureestTmaintenue constante et le volume V0 occupé par
le gaz dans le ballon est constant : T = 296 K et0V= 275 mL
t (min) 0 1,0 2,0 3,0 4,0 5,0 8,0 11,0 13,0 ... 145 427 1308 1757 1896
2
p(t) (10 Pa) 1020 1038 1038 1055 1063 1068 1078 1084 1086 ... 1103 1108 1111 1112 1112
La verrerie mise à disposition est en partie la vante
sui :
- fioles jaugées de 50 mL, 100 mL, 200 mL, 250 mL,500 mL ;
- pipettes jaugées de 5 mL, 10 mL, 20 mL, 25 mL ;
- pipettes graduées de 5 mL, 10 mL, 20 mL, 25 mL ;
- éprouvettes graduées de 10 mL, 20 mL, 250 mL, 500 mL.
2.1. Quels matériels, pris dans la verrerie mise à disposition, doit-on utiliser pour préparer 1S?
2.2. Avancement de la réaction
2.2.1. On note :
- n1 la quantité initiale d’ions hypochlorite dans le lume
vo V1 de solution dans le ballon ;
- n2 la quantité initiale d’ions chlorure dans ce mêmeolumev de solution ;
- n3 la quantité initiale de dioxygène présent dans leallon.
b
Compléter la dernière ligne du tableau d’évolution du système chimique, de l’annexe à rendre
avec la copie (aucune application numérique n’est demandée).
2.2.2. En supposant que le dioxygène O 2(g) est un gaz parfait, on montre que l’expression de
l’avancement x(t) de la réaction à l’instant de dat
e t en fonction de p(t), p(t0 = 0), T et V o est :
[p t() − p(t0 = 0)]. V0
avec R = 8,314 Pa.m .mol -1.K
3 -1
x(t)= .
R.T
Calculer x(t 1) à l’instant de datet1 = 11,0 min.
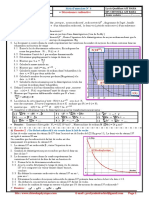
2.3. Exploitation des résultats
À partir des valeurs calculées de l’avancement x,n otrace la courbe de l’annexe (à rendre avec la
copie) Elle représente l’évolution, au cours du temps,e dl’avancement x de la réaction qui se déroule
dans le ballon.
2.3.1. Définir à l’instant de date t, par une relation
ttérale,
li la vitesse v(t) de la réaction qui a lieu
dans le ballon.
2.3.2. Comment évolue v(t) au cours du temps ? Justifier
la réponse, sans calcul, en utilisant le
graphique.
2.3.3. Citer le facteur cinétique responsable de l’évolut
ion de la vitesse v(t) de la réaction au cours
du temps.
2.3.4. Définir le temps de demi-réaction.
–3
2.3.5. La valeur de l’avancement final déterminée expérime
ntalement est x f = 1,04 × 10 mol.
En utilisant cette valeur, déterminer graphiquement une valeur approchée du temps de
demi-réaction. On fera apparaître clairement, sur
a courbe
l de l’annexe (à rendre avec la
copie ), la méthode utilisée.
ancien programme
ANNEXE
Tableau d'évolution
–
Équation de la réaction 2 ClO (aq) = 2 Cl – (aq) + O 2 (g)
Avancement nClO (mol) nCl − (mol) nO2 (mol)
État du système −
(mol)
État initial 0 n1 n2 n3
Au cours de la
x
transformation
Corrigé $
Copyright ©2003-2020 Association Labolycée -
Webmaster : Arthur Toussaint - Professeurs
rédacteurs : E. Daïni, J. Morazzani, J. Clément,
D.Ramirez. B.Lachaud J.Bernon
Vous aimerez peut-être aussi
- 2004 09 National Sujet Du - Chlore - Dans - EauDocument4 pages2004 09 National Sujet Du - Chlore - Dans - Eauالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exercices 32 Decroissance Radioactive (PR Mehdi El Hichami)Document4 pagesExercices 32 Decroissance Radioactive (PR Mehdi El Hichami)trdr42gs8gPas encore d'évaluation
- Decroissance Radioactive Exercices Non Corriges 6Document6 pagesDecroissance Radioactive Exercices Non Corriges 6Karroum MohamedPas encore d'évaluation
- 2009 Reunion Exo2 Sujet PH Datation 7ptsDocument4 pages2009 Reunion Exo2 Sujet PH Datation 7ptsالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Serie1 Nuclaire Converted BestcoursDocument2 pagesSerie1 Nuclaire Converted BestcourstaziadambkPas encore d'évaluation
- Lycee Qualiant Tha Housseine Devoir 2 2Pcf 2022/2023Document2 pagesLycee Qualiant Tha Housseine Devoir 2 2Pcf 2022/2023yassine wxahdiPas encore d'évaluation
- TD RadioactiviteDocument13 pagesTD RadioactiviteZobel Tchomgui100% (1)
- Travaux Diriges de Chimie Generale (Enstmo)Document4 pagesTravaux Diriges de Chimie Generale (Enstmo)pierreboris123Pas encore d'évaluation
- Série D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument7 pagesSérie D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDRima El100% (2)
- Série N°1 Physique RadioactivitéDocument7 pagesSérie N°1 Physique RadioactivitédouaeelkhallouqiPas encore d'évaluation
- Fiche de TD N°1Document5 pagesFiche de TD N°1Paola DjeugaPas encore d'évaluation
- Exercices 29 Decroissance Radioactive (Mahdade Allal)Document7 pagesExercices 29 Decroissance Radioactive (Mahdade Allal)yassin2009xxxxPas encore d'évaluation
- Série NucDocument3 pagesSérie NucMëđï Bëñmãššøůđ BnmssdPas encore d'évaluation
- TD 3: Propriétés Électriques Des SolutionsDocument2 pagesTD 3: Propriétés Électriques Des SolutionsInés bekhouchPas encore d'évaluation
- Annales Gratuites Bac 2006 Physique - Radioactivité Et ArchéologieDocument7 pagesAnnales Gratuites Bac 2006 Physique - Radioactivité Et ArchéologieSIBAFOPas encore d'évaluation
- Devoir Enseignement Scientifique - Première - Avril 2020: Exercice 1: Révisions de SecondeDocument4 pagesDevoir Enseignement Scientifique - Première - Avril 2020: Exercice 1: Révisions de SecondeIrieej PPas encore d'évaluation
- DS 2 S1 M2 MouslimDocument2 pagesDS 2 S1 M2 MouslimMr. magnetoPas encore d'évaluation
- Série Complete Nucleaire Prof Elmnaouar (WWW - Pc1.ma)Document9 pagesSérie Complete Nucleaire Prof Elmnaouar (WWW - Pc1.ma)fardadi rachidPas encore d'évaluation
- Decroissance Radioactive Exercices Non Corriges 1 2 PDFDocument3 pagesDecroissance Radioactive Exercices Non Corriges 1 2 PDFpdf100% (1)
- Exercice Physique C01Document2 pagesExercice Physique C01aloulagairmainePas encore d'évaluation
- Série N1 - La Décroissance RadioactiveDocument8 pagesSérie N1 - La Décroissance RadioactiveAbderrahmane El Ouafy100% (1)
- Phys 267 TD6Document3 pagesPhys 267 TD6arfPas encore d'évaluation
- EXERCICE (Datation Au Carbone C14)Document7 pagesEXERCICE (Datation Au Carbone C14)Imed Benrhouma100% (2)
- Travail A Faire - RadioactiviteDocument4 pagesTravail A Faire - Radioactiviteadjidavibruno7Pas encore d'évaluation
- Syn 5Document5 pagesSyn 5Hisham Nice-lionPas encore d'évaluation
- Qui MicaDocument8 pagesQui Micatamylemor2002Pas encore d'évaluation
- Chimie: (7 Points) : Contrôle 2 Semestre IDocument2 pagesChimie: (7 Points) : Contrôle 2 Semestre ImedPas encore d'évaluation
- PC RadioactivitéDocument4 pagesPC RadioactivitéDieu-Grâce PangouPas encore d'évaluation
- Transformation Nucléaire: ExercicesDocument7 pagesTransformation Nucléaire: ExercicesHamid Ez-zahirPas encore d'évaluation
- 2-Examens BAC Nucleaire PC FRDocument4 pages2-Examens BAC Nucleaire PC FRMouad Driouch SMIA-TD4100% (1)
- TD N°1 CHM 141 2023 - 2024Document2 pagesTD N°1 CHM 141 2023 - 2024nkolaaxelPas encore d'évaluation
- Corr SCM Chimie1 Jan01Document5 pagesCorr SCM Chimie1 Jan01Nadia Ait AhmedPas encore d'évaluation
- Exercices 2 Decroissance RadioactiveDocument1 pageExercices 2 Decroissance RadioactivesmfouazePas encore d'évaluation
- Devoir Enseignement Scientifique - Première - Avril 2020Document3 pagesDevoir Enseignement Scientifique - Première - Avril 2020Agathe LenquettePas encore d'évaluation
- CCCC PDFDocument14 pagesCCCC PDFHamza El-ghrirPas encore d'évaluation
- Ed 4 Ue 3Document1 pageEd 4 Ue 3Tim BauerPas encore d'évaluation
- TD#1-Entités Chimiques - 2020-2021 - CorrDocument7 pagesTD#1-Entités Chimiques - 2020-2021 - Corrrayan.delalayPas encore d'évaluation
- TD#1-Entités Chimiques - 2020-2021Document4 pagesTD#1-Entités Chimiques - 2020-2021rayan.delalayPas encore d'évaluation
- TP ConductimetrieDocument1 pageTP ConductimetrieIndai apekoPas encore d'évaluation
- Radio Act I ViteDocument3 pagesRadio Act I ViteCap TainPas encore d'évaluation
- 2018-2019 DS 3 de Physique Et Corrigé: Fichier Extrait Du DocumentDocument9 pages2018-2019 DS 3 de Physique Et Corrigé: Fichier Extrait Du DocumentadamkhoujabachPas encore d'évaluation
- Cours Chimie 2023Document6 pagesCours Chimie 2023SoufianeMoustakbalPas encore d'évaluation
- 20EnsSc1ere c1 BassmDocument5 pages20EnsSc1ere c1 BassmNessrine ZahiPas encore d'évaluation
- Atome Et Liaison (Concours)Document8 pagesAtome Et Liaison (Concours)safia ouyoubPas encore d'évaluation
- Concours 2012 (+sol.) Proposition EPST23Document19 pagesConcours 2012 (+sol.) Proposition EPST23Nidal BestPas encore d'évaluation
- Anciens Sujets de Chimie GDocument26 pagesAnciens Sujets de Chimie GDiafara MaïgaPas encore d'évaluation
- Devoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2011-2012) MR Sdiri AnisDocument4 pagesDevoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2011-2012) MR Sdiri AnisMohamed SaidiPas encore d'évaluation
- TD RadioactiviteDocument1 pageTD RadioactiviteHamza SrhPas encore d'évaluation
- CORRECTION DM Devoir Chap 1et 2Document3 pagesCORRECTION DM Devoir Chap 1et 2hessasPas encore d'évaluation
- Devoir 2 Modele 1 Physique Chimie 2 Bac SPC Semestre 1 1Document3 pagesDevoir 2 Modele 1 Physique Chimie 2 Bac SPC Semestre 1 1Marouane AkkaPas encore d'évaluation
- Ad2.Loi de DecroissanceDocument4 pagesAd2.Loi de DecroissanceAnge RaphaëlPas encore d'évaluation
- La Décroissance Radioactive Noyau Masse Et Énergie Série 3Document13 pagesLa Décroissance Radioactive Noyau Masse Et Énergie Série 3diwassim88Pas encore d'évaluation
- Cours Radioactivite 2009-2010 PDFDocument22 pagesCours Radioactivite 2009-2010 PDFSafa chagrenPas encore d'évaluation
- 2008 Polynesie Exo3 Sujet Radioactivite 4ptsDocument2 pages2008 Polynesie Exo3 Sujet Radioactivite 4ptsla physique selon le programme Français100% (1)
- Devoir 2 1S 2 SM (22-23)Document10 pagesDevoir 2 1S 2 SM (22-23)Anas TalhiPas encore d'évaluation
- HTTP WWW - Ressources-Stl - FR ST Terminale ExercicesphysiDocument7 pagesHTTP WWW - Ressources-Stl - FR ST Terminale ExercicesphysiMohamed Elouakil0% (1)
- Exercices 2 Decroissance RadioactiveDocument1 pageExercices 2 Decroissance RadioactiveMery EmPas encore d'évaluation
- Xercices: Décroissance Radioactive: WWW - Pc1.maDocument2 pagesXercices: Décroissance Radioactive: WWW - Pc1.mayasserofficiel2006Pas encore d'évaluation
- Introduction à la physique nucléaire et des particulesD'EverandIntroduction à la physique nucléaire et des particulesPas encore d'évaluation
- Rétrospective 2023 Sur SpotifyDocument1 pageRétrospective 2023 Sur SpotifyALIENN 51Pas encore d'évaluation
- Mongolie - Japon - Recherche GoogleDocument1 pageMongolie - Japon - Recherche GoogleALIENN 51Pas encore d'évaluation
- Controle - 1 - Bac - SM - 2020 Prof - Elhamri (WWW - Pc1.ma) .PDF - Google Drive 2Document1 pageControle - 1 - Bac - SM - 2020 Prof - Elhamri (WWW - Pc1.ma) .PDF - Google Drive 2ALIENN 51100% (1)
- Resumer Du Cours de Rotation 1bacDocument1 pageResumer Du Cours de Rotation 1bacALIENN 51Pas encore d'évaluation
- Controle 1 - 13 S1 PC 1bac FRDocument2 pagesControle 1 - 13 S1 PC 1bac FRALIENN 51Pas encore d'évaluation
- Uploads131013102001sm1an-Exercices Logique Ensembles PDFDocument30 pagesUploads131013102001sm1an-Exercices Logique Ensembles PDFALIENN 51Pas encore d'évaluation
- Japon - Espagne - Recherche GoogleDocument1 pageJapon - Espagne - Recherche GoogleALIENN 51Pas encore d'évaluation
- CinetiqueDocument50 pagesCinetiquesidi mohamed el amine nekkalPas encore d'évaluation
- Chap1 Mecanique - Conditions D'équilibre BCPST2Document5 pagesChap1 Mecanique - Conditions D'équilibre BCPST2Ariel AdepoPas encore d'évaluation
- Asqual Geotesan PP NT 235Document2 pagesAsqual Geotesan PP NT 235ELMSSALI MOHAMEDPas encore d'évaluation
- Section 7 - Analyse Spatiale Et SIGDocument13 pagesSection 7 - Analyse Spatiale Et SIGBouzid Med KhaledPas encore d'évaluation
- TD ProbaII 23-24 IUADocument5 pagesTD ProbaII 23-24 IUAJunior Fidèle N'DriPas encore d'évaluation
- TD 5Document2 pagesTD 5LGT AMINEPas encore d'évaluation
- Dynamique de Fluides RéelsDocument17 pagesDynamique de Fluides RéelsDile Stephen SAMBA SAMBAPas encore d'évaluation
- ContreventementDocument17 pagesContreventementlaila sqalli houssainiPas encore d'évaluation
- Devoir 01 2bacBIOF CorrigéeDocument8 pagesDevoir 01 2bacBIOF Corrigéewww.etudiantaymanemchibikPas encore d'évaluation
- Controle Des SouduresDocument3 pagesControle Des SouduresAmir Dalam100% (1)
- Chapitre 3 Cinématique PDFDocument41 pagesChapitre 3 Cinématique PDFYoussef ChfiriPas encore d'évaluation
- Effet D'un Groupe de Batiments Sur L'ecoulement de L'air (Vent) Et Le Confort Des Piétons Dans Les Espace Exterieurs - Gouizi Yamina 2004Document5 pagesEffet D'un Groupe de Batiments Sur L'ecoulement de L'air (Vent) Et Le Confort Des Piétons Dans Les Espace Exterieurs - Gouizi Yamina 2004Fa HimaPas encore d'évaluation
- CH 8 Cycles MoteursDocument20 pagesCH 8 Cycles MoteursMehdiaPas encore d'évaluation
- Series Fourier PDFDocument11 pagesSeries Fourier PDFGoprohsPas encore d'évaluation
- CCV001 01 Statique TD01 2010BDocument5 pagesCCV001 01 Statique TD01 2010BHandresyMandimbyPas encore d'évaluation
- Intégration Analyse Hilbertienne by Alain GuichardetDocument212 pagesIntégration Analyse Hilbertienne by Alain GuichardetNa DiaPas encore d'évaluation
- TDC Troisieme EditionDocument288 pagesTDC Troisieme EditionMamoudou MballoPas encore d'évaluation
- Exercices Sur Les Intégrales GénéraliséesDocument67 pagesExercices Sur Les Intégrales GénéraliséesAbdellah LamniiPas encore d'évaluation
- EDT Cours TD Nominatifs SMP2 SP MAJ 18-03-2022Document1 pageEDT Cours TD Nominatifs SMP2 SP MAJ 18-03-2022hakima ait sghierPas encore d'évaluation
- Serie1CH2 BIO2 23Document2 pagesSerie1CH2 BIO2 23siwarlab18Pas encore d'évaluation
- Le Pont de Schering: ConceptionDocument1 pageLe Pont de Schering: ConceptionBibliothèque Al-itkanPas encore d'évaluation
- Corrigé EXO1 2 RappelsDocument2 pagesCorrigé EXO1 2 RappelsSmatii DjamelPas encore d'évaluation
- Genie Parasismique Presentation Intro Plus 2edDocument49 pagesGenie Parasismique Presentation Intro Plus 2edchannelmpetiPas encore d'évaluation
- Pas À Pas Vers Le Collège 1Document33 pagesPas À Pas Vers Le Collège 1Mounir MoezPas encore d'évaluation
- Guide Des CondensateursDocument9 pagesGuide Des CondensateursCÖPA SODAZINDJIPas encore d'évaluation
- BLPC 218 15-23Document9 pagesBLPC 218 15-23Faiza SiariPas encore d'évaluation
- Chapitre 5 - STDocument50 pagesChapitre 5 - STDeghboudj Samir100% (1)
- La Proportionnalité - Partie 1 - 4e (Cours)Document2 pagesLa Proportionnalité - Partie 1 - 4e (Cours)MiraShinPas encore d'évaluation
- Temp C3 A9ratureDocument5 pagesTemp C3 A9ratureDavidPas encore d'évaluation
- Acoustique, Chapitre 2Document586 pagesAcoustique, Chapitre 2Ali KHALFAPas encore d'évaluation