Académique Documents
Professionnel Documents
Culture Documents
DS 2 S1 M2 Mouslim
Transféré par
Mr. magnetoTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
DS 2 S1 M2 Mouslim
Transféré par
Mr. magnetoDroits d'auteur :
Formats disponibles
Evaluation N°2 Page
1
Niveau : 2BACSPF 2
Physique - Chimie Durée 1h45min
Filière : Science expérimentale Option : Science physique Coefficient 7
Barème Physique (13 pts)
Exercice 1
Le chlore possède plusieurs isotopes dont trois seulement existent à l’état naturel : le chlore 35 ( 𝟑𝟓
𝟏𝟕𝑪𝒍), le
𝟑𝟕 𝟑𝟔
chlore 37 ( 𝟏𝟕𝑪𝒍) et le chlore 36 ( 𝟏𝟕𝑪𝒍). Les deux premiers sont stables alors que le chlore 36 est radioactif.
Dans les eaux de surface (mers, lacs) le chlore 36 est régulièrement renouvelé et la quantité du chlore 36 reste
constante au cours du temps.
Dans la glace à plusieurs mètres sous la surface, le renouvellement n’existe plus et la proportion en chlore 36
par rapport à tous les noyaux de chlore présent initialement diminue au cours du temps.
0.5 1) Donner la composition du noyau de chlore 36.
0.5 2) Donner la définition du terme « isotopes ».
0.5 3) Donner la définition d’un noyau radioactif.
𝟑𝟔
4) La réaction de désintégration du chlore 36 ( 𝟑𝟔 𝟏𝟕𝑪𝒍) donne un noyau d’argon stable de symbole 𝟏𝟖𝑨𝒓.
0.5 4-1) Donner l’équation de la désintégration d’un noyau de chlore 36.
0.5 4-2) Donner le nom de la particule émise et le nom du type de radioactivité mis en jeu.
0.5 5) Donner l’expression de la loi de décroissance radioactive.
0.5 6) Donner la définition du temps de demi-vie.
1 7) Calculer 𝝀 la valeur de la constante radioactive du chlore 36.
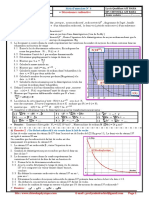
8) On cherche à déterminer l’âge 𝒕 d’un échantillon de glace de masse prélevé dans une carotte glaciaire de
l’Arctique et pour lequel il n’y a plus que 𝟕𝟓 % de noyaux de chlore 36 par rapport à un échantillon
récent de même masse.
𝑵(𝒕)
0.5 8-1) Donner la valeur du rapport pour le morceau de glace étudié.
𝑵𝟎
𝒕 𝑵𝒕
( )
1 8-2) À l’aide de la loi de décroissance, montrer que l’âge 𝒕 de l’échantillon s’exprime par : 𝒕 = − 𝒍𝒏𝟐
𝟏/𝟐
. 𝒍𝒏 𝑵
𝟎
0.5 8-3) Déterminer l’âge 𝒕 de l’échantillon de glace de l’Arctique.
Donnée : la demi-vie du chlore 36 : 𝒕𝟏/𝟐( 𝟑𝟔 𝟓
𝟏𝟕𝑪𝒍) = 𝟑, 𝟎𝟖. 𝟏𝟎 𝒂𝒏𝒔
Exercice 2
Dans certaines conditions, l’uranium 235 peut se scinder en deux noyaux plus légers et plus stables ; le
strontium et le xénon selon l’équation suivante : 𝟐𝟑𝟓 𝟏 𝟗𝟒 𝐀
𝟗𝟐𝐔 + 𝟎𝐧 ⟶ 𝐳𝐒𝐫 + 𝟓𝟒𝐗𝐞 + 𝟑 𝟎𝐧
𝟏
0.5 1) Comment appelle-t-on ce type de réaction ?
1 2) Déterminer la valeur de 𝑨 et de 𝒁.
1 3) Déterminer ∆𝐄 l’énergie de cette réaction en 𝐌𝐞𝐕 puis en joule.
1.5 4) Tracer le diagramme énergétique de cette réaction en exprimant les énergies en 𝐌𝐞𝐯.
1 5) Calculer en (u) le défaut de masse ∆𝒎 du noyau d’uranium 235.
0.5 6) Calculer (en MeV) l’énergie de liaison du noyau d’uranium 235.
0.5 7) En déduire l’énergie de liaison par nucléon 𝝃( 𝟐𝟑𝟓
𝟗𝟐𝐔).
0.5 𝟐𝟑𝟓 𝟐𝟑𝟖
8) Parmi ces deux isotopes 𝟗𝟐𝐔 et 𝟗𝟐𝐔 lequel est plus stable ? Justifier votre réponse.
Données : 𝝃( 𝟐𝟑𝟖 𝟗𝟐𝐔) = 𝟕. 𝟓𝟕 𝐌𝐞𝐯⁄𝐧𝐮𝐜𝐥é𝐨𝐧 et 𝟏𝐮 = 𝟗𝟑𝟏, 𝟓 𝐌𝐞𝐕. 𝐜 −𝟐 et 𝟏 𝐌𝐞𝐕 = 𝟏, 𝟔 𝟏𝟎 −𝟏𝟑 J
Uranium Strontium Xénon Neutron Proton
235 94 A 1 1
Symbole 92U zSr 54Xe 0n 1p
Masse (en u) 235,120 93,8946 138,888 1,00866 1,00728
Evaluation N°2 Page
2
Niveau : 2BACSPF 2
Physique - Chimie Durée 1h45min
Filière : Science expérimentale Option : Science physique Coefficient 7
Barème Chimie (7 pts)
L’objectif de cet exercice est d’étudier les propriétés de la réaction de l’acide lactique 𝑪𝟑 𝑯𝟔 𝑶𝟑 avec l’eau, pour
cela on prépare à 25° une solution aqueuse (𝐒) de cet acide de volume 𝐕 et de concentration molaire
𝐂 = 𝟐. 𝟏𝟎−𝟑 𝐦𝐨𝐥. 𝐋−𝟏 . la mesure de la conductance de la solution donne la valeur : 𝑮 = 𝟎. 𝟏 𝒎𝑺
0.5 1) Définir un acide au sens de Bronsted.
0.25 2) Donner les couples acide/base mises en jeu lors de la réaction de 𝑪𝟑 𝑯𝟔𝑶𝟑 avec 𝑯𝟐 𝑶.
0.25 3) En déduire l’équation de la réaction.
1 4) Dresser le tableau d’avancement en fonction de 𝐂, 𝐕, 𝐱 , 𝐱𝐦𝐚𝐱 et 𝐱é𝐪
1 𝑮
5) Montrer que l’expression du taux d’avancement final de la solution est donnée par 𝝉 = (𝝀
𝟏 + 𝝀𝟐 ).𝑪.𝒌
Calculer sa valeur et conclure.
1 6) Montrer que la valeur de 𝒑𝑯 de la solution (𝑆) est 𝒑𝑯 = 𝟒. 𝟓𝟗
𝑪.𝝉𝟐
1 7) Montrer que l’expression de la constante d’équilibre de la réaction est donnée par : 𝑲 = (𝟏−𝝉) calculer sa
valeur.
𝑲
0.5 8) Montrer que dans le cas d’une réaction très limitée (𝝉 ≪ 𝟏) on peut écrire 𝝉 = √ 𝑪
0.5 9) Quelle est l’effet de la constante d’équilibre sur le taux d’avancement.
0.5 10) Calculer 𝛕′ le taux d’avancement d’une solution (𝐒′) de concentration molaire 𝐂′ = 𝟐. 𝟏𝟎−𝟒 𝐦𝐨𝐥/𝐋
préparée à 25° à partir de la solution (𝐒) par dilution (on suppose que la réaction est très limitée).
0.5 11) Comparer 𝛕′ et 𝛕 et en déduire l’influence de la concentration initiale sur le taux d’avancement final.
Données : 𝛌𝐂𝟑𝐇𝟓𝐎−𝟑 = 𝛌𝟏 = 𝟒 𝐦𝐒. 𝐦𝟐 . 𝐦𝐨𝐥−𝟏 et 𝛌𝐇𝟑𝐎+ = 𝛌𝟐 = 𝟑𝟓 𝐦𝐒. 𝐦𝟐 . 𝐦𝐨𝐥−𝟏 et 𝒌 = 𝟎. 𝟏𝒎
Vous aimerez peut-être aussi
- Lycee Qualiant Tha Housseine Devoir 2 2Pcf 2022/2023Document2 pagesLycee Qualiant Tha Housseine Devoir 2 2Pcf 2022/2023yassine wxahdiPas encore d'évaluation
- Devoir 2 1S 2 SM (22-23)Document10 pagesDevoir 2 1S 2 SM (22-23)Anas TalhiPas encore d'évaluation
- Devoir 2 Modele 1 Physique Chimie 2 Bac SPC Semestre 1 1Document3 pagesDevoir 2 Modele 1 Physique Chimie 2 Bac SPC Semestre 1 1Marouane AkkaPas encore d'évaluation
- Du Chlore Dans L'eau LabolycéeDocument1 pageDu Chlore Dans L'eau LabolycéeALIENN 51Pas encore d'évaluation
- Série Complete Nucleaire Prof Elmnaouar (WWW - Pc1.ma)Document9 pagesSérie Complete Nucleaire Prof Elmnaouar (WWW - Pc1.ma)fardadi rachidPas encore d'évaluation
- SVT Probatd 2009Document7 pagesSVT Probatd 2009murielle matanePas encore d'évaluation
- Devoir 2, Modèle 2Document1 pageDevoir 2, Modèle 2Abd Razak Ëł KhaïriPas encore d'évaluation
- TDN - 2&corrig - Structure 2020 - 2021 - 2Document3 pagesTDN - 2&corrig - Structure 2020 - 2021 - 2Aissiou NabilaPas encore d'évaluation
- Chimie: (7 Points) Exercice 1: (4,5 Points) : X Mol.lDocument4 pagesChimie: (7 Points) Exercice 1: (4,5 Points) : X Mol.lMohamed SaidiPas encore d'évaluation
- Devoir 5 NuclDocument3 pagesDevoir 5 NuclalaeddinePas encore d'évaluation
- Serie1 Nuclaire Converted BestcoursDocument2 pagesSerie1 Nuclaire Converted BestcourstaziadambkPas encore d'évaluation
- (WWW - Al7ibre - Com) Examen National Physique-Chimie SPC Normale 2023Document6 pages(WWW - Al7ibre - Com) Examen National Physique-Chimie SPC Normale 2023malokaPas encore d'évaluation
- Controle 2 S1Document2 pagesControle 2 S1doaa essabikPas encore d'évaluation
- Série D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument7 pagesSérie D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDRima El100% (2)
- Orniformation Probatoire 2009 D SVTDocument7 pagesOrniformation Probatoire 2009 D SVTmoivoici147Pas encore d'évaluation
- S1 DS N°3 2bacDocument2 pagesS1 DS N°3 2bacツheyPas encore d'évaluation
- Série3 ChromatographieDocument6 pagesSérie3 ChromatographieIymen Bouti100% (1)
- Normal 2018 PDFDocument10 pagesNormal 2018 PDFMohamed El OuahdaniPas encore d'évaluation
- Devoir 1Document1 pageDevoir 1SAID yousfiPas encore d'évaluation
- Controle2 2Document2 pagesControle2 2amina oubennaiPas encore d'évaluation
- Série N°4Document1 pageSérie N°4Jihad ELPas encore d'évaluation
- PC RadioactivitéDocument4 pagesPC RadioactivitéDieu-Grâce PangouPas encore d'évaluation
- Examen Blanc SC Math Num 3Document10 pagesExamen Blanc SC Math Num 3Yasmine Ine100% (1)
- Devoir 4Document2 pagesDevoir 4Ahmed Ahmed100% (1)
- Devoir A Domicile Semestre 1 Modéle 1 2024-2023 - PC3Document2 pagesDevoir A Domicile Semestre 1 Modéle 1 2024-2023 - PC3omailina7Pas encore d'évaluation
- Examen Blanc FinalDocument7 pagesExamen Blanc Finalyunuabou3Pas encore d'évaluation
- Examen Blanc Spc2022 IcheDocument7 pagesExamen Blanc Spc2022 Ichesine abdellahPas encore d'évaluation
- Examen National PC - Filière SVT - Rattrapage - 2018Document6 pagesExamen National PC - Filière SVT - Rattrapage - 2018Soufyan PowerPas encore d'évaluation
- Travail A Faire - RadioactiviteDocument4 pagesTravail A Faire - Radioactiviteadjidavibruno7Pas encore d'évaluation
- Contrôle 3Document3 pagesContrôle 3youssef100% (2)
- Examens Nationaux PC 2011-2023Document179 pagesExamens Nationaux PC 2011-2023Abdo IdrissiPas encore d'évaluation
- Devoir Enseignement Scientifique - Première - Avril 2020: Exercice 1: Révisions de SecondeDocument4 pagesDevoir Enseignement Scientifique - Première - Avril 2020: Exercice 1: Révisions de SecondeIrieej PPas encore d'évaluation
- TD3 Structure ElectroniqueDocument4 pagesTD3 Structure ElectroniqueAnis ChaibiPas encore d'évaluation
- Fiche TD N°1 Ue CHM111Document4 pagesFiche TD N°1 Ue CHM111Raphaël DjakbaPas encore d'évaluation
- PCT 3è-1Document1 pagePCT 3è-1arsene BATAWUILAPas encore d'évaluation
- Chimie 2Document2 pagesChimie 2tcheva jokhanan TiambiPas encore d'évaluation
- PC SVT RS 2016 (WWW - Pc1.ma) PDFDocument7 pagesPC SVT RS 2016 (WWW - Pc1.ma) PDFAssraoui SellamPas encore d'évaluation
- Examens Bac International PC SVT 2016 RDocument11 pagesExamens Bac International PC SVT 2016 Rkhaoula ettalebPas encore d'évaluation
- Devoir 2 PC BiofDocument2 pagesDevoir 2 PC BiofElkadiri IlyesPas encore d'évaluation
- 2008 09 Antilles Exo1 Sujet Nucleaire Ester 8ptsDocument3 pages2008 09 Antilles Exo1 Sujet Nucleaire Ester 8ptsLoulou PetitePas encore d'évaluation
- Devoir Enseignement Scientifique - Première - Avril 2020Document3 pagesDevoir Enseignement Scientifique - Première - Avril 2020Agathe LenquettePas encore d'évaluation
- Bac Blanc Série C 2023 Sujet 2Document6 pagesBac Blanc Série C 2023 Sujet 2pemejosuePas encore d'évaluation
- Qui MicaDocument8 pagesQui Micatamylemor2002Pas encore d'évaluation
- Série N1 - La Décroissance RadioactiveDocument8 pagesSérie N1 - La Décroissance RadioactiveAbderrahmane El Ouafy100% (1)
- Noyaux, Masse Et Énergie FDocument4 pagesNoyaux, Masse Et Énergie Fsihammouatassim3Pas encore d'évaluation
- Science Physique Bac Sénégal 2009Document2 pagesScience Physique Bac Sénégal 2009Line Hustling DollarPas encore d'évaluation
- TS - BAC Blanc N°1 - ObligatoireDocument9 pagesTS - BAC Blanc N°1 - ObligatoirephytanjaPas encore d'évaluation
- Proposition 1Document8 pagesProposition 1Testeur MohammediaPas encore d'évaluation
- Decroissance Nucliere BiofDocument8 pagesDecroissance Nucliere BiofyoussefPas encore d'évaluation
- EVAL4 2dec FAMMEGNE 2021Document4 pagesEVAL4 2dec FAMMEGNE 2021princessdf89Pas encore d'évaluation
- Contrôle 24 (PR Aghattas Hachim)Document2 pagesContrôle 24 (PR Aghattas Hachim)Mouhibi Abdellah0% (1)
- Biof Exam Blanc 09-05-2020Document9 pagesBiof Exam Blanc 09-05-2020Hajar NassilaPas encore d'évaluation
- Devoir Maison #01Document3 pagesDevoir Maison #01Amine AlaoUii AlaouiPas encore d'évaluation
- Decroissance Radioactive Exercices Non Corriges 3 1Document2 pagesDecroissance Radioactive Exercices Non Corriges 3 1boufdiliPas encore d'évaluation
- Exercices 32 Decroissance Radioactive (PR Mehdi El Hichami)Document4 pagesExercices 32 Decroissance Radioactive (PR Mehdi El Hichami)trdr42gs8gPas encore d'évaluation
- Série D'exercice 2 Nucleaire Et Etat Equilibre ModéfierDocument11 pagesSérie D'exercice 2 Nucleaire Et Etat Equilibre Modéfierdouaabouab2021Pas encore d'évaluation
- Sujet S1 S1a S3Document4 pagesSujet S1 S1a S3nova couliPas encore d'évaluation
- TD1 2023-2024Document2 pagesTD1 2023-2024justinredmi802Pas encore d'évaluation
- Méthodologie: ContexteDocument6 pagesMéthodologie: ContexteAymen Ben BrahimPas encore d'évaluation
- Radioprotection PPTDocument25 pagesRadioprotection PPTNor CenePas encore d'évaluation
- Resumé NucléaireDocument5 pagesResumé NucléaireMëđï Bëñmãššøůđ BnmssdPas encore d'évaluation
- Série Modèle Atomique TC BIOF (WWW - Pc1.ma)Document1 pageSérie Modèle Atomique TC BIOF (WWW - Pc1.ma)Home erriahiPas encore d'évaluation
- TP 2vDocument7 pagesTP 2vAli La100% (2)
- Examen Nucl 2018 Avec CorrigéDocument5 pagesExamen Nucl 2018 Avec CorrigéKarimBenAPas encore d'évaluation
- 2.3 - Cours - L Energie NucleaireDocument23 pages2.3 - Cours - L Energie Nucleaireassma BENDAHOUPas encore d'évaluation
- MasterClass 2017Document57 pagesMasterClass 2017mcb0431703Pas encore d'évaluation
- Epreuve de Biophysique CorrigDocument3 pagesEpreuve de Biophysique CorrigFofana LancinéPas encore d'évaluation
- Cap AtomistiqueDocument40 pagesCap AtomistiqueAll AhmeDciaPas encore d'évaluation
- Pourquoi Le Nucléaire (Bertrand Barré, Jean-Marc Jancovici) (Z-Library)Document182 pagesPourquoi Le Nucléaire (Bertrand Barré, Jean-Marc Jancovici) (Z-Library)Favre JordanPas encore d'évaluation
- 2 C O1 Des Atomes Aux IonsDocument6 pages2 C O1 Des Atomes Aux IonsPecorella100% (1)
- Syn 5Document5 pagesSyn 5Hisham Nice-lionPas encore d'évaluation
- Chap 1Document64 pagesChap 1Souf Abidi100% (2)
- Séminaires InternesDocument31 pagesSéminaires Interneszakaria nabilPas encore d'évaluation
- Examen Corrige SN 2015Document5 pagesExamen Corrige SN 2015Yc YacinePas encore d'évaluation
- (Ingénierie Et Développement Durable) Rodolphe Antoni, Laurent Bourgois (Auth.) - Physique Appliquée À L'exposition Externe - Dosimétrie Et Radioprotection (2013, Springer Paris) PDFDocument479 pages(Ingénierie Et Développement Durable) Rodolphe Antoni, Laurent Bourgois (Auth.) - Physique Appliquée À L'exposition Externe - Dosimétrie Et Radioprotection (2013, Springer Paris) PDFYassineJouddiPas encore d'évaluation
- BiophysiqueDocument2 pagesBiophysiquediayeloupPas encore d'évaluation
- RMN 2DDocument14 pagesRMN 2Dezo ezoPas encore d'évaluation
- Cours RMNDocument47 pagesCours RMNSanaa Laslami33% (3)
- Le Modele de L Atome Corrige Serie D Exercices 1 1Document8 pagesLe Modele de L Atome Corrige Serie D Exercices 1 1rihabPas encore d'évaluation
- Physique ChimieTerminale1395852877Document1 pagePhysique ChimieTerminale1395852877Yaovi Serge GatsiPas encore d'évaluation
- BN 3452Document28 pagesBN 3452Alex GrxPas encore d'évaluation
- Annatut' UE3a-Biophysique 2012-2013Document35 pagesAnnatut' UE3a-Biophysique 2012-2013momarrid infoPas encore d'évaluation
- Cours Interaction Rayonnementent MatièreDocument53 pagesCours Interaction Rayonnementent MatièreSouliman BEN HAMMOUPas encore d'évaluation
- Épreuve Sciences Physiques Classe 4ème Sciences 1 Prof: Chebbi RachidDocument4 pagesÉpreuve Sciences Physiques Classe 4ème Sciences 1 Prof: Chebbi RachidMohamed SaidiPas encore d'évaluation
- Chernoyl AnouarDocument21 pagesChernoyl AnouarAnouar FaouziPas encore d'évaluation
- Livre Blanc Medecine Nu Clea I ReDocument43 pagesLivre Blanc Medecine Nu Clea I RejokerhuPas encore d'évaluation
- StratigraphieDocument61 pagesStratigraphieYoussef CHPas encore d'évaluation
- La Radioactivité PDFDocument20 pagesLa Radioactivité PDFBreathe 4 footballPas encore d'évaluation
- Géobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainD'EverandGéobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainÉvaluation : 4.5 sur 5 étoiles4.5/5 (2)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Harmonisation Energétique des Personnes: Manuel de Curothérapie 2020D'EverandHarmonisation Energétique des Personnes: Manuel de Curothérapie 2020Évaluation : 4 sur 5 étoiles4/5 (8)
- Conception & Modélisation CAO: Le guide ultime du débutantD'EverandConception & Modélisation CAO: Le guide ultime du débutantPas encore d'évaluation
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Histoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsD'EverandHistoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsPas encore d'évaluation
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- Le profilage au service du football: Démarche scientifique pour un recrutement et entraînements optimisésD'EverandLe profilage au service du football: Démarche scientifique pour un recrutement et entraînements optimisésPas encore d'évaluation
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)