Académique Documents
Professionnel Documents
Culture Documents
Devoir 2 1S 2 SM (22-23)
Transféré par
Anas TalhiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Devoir 2 1S 2 SM (22-23)
Transféré par
Anas TalhiDroits d'auteur :
Formats disponibles
Deuxième Bac : Devoir surveillé :2
SM :1 et 2
Physique Chimie
Durée :2h Vendredi : 23-12-2022
Exercice : 1 (7 pts)
L’iode 131 est un élément radioactif, utilisé à petite doses, notamment pour des
applications médicales.
Cet exercice a pour but d’étudier la désintégration de l’iode 131.
Données
Constante d’Avogadro : 𝑁𝐴 = 6,02. 1023 𝑚𝑜𝑙 −1
masse molaire de l’iode : 𝑀( 131
53𝐼 ) = 131𝑔. 𝑚𝑜𝑙
−1
masse des noyaux :
53𝐼 ) = 130,8770𝜇 , 𝑚( 53𝐼 ) = 122,8765𝜇 ,
𝑚( 131 𝑚𝑝 = 1,0073𝜇 , 𝑚𝑛 = 1,0087𝜇
123
les énergies :
𝐸1 = 123019,01𝑀𝑒𝑉 , 𝐸2 = 121911,92𝑀𝑒𝑉 , 𝐸3 = 121911,04𝑀𝑒𝑉 , ∆𝐸1 = −0,79𝑀𝑒𝑉
1- Déterminer la ou (les) proposition(s) juste(s) parmi les propositions suivantes (1pt)
Chakir abdeljalil chakir203@gmail.com www.rihabpc.com Page1
1-1- La masse d’un noyau est égale à la somme des masses de ses nucléons.
1-2- Les isotopes sont des nucléides partageant le même nombre de neutrons et ayant
le nombre de protons différent
1-3- L’activité d’un échantillon à un instant est proportionnelle au nombre de noyaux
radioactifs présents dans cet échantillon à cet instant.
1-4- La fission est une transformation nucléaire provoquée.
2- Parmi les isotopes de l’iode, on trouve 13153𝐼 et 53𝐼 .comparer la stabilité des nucléides 53𝐼
123 131
et 123
53𝐼 . (1pt)
3- L’isotope 131 53𝐼 est radioactif 𝛽 qui se transforme en Xénon 𝑍𝑋𝑒 .la demi-vie de 53𝐼 est
− 𝐴 131
𝑡1⁄ ( 131
53𝐼 ) = 8𝑗𝑜𝑢𝑟𝑠.
2
A 𝑡 = 0,on considere un échantillon d’iode de masse 𝑚0 = 0,12𝑔.Le pourcentage massique
de l’isotope 131
53𝐼 dans cet échantillon est 72,6%
3-1- Ecrire l’équation de la désintégration nucléaire de 131
53𝐼 (1pt)
3-2- Calculer 𝑎0 l’activité de cet
échantillon à 𝑡 = 0 (1pt)
3-3- Déterminer en fonction de 𝑡1⁄ ,
2
l’expression de la durée 𝑡1 au bout de
la quelle les 99% des noyaux des 131 53𝐼
auront disparu par désintégration.
calculer sa valeur (1pt)
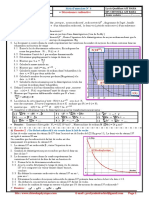
3-4- Le diagramme d’énergie de cette
transformation est donné par le
document à coté
3-4-1- Calcule ∆𝐸 l’énergie libérée par
la désintégration d’un noyau de 131 53𝐼
(1pt)
3-4-2- Calculer 𝐸𝑙 ( 𝐴𝑍𝑋𝑒) l’énergie de liaison
du noyau fils formée 𝐴𝑍𝑋𝑒 (1pt)
Exercice : 2 (6 pts)
Le radium a été découvert par Pierre et Marie Curie en 1898
En médecine, on emploi Le radium 223 comme producteur de radon dans le traitement
de certains cancers. Le radium 223 a été approuvé dans le traitement des métastases
osseuses. On a aussi utilisé le radium pour rendre les aiguilles de montre luminescentes.
Cet exercice a pour but d’étudier la désintégration du radium 226
Données :
Masse des noyaux
88𝑅𝑎 ) = 225,9771𝜇 ,
𝑚( 226 88𝑅𝑎 ) = 229,9888𝜇 , 𝑚( 86𝑅𝑛) = 221,9704𝜇 ,
𝑚( 230 222
𝑚( 42𝐻𝑒 ) = 4,0015𝜇 𝑚𝑝 = 1,0073𝜇 , 𝑚𝑛 = 1,0087𝜇
Temps de demi-vie : 𝑡1⁄ ( 226
88𝑅𝑎 ) = 1620𝑎𝑛𝑠
2
1𝑒𝑉 = 1,6. 10−19 𝐽 1𝜇 = 931,5𝑀𝑒𝑉. 𝑐 −2
Chakir abdeljalil chakir203@gmail.com www.rihabpc.com Page2
Le nucléide de Radium 226
88𝑅𝑎 est radioactif, se désintègre pour donner naissance au nucléide 86𝑅𝑛
222
1- Ecrire l’équation de désintégration nucléaire (1pt)
2- Comparer la stabilité des deux isotopes 22688𝑅𝑎 et 88𝑅𝑎
230
(1pt)
3- Calculer ∆𝐸 l’énergie libérée par la désintégration du nucléide de radium 226
88𝑅𝑎 (1pt)
4- On possède à l’instant 𝑡 = 0 un échantillon de Radium 88𝑅𝑎 ,sa puissance nucléaire initiale
226
est 𝑃0 = 1,01𝑚𝑊
4-1- Montrer que la valeur de l’activité de l’échantillon à l’instant 𝑡 = 0 est
𝑎0 = 1,30. 109 𝐵𝑞 (1pt)
4-2- Calculer 𝑎 la valeur de l’activité de l’échantillon à l’instant 𝑡 = 4860𝑎𝑛𝑠 (1pt)
𝑁( 222𝑅𝑛)
4-3- On considère à l’instant 𝑡, 𝑟 = 𝑁( 226
86
𝑅𝑎 )
88
avec :- 𝑁( 222
86𝑅𝑛) le nombre de noyaux 22286𝑅𝑛 à l’instant 𝑡
- 226
𝑁( 88𝑅𝑎) le nombre de noyaux 88𝑅𝑎 à l’instant 𝑡
226
Trouver l’expression de 𝑡 en fonction de 𝑡1⁄ et 𝑟 et calculer sa valeur auquel
2
𝑟 = 0,2 (1pt)
Exercice : 3 (7 pts)
Partie 1 : Réaction entre l’acide benzoïque et l’eau
Données : les conductivités molaires ioniques en (𝑚𝑆. 𝑚2 . 𝑚𝑜𝑙 −1 ) :
𝜆1 = 𝜆𝐻3 𝑂+ = 35 , 𝜆2 = 𝜆𝐶5 𝐻6 𝐶𝑂𝑂− = 3,2 , 𝜆3 = 𝜆𝐶𝑙− = 7,63
1- On prépare une solution aqueuse 𝑆1 d’acide benzoïque 𝐶6 𝐻5 𝐶𝑂𝑂𝐻 de
concentration 𝐶 ,de volume 𝑉 et de constante d’acidité 𝐾 = 𝐾𝐴 = 6,28 × 10−5
- La mesure de la conductance de cette solution donne 𝐺1 = 8,6. 10−5 𝑆.
- La mesure de la conductance dans les mêmes conditions d’une solution d’acide
Chakir abdeljalil chakir203@gmail.com www.rihabpc.com Page3
chlorhydrique (𝐻3 𝑂+ + 𝐶𝑙 − ) de même concentration donne la valeur
𝐺2 = 4,3. 10−4 𝑆.
1-1- Ecrire l'équation de la réaction d’acide benzoïque avec l'eau. (0,5pt)
1-2- Exprimer la conductance 𝐺1 de la solution 𝑆1en fonction des conductivités
molaires ioniques et de la concentration des ions oxoniums et de la
constante de la cellule de mesure K. (0,5pt)
1-3- Exprimer 𝜏 le taux d’avancement final de la réaction d’acide benzoïque avec
l'eau en fonction de 𝐺1 ,des conductivités molaires ioniques ,de la
concentration 𝐶 et de la constante de la cellule de mesure 𝑘 (0,5pt)
1-4- Exprimer 𝐾 la constante d’équilibre associée la réaction d’acide benzoïque
avec l'eau en fonction de :
𝜏 le taux d’avancement final et la concentration 𝐶. (0,5pt)
1-5- Sachant que la réaction du chlorure d'hydrogène avec l'eau est une
réaction totale. Exprimer 𝜏 le taux d’avancement final la réaction d’acide
benzoïque avec l'eau en fonction de :
𝐺1 , 𝐺2 , 𝜆1 , 𝜆2 𝑒𝑡 𝜆3
Et calculer sa valeur (0,5pt)
1-6- calculer la concentration 𝐶 et déduire la valeur de 𝑝𝐻 de la solution
d’acide benzoïque (0,5pt)
2- On dilue la solution d’acide benzoïque 𝐶6 𝐻5 𝐶𝑂𝑂𝐻 20fois
2-1- calculer la concentration 𝐶1 de la solution diluée (0,5pt)
2-2- calculer le nouveau taux d’avancement final 𝜏1 (0,5pt)
2-3- calculer 𝑝𝐻1 (0,5pt)
2-4- En déduire l’effet de la dilution sur la valeur de 𝑝𝐻 et le taux
d’avancement final (0,5pt)
Partie 2 : Réaction entre l’acide méthanoïque 𝐻𝐶𝑂𝑂𝐻 et l’ion éthanoate 𝐶𝐻3𝐶𝑂𝑂−
Données : les conductivités molaires ioniques en (𝑚𝑆. 𝑚2 . 𝑚𝑜𝑙 −1 ) :
𝜆1 = 𝜆𝑁𝑎+ = 5,01 , 𝜆2 = 𝜆𝐶𝐻3 𝐶𝑂𝑂− = 4,1 , 𝜆3 = 𝜆𝐻𝐶𝑂𝑂− = 5,46
On prépare un volume 𝑉 = 50𝑚𝐿 d’une solution aqueuse en mélangeant une quantité de
matière 𝑛1 = 2,5𝑚𝑚𝑜𝑙 d’acide méthanoïque 𝐻𝐶𝑂𝑂𝐻 avec 𝑛2 = 5𝑚𝑚𝑜𝑙 d’éthanoate de
sodium (𝑁𝑎+ + 𝐶𝐻3 𝐶𝑂𝑂− ) .La conductivité de ce mélange est 𝜎 = 0,973 𝑆. 𝑚−1 .
1- Écrire l’équation de la réaction entre l’acide méthanoïque et l’ion éthanoate.
Et Dresser le tableau d’avancement (0,5pt)
2- Exprimer la concentration des différents espèces chimique présent en solution en
fonction de : 𝑛1 , 𝑛2 , 𝑉 et [𝐻𝐶𝑂𝑂− ]𝑓 la concentration finale des ions methanoate.
Et trouver l’expression la conductivité 𝜎 de la solution en fonction de :
𝑛2 , 𝑉 , 𝜆1 , 𝜆2 , 𝜆3 et [𝐻𝐶𝑂𝑂− ]𝑓 , puis calculer la valeur de [𝐻𝐶𝑂𝑂− ]𝑓 (0,5pt)
3- Calculer 𝜏 le taux d’avancement de la réaction (0,5pt)
4- montrer que 𝐾 la constante d’équilibre de la réaction s’écrit sous la forme :
τ2
𝐾 = (1−τ)(2−τ) puis calculer sa valeur (0,5pt)
Chakir abdeljalil chakir203@gmail.com www.rihabpc.com Page4
Bonne chance
Faite attention
Aux radiations
Du devoir !!!
Chakir abdeljalil chakir203@gmail.com www.rihabpc.com Page5
Solution
Exercice : 1
1- (les) proposition(s) juste(s) parmi les propositions suivantes
1-3 et 1-4
2- comparaison de la stabilité des nucléides 131
53𝐼 et 53𝐼
123
Pour comparer la stabilité on calcul les énergies de liaison par nucléons pour chaque
noyaux :
𝐸𝑙 ( 131
53𝐼 ) ∆𝑚( 131
53𝐼 ). 𝐶
2 [(53 × 1,0073) + (78 × 1,0087) − 130,8770] 2
𝜉𝑙 ( 131
53𝐼 ) = = = .𝐶
131 131 131
123
𝐸𝑙 ( 123
53𝐼 ) ∆𝑚( 123
53𝐼 ). 𝐶
2 [(53 × 1,0073) + (70 × 1,0087) − 122,8765] 2
{ 𝜉𝑙 ( 53 𝐼 ) = = = .𝐶
123 123 123
𝜉𝑙 ( 131 −3 2
53𝐼 ) = 9,0725 × 10 𝜇. 𝐶 = 9,0725 × 10
−3
× 931,5𝑀𝑒𝑉. 𝑐 −2 . 𝐶 2 = 8,4510𝑀𝑒𝑉. 𝑛𝑢𝑐𝑙𝑒𝑜𝑛 −1
{
𝜉𝑙 ( 123 −3 2 −3 −2 2
53𝐼 ) = 9,1008 × 10 𝜇. 𝐶 = 9,1008 × 10 . 931,5𝑀𝑒𝑉. 𝑐 . 𝐶 = 8,4774𝑀𝑒𝑉. 𝑛𝑢𝑐𝑙𝑒𝑜𝑛
−1
𝜉 ( 131
53𝐼 ) = 8,4510𝑀𝑒𝑉. 𝑛𝑢𝑐𝑙𝑒𝑜𝑛
−1
{ 𝑙 123
𝜉𝑙 ( 53𝐼 ) = 8,4774𝑀𝑒𝑉. 𝑛𝑢𝑐𝑙𝑒𝑜𝑛 −1
Puisque : 𝜉𝑙 ( 123
53𝐼 ) > 𝜉𝑙 ( 53𝐼 ) le noyau 53𝐼 est plus stable que 53𝐼
131 123 131
3- L’isotope 131 53𝐼 est radioactif 𝛽 qui se transforme en Xénon 𝑍𝑋𝑒 .la demi-vie de
− 𝐴 131
53𝐼 est
𝑡1⁄ ( 131
53𝐼 ) = 8𝑗𝑜𝑢𝑟𝑠.
2
3-1- l’équation de la désintégration nucléaire de 131
53𝐼
on a : 53𝐼 → 𝑍𝑋𝑒 + −1𝑒
131 𝐴 0
131 = 𝐴 + 0 𝐴 = 131
En appliquant la loi de conservation : { ⇒ { Donc : 131
54𝑋𝑒
53 = 𝑍 − 1 𝑍 = 54
D’où : 131 131
53𝐼 → 54𝑋𝑒 + −1𝑒
0
3-2- Calcul 𝑎0 l’activité de cet échantillon à 𝑡 = 0
𝑙𝑛2 𝑚0 ( 131
53𝐼 )
𝑎0 = 𝜆. 𝑁0 ( 131
53𝐼 ) = 𝑡 131 . . 𝑁𝐴
1⁄ ( 53𝐼 ) 𝑀( 131
53𝐼 )
2
avec 𝒎𝟎 ( 13153𝐼 ) = 72,6% de la masse 𝒎𝟎 c,à,d : 𝑚0 ( 53𝐼 ) = 0,726.0,12 = 0,08712𝑔
131
et : 𝑡1⁄ ( 131
53𝐼 ) = 8𝑗𝑜𝑢𝑟𝑠 = 8 × 24 × 3600 = 0,6912 × 10 𝑠
6
2
Calcul de 𝑎0
𝑙𝑛2 0,08712
𝑎0 = 0,6912×106 . 131 . 6,02. 1023 = 3,9966 × 1014 D’où 𝑎0 = 3,9966 × 1014 𝐵𝑞
3-3- l’expression de la durée 𝑡1 au bout de la quelle les 99% des noyaux des 131 53𝐼
auront disparu par désintégration .calculer sa valeur
d’après la loi de désintégration on a : 𝑁(𝑡) = 𝑁0 . 𝑒 −𝜆.𝑡1 avec 𝑁(𝑡) = 0,01. 𝑁0
𝑙𝑛2
− .𝑡1
𝑡1
Donc : 0,01. 𝑁0 = 𝑁0 . 𝑒 −𝜆.𝑡1
⇒ 0,01 = 𝑒 −𝜆.𝑡1
=𝑒 ⁄2
D’où : 𝑡1 = 6,6439. 𝑡1⁄
𝑙𝑛2
donc : − . 𝑡1 = 𝑙𝑛0,01 ⇒ 𝑡1 = 6,6439. 𝑡1⁄
𝑡1⁄ 2 2
2
Chakir abdeljalil chakir203@gmail.com www.rihabpc.com Page6
calcul de 𝑡1 : 𝑡1 = 6,6439.8 = 53,1512 D’où : 𝑡1 = 53,1512𝑗𝑜𝑢𝑟𝑠
3-4- Exploitation du diagramme d’énergie
3-4-1- Calcul ∆𝐸 l’énergie libérée par la désintégration d’un noyau de 131
53𝐼
D’après le diagramme on a : ∆𝐸 = 𝐸3 − 𝐸2 = 121911,04 − 121911,92
D’où : ∆𝐸 = −0,88𝑀𝑒𝑉
3-4-2- Calculer 𝐸𝑙 ( 𝐴𝑍𝑋𝑒)
D’après le diagramme on a :
∆𝐸1 + 𝐸𝑙 ( 𝐴𝑍𝑋𝑒) = 𝐸3 − 𝐸1
Exercice : 2
1- l’équation de désintégration nucléaire
226 222 𝐴
88𝑅𝑎 → 86𝑅𝑛 + 𝑍𝑋
226 = 222 + 𝐴 𝐴=4
En appliquant la loi de conservation : { ⇒ { Donc : 𝐴𝑍𝑋 = 42𝐻𝑒
88 = 86 + 𝑍 𝑍=2
D’où :
226 222 4
88𝑅𝑎 → 86𝑅𝑛 + 2𝐻𝑒
2- Comparaison la stabilité des deux isotopes 226 88𝑅𝑎 et 88𝑅𝑎
230
Pour comparer la stabilité on calcul les énergies de liaison par nucléons pour chaque
noyaux :
𝐸𝑙 ( 226
88𝑅𝑎 ) ∆𝑚( 226
88𝑅𝑎 ). 𝐶
2 [(88 × 1,0073) + (138 × 1,0087) − 225,9771] 2
𝜉𝑙 ( 226
88 𝑅𝑎 ) = = = .𝐶
226 226 226
230
𝐸𝑙 ( 230
88𝑅𝑎 ) ∆𝑚( 230
88𝑅𝑎 ). 𝐶
2 [(88 × 1,0073) + (142 × 1,0087) − 229,9888] 2
𝜉 ( 𝑅𝑎 ) = = = .𝐶
{ 𝑙 88 230 230 230
𝜉 ( 226𝑅𝑎 ) = 8,2562 × 10−3 𝜇. 𝐶 2 = 8,2562 × 10−3 × 931,5𝑀𝑒𝑉. 𝑐 −2 . 𝐶 2 = 7,6906𝑀𝑒𝑉. 𝑛𝑢𝑐𝑙𝑒𝑜𝑛 −1
{ 𝑙 88
𝜉𝑙 ( 230 −3 2 −3 −2 2
88𝑅𝑎 ) = 8,2130 × 10 𝜇. 𝐶 = 8,2130 × 10 . 931,5𝑀𝑒𝑉. 𝑐 . 𝐶 = 7,6504𝑀𝑒𝑉. 𝑛𝑢𝑐𝑙𝑒𝑜𝑛
−1
𝜉𝑙 ( 226
88𝑅𝑎 ) = 7,6906𝑀𝑒𝑉. 𝑛𝑢𝑐𝑙𝑒𝑜𝑛
−1
{
𝜉𝑙 ( 230
88𝑅𝑎 ) = 7,6504𝑀𝑒𝑉. 𝑛𝑢𝑐𝑙𝑒𝑜𝑛
−1
Puisque : 𝜉𝑙 ( 226
88𝑅𝑎 ) > 𝜉𝑙 ( 88𝑅𝑎 ) le noyau
230 226
88𝑅𝑎 est plus stable que 230
88𝑅𝑎
3- Calcul ∆𝐸 l’énergie libérée par la désintégration du nucléide de radium 226
88𝑅𝑎
226
∆𝐸 = ∆𝑚. 𝐶 2 = (𝑚( 42𝐻𝑒) + 𝑚( 222
86𝑅𝑛) − 𝑚( 88𝑅𝑎 )). 𝐶
2
∆𝐸 = [4,0015 + 221,9704 − 225,9771]. 𝐶 2 = −5,2 × 10−3 𝜇. 𝐶 2 = −5,2 × 10−3 . 931,5𝑀𝑒𝑉. 𝑐 −2 . 𝐶 2
∆𝐸 = −4,8438𝑀𝑒𝑉
4- La puissance nucleaire
𝐽
4-1- on a la puissance : 𝑃0 = 1,01𝑚𝑊 = 1,01 × 10−3 𝑊 = 1,01 × 10−3 ⁄𝑠
C’est-à-dire en une seconde il Ya libération d’une énergie : 𝐸0 = 1,01 × 10−3 𝑗 à
cause de la désintégration de 𝑁0 ( 226
88𝑅𝑎 ) c’est-à-dire : 𝑁0 ( 88𝑅𝑎 ) représente le
226
nombre de noyaux désintégré par seconde c’est l’activité donc : 𝑎0 = 𝑁0 ( 226 88𝑅𝑎 )
Chakir abdeljalil chakir203@gmail.com www.rihabpc.com Page7
𝐸 𝐸
Avec : 𝑁0 ( 226 0
88𝑅𝑎 ) = ∆𝐸 ⇒ 𝑎0 = ∆𝐸0
𝐸 1,01×10−3
AN : 𝑎0 = ∆𝐸0 = = 1,2903 × 109
4,8438×106 ×1,6×10−19
D’où : 𝑎0 = 1,3 × 109 𝐵𝑞
4-2- Calcul 𝑎 la valeur de l’activité de l’échantillon à l’instant 𝑡 = 4860𝑎𝑛𝑠
𝑙𝑛2
− .𝑡
D’après la loi de désintégration radioactive : 𝑎(𝑡) = 𝑎0 . 𝑒 −𝜆.𝑡 𝑡1
= 𝑎0 . 𝑒 ⁄2
𝑙𝑛2
D’où : 𝑎(𝑡) = 0,163 × 109 𝐵𝑞
− .4860
𝑎(𝑡) = 1,30. 109 . 𝑒 = 0,163 × 109
1620
4-3- l’expression de 𝑡 en fonction de 𝑡1⁄ et 𝑟 et calculer sa valeur auquel 𝑟 = 0,2
2
d’après la loi de désintégration on a : 𝑁(𝑡) = 𝑁0 . 𝑒 −𝜆.𝑡
226
𝑁(𝑡) = 𝑁( 88𝑅𝑎)
on a : { Donc : 𝑁( 226 226 222
88𝑅𝑎 ) = [𝑁( 88𝑅𝑎 ) + 𝑁( 86𝑅𝑛)]. 𝑒
−𝜆.𝑡
𝑁0 = 𝑁( 226
88 𝑅𝑎 ) + 𝑁 ( 222
86 𝑅𝑛 )
𝑁( 226
88𝑅𝑎) 𝑁( 226 222
88𝑅𝑎) + 𝑁( 86𝑅𝑛)
−𝜆.𝑡
=𝑒 ⇒ = 𝑒 𝜆.𝑡
𝑁( 226 222
88𝑅𝑎) + 𝑁( 86𝑅𝑛) 𝑁( 226
88𝑅𝑎)
𝑙𝑛2
.𝑡
𝑁( 222
86𝑅𝑛) 𝑡1
⇒ 1+ =𝑒 𝜆.𝑡
⇒1+𝑟 =𝑒 𝜆.𝑡
=𝑒 ⁄2
on introduit 𝑙𝑛
𝑁( 226
88𝑅𝑎)
𝑡1⁄ .𝑙𝑛(1+𝑟)
𝑙𝑛2
Donc : 𝑡
2
𝑐′ 𝑒𝑠𝑡à 𝑑𝑖𝑟𝑒 ∶ 𝑙𝑛(1 + 𝑟) = 𝑡 . 𝑡 =
1⁄ 𝑙𝑛2
2
D’où : 𝑡 = 428,06𝑎𝑛𝑠
1620.𝑙𝑛(1+0,2)
Calcul de 𝑡 : 𝑡 = = 428,06
𝑙𝑛2
Exercice : 3
Partie 1 : Réaction entre l’acide benzoïque et l’eau
Données : les conductivités molaires ioniques en (𝑚𝑆. 𝑚2 . 𝑚𝑜𝑙 −1 ) :
𝜆1 = 𝜆𝐻3 𝑂+ = 35 , 𝜆2 = 𝜆𝐶5 𝐻6 𝐶𝑂𝑂− = 3,2 , 𝜆3 = 𝜆𝐶𝑙− = 7,63
1- On prépare une solution aqueuse 𝑆1 d’acide benzoïque 𝐶6 𝐻5 𝐶𝑂𝑂𝐻 de
concentration en soluté apporte est 𝐶 et de volume𝑉.
- La mesure de la conductance de cette solution donne 𝐺1 = 8,6. 10−5 𝑆.
- La mesure de la conductance dans les mêmes conditions d’une solution d’acide
chlorhydrique (𝐻3 𝑂+ + 𝐶𝑙 − ) de même concentration donne la valeur
𝐺2 = 4,3. 10−4 𝑆.
1-1- l'équation de la réaction d’acide benzoïque avec l'eau.
𝐶6 𝐻5 𝐶𝑂𝑂𝐻(𝑎𝑞) + 𝐻2 𝑂(𝑙) ⇌ 𝐶5 𝐻6 𝐶𝑂𝑂− (𝑎𝑞) + 𝐻3 𝑂+ (𝑎𝑞)
1-2- la conductance 𝐺1 de la solution 𝑆1
𝐺1 = 𝑘. [𝐻3 𝑂+ ](𝜆1 + 𝜆2 )
1-3- le taux d’avancement final de la réaction d’acide benzoïque avec l'eau
𝑥 [𝐻3 𝑂 + ] 𝐺 𝐺1
On a : 𝜏 = 𝑥 𝑓 = = 𝑘.𝐶.(𝜆 1+𝜆 D’où : 𝜏 =
𝑚 𝐶 1 2) 𝑘.𝐶.(𝜆1 +𝜆2 )
1-4- la constante d’équilibre associée la réaction d’acide benzoïque avec
l'eau
Chakir abdeljalil chakir203@gmail.com www.rihabpc.com Page8
[𝐻3 𝑂 + ]2é𝑞 [𝐻3 𝑂 + ]2é𝑞 𝐶 2 .𝜏2 𝐶.𝜏2 𝐶.𝜏2
on a : 𝐾 = [𝐶 = 𝐶−[𝐻 +]
= 𝐶(1−𝜏) = D’où : 𝐾 =
6 𝐻5 𝐶𝑂𝑂𝐻]é𝑞 3𝑂 é𝑞 1−𝜏 1−𝜏
1-5- le taux d’avancement final la réaction d’acide benzoïque avec l'eau
*- pour 𝐻𝐶𝑙 l’équation de la réaction avec l’eau est :
𝐻𝐶𝑙(𝑎𝑞) + 𝐻2 𝑂(𝑙) → 𝐶𝑙 − (𝑎𝑞) + 𝐻3 𝑂+ (𝑎𝑞)
′
Puisque la réaction est totale on a : 𝜏 ′ = 1 et 𝐺2 = 𝑘. [𝐻3 𝑂+ ] . (𝜆1 + 𝜆3 )
[𝐻3 𝑂 + ]′
𝜏′ = 1 = ⇒ [𝐻3 𝑂+ ]′ = 𝐶 d’où 𝐺2 = 𝑘. 𝐶. (𝜆1 + 𝜆3 ) (1)
𝐶
*- pour 𝐶6 𝐻5 𝐶𝑂𝑂𝐻
on a :𝐺1 = 𝑘. [𝐻3 𝑂+ ](𝜆1 + 𝜆2 ) avec [𝐻3 𝑂+ ] = 𝐶. 𝜏
D’où 𝐺1 = 𝑘. 𝐶. 𝜏. (𝜆1 + 𝜆2 ) (2)
(2) 𝐺1 𝜏.(𝜆1 +𝜆2 ) 𝐺1 .(𝜆1 +𝜆3 )
Donc : donne : = (𝜆1 +𝜆3 )
D’où 𝜏=
(1) 𝐺2 𝐺2 .(𝜆1 +𝜆2 )
𝐺1 .(𝜆1 +𝜆3 ) 8,6×10−5 .(35+7,63)
AN : 𝜏 = = = 0,22 D’où : 𝜏 = 0,22 = 22%
𝐺2 .(𝜆1 +𝜆2 ) 4,3×10−4 .(35+3,2)
1-6- calcul de la concentration 𝐶 et déduire la valeur de 𝑝𝐻 de la solution
d’acide benzoïque
𝐶.𝜏2 𝐾.(1−𝜏) 6,28×10−5 .(1−0,22)
on a : 𝐾 = ⇒ 𝐶= AN : 𝐶 = = 1 × 10−3
1−𝜏 𝜏2 0,222
D’ou : 𝐶 = 1 × 10−3 𝑚𝑜𝑙. 𝐿−1
On a : 𝑝𝐻 = −𝐿𝑜𝑔[𝐻3 𝑂+ ] = −𝐿𝑜𝑔(𝐶. 𝜏)
AN: 𝑝𝐻 = −𝐿𝑜𝑔(𝐶. 𝜏) = −𝐿𝑜𝑔(1 × 10−3 × 0,22) = 3,66
D’ou : 𝑝𝐻 = 3,66
2- solution diluée
𝐶 1×10−3
2-1- la concentration : 𝐶1 = 20 = = 5 × 10−5
20
D’ou: 𝐶1 = 5 × 10−5 𝑚𝑜𝑙. 𝐿−1
2-2- le taux d’avancement final 𝜏1
𝐶1 .𝜏1 2
on a la constante d’équilibre : 𝐾 = ⇒ 𝐶1 . 𝜏12 + 𝐾. 𝜏1 − 𝐾 = 0
1−𝜏1
on obtient une équation de second degré:
1 × 10−3 . 𝜏12 + 6,28 × 10−5 . 𝜏1 − 6,28 × 10−5 = 0
Après la solution de l’équation on trouve : 𝜏1 = 0,28 = 28%
2-3- la valeur de 𝑝𝐻 :
On a : 𝑝𝐻1 = −𝐿𝑜𝑔[𝐻3 𝑂 + ] = −𝐿𝑜𝑔(𝐶1 . 𝜏1 )
AN: 𝑝𝐻1 = −𝐿𝑜𝑔(5 × 10−5 . 0,28) = 4,9 D’où : 𝑝𝐻1 = 4,9
2-4- d’aprés les calculs
la dilution de la solution produit l’augmentation de la valeur de 𝑝𝐻 et 𝜏
Partie 2 : Réaction entre l’acide méthanoïque 𝐻𝐶𝑂𝑂𝐻 et l’ion éthanoate 𝐶𝐻3𝐶𝑂𝑂−
Données : les conductivités molaires ioniques en (𝑚𝑆. 𝑚2 . 𝑚𝑜𝑙 −1 ) :
𝜆1 = 𝜆𝑁𝑎+ = 5,01 , 𝜆2 = 𝜆𝐶𝐻3 𝐶𝑂𝑂− = 4,1 , 𝜆3 = 𝜆𝐻𝐶𝑂𝑂− = 5,46
On prépare un volume 𝑉 = 50𝑚𝐿 d’une solution aqueuse en mélangeant une quantité de
matière 𝑛1 = 2,5𝑚𝑚𝑜𝑙 d’acide méthanoïque 𝐻𝐶𝑂𝑂𝐻 avec 𝑛2 = 5𝑚𝑚𝑜𝑙 d’éthanoate de
sodium (𝑁𝑎+ + 𝐶𝐻3 𝐶𝑂𝑂− ) .La conductivité de ce mélange est 𝜎 = 0,973 𝑆. 𝑚−1 .
Chakir abdeljalil chakir203@gmail.com www.rihabpc.com Page9
1- l’équation de la réaction entre l’acide méthanoïque et l’ion éthanoate. et le tableau
d’avancement
Equation 𝐻𝐶𝑂𝑂𝐻 + 𝐶𝐻3 𝐶𝑂𝑂− ⇌ 𝐻𝐶𝑂𝑂− + 𝐶𝐻3 𝐶𝑂𝑂𝐻
Etat initial 𝑛1 𝑛2 0 0
Etat intermédiaire 𝑛1 − 𝑥 𝑛2 − 𝑥 𝑥 𝑥
Etat final 𝑛1 − 𝑥𝑓 𝑛2 − 𝑥𝑓 𝑥𝑓 𝑥𝑓
2- la concentration des différentes espèces chimiques présentes en solution
𝑛1 −𝑥 𝑛 𝑥 𝑛
*- [𝐻𝐶𝑂𝑂𝐻]𝑓 = 𝑉 𝑓 = 𝑉1 − 𝑉𝑓 = 𝑉1 − [𝐻𝐶𝑂𝑂− ]𝑓
𝑛2 −𝑥𝑓 𝑛2 𝑥𝑓 𝑛2
*- [𝐶𝐻3 𝐶𝑂𝑂− ]𝑓 = = − = − [𝐻𝐶𝑂𝑂− ]𝑓
𝑉 𝑉 𝑉 𝑉
*- [𝐶𝐻3 𝐶𝑂𝑂𝐻]𝑓 = [𝐻𝐶𝑂𝑂− ]𝑓
L’expression de la conductivité 𝜎
𝜎 = [𝑁𝑎 + ]𝑓 × 𝜆1 + [𝐶𝐻3 𝐶𝑂𝑂− ]𝑓 × 𝜆2 + [𝐻𝐶𝑂𝑂− ]𝑓 × 𝜆3
𝑛2 𝑛
𝜎= × 𝜆1 + ( 𝑉2 − [𝐻𝐶𝑂𝑂− ]𝑓 ) × 𝜆2 + [𝐻𝐶𝑂𝑂− ]𝑓 × 𝜆3
𝑉
𝑛2 𝑛2
𝜎= × 𝜆1 + × 𝜆2 − [𝐻𝐶𝑂𝑂− ]𝑓 × 𝜆2 + [𝐻𝐶𝑂𝑂− ]𝑓 × 𝜆3
𝑉 𝑉
𝑛2
𝜎= × (𝜆1 + 𝜆2 ) + (𝜆3 − 𝜆2 ) × [𝐻𝐶𝑂𝑂− ]𝑓
𝑛
𝑉
𝜎− 2 ×(𝜆1 +𝜆2 )
D’où : [𝐻𝐶𝑂𝑂− ]𝑓 = 𝑉
(𝜆3 −𝜆2 )
5×10−3
0,973 − ×(5,01+4,1)×10−3
AN : [𝐻𝐶𝑂𝑂− ] 𝑓 = 50×10−6
(5,46−4,1)×10−3
= 45,588𝑚𝑜𝑙. 𝑚−3 = 0,0456𝑚𝑜𝑙. 𝐿−1
D’où : [𝐻𝐶𝑂𝑂− ]𝑓 = 45,588𝑚𝑜𝑙. 𝑚−3 = 0,0456𝑚𝑜𝑙. 𝐿−1
3- Calcul de 𝜏 le taux d’avancement de la réaction
𝑥 [𝐻𝐶𝑂𝑂 − ]𝑓 ×𝑉 0,0456×50×10−3
𝜏 = 𝑥𝑓 = = = 0,91 = 91% D’où : 𝜏 = 0,91 = 91%
𝑚 𝑛1 2,5×10−3
4- Expression de 𝐾 la constante d’équilibre de la réaction
D’après l’équation de la réaction on a :
[𝐶𝐻3 𝐶𝑂𝑂𝐻]𝑓 ×[𝐻𝐶𝑂𝑂− ]𝑓 𝑥𝑓 2
𝐾 = [𝐻𝐶𝑂𝑂𝐻] −] = (𝑛 avec : 𝑥𝑓 = 𝜏 × 𝑛1 𝑒𝑡 𝑛2 = 2𝑛1
𝑓 ×[𝐶𝐻3 𝐶𝑂𝑂 𝑓 1 −𝑥𝑓 )×(𝑛2 −𝑥𝑓 )
(𝜏×𝑛1 )2 τ2 τ2
Donc : 𝐾 = (𝑛 = (1−τ)(2−τ) D’où 𝐾 = (1−τ)(2−τ)
1 −𝜏×𝑛1 )×(2𝑛1 −𝜏×𝑛1 )
0,912
sa valeur 𝐾 = (1−0,91)(2−0,91) = 8,44 D’où : 𝐾 = 8,44
Chakir abdeljalil chakir203@gmail.com www.rihabpc.com Page10
Vous aimerez peut-être aussi
- Lycee Qualiant Tha Housseine Devoir 2 2Pcf 2022/2023Document2 pagesLycee Qualiant Tha Housseine Devoir 2 2Pcf 2022/2023yassine wxahdiPas encore d'évaluation
- Devoir 2 Modele 1 Physique Chimie 2 Bac SPC Semestre 1 1Document3 pagesDevoir 2 Modele 1 Physique Chimie 2 Bac SPC Semestre 1 1Marouane AkkaPas encore d'évaluation
- Controle 2 - 2 S1 2bac FRDocument3 pagesControle 2 - 2 S1 2bac FRsmail hallaouiPas encore d'évaluation
- Gsa 2bac 1819 S1 C2 PCF PCDocument3 pagesGsa 2bac 1819 S1 C2 PCF PCAmine AlaoUii AlaouiPas encore d'évaluation
- Série NucDocument3 pagesSérie NucMëđï Bëñmãššøůđ BnmssdPas encore d'évaluation
- R2009SMDocument8 pagesR2009SMmjidooooPas encore d'évaluation
- DS 2 S1 M2 MouslimDocument2 pagesDS 2 S1 M2 MouslimMr. magnetoPas encore d'évaluation
- État Final D'un SystèmeDocument3 pagesÉtat Final D'un SystèmeAdrien BerryPas encore d'évaluation
- Bac Blanc 2 SM (21-22)Document9 pagesBac Blanc 2 SM (21-22)Salma Bendaoud100% (1)
- Devoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1Document3 pagesDevoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1AYMAN FFPas encore d'évaluation
- CC Exos - 2009 2010 PDFDocument8 pagesCC Exos - 2009 2010 PDFSimplice AssemienPas encore d'évaluation
- Fiche 2Document3 pagesFiche 2Wadih MansourPas encore d'évaluation
- Decroissance Radioactive Exercices Non Corriges 6Document6 pagesDecroissance Radioactive Exercices Non Corriges 6Karroum MohamedPas encore d'évaluation
- Normal 2018 PDFDocument10 pagesNormal 2018 PDFMohamed El OuahdaniPas encore d'évaluation
- Devoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Ridha Ben Yahmed PDFDocument4 pagesDevoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2013-2014) MR Ridha Ben Yahmed PDFMajed GharibPas encore d'évaluation
- Devoir Survéillé #2 2eme Bac PC3 2022 - 2023 Prof - Kharacha (WWW - Pc1.ma) - 7Document3 pagesDevoir Survéillé #2 2eme Bac PC3 2022 - 2023 Prof - Kharacha (WWW - Pc1.ma) - 7medPas encore d'évaluation
- PC Tle S TD 11Document2 pagesPC Tle S TD 11Dossou Salome Le VétérinairePas encore d'évaluation
- Examens Maroc 2008 2017Document161 pagesExamens Maroc 2008 2017Rayen MlaouhiaPas encore d'évaluation
- TS - BAC Blanc N°1 - ObligatoireDocument9 pagesTS - BAC Blanc N°1 - ObligatoirephytanjaPas encore d'évaluation
- Corrigé Série 2 - Chimie Inorganique 1Document5 pagesCorrigé Série 2 - Chimie Inorganique 1kiritosunny30Pas encore d'évaluation
- الامتحان الوطني في مادة الفيزياء والكيمياء 2015 علوم فيزيائية ترجمة فرنسية الدورة العاديةDocument7 pagesالامتحان الوطني في مادة الفيزياء والكيمياء 2015 علوم فيزيائية ترجمة فرنسية الدورة العاديةjouaitiPas encore d'évaluation
- Examen National Physique Chimie Sciences Maths 2012 Rattrapage SujetDocument8 pagesExamen National Physique Chimie Sciences Maths 2012 Rattrapage SujetYoussef LaaoujePas encore d'évaluation
- 31RS11 PDFDocument8 pages31RS11 PDFMoufida ZouaghiPas encore d'évaluation
- Serie Les Piles PCDocument7 pagesSerie Les Piles PCalaeddinePas encore d'évaluation
- 2-Examens BAC Nucleaire PC FRDocument4 pages2-Examens BAC Nucleaire PC FRMouad Driouch SMIA-TD4100% (1)
- Devoir 2Document2 pagesDevoir 2mehdi benmassoudPas encore d'évaluation
- Exams Nationaux Adaptés PC-BIOF2024Document208 pagesExams Nationaux Adaptés PC-BIOF2024othmane.zaariPas encore d'évaluation
- Examen Blanc SM Inter2222 PDFDocument8 pagesExamen Blanc SM Inter2222 PDFMouad Chaker100% (1)
- Devoir 2 PC BiofDocument2 pagesDevoir 2 PC BiofElkadiri IlyesPas encore d'évaluation
- (WWW - Al7ibre - Com) Examen National Physique-Chimie SPC Normale 2023Document6 pages(WWW - Al7ibre - Com) Examen National Physique-Chimie SPC Normale 2023malokaPas encore d'évaluation
- Devoir 2, Modèle 2Document1 pageDevoir 2, Modèle 2Abd Razak Ëł KhaïriPas encore d'évaluation
- DS2 S2 SexpDocument2 pagesDS2 S2 SexpIMAD EL BYDARYPas encore d'évaluation
- Controle 2 S1Document2 pagesControle 2 S1doaa essabikPas encore d'évaluation
- TD de Thermo L3 (20-21)Document2 pagesTD de Thermo L3 (20-21)Harvey Specter100% (2)
- Chimie Des Solutions Aqueuses TD 5Document6 pagesChimie Des Solutions Aqueuses TD 5WIJDANEPas encore d'évaluation
- Série 1 (2020-2021)Document5 pagesSérie 1 (2020-2021)SBA Nabil ZakariaPas encore d'évaluation
- Les Exams Nationaux PC 2008-2019Document164 pagesLes Exams Nationaux PC 2008-2019바드 에딘Pas encore d'évaluation
- Serie1 Nuclaire Converted BestcoursDocument2 pagesSerie1 Nuclaire Converted BestcourstaziadambkPas encore d'évaluation
- SERIE 4 Atome D'hydrogène 2021Document2 pagesSERIE 4 Atome D'hydrogène 2021rayanezianimalakPas encore d'évaluation
- الامتحان الوطني في مادة الفيزياء والكيمياء 2011 علوم رياضية ترجمة فرنسية الدورة الاستدراكيةDocument16 pagesالامتحان الوطني في مادة الفيزياء والكيمياء 2011 علوم رياضية ترجمة فرنسية الدورة الاستدراكيةFahmiPas encore d'évaluation
- Transformation Nucléaire: ExercicesDocument7 pagesTransformation Nucléaire: ExercicesHamid Ez-zahirPas encore d'évaluation
- TD1 2023-2024Document2 pagesTD1 2023-2024justinredmi802Pas encore d'évaluation
- D'une: Cu SODocument2 pagesD'une: Cu SOThe KuuPas encore d'évaluation
- TP CinétiqueDocument3 pagesTP Cinétiquevalessa.barbierPas encore d'évaluation
- Examen National Physique Chimie SPC 2013 Rattrapage SujetDocument6 pagesExamen National Physique Chimie SPC 2013 Rattrapage Sujetothmane GbPas encore d'évaluation
- Fiche Pour Travaux Dirigés #3 de Physique-Chimie-TechnologieDocument4 pagesFiche Pour Travaux Dirigés #3 de Physique-Chimie-TechnologieIbrahim NchouapinePas encore d'évaluation
- Concours 2012 (+sol.) Proposition EPST23Document19 pagesConcours 2012 (+sol.) Proposition EPST23Nidal BestPas encore d'évaluation
- الامتحان التجريبي مسلك علوم فيزيائية خيار فرنسيةDocument8 pagesالامتحان التجريبي مسلك علوم فيزيائية خيار فرنسيةHAMADA1972100% (1)
- Examen National Physique Chimie SPC 2015 Normale SujetDocument7 pagesExamen National Physique Chimie SPC 2015 Normale SujetYassin DaoudiPas encore d'évaluation
- Noyaux, Masse Et Énergie FDocument4 pagesNoyaux, Masse Et Énergie Fsihammouatassim3Pas encore d'évaluation
- Devoir 1Document1 pageDevoir 1SAID yousfiPas encore d'évaluation
- En PC Biof 2010 SNDocument6 pagesEn PC Biof 2010 SNEL MEHDI EL HAMDOUCHIPas encore d'évaluation
- Examens Nationaux SMF + Correction - de 2008 À 2022 ELHAFYANI - CopieDocument504 pagesExamens Nationaux SMF + Correction - de 2008 À 2022 ELHAFYANI - CopieMG 11Pas encore d'évaluation
- Série D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument7 pagesSérie D'exercices 4, Décroissance Radioactive, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDRima El100% (2)
- R 2015 SM (F)Document8 pagesR 2015 SM (F)سكو زاPas encore d'évaluation
- Série N°3Document2 pagesSérie N°3kim namjoon100% (1)
- Tous Les Bac Biof Option SM SABOURDocument176 pagesTous Les Bac Biof Option SM SABOURdawd.bouzaherPas encore d'évaluation
- Devoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2013-2014)Document5 pagesDevoir de Synthèse N°3 - Sciences Physiques - Bac Sciences Exp (2013-2014)AliMchirguiPas encore d'évaluation
- Travaux Dirigés de Chimie N° 6: Exercice 1: Équations de Réaction Et Constantes D'équilibreDocument4 pagesTravaux Dirigés de Chimie N° 6: Exercice 1: Équations de Réaction Et Constantes D'équilibreAbderrahman IGHNIHPas encore d'évaluation
- 4 - Propriétés Physiques Du Sol2Document15 pages4 - Propriétés Physiques Du Sol2isaouahPas encore d'évaluation
- Aquap SNCTDocument22 pagesAquap SNCTRobertBostanPas encore d'évaluation
- Cours 17-ProteinesEnzymes Etudiants2Document10 pagesCours 17-ProteinesEnzymes Etudiants2Cita CitaPas encore d'évaluation
- HUG - Tableau Médicaments Qui Peuvent Être Coupés Et/ou Écrasés HUGDocument45 pagesHUG - Tableau Médicaments Qui Peuvent Être Coupés Et/ou Écrasés HUGAurum100% (1)
- FT Mopur3 FRDocument9 pagesFT Mopur3 FRMiangaly ChriiPas encore d'évaluation
- Sika Carbodur SDocument5 pagesSika Carbodur SFokou Nimpa Martial RaoulPas encore d'évaluation
- TP Chimie S1Document58 pagesTP Chimie S1François Adolphe50% (2)
- Chromatographie Et Spectroscopie de MasseDocument18 pagesChromatographie Et Spectroscopie de MasseWalid AbouloifaPas encore d'évaluation
- 6 Chapitre 5Document25 pages6 Chapitre 5Mohamed LeoPas encore d'évaluation
- Directives Environnementales, Sanitaires Et Sécuritaires Pour L'exploitation Du Pétrole Et Du Gaz en Mer (Offshore)Document30 pagesDirectives Environnementales, Sanitaires Et Sécuritaires Pour L'exploitation Du Pétrole Et Du Gaz en Mer (Offshore)julienfolquetPas encore d'évaluation
- Cour ÉconomieDocument16 pagesCour Économieyoung Osi237Pas encore d'évaluation
- Sables de Moulage - TsaucrayDocument4 pagesSables de Moulage - TsaucrayTriki BilelPas encore d'évaluation
- Exo 54 - Dosage Acide Benzoique EDocument2 pagesExo 54 - Dosage Acide Benzoique EislameilhamiPas encore d'évaluation
- Compax EquipementDocument3 pagesCompax EquipementSteve Alain Onana DangPas encore d'évaluation
- Chihab+belkacem TP RABEHIDocument7 pagesChihab+belkacem TP RABEHIbouhebl chihabPas encore d'évaluation
- Carburants Document de LectureDocument56 pagesCarburants Document de LecturebeyPas encore d'évaluation
- Evaluation Du Premier SemestreDocument4 pagesEvaluation Du Premier SemestrekathyPas encore d'évaluation
- AmidonDocument9 pagesAmidonchristophePas encore d'évaluation
- Cours 4 - Le NoyauDocument9 pagesCours 4 - Le Noyaumanuelakouadio405Pas encore d'évaluation
- Piles Electrochimiques PDFDocument12 pagesPiles Electrochimiques PDFAzizElheni100% (1)
- 01 - Les Cinq Synthese de DMCDocument227 pages01 - Les Cinq Synthese de DMCChërchěf DjămiīlåPas encore d'évaluation
- THESE Nouh AARABDocument183 pagesTHESE Nouh AARABaissa ambarkiPas encore d'évaluation
- Chapitre III Champ CristallinDocument9 pagesChapitre III Champ Cristallinعبد الصمد بوالعيشPas encore d'évaluation
- Rapport D'exposé La Gestion Des Déchets Liquides.: Réalisé ParDocument15 pagesRapport D'exposé La Gestion Des Déchets Liquides.: Réalisé ParAbderrahim AzarkanPas encore d'évaluation