Académique Documents
Professionnel Documents
Culture Documents
Serie Les Piles PC
Transféré par
alaeddineTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Serie Les Piles PC
Transféré par
alaeddineDroits d'auteur :
Formats disponibles
Série d’exercices
Exercice 1
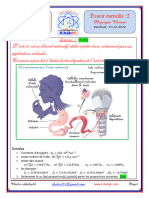
On considère la pile cobalt-argent suivante schématisée ci contre :
❶ Déterminer la polarité de cette pile .
❷ Écrire l’équation de la demi-réaction qui se produit près
de chaque électrode , et déduire l’équation globale qui 𝑰
se produit lors de fonctionnement de cette pile .
❸ Quel est le rôle du pont ionique ?
❹ Sachant que la concentration initiale de deux solutions
électrolytiques est : 𝑪 = 𝟐 × 𝟏𝟎−𝟐 𝒎𝒐𝒍. 𝑳−𝟏 . Calculer la
valeur du quotient de réaction initial associé à cette
réaction .
❺ Comment évolue ce quotient de réaction lors de fonctionnement de cette pile ?
❻ Lors de fonctionnement , la pile débite un courant électrique d’intensité 𝐈 = 𝟒𝟓𝐦𝐀
𝒂 − Dresser le tableau d’avancement associé à la réaction qui se produit lors de
fonctionnement de la pile .
𝒄 −Déterminer la durée de vie ∆𝒕𝒎𝒂𝒙 ( on considère que la quantité de matière dans les
deux plaques est en excès ) . On donne volume de deux la solutions : 𝐕 = 𝟏𝟎𝟎𝐦𝐋
𝒅 − Calculer la capacité de cette pile .
▪ Le volume des deux la solutions : 𝐕 = 𝟏𝟎𝟎𝐦𝐋
Données :
▪ La constante de faraday : 𝑭 = 𝟗, 𝟔𝟓 × 𝟏𝟎𝟒 𝐂. 𝒎𝒐𝒍.−𝟏
Exercice 𝟐
On relie par un pont ionique une demi-pile contenant une plaque de nickel 𝑵𝒊 plongée dans
une solution de sulfate de de nickel (𝑵𝒊𝟐+ 𝟐−
(𝒂𝒒) + 𝑺𝑶𝟒(𝒂𝒒) ) de concentration
𝑪𝟏 = 𝟏 × 𝟏𝟎−𝟐 𝒎𝒐𝒍. 𝑳−𝟏 , à une autre demi-pile contenant une plaque d’étain 𝑺𝒏 plongée dans
une solution de sulfate d’étain (𝑺𝒏𝟐+ 𝟐− −𝟏
(𝒂𝒒) + 𝑺𝑶𝟒(𝒂𝒒) ) de concentration 𝑪𝟐 = 𝟏 × 𝟏𝟎 𝒎𝒐𝒍. 𝑳
−𝟏
La constante d’équilibre à 𝟐𝟓℃ associée à la réaction : 𝑵𝒊𝟐+ 𝟐+
(𝒂𝒒) + 𝑺𝒏(𝒔) ⇌ 𝑵𝒊(𝒔) + 𝑺𝒏(𝒂𝒒)
est : 𝑲 = 𝟖, 𝟗 × 𝟏𝟎−𝟒
❶ Prévoir le sens d’évolution du système chimique constituant la pile considérée .
❷ Écrire l’équation de la demi-réaction qui se produit près de chaque électrode .
❸ Faire un dessin de cette pile et y représenter le mouvement des différents porteurs de
charge .
❹ Donner le schéma conventionnelle de cette pile .
❺ Lors de fonctionnement , la pile débite un courant électrique d’intensité 𝐈 = 𝟐𝟎𝐦𝐀 pendant
une ∆𝒕 = 𝟑𝟓𝒎𝒊𝒏 .
𝒂 −Calculer la quantité d’électricité délivrée par la pile pendant cette durée .
𝒃 − Dresser le tableau d’avancement associé à la réaction qui se produit près de la cathode .
𝒄 − Calculer la variation de la masse de la plaque 𝑺𝒏 d’étain au bout de la durée ∆𝒕.
𝒅 − Calculer la concentration des ions d’étain 𝑺𝒏𝟐+ (𝒂𝒒) au bout de la durée ∆𝒕 .
▪ Le volume de deux la solutions : 𝐕 = 𝟏𝟎𝟎𝐦𝐋
Données : ▪ La masse molaire d’étain : 𝐌 𝐒𝐧 = 𝟏𝟏𝟖, 𝟕𝟏𝐠. 𝒎𝒐𝒍.−𝟏
▪ La constante de faraday : 𝑭 = 𝟗, 𝟔𝟓 × 𝟏𝟎𝟒 𝐂. 𝒎𝒐𝒍.−𝟏
2BAC PCF - PHYSIQUE CHIMIE S2 85
Exercice 𝟑
Exercice 𝟒
2BAC PCF - PHYSIQUE CHIMIE S2 86
Exercice 𝟓
Exercice 𝟔
2BAC PCF - PHYSIQUE CHIMIE S2 87
Exercice 𝟕
2BAC PCF - PHYSIQUE CHIMIE S2 88
Exercice 𝟖
Exercice 𝟗
2BAC PCF - PHYSIQUE CHIMIE S2 89
Exercice 𝟏𝟎
2BAC PCF - PHYSIQUE CHIMIE S2 90
Exercice 𝟏𝟏
2BAC PCF - PHYSIQUE CHIMIE S2 91
Vous aimerez peut-être aussi
- Examen Blanc SM Inter2222 PDFDocument8 pagesExamen Blanc SM Inter2222 PDFMouad Chaker100% (1)
- Les RevetementsDocument28 pagesLes RevetementsZoheir GHARBIPas encore d'évaluation
- Bac Blanc 2 SM (21-22)Document9 pagesBac Blanc 2 SM (21-22)Salma Bendaoud100% (1)
- ElectrochimieDocument15 pagesElectrochimieMoustapha SallPas encore d'évaluation
- B Blan 2021 (SP)Document7 pagesB Blan 2021 (SP)HAMADA1972Pas encore d'évaluation
- 628be6e12313b - Sujet - 3 - Physique Melloul Lele5erDocument11 pages628be6e12313b - Sujet - 3 - Physique Melloul Lele5erIlyes Ben Jemaa0% (1)
- Série D'exercice 2 Nucleaire Et Etat Equilibre ModéfierDocument11 pagesSérie D'exercice 2 Nucleaire Et Etat Equilibre Modéfierdouaabouab2021Pas encore d'évaluation
- 648cd3ea422fd - Enoncé Bac 2023 SCDocument13 pages648cd3ea422fd - Enoncé Bac 2023 SChamzaballoumi1Pas encore d'évaluation
- Controle2 2Document2 pagesControle2 2amina oubennaiPas encore d'évaluation
- Activités 1Document4 pagesActivités 1LAILA ASLOUZIPas encore d'évaluation
- TD de Thermo L3 (20-21)Document2 pagesTD de Thermo L3 (20-21)Harvey Specter100% (2)
- Série N°17Document4 pagesSérie N°17Jihad ELPas encore d'évaluation
- Solutions Exemple 9.4Document126 pagesSolutions Exemple 9.4Yosr Ben SaidPas encore d'évaluation
- Devoir 2 1S 2 SM (22-23)Document10 pagesDevoir 2 1S 2 SM (22-23)Anas TalhiPas encore d'évaluation
- Série Complete Nucleaire Prof Elmnaouar (WWW - Pc1.ma)Document9 pagesSérie Complete Nucleaire Prof Elmnaouar (WWW - Pc1.ma)fardadi rachidPas encore d'évaluation
- Cours ChimieDocument6 pagesCours ChimieTarikElHafiPas encore d'évaluation
- Examen National Physique Chimie 2 Bac SVT 2017 Normale CorrigeDocument10 pagesExamen National Physique Chimie 2 Bac SVT 2017 Normale CorrigeMohamed SaidiPas encore d'évaluation
- Correction Examen 2016-2020Document68 pagesCorrection Examen 2016-2020Mohamed SaidiPas encore d'évaluation
- Controle 2 - 2 S1 2bac FRDocument3 pagesControle 2 - 2 S1 2bac FRsmail hallaouiPas encore d'évaluation
- Présentation 3 - Cellule ÉlectrolytiqueDocument44 pagesPrésentation 3 - Cellule ÉlectrolytiqueAbdou Djelama0% (1)
- Sujet BAC 1 BL 1DDocument2 pagesSujet BAC 1 BL 1DTB - Business en lignePas encore d'évaluation
- Serie Pile Electrochimique 4 ST1 2022-2023Document8 pagesSerie Pile Electrochimique 4 ST1 2022-2023bachir LPas encore d'évaluation
- Suivi Temporel Et Vitesse de Reaction Cours Corrige Et CompleteDocument7 pagesSuivi Temporel Et Vitesse de Reaction Cours Corrige Et CompleteYassine RabikPas encore d'évaluation
- Devoir 2-s1 1BAC FR P.khaldoune (WWW - Pc1.ma)Document2 pagesDevoir 2-s1 1BAC FR P.khaldoune (WWW - Pc1.ma)saifeddinebenichou0Pas encore d'évaluation
- Chapitre 4Document21 pagesChapitre 4RAMDEPas encore d'évaluation
- Devoir Maison 1 S2Document4 pagesDevoir Maison 1 S2labiadsihame73Pas encore d'évaluation
- DS 6 SM Aet B 2018Document3 pagesDS 6 SM Aet B 2018Med BriniPas encore d'évaluation
- Devoir de Synthèse N°2 - Sciences Physiques - Bac Math (2013-2014) MR Barhoumi EzzedineDocument5 pagesDevoir de Synthèse N°2 - Sciences Physiques - Bac Math (2013-2014) MR Barhoumi EzzedineWajih M'likiPas encore d'évaluation
- Cours Conversion D'énergie Master 1 Propulsion SpatialeDocument4 pagesCours Conversion D'énergie Master 1 Propulsion SpatialeŒūb Æÿ KęVįnPas encore d'évaluation
- Dev de Synthese N°1 4eme SC Technique 1 FinalDocument5 pagesDev de Synthese N°1 4eme SC Technique 1 FinalMouhamed Ali SahbaniPas encore d'évaluation
- Devoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1Document3 pagesDevoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1AYMAN FFPas encore d'évaluation
- Série 2 SMIA 2020-2021Document3 pagesSérie 2 SMIA 2020-2021fahedPas encore d'évaluation
- TD3 Marrakech PDFDocument3 pagesTD3 Marrakech PDFJenina Manks100% (1)
- Devoir 1 S2 AIT EL MADANEDocument4 pagesDevoir 1 S2 AIT EL MADANEothmane.zaariPas encore d'évaluation
- RlccoursDocument8 pagesRlccoursKamal KamalPas encore d'évaluation
- Chimie 3Document5 pagesChimie 3LAILA ASLOUZIPas encore d'évaluation
- Er Abpsp Bepc 19 PDFDocument4 pagesEr Abpsp Bepc 19 PDFMauhutin Ambroise AMOUSSOUPas encore d'évaluation
- UTC105-Final Juillet 2020 - FRDocument8 pagesUTC105-Final Juillet 2020 - FRJohnny KOZYKOJOKIANPas encore d'évaluation
- SolutionExercices1et2 Serie3 THERMODYNAMIQUEDocument5 pagesSolutionExercices1et2 Serie3 THERMODYNAMIQUEloubnarymPas encore d'évaluation
- Presentation S3Document9 pagesPresentation S3Mohemed DahrPas encore d'évaluation
- Contrôle 15 (PR Hamza Khaldoune)Document2 pagesContrôle 15 (PR Hamza Khaldoune)manounemaryame19Pas encore d'évaluation
- Travaux Dirigés de Chimie N° 6: Exercice 1: Équations de Réaction Et Constantes D'équilibreDocument4 pagesTravaux Dirigés de Chimie N° 6: Exercice 1: Équations de Réaction Et Constantes D'équilibreAbderrahman IGHNIHPas encore d'évaluation
- Noyaux, Masse Et Énergie FDocument4 pagesNoyaux, Masse Et Énergie Fsihammouatassim3Pas encore d'évaluation
- CC Exos - 2009 2010 PDFDocument8 pagesCC Exos - 2009 2010 PDFSimplice AssemienPas encore d'évaluation
- TD ThermodynamiqueDocument5 pagesTD ThermodynamiqueEmmanuel KingPas encore d'évaluation
- Effet de La TemperatureDocument18 pagesEffet de La TemperatureMira MslPas encore d'évaluation
- Chimie Des Solutions Aqueuses TD 5Document6 pagesChimie Des Solutions Aqueuses TD 5WIJDANEPas encore d'évaluation
- S1 DS N°3 2bacDocument2 pagesS1 DS N°3 2bacツheyPas encore d'évaluation
- Série N°3 - CorrigéDocument7 pagesSérie N°3 - CorrigéFatima Zohra El GharbaouiPas encore d'évaluation
- Série Dexercices Sur Lélectrode Normale À HydrogèneDocument4 pagesSérie Dexercices Sur Lélectrode Normale À HydrogènechadaPas encore d'évaluation
- 02-Vitesse SerieDocument5 pages02-Vitesse SerieboustakatbPas encore d'évaluation
- Cours 1 - Suivi Temporel D'une TransformationDocument7 pagesCours 1 - Suivi Temporel D'une TransformationsalhiPas encore d'évaluation
- DS2 S2 SexpDocument2 pagesDS2 S2 SexpIMAD EL BYDARYPas encore d'évaluation
- TD Chap V - Tuyère Simple - Gaz ParfaitDocument5 pagesTD Chap V - Tuyère Simple - Gaz ParfaitMathilde MimiPas encore d'évaluation
- Controle 2 - 9 S1 PC 1bac FRDocument2 pagesControle 2 - 9 S1 PC 1bac FRHamza MouhibPas encore d'évaluation
- Correction Ds1 Bac SC 2018Document3 pagesCorrection Ds1 Bac SC 2018Anis DahnenPas encore d'évaluation
- Résumé. Chap1.Décroissance Radioactive 2022Document2 pagesRésumé. Chap1.Décroissance Radioactive 2022Saad Filali Oujdi50% (2)
- Comportement Global D'un Circuit électrique-cours-FRDocument7 pagesComportement Global D'un Circuit électrique-cours-FRاپن فلسىطين المتمرد شخصىيآ33% (3)
- Decroissance RadioactiveDocument11 pagesDecroissance Radioactivedawd.bouzaherPas encore d'évaluation
- Fiche Pédagogique Champ MagnétiqueDocument2 pagesFiche Pédagogique Champ MagnétiquealaeddinePas encore d'évaluation
- Fiche Pédagogique 3 Les Transformations S'éffectuant Dans Les Deux SensDocument2 pagesFiche Pédagogique 3 Les Transformations S'éffectuant Dans Les Deux SensalaeddinePas encore d'évaluation
- Fiche Pédagogique 9 Transformations Forcées ÉlectrolyseDocument3 pagesFiche Pédagogique 9 Transformations Forcées ÉlectrolysealaeddinePas encore d'évaluation
- Fiche Pédagogique 8 Piles ÉlectrochimiquesDocument2 pagesFiche Pédagogique 8 Piles ÉlectrochimiquesalaeddinePas encore d'évaluation
- Fiche Pédagogique 5 Les Transformations Associées Au Réactions Acido-BasiquesDocument2 pagesFiche Pédagogique 5 Les Transformations Associées Au Réactions Acido-BasiquesalaeddinePas encore d'évaluation
- Fiche Pédagogique 4 État D'équilibreDocument3 pagesFiche Pédagogique 4 État D'équilibrealaeddinePas encore d'évaluation
- DM SM MVT Piste CurviligneDocument2 pagesDM SM MVT Piste CurvilignealaeddinePas encore d'évaluation
- Exercice Projectile Messi by Alaeddine ABIDADocument5 pagesExercice Projectile Messi by Alaeddine ABIDAalaeddinePas encore d'évaluation
- Fiche Pédagogique 7 Transformations SpontanéesDocument2 pagesFiche Pédagogique 7 Transformations SpontanéesalaeddinePas encore d'évaluation
- ChimieDocument1 pageChimiealaeddinePas encore d'évaluation
- Wa0011Document2 pagesWa0011alaeddinePas encore d'évaluation
- DM 13 Newt PCDocument1 pageDM 13 Newt PCalaeddinePas encore d'évaluation
- DM 32 SM ProjectileDocument2 pagesDM 32 SM ProjectilealaeddinePas encore d'évaluation
- DM 9 Newt PCDocument1 pageDM 9 Newt PCalaeddinePas encore d'évaluation
- DM 14 Newt PCDocument2 pagesDM 14 Newt PCalaeddinePas encore d'évaluation
- DM 3 Newt PCDocument2 pagesDM 3 Newt PCalaeddinePas encore d'évaluation
- DM 4 Newt PCDocument1 pageDM 4 Newt PCalaeddinePas encore d'évaluation
- DM 2 Newt SMDocument1 pageDM 2 Newt SMalaeddinePas encore d'évaluation
- DM 4 Newt SMDocument1 pageDM 4 Newt SMalaeddinePas encore d'évaluation
- DM 3 Newt SMDocument1 pageDM 3 Newt SMalaeddinePas encore d'évaluation
- DM 1Document1 pageDM 1alaeddinePas encore d'évaluation
- Exercice 23Document2 pagesExercice 23alaeddinePas encore d'évaluation
- Pile DaniellDocument16 pagesPile DaniellYassir IbralPas encore d'évaluation
- Diagramme E-pHDocument18 pagesDiagramme E-pHCHAIMA DEHBIPas encore d'évaluation
- Chapitre Iv - Reactions Doxydo-ReductionsDocument20 pagesChapitre Iv - Reactions Doxydo-ReductionselkhiatmohammedaminePas encore d'évaluation
- Cours 1 Les Piles Et Récupération D'énergieDocument6 pagesCours 1 Les Piles Et Récupération D'énergieBOURASSPas encore d'évaluation
- Serie 3 PDFDocument13 pagesSerie 3 PDFMoha T OmpPas encore d'évaluation
- PGMW 001 JDocument3 pagesPGMW 001 JAntoine lazarus MaomyPas encore d'évaluation
- Catalogue Marquage MinDocument47 pagesCatalogue Marquage MinKacem Mohamed NaimPas encore d'évaluation
- Cor 900Document6 pagesCor 900salimPas encore d'évaluation
- Chimie Générale5Document50 pagesChimie Générale5Talouth TourePas encore d'évaluation
- ELECTRODE Cu CuSO4Document1 pageELECTRODE Cu CuSO4NEXTWAY TECHNOLOGIEPas encore d'évaluation
- Bibliographie InternetDocument12 pagesBibliographie Internethyd20Pas encore d'évaluation
- Conductivité 2020Document55 pagesConductivité 2020AHMED DERBESSPas encore d'évaluation
- Tableau RedoxDocument11 pagesTableau RedoxTutus RonyPas encore d'évaluation
- RapportDocument7 pagesRapportMed Outaghjijte0% (1)
- Capteurs ÉlectrochimoiquesDocument36 pagesCapteurs ÉlectrochimoiquesJean-Loïc BauchetPas encore d'évaluation
- Atomix Chimie 3eme MathDocument146 pagesAtomix Chimie 3eme MathMohamedBouguechaPas encore d'évaluation
- Correction D'examen Blanc SPC2022 ICHEDocument5 pagesCorrection D'examen Blanc SPC2022 ICHEMoùnïm ELPas encore d'évaluation
- DS 5Document4 pagesDS 5Houssam BenkerroumPas encore d'évaluation
- Thèse: Docteur de L'institut National Polytechnique de ToulouseDocument123 pagesThèse: Docteur de L'institut National Polytechnique de ToulouseMarwan JBPas encore d'évaluation
- S4 Conductance Et Conductivité 1BAC IntDocument5 pagesS4 Conductance Et Conductivité 1BAC Intwassimelagri39Pas encore d'évaluation
- Nombre de TransportDocument15 pagesNombre de TransportČhįfaâ BęnPas encore d'évaluation
- I. Principes de Piles Galvaniques: Demi-PileDocument15 pagesI. Principes de Piles Galvaniques: Demi-PileMOHAMMED ZOUINIPas encore d'évaluation
- TP ElectroDocument10 pagesTP ElectroHaya alameddine100% (1)
- TD Courbes Intensité-Potentiel + Sol Exo 6Document3 pagesTD Courbes Intensité-Potentiel + Sol Exo 6Hamza Kaidi100% (5)
- Cours Potentiel Demi-VagueDocument15 pagesCours Potentiel Demi-VagueLise LangPas encore d'évaluation
- Cours D'electrochimie 1-ConvertiDocument13 pagesCours D'electrochimie 1-ConvertiMarwa HociniPas encore d'évaluation
- C23 - Correction Exercice 9Document1 pageC23 - Correction Exercice 9mohamed abdoulkaderPas encore d'évaluation
- TafelDocument9 pagesTafelJunior CharlesPas encore d'évaluation
- 16 - Determination-Des-Metaux-Lourds-Par-VoieDocument7 pages16 - Determination-Des-Metaux-Lourds-Par-VoieMaria MirceaPas encore d'évaluation