Académique Documents
Professionnel Documents
Culture Documents
Acfrogcxq Oi8edviyud Pmhxi8cizcsfvhgxwie Qlt5oajtfmtfsxkzl3ej2izbde0ffnok8hxdpqtz0og8 Iov6udvjyzntpeu6qhzy8ruuyujdc7vvx6iathpetbhlffvnpl1pouupajjjxe
Transféré par
Paul François NdiayeCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Acfrogcxq Oi8edviyud Pmhxi8cizcsfvhgxwie Qlt5oajtfmtfsxkzl3ej2izbde0ffnok8hxdpqtz0og8 Iov6udvjyzntpeu6qhzy8ruuyujdc7vvx6iathpetbhlffvnpl1pouupajjjxe
Transféré par
Paul François NdiayeDroits d'auteur :
Formats disponibles
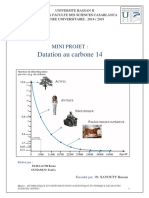
Dans la nature il existe des produits instables dits radioactifs.
En se désintégrant l’élément radioactif
« père =P» se transforme spontanément en un élément « fils=F » stable : Exemple le Rubidium
(87Rb) se transforme en Strontium (87Sr).Quelle que soit la quantité de l’élément « père »il faut
toujours le même temps pour que cette quantité se réduise de moitié par désintégration : Cette
durée caractéristique des éléments radioactifs est appelée période ou demi-vie (T).
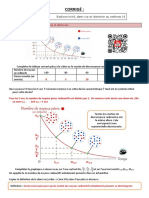
1. Détermine la masse d’éléments père aux temps : 2T, 3T et 4T en te servant du document 4a pour
le Rubidium (On considère pour l’échelle des ordonnées : une graduation équivaut à 1 UA = 1unité
arbitraire)
2. Quel serait l’âge d’une roche contenant du Rubidium dont la masse est 1 UA ?
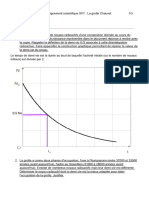
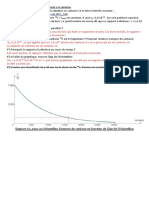
Dans l’organisme vivant la masse de carbone 14 (isotope radio actif du carbone 12) est d’environ
1.10-12 g. Pendant toute la vie de l’organisme le taux est remarquablement constant à cause des
apports alimentaires. A la mort, ce taux de carbone 14 commence à diminuer par une désintégration
radioactive donnant naissance à de l’azote (produit stable).
Sachant que la demi-vie du carbone 14 est de 5730 ans (Tous les 5730 ans la masse de carbone
diminue de moitié)
- Détermine l’âge de la mort de l’organisme dont les os sont restés fossiles dans une couche
sédimentaire contiennent 0, 125.10-12g de carbone 14.
La datation absolue est basée sur la radioactivité de certains éléments chimiques présents à l’état de
trace dans les échantillons de roches. Ces éléments radioactifs se désintègrent en se réduisant de
moitié pendant période T appelée demi-vie. Les deux méthodes de datation ont permis aux
géologues de donner la chronologie des temps géologiques.
Vous aimerez peut-être aussi
- 2006 National Exo1 Sujet Radioactivite 5 5ptsDocument3 pages2006 National Exo1 Sujet Radioactivite 5 5ptsAlexandre PanierPas encore d'évaluation
- Datation Au Carbone 14Document17 pagesDatation Au Carbone 14مشاغب الودادي100% (1)
- Radioactivité Et DatationDocument3 pagesRadioactivité Et Datationykp2tmsndrPas encore d'évaluation
- Exercice Physique C01Document2 pagesExercice Physique C01aloulagairmainePas encore d'évaluation
- CCCC PDFDocument14 pagesCCCC PDFHamza El-ghrirPas encore d'évaluation
- Chapitre 1 Activité 3Document2 pagesChapitre 1 Activité 33fvalimvakaPas encore d'évaluation
- Datation AbsolueDocument12 pagesDatation AbsolueAlexandre RemyPas encore d'évaluation
- Annales Gratuites Bac 2006 Physique - Radioactivité Et ArchéologieDocument7 pagesAnnales Gratuites Bac 2006 Physique - Radioactivité Et ArchéologieSIBAFOPas encore d'évaluation
- Les Méthodes de Datation - L'archéométrieDocument13 pagesLes Méthodes de Datation - L'archéométrieLejaxhe100% (1)
- Exercices 2 Decroissance RadioactiveDocument1 pageExercices 2 Decroissance RadioactiveMery EmPas encore d'évaluation
- Exercices 2 Decroissance RadioactiveDocument1 pageExercices 2 Decroissance RadioactivesmfouazePas encore d'évaluation
- Corrige Radioactivite Demi Vie Et Datation Au Carbone 14Document5 pagesCorrige Radioactivite Demi Vie Et Datation Au Carbone 14Moustapha DiagnePas encore d'évaluation
- Nouha Ramadan Hamou Mouna Exercice D'application 2Document1 pageNouha Ramadan Hamou Mouna Exercice D'application 2rihabPas encore d'évaluation
- La RadiochronologieDocument16 pagesLa RadiochronologieMAX KAYLEPas encore d'évaluation
- EXERCICE (Datation Au Carbone C14)Document7 pagesEXERCICE (Datation Au Carbone C14)Imed Benrhouma100% (2)
- Exercice D'entraînement en Mathématiques: Partie 2Document2 pagesExercice D'entraînement en Mathématiques: Partie 2Dylan LimierPas encore d'évaluation
- Datatemps CoursDocument7 pagesDatatemps CoursYANPas encore d'évaluation
- Exercice D'entraînement en Mathématiques: Partie 2Document2 pagesExercice D'entraînement en Mathématiques: Partie 2Dylan LimierPas encore d'évaluation
- Enseignement Scientifique Physique 3Document3 pagesEnseignement Scientifique Physique 3martin.demolin605Pas encore d'évaluation
- Cours CompletDocument10 pagesCours CompletRahim MoumouniPas encore d'évaluation
- Datation Au Carbone 14 - Bac Blanc Janvier 2003Document6 pagesDatation Au Carbone 14 - Bac Blanc Janvier 2003Anis DahnenPas encore d'évaluation
- RadioactiviteDocument2 pagesRadioactiviteel BOUKARAI RaniaPas encore d'évaluation
- Video DatationDocument33 pagesVideo DatationStephani BouraPas encore d'évaluation
- CS137SANDocument8 pagesCS137SANKnightmare WolfPas encore d'évaluation
- I.1 Un Niveau D'organisationDocument15 pagesI.1 Un Niveau D'organisationSabine BenichouPas encore d'évaluation
- I/ Le Principe de La Datation Absolue Est Basé Sur La Décroissance Radioactive de Certains Éléments ChimiquesDocument8 pagesI/ Le Principe de La Datation Absolue Est Basé Sur La Décroissance Radioactive de Certains Éléments ChimiquesAlpha Softino LAMBALPas encore d'évaluation
- Fiche RadiochronologieDocument3 pagesFiche RadiochronologieAbdou Dodo BohariPas encore d'évaluation
- La GeocronologieDocument12 pagesLa GeocronologieGhada GhadaPas encore d'évaluation
- Elément de GéologieDocument48 pagesElément de GéologieChota ChrifPas encore d'évaluation
- Expose Page de Garde GedeonDocument8 pagesExpose Page de Garde Gedeonadoniastewanou2006Pas encore d'évaluation
- Controle 3 2bac SMDocument2 pagesControle 3 2bac SMnouhayla100% (1)
- Xercices: Décroissance Radioactive: WWW - Pc1.maDocument2 pagesXercices: Décroissance Radioactive: WWW - Pc1.mayasserofficiel2006Pas encore d'évaluation
- TD RadioactiviteDocument1 pageTD RadioactiviteHamza SrhPas encore d'évaluation
- Geo PDFDocument13 pagesGeo PDFAKPas encore d'évaluation
- Datatemps BoDocument3 pagesDatatemps Bokekeleon66Pas encore d'évaluation
- Corrigé Test DiagnostiqueDocument6 pagesCorrigé Test Diagnostiqueismail dialloPas encore d'évaluation
- Radioactivité CoursDocument6 pagesRadioactivité CoursNOUSSAPas encore d'évaluation
- Rps La Datation Au Carbone 14Document5 pagesRps La Datation Au Carbone 14The oCeAnPas encore d'évaluation
- Jires 1ereDocument11 pagesJires 1eredreyerdoc4Pas encore d'évaluation
- Grotte LascauxDocument5 pagesGrotte LascauxThe oCeAnPas encore d'évaluation
- Partie II Séance 3Document15 pagesPartie II Séance 3wafaebelhaibaPas encore d'évaluation
- Comprendre La Datation Au Carbone 14Document12 pagesComprendre La Datation Au Carbone 14Boubekeur HamegPas encore d'évaluation
- Exercices 18 Decroissance RadioactiveDocument1 pageExercices 18 Decroissance Radioactiveyassin2009xxxxPas encore d'évaluation
- 2004 Maroc Sujet DatationDocument2 pages2004 Maroc Sujet Datationanon_441994392Pas encore d'évaluation
- Chapitre 1Document8 pagesChapitre 1fortrieceliaPas encore d'évaluation
- Enonce Datation Au Carbone 14 Et Ossement de Mammouth 1Document1 pageEnonce Datation Au Carbone 14 Et Ossement de Mammouth 1Moustapha Diagne0% (1)
- Enonce Datation Au Carbone 14 Et Ossement de Mammouth 1Document1 pageEnonce Datation Au Carbone 14 Et Ossement de Mammouth 1Yasmine El AlamiPas encore d'évaluation
- Technetium Tc99 v2Document25 pagesTechnetium Tc99 v2Esstst RadiologiePas encore d'évaluation
- Correction Activité Datation Ens Scient 1.1 2022 2023Document1 pageCorrection Activité Datation Ens Scient 1.1 2022 2023Mistake'sPas encore d'évaluation
- Cours Radioactivite 2011-2012Document22 pagesCours Radioactivite 2011-2012triki melekPas encore d'évaluation
- Geochimie IsoDocument10 pagesGeochimie IsoWillPas encore d'évaluation
- Rps La Datation Au Carbone 14Document5 pagesRps La Datation Au Carbone 14Boureima DraboPas encore d'évaluation
- Support de Cours - ChimiostratigraphieDocument11 pagesSupport de Cours - ChimiostratigraphieKhadi JaaPas encore d'évaluation
- Exercices 18 Decroissance RadioactiveDocument1 pageExercices 18 Decroissance RadioactiveAmine AlaoUii AlaouiPas encore d'évaluation
- Tspé Sc18 TD10Document2 pagesTspé Sc18 TD10loliPas encore d'évaluation
- 1.1 Notions de RadioactivitéDocument24 pages1.1 Notions de Radioactivitéabderrahmene achlafPas encore d'évaluation
- Geochimie IsotopiqueDocument25 pagesGeochimie IsotopiqueWillPas encore d'évaluation
- Lanthane et lanthanides: Les Grands Articles d'UniversalisD'EverandLanthane et lanthanides: Les Grands Articles d'UniversalisPas encore d'évaluation