Académique Documents
Professionnel Documents
Culture Documents
Combustion Du Carbone (Réaction Chimique) - Wikipédia
Transféré par
adem bellaaj0 évaluation0% ont trouvé ce document utile (0 vote)
8 vues1 pageTitre original
Combustion Du Carbone (Réaction Chimique) — Wikipédia
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
8 vues1 pageCombustion Du Carbone (Réaction Chimique) - Wikipédia
Transféré par
adem bellaajDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 1
… Rech
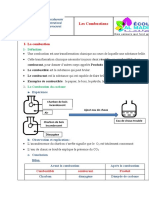
Combustion du carbone
(réaction chimique)
… … …
Pour les articles homonymes, voir Combustion
du carbone.
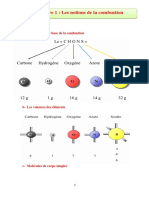
La combustion du carbone est l'oxydation du
carbone C par le dioxygène O2. Deux réactions
sont possibles, selon la disponibilité du
dioxygène :
C + 21 O2 → CO (combustion incomplète) ;
C + O2 → CO2 (combustion complète).
La première réaction se produit quand la
quantité de dioxygène disponible (ou le flux
entrant) est faible, la seconde quand elle est
élevée. Dans des situations intermédiaires les
deux réactions peuvent se produire
concurremment.
Les deux gaz produits sont inodores. Le
dioxyde de carbone CO2 n'est pas toxique,
mais des risques d'asphyxie existent si le
dioxygène se raréfie trop du fait de la
combustion. Le monoxyde de carbone est en
revanche très toxique et conduit à des
accidents graves, voire mortels, quand la
combustion se produit dans des locaux
insuffisamment aérés.
Comme pour presque tous les types de
combustion, celle du carbone requiert, en plus
de la mise en présence d'un combustible et
d'un comburant (ici, le carbone et le
dioxygène), une énergie d'activation, ces trois
ingrédients constituant ce qu'on appelle le
triangle du feu. L'énergie d'activation
nécessaire dépend de l'état de division du
carbone : une étincelle suffit à déclencher un
coup de poussière, une explosion souvent
meurtrière, quand de la poussière de charbon
est dispersée dans l'air ; un échauffement local
est nécessaire à l'embrasement de carbone
moins divisé mais pas trop compact, comme le
petit bois ou un tissu ; une flamme préexistante
est nécessaire pour enflammer un bloc de
carbone ou un bloc de bois.
Combustion des suies
émises par un moteur
Diesel
Références
Articles connexes
Dernière modification il y a 1 an par …
Le contenu est disponible sous licence CC BY-SA
3.0 sauf mention contraire.
Politique de confidentialité •
Conditions d’utilisation •
Désactiver la version mobile
Vous aimerez peut-être aussi
- La CombustionDocument3 pagesLa Combustionelmouden rachidPas encore d'évaluation
- CombustionDocument12 pagesCombustionAbd El Basset BeNmansourPas encore d'évaluation
- ILEPHYSIQUE Chimie 4 Combustions Transformations Chimiques CoursDocument3 pagesILEPHYSIQUE Chimie 4 Combustions Transformations Chimiques CoursMoussa BanaPas encore d'évaluation
- Chapitre 2 - Les Notions de La CombustionDocument6 pagesChapitre 2 - Les Notions de La CombustionTahar YahiaouiPas encore d'évaluation
- Lutte Contre L'incendie Juillet 2013Document30 pagesLutte Contre L'incendie Juillet 2013MohamedAroudam100% (1)
- 4e Chap4Document5 pages4e Chap4zehwa aliPas encore d'évaluation
- Combustion CoursDocument6 pagesCombustion CoursNessrine ZahiPas encore d'évaluation
- Chap 2 La CombustionDocument17 pagesChap 2 La CombustionmilanoaaPas encore d'évaluation
- Les-Combustions 062405Document12 pagesLes-Combustions 062405Abdellah ElmahniPas encore d'évaluation
- PC 5ème - L9 - Combustion Du CarboneDocument6 pagesPC 5ème - L9 - Combustion Du CarbonewonderplancadiPas encore d'évaluation
- Chef D Agres Inc 2 PDFDocument116 pagesChef D Agres Inc 2 PDFMegresAmir100% (2)
- Risque Incend-Expls 2020 Hsst-ConvertiDocument16 pagesRisque Incend-Expls 2020 Hsst-ConvertiImad BelhadiPas encore d'évaluation
- Chimie 6eDocument2 pagesChimie 6eNemir MimirPas encore d'évaluation
- Cours Chapitre-2Document33 pagesCours Chapitre-2amiira bouzouadaPas encore d'évaluation
- Comprehention Systeme FeuDocument34 pagesComprehention Systeme FeuLcs GjnPas encore d'évaluation
- Chap 1 Les CombustionsDocument6 pagesChap 1 Les CombustionsmazhourPas encore d'évaluation
- Les CombustionsDocument12 pagesLes CombustionsDoudou DidouPas encore d'évaluation
- CarboneDocument4 pagesCarboneHELENE MOTTE -CAMPUS-Pas encore d'évaluation
- Le Triangle Du FeuDocument6 pagesLe Triangle Du FeuLarache ThamiPas encore d'évaluation
- Chap8-Oxydation Du Carbone Soufre Du FerDocument5 pagesChap8-Oxydation Du Carbone Soufre Du Ferzerbo rayaisse ousmanePas encore d'évaluation
- La Réaction Chimique - Les Combustions - Prof - TAHIRI (WWW - Pc1.ma)Document4 pagesLa Réaction Chimique - Les Combustions - Prof - TAHIRI (WWW - Pc1.ma)Nassima NassomaPas encore d'évaluation
- Cours PPT 1 - CombustionsDocument13 pagesCours PPT 1 - CombustionsadnanPas encore d'évaluation
- ACTIVITE Risques Lies Aux CombustionsDocument4 pagesACTIVITE Risques Lies Aux Combustionslarbiyassine43Pas encore d'évaluation
- La Combustion ProjetDocument8 pagesLa Combustion ProjetFatma Ezzahra Rziga100% (1)
- LDP Cycle4 Chap08Document4 pagesLDP Cycle4 Chap08TOUFOULATI Mon enfancePas encore d'évaluation
- Les Combustions - Partie 2Document8 pagesLes Combustions - Partie 2Marc EvansPas encore d'évaluation
- SsiapDocument15 pagesSsiapSunday OlujimiPas encore d'évaluation
- LES CombustionDocument4 pagesLES Combustionwalid bakkouriPas encore d'évaluation
- Chapitre 3Document16 pagesChapitre 3Amani Ben OthmenPas encore d'évaluation
- COURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFDocument36 pagesCOURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFKone Ousmane100% (1)
- Prévention D'IncendieDocument75 pagesPrévention D'IncendieYousra SNPas encore d'évaluation
- Energieplus-Lesite - Be-Combustion Et CombustiblesDocument6 pagesEnergieplus-Lesite - Be-Combustion Et CombustiblesDjamila BENYOUCEF100% (1)
- Chapitre 6 - Transformation ChimiqueDocument4 pagesChapitre 6 - Transformation Chimiqueroxane.bouskela1Pas encore d'évaluation
- Les CombustionsDocument5 pagesLes Combustionsjad.bnfdlPas encore d'évaluation
- 19 IncendieDocument9 pages19 Incendiesaidiadamyounes711Pas encore d'évaluation
- CombustionDocument5 pagesCombustionmechanical_engineer76Pas encore d'évaluation
- Combustion Et CombustiblesDocument35 pagesCombustion Et CombustiblesAbo KolouPas encore d'évaluation
- Chap 7 La Combustion Du CarboneDocument10 pagesChap 7 La Combustion Du Carbonechoulio95100Pas encore d'évaluation
- La CombustionDocument2 pagesLa CombustionJuliettePas encore d'évaluation
- CR 4 Les CombustionsDocument22 pagesCR 4 Les Combustionskawtar bourkanPas encore d'évaluation
- 001 Inc - La - CombustionDocument17 pages001 Inc - La - Combustionsergis9servicesPas encore d'évaluation
- Les Combustions Resume de Cours 1Document3 pagesLes Combustions Resume de Cours 1Sa MoPas encore d'évaluation
- F3-Support de Formation Lutte Contre Incendie P MidiDocument56 pagesF3-Support de Formation Lutte Contre Incendie P MidiYahya JamaleddinePas encore d'évaluation
- Chapitre 5combustion Livret DocxDocument6 pagesChapitre 5combustion Livret Docxalseiny923Pas encore d'évaluation
- Yasser HseDocument2 pagesYasser HseyasserPas encore d'évaluation
- Risque Incend-Expls 2020 HSSTDocument16 pagesRisque Incend-Expls 2020 HSSTRøü DāîNä100% (1)
- HCGJBCHDocument10 pagesHCGJBCHAmira MiraPas encore d'évaluation
- 4 1 Chapitre - 4 2Document5 pages4 1 Chapitre - 4 2Rachid BouhssainPas encore d'évaluation
- Combustion 4emeDocument6 pagesCombustion 4emeAbđė Ěł ŁğđPas encore d'évaluation
- Formation Contre LA COMBUSTION Et L 'EXPLOSIMETRIEDocument56 pagesFormation Contre LA COMBUSTION Et L 'EXPLOSIMETRIEYahya JamaleddinePas encore d'évaluation
- 4SP41TEWB6123C02 CorrigeCoursPhysiqueChimie-U02Document12 pages4SP41TEWB6123C02 CorrigeCoursPhysiqueChimie-U02d.g.zahra17Pas encore d'évaluation
- 9-Les Risques IncendieDocument59 pages9-Les Risques IncendieOuenaPas encore d'évaluation
- Les Combustions - Partie 1Document4 pagesLes Combustions - Partie 1Marc EvansPas encore d'évaluation
- Les Combustions - Partie 1Document4 pagesLes Combustions - Partie 1Marc EvansPas encore d'évaluation
- Cours 14 - Les CombustionsDocument3 pagesCours 14 - Les CombustionsadnanPas encore d'évaluation
- CombustionDocument3 pagesCombustionHamidou ElbihawiPas encore d'évaluation
- Changement Climatique: Deux Théories Expliquant le Réchauffement GlobalD'EverandChangement Climatique: Deux Théories Expliquant le Réchauffement GlobalPas encore d'évaluation