Académique Documents
Professionnel Documents
Culture Documents
Chapitre 6 - Transformation Chimique
Transféré par
roxane.bouskela1Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chapitre 6 - Transformation Chimique
Transféré par
roxane.bouskela1Droits d'auteur :
Formats disponibles
Troisièmes – 2023/2024
CHAPITRE 6 : LA TRANSFORMATION CHIMIQUE
Les combustions sont des transformations chimiques qui surviennent quand trois éléments (combustible,
comburant et source d'énergie) sont présents. Elles présentent de nombreux dangers, qu'il faut savoir éviter.
De même, lors des épisodes pluvieux, l’acidité des eaux de pluie peut provoquer de nombreux dégâts sur les
structures en fer. Il s’agit également d’une transformation chimique. Comment expliquer l’apparition de ces
dégâts ?
I. LES COMBUSTIONS
1. Le triangle de feu
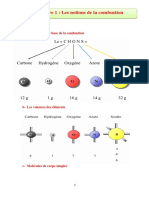
Pour qu'une combustion ait lieu, trois éléments sont nécessaires :
• Un combustible : le réactif susceptible de brûler (carbone, méthane, papier, etc.).
• Un comburant : le réactif entretenant la combustion. Le plus souvent, le dioxygène (présent dans l'air)
est le comburant.
• Une source d'énergie qui enclenche la combustion (la chaleur, une étincelle, etc.).
Ces trois éléments représentent le triangle de feu. Si l'un des trois éléments manque, alors il est impossible de
réaliser une combustion. Le triangle de feu récapitule les trois éléments nécessaires à une combustion :
2. La combustion et la transformation chimique
Définition. La combustion est une transformation chimique libérant de l'énergie, au cours de laquelle un
combustible et un comburant sont consommés et des produits sont formés. On peut alors écrire :
Combustible + Comburants → Produit(s)
a) La combustion du carbone
Au cours de la combustion du carbone (C), du carbone est consommé, c’est le combustible. Du dioxygène
(O2) est consommé, c’est le comburant. Du dioxyde de carbone (CO2) apparaît. L’équation de la
transformation chimique s’écrit alors :
C (s) + O2 (g) → CO2 (g)
b) La combustion du méthane
► Activité #3 : Comment équilibrer une équation chimique ?
Lors de la combustion complète du méthane, le méthane (CH4) et le dioxygène (O2) sont consommés ; il se
forme du dioxyde de carbone (CO2) et de l’eau (H2O). L’équation de la transformation chimique s’écrit alors :
CH4 + 2 O2 → CO2 + 2 H2O
3. Les dangers des combustions
a) La combustion incomplète
Définition. Lorsque, lors d'une combustion, le dioxygène est insuffisant, on obtient une combustion incomplète.
Lors de la combustion incomplète du méthane :
• La flamme devient jaune au lieu d'être bleue.
• De la fumée noire se forme.
• De nouveaux produits se forment : le carbone (composant la fumée noire) et le monoxyde de carbone (gaz
incolore, inodore et très toxique).
Le monoxyde de carbone est dangereux, notamment du fait qu'il soit incolore et inodore, on ne se rend donc
pas compte de sa présence. Pour éviter qu'une combustion soit incomplète, il faut s'assurer que l'espace où
elle a lieu est suffisamment aéré.
b) L'asphyxie
Définition. L'asphyxie correspond au défaut d'oxygénation du sang. Sans action extérieure, l'asphyxie mène
rapidement à l'inconscience puis à la mort. Une asphyxie prolongée peut également entraîner des séquelles au
cerveau.
JM Ringeard
• Une combustion dans un espace confiné peut provoquer une asphyxie, car en consommant le dioxygène,
elle en diminue la quantité disponible.
• Lorsque la combustion est incomplète, le monoxyde de carbone formé se fixe sur les globules rouges à la
place du dioxygène et en prive donc l'organisme.
Pour éviter l'asphyxie, il faut s'éloigner du lieu de la combustion et aussi s'assurer qu'il est suffisamment aéré.
c) La combustion explosive
Définition. Une combustion peut être explosive si le combustible et le dioxygène sont mélangés dans une
certaine proportion.
Pour éviter les risques d'explosion, il faut éloigner les matières inflammables et combustibles du lieu de la
combustion et ne pas tenter de mettre le feu à des objets non prévus pour.
II. ATTAQUE D’UN METAL PAR UN ACIDE
1. Rappels sur le pH
Définition. Le pH permet de reconnaître le caractère acide, neutre ou basique d’une solution. Il se mesure à
l’aide d’un pH-mètre ou de bandes de papier pH. Le pH est également une mesure de la quantité en ions
hydrogènes H+ ou en ions hydroxydes OH– présents dans les solutions aqueuses.
• Si le pH = 7, la solution contient autant d'ions hydrogène que d'ions hydroxyde.
• Si le pH < 7, la solution est acide et concentrée en ions hydrogène H+. Les ions H+ sont majoritaires
et sont responsables de l’acidité.
• Si le pH > 7, la solution est basique et concentrée en ions hydroxyde HO−. Les ions HO- sont
majoritaires et sont responsables de la basicité.
Les produits acides et basiques concentrés sont dangereux car ils provoquent des brûlures graves de la peau
et des yeux. Pour se protéger, il faut porter une blouse, des lunettes de protection et des gants. Pour diminuer
leur dangerosité, il faut les diluer !
Remarque. Lors de la réaction entre un acide et une base, l’ion hydrogène de l’acide réagit avec l’ion hydroxyde
de la base pour former de l’eau. Cette réaction dégage de la chaleur.
H+(acide) + HO–(base) → H2 O
2. Cas pratique : réaction entre l’acide chlorhydrique et le fer
Définition. Lors de la réaction entre un acide et un métal, l’ion hydrogène de l’acide réagit avec le métal pour
former du dihydrogène et un ion métallique.
acide (aq) + métal (s) → dihydrogène (gaz) + ion métallique (aq)
Remarque. L’acide chlorhydrique réagit avec le fer, le zinc et l’aluminium mais pas avec le cuivre, l’argent, l’or
et le platine.
Certaines espèces chimiques sont présentes dans les réactifs et les produits mais n’apparaissent pas dans
l’équation : elles sont dites spectatrices.
III. CE QUE JE DOIS SAVOIR
Connaissances associées
Définir les réactions de combustion.
Connaître et identifier les dangers de la combustion.
Associer le caractère acide ou basique à la présence d’ions H+ et OH−.
Connaitre la réaction entre un acide et une base.
Connaitre la réaction entre un acide et un métal.
FEUILLE D’EXERCICES
Exercices niveau novice
Exercice 1. L’effort ça creuse.
Lors d’une activité physique d’endurance, le corps humain a besoin d’un apport d’énergie. Cette énergie provient
de la transformation chimique des aliments.
Le glucose, présent notamment dans les aliments sucrés, subit une réaction de combustion au niveau des
muscles. En présence de dioxygène, il est consommé. Du dioxyde de carbone et de l’eau font formés.
La combustion du glucose libère de l’énergie. Une partie est utilisée par le muscle pour effectuer une contraction,
l’autre partie est dissipée sous forme de chaleur.
1. Ecrire l’équation bilan de la combustion du glucose.
2. Quelles substances constituent le combustible et le comburant ?
3. Quelle expérience met en évidence le dioxyde de carbone formé lors de la combustion du glucose ?
4. Pourquoi la température du corps humain augmente-t-elle lors d’un effort ?
Exercice 2. Ions et pH
1. Quel est l’ion responsable de l’acidité d’une solution aqueuse ?
1. Quel est l’ion responsable de la basicité d’une solution aqueuse ?
2. Une solution qui contient davantage d’ions H+ que d’ions HO– est-elle acide ou basique ?
3. Une solution qui contient davantage d’ions HO– que d’ions H+ est-elle acide ou basique ?
Exercice 3. Soit la réaction entre le zinc et un acide :
1. Compléter l’équation de réaction.
Equation Zn + 2 …… → Zn2+ + ……
Nombre d’atomes
Nombre de charges
Charge totale
2. Quelles expériences mettent en évidence les produits de cette réaction. Justifier.
3. Certaines maisons ont des gouttières en Zinc. Pourquoi les propriétaires doivent-ils les remplacer
régulièrement ?
Exercices niveau confirmé
Exercice 4. Le parasol chauffant.
Un parasol chauffant fonctionne au gaz propane (C3H8).
1. Ecrire l’équation équilibrée de la transformation chimique.
2. Pourquoi la modélisation représentée ci-dessus est-elle correcte ?
3. Pour dix molécules de propane consommée, combien de molécules de dioxygène réagissent ?
Exercice 5. Une transformation enivrante.
Depuis l’Antiquité, les boissons alcoolisées sont obtenues par fermentation des fruits. On sait aujourd’hui que
la transformation chimique du glucose (C6H12O6) permet d’obtenir l’éthanol (C2H6O) et du dioxyde de carbone
(CO2).
1. Quel est le réactif ?
2. Quels sont les produits ?
3. Ecrire l’équation équilibrée de cette transformation chimique.
Exercice 6. Un système de chauffage.
Un briquet contient du butane liquide surmonté de gaz butane (C4H10) sous pression. En appuyant sur le bouton,
le butane s’échappe. En tournant la molette, une étincelle est créée et le gaz butane peut alors s’enflammer.
Hugues actionne un briquet. Il met sa main à une dizaine de centimètre au-dessus de la flamme.
Il place ensuite un tube à essai sec au-dessus de la flamme. Il verse de l’eau de chaux dans ce tube après avoir
recueilli les produits de la combustion. L’eau de chaux se trouble.
1. Que constate Hugues en plaçant sa main au-dessus de la flamme ?
2. Quel est le produit mis en évidence par le test à l’eau de chaux ?
3. Un second produit obtenu est mis en évidence par le test au sulfate de suivre anhydre. Quel est ce second
produit ?
4. Quelle est l’équation équilibrée de cette combustion ?
Exercice 7. Compléter les équations suivantes.
1. Fe + …… H+ → Fe2+ + H2
2. …… Al + …… H+ → 2 Al3+ + 3 H2
3. Zn + 2 …… → Zn2+ + ……
-
4. Fe3+ + …… HO → Fe(OH)3
Exercices niveau expert
Exercice 8. L’arôme de poire.
Salomé se rend compte qu’elle a oublié de copier la fin de l’équation de la synthèse de l’arôme de poire :
Acide éthanoïque + Hexanol → Arôme de poire + Eau
C2H4O2 + C6H14O → C…H…O… + …`
Quelle est la formule chimique de l’arôme de poire ? Justifier.
Exercice 9. Une fondue.
On veut étudier la combustion de l’éthanol (alcool), un combustible utilisé dans les réchauds à fondue. Un tube
à essais est placé au-dessus de la flamme d’un réchaud, puis on y verse de l’eau de chaux.
Parmi les trois équitations de transformation proposées, laquelle représente la combustion de l’éthanol ?
Justifier.
1. 2 CH4O + 3 O2 → 2 CO2 + 4 H2O
2. C2H6O + 3 O2 → 2 CO2 + 3 H2O
3. C2H6O + O2 → C2H4O2 + H2O
Vous aimerez peut-être aussi
- Devoir - Équilibrage Des Réactions ChimiquesDocument2 pagesDevoir - Équilibrage Des Réactions Chimiquesjasmine rollockPas encore d'évaluation
- Les LoyautésDocument11 pagesLes LoyautésBdu MV0% (1)
- Le Petit Lexique Du VinDocument5 pagesLe Petit Lexique Du VinSalah KmadouPas encore d'évaluation
- COURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFDocument36 pagesCOURS SUR LA COMBUSTION - L2 - 2019 - 2020 - IUAEtudiant PDFKone Ousmane100% (1)
- PC - 2nde - C A - Cours - Complet - Lycee - Numerique - Cote - D IvoireDocument216 pagesPC - 2nde - C A - Cours - Complet - Lycee - Numerique - Cote - D IvoireLAWSON NICOLAS100% (1)
- Controle Qualite de La Matiere - ALILI Zohra - 835 PDFDocument43 pagesControle Qualite de La Matiere - ALILI Zohra - 835 PDFAmirou Baby Mixico100% (1)
- Les Combustions - Partie 2Document8 pagesLes Combustions - Partie 2Marc EvansPas encore d'évaluation
- ExercicesEtDS Etude Quantitative Chimie BEPDocument2 pagesExercicesEtDS Etude Quantitative Chimie BEPMenasria HakimPas encore d'évaluation
- La CombustionDocument3 pagesLa Combustionelmouden rachidPas encore d'évaluation
- FichierDocument3 pagesFichierwalid bakkouriPas encore d'évaluation
- Série 1 - Notion de Réaction ChimiqueDocument2 pagesSérie 1 - Notion de Réaction Chimiquelibrairie najahPas encore d'évaluation
- Série. Les Lois de La Réaction ChimiqueDocument2 pagesSérie. Les Lois de La Réaction ChimiqueAyoub EchahelPas encore d'évaluation
- Série 2 - Les CombustionsDocument2 pagesSérie 2 - Les CombustionsYouSsra A'sPas encore d'évaluation
- Chap 1 Les CombustionsDocument6 pagesChap 1 Les CombustionsmazhourPas encore d'évaluation
- Combustion CoursDocument6 pagesCombustion CoursNessrine ZahiPas encore d'évaluation
- Chimie Minéral Cours PDFDocument67 pagesChimie Minéral Cours PDFMerveille NsumbuPas encore d'évaluation
- 2S Wahab Diop-TD Réaction Chimique 2010Document2 pages2S Wahab Diop-TD Réaction Chimique 2010Fy Ezahana100% (2)
- Correction D ExercicesDocument2 pagesCorrection D Exerciceslesdeux tchatcheusePas encore d'évaluation
- Détermination D'une Formule BruteDocument3 pagesDétermination D'une Formule BruteAhmed Ben RomdhanePas encore d'évaluation
- Exercices Reaction Chimique Bep IndustrielDocument1 pageExercices Reaction Chimique Bep IndustrielhossamkamalPas encore d'évaluation
- Les Rc3a9actions ChimiquesDocument15 pagesLes Rc3a9actions ChimiquesJean SangaréPas encore d'évaluation
- Les Reactions Chimiques Cours 5Document3 pagesLes Reactions Chimiques Cours 5hamza manafPas encore d'évaluation
- 4e Chap4Document5 pages4e Chap4zehwa aliPas encore d'évaluation
- CHP 4 Les CombustionsDocument6 pagesCHP 4 Les Combustionsnaceur rbiiPas encore d'évaluation
- 2024 Exercice Acide + Fer CorrectionDocument2 pages2024 Exercice Acide + Fer Correctionmathou.mvPas encore d'évaluation
- CombustionDocument12 pagesCombustionAbd El Basset BeNmansourPas encore d'évaluation
- 06 Notion de Reaction ChimiqueDocument3 pages06 Notion de Reaction Chimiquemedabdellahisamba34Pas encore d'évaluation
- Réactions Os 2023Document9 pagesRéactions Os 2023paulverbaerePas encore d'évaluation
- 12 ReactionsDocument26 pages12 ReactionsfayePas encore d'évaluation
- Etude Quantitative D'une Réaction Chimique I) Conservation de La MasseDocument2 pagesEtude Quantitative D'une Réaction Chimique I) Conservation de La MasseMouhibi AbdellahPas encore d'évaluation
- PC 5ème - L9 - Combustion Du CarboneDocument6 pagesPC 5ème - L9 - Combustion Du CarbonewonderplancadiPas encore d'évaluation
- 07-Combustion MethanekrjjdjdjfjdhdhdhhdhdhhdjkDocument6 pages07-Combustion MethanekrjjdjdjfjdhdhdhhdhdhhdjkyassinePas encore d'évaluation
- Chimie 3emDocument10 pagesChimie 3emNambinintsoa HeriniainaPas encore d'évaluation
- ILEPHYSIQUE Chimie 4 Combustions Transformations Chimiques CoursDocument3 pagesILEPHYSIQUE Chimie 4 Combustions Transformations Chimiques CoursMoussa BanaPas encore d'évaluation
- Exercices Sur La Reaction Chimique NIIDocument7 pagesExercices Sur La Reaction Chimique NIIPhysique Mehdaoui0% (1)
- 02 Les CombustionsDocument2 pages02 Les CombustionsZAKARIA EL KHABBABIPas encore d'évaluation
- 14 Réactions ChimiqueDocument3 pages14 Réactions ChimiqueThierry DucosPas encore d'évaluation
- Cours Equation Bilan (Mars 2023)Document7 pagesCours Equation Bilan (Mars 2023)riwanlonguetPas encore d'évaluation
- Equilibrage Des Reactions RedoxDocument21 pagesEquilibrage Des Reactions RedoxАли ИбрагимPas encore d'évaluation
- 2éme Partie Bilan Des RéactionsDocument3 pages2éme Partie Bilan Des Réactionskapalab108Pas encore d'évaluation
- Cours Chapitre-2Document33 pagesCours Chapitre-2amiira bouzouadaPas encore d'évaluation
- 2 - HydrogeneDocument13 pages2 - HydrogeneSila PharmPas encore d'évaluation
- Chap 7 La Combustion Du CarboneDocument10 pagesChap 7 La Combustion Du Carbonechoulio95100Pas encore d'évaluation
- Ch6 Habitat Activite Bilan CarboneDocument6 pagesCh6 Habitat Activite Bilan CarboneCamille SiropPas encore d'évaluation
- Exercices Sur Réaction Chimique 3emeDocument1 pageExercices Sur Réaction Chimique 3emeIbrahima Thiaw100% (1)
- CR 4 Les CombustionsDocument22 pagesCR 4 Les Combustionskawtar bourkanPas encore d'évaluation
- LES CombustionDocument4 pagesLES Combustionwalid bakkouriPas encore d'évaluation
- Exercices de Revisions Pour Le 2eme Brevet BlancDocument6 pagesExercices de Revisions Pour Le 2eme Brevet BlancLola TomasPas encore d'évaluation
- Chimie 9éme-1Document29 pagesChimie 9éme-1Hama Coulibaly88% (8)
- 4SP41TEWB6123C02 CorrigeCoursPhysiqueChimie-U02Document12 pages4SP41TEWB6123C02 CorrigeCoursPhysiqueChimie-U02d.g.zahra17Pas encore d'évaluation
- هناDocument6 pagesهناFatiha SaadiaPas encore d'évaluation
- Chap8-Oxydation Du Carbone Soufre Du FerDocument5 pagesChap8-Oxydation Du Carbone Soufre Du Ferzerbo rayaisse ousmanePas encore d'évaluation
- Combustion 4emeDocument6 pagesCombustion 4emeAbđė Ěł ŁğđPas encore d'évaluation
- Les Combustions Exercices Non Corriges 3Document2 pagesLes Combustions Exercices Non Corriges 3Badr LoulantiPas encore d'évaluation
- Serie Reacton Chimique (Ziz'sciences)Document6 pagesSerie Reacton Chimique (Ziz'sciences)TD Maths et Physique Chimie corrigé100% (1)
- Oxydation Et RéductionDocument2 pagesOxydation Et RéductionFélix Kouassi100% (1)
- Chimie 6eDocument2 pagesChimie 6eNemir MimirPas encore d'évaluation
- S6 Chapitre 6 Cinetique Chimique PDFDocument12 pagesS6 Chapitre 6 Cinetique Chimique PDFAzizElheni100% (1)
- 2nd AC - C1 Lélément ChimiqueDocument7 pages2nd AC - C1 Lélément ChimiqueYoman Arthur verdier Assui100% (1)
- Les Combustions - Partie 1Document4 pagesLes Combustions - Partie 1Marc EvansPas encore d'évaluation
- Les Combustions - Partie 1Document4 pagesLes Combustions - Partie 1Marc EvansPas encore d'évaluation
- Sindbad Le Magnifique 2:: Un Livre Interactif de Laurent GARNAULTDocument191 pagesSindbad Le Magnifique 2:: Un Livre Interactif de Laurent GARNAULTdavid DEKNUDTPas encore d'évaluation
- Fiche ChampagneDocument4 pagesFiche ChampagneAline FIGUEIREDOPas encore d'évaluation
- Listes Des Equipements RecusDocument3 pagesListes Des Equipements RecusGedion DouaPas encore d'évaluation
- Tavernier-2022-Ivresse OugaritDocument25 pagesTavernier-2022-Ivresse OugaritTavernierPas encore d'évaluation
- Copie de Sainte ConstanceDocument4 pagesCopie de Sainte Constance9rinaPas encore d'évaluation
- JSVV2019 Mouret 1 PDFDocument5 pagesJSVV2019 Mouret 1 PDFolegPas encore d'évaluation
- Carnet de Chants Pour Le 20Document20 pagesCarnet de Chants Pour Le 20Céline PhilipponPas encore d'évaluation
- HistamineDocument1 pageHistamineMaryse DechozPas encore d'évaluation
- Formule Casse Ventre - KfbioDocument1 pageFormule Casse Ventre - Kfbiorosalinejessy31Pas encore d'évaluation
- 14TPO Le Bioethanol 1Document4 pages14TPO Le Bioethanol 1TshisolaPas encore d'évaluation
- Catalogue PDFDocument28 pagesCatalogue PDFSiheme RAJHIPas encore d'évaluation
- Azote Aminé LibreDocument4 pagesAzote Aminé LibreanwarPas encore d'évaluation
- Les-Climats - Carta de VinhosDocument314 pagesLes-Climats - Carta de VinhosftPas encore d'évaluation
- Heli Eny  - Surtout Pas Lui - 2023 - 1001ebooks - ClubDocument329 pagesHeli Eny  - Surtout Pas Lui - 2023 - 1001ebooks - Clubmelamel60400Pas encore d'évaluation
- Grammaire Progressive Du Français Niveau Intermédiaire 3e Édition 2Document284 pagesGrammaire Progressive Du Français Niveau Intermédiaire 3e Édition 2Phương AnhPas encore d'évaluation
- Le Point 2644 - Reportage en CriméeDocument8 pagesLe Point 2644 - Reportage en CriméeSonya ZuevaPas encore d'évaluation
- Explication Linéaire Du Texte 14odtDocument3 pagesExplication Linéaire Du Texte 14odtel sezPas encore d'évaluation
- Cours-Prospection Et Étude de MarchésDocument26 pagesCours-Prospection Et Étude de MarchésBOUKATTASSA100% (1)
- CombinepdfDocument6 pagesCombinepdfINFINITY & BEYONDPas encore d'évaluation
- Business Plan - Brasserie Artisanale Autre MondeDocument21 pagesBusiness Plan - Brasserie Artisanale Autre MondeVincent ManiezPas encore d'évaluation
- Absinthe Et ArmoiseDocument10 pagesAbsinthe Et ArmoiseDjillali OuhibPas encore d'évaluation
- Analyse Sensorielle (Vin) - Eric VerdierDocument63 pagesAnalyse Sensorielle (Vin) - Eric VerdierREGIS ZILSPas encore d'évaluation
- Shahrazad Restaurant & Lounge À Saint-Gilles - Menu, Avis, Prix Et Réservation TheForkDocument1 pageShahrazad Restaurant & Lounge À Saint-Gilles - Menu, Avis, Prix Et Réservation TheForksanPas encore d'évaluation
- Maitre PuntilaDocument3 pagesMaitre PuntilaLouis PocherPas encore d'évaluation
- White Dwarf - Numéro 458 - Août 2020Document6 pagesWhite Dwarf - Numéro 458 - Août 2020Julien DumortierPas encore d'évaluation
- Design Summerockz Salou 2022Document16 pagesDesign Summerockz Salou 2022Lo AnaPas encore d'évaluation
- Réponse À Un CrétinDocument1 pageRéponse À Un CrétinPhilippe Louis BeauvieuxPas encore d'évaluation