Académique Documents
Professionnel Documents
Culture Documents
TS - DM2 Corrigé - Phys 2-Chim 3
Transféré par
phytanjaCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TS - DM2 Corrigé - Phys 2-Chim 3
Transféré par
phytanjaDroits d'auteur :
Formats disponibles
TS - CORRECTION DM 2
Physique 2 : Les ondes mécaniques progressives périodiques
Chimie 3 : Suivi temporel d’une réaction chimique
LA PHYSIQUE SUR UN PLAN D’EAU
Amérique du nord, juin 2004
Onde à la surface de l’eau
1. La cuve à ondes est utilisée en classe pour l'étude de la propagation des ondes à la surface de l'eau.
2. L'onde générée par le gerris est transversale, en effet la direction de la perturbation est perpendiculaire à la
direction de propagation de l'onde.
3. à l'instant t + t1 : le brin d'herbe descend.
à l'instant t + t1+ t2 : le brin d'herbe remonte.
à l'instant t + t1+ t2 + t3 : le brin d'herbe redescend.
à l'instant t + t1+ t2 + t3 + t4 : le brin d'herbe remonte un peu.
à l'instant t + t1+ t2 + t3 + t4 + t5 : le brin d'herbe retrouve sa position initiale.
Il n'y a pas eu transport de matière, seulement un déplacement temporaire.
4. La distance entre la source vibratoire et la perturbation est :
à la date t1 : d1 = 1,0 cm x 100 = 1,0.102 cm = 1,0 m
à la date t2 : d2 = 2,0 cm x 100 = 2,0.102 cm = 2,0 m.
d2
(on multiplie par 100 pour tenir compte de l'échelle)
d1
Donc l'onde a parcouru la distance d = d2 – d1 = 2,0 – 1,0 = 1,0 m
pendant la durée t = t2 – t1 = 10 s, ce qui donne la célérité de l'onde :
d 1,0 -1 à t1
v= = = 1,0.10 m.s-1 = 10 cm.s-1
∆t 10 à t2 = t1 + 10 s
5,3
5. Sur le schéma on mesure : 3 λ = 5,3 cm soit en réalité 3 λ = = 2,65 cm
2
5,3
donc λ = = 0,88 cm = 8,8.10–3 m
2x3
Il est impératif de mesurer plusieurs longueurs d'onde afin de
3
diminuer l'erreur relative de la mesure.
v
6. On sait que λ = donc v = λ x ν = 0,88 x 5 = 4,4 cm.s–1
ν
7. a. Plus la distance entre les galets est faible face à la longueur d'onde et plus le phénomène de diffraction sera
accentué. La longueur d'onde a pour ordre de grandeur 10 –2 m, l'ouverture doit avoir le même ordre de
grandeur ou un ordre de grandeur plus faible.
b. Il y a diffraction de l'onde par le trou formé entre les galets.
c. La longueur d'onde n'est pas modifiée par la diffraction. L'ouverture se comporte comme une source
vibratoire : les ondes diffractées sont circulaires.
Figure 7
TS Correction du DM 2 - Physique 2 et Chimie 2 Page 1/3
OXYDATION DE L’ACIDE OXALIQUE
A. Préliminaires
1. La demi-équation d’oxydoréduction est :
2 CO2(aq) + 2 H+(aq) + 2 e- = H2C2O4(aq)
2. a. Une solution d’ions permanganate MnO4- est intensément colorée en violet ;
Une solution d’ions manganèse (II) Mn2+ est très faiblement colorée en rose.
b. La demi-équation d’oxydoréduction est :
MnO4-(aq) + 8 H+(aq) + 5 e- = Mn+2(aq) + 4 H2O(l)
3. L’équation de la réaction entre l’ion permanganate MnO4-(aq) et l’acide oxalique H2C2O4(aq) est :
2 MnO4-(aq) + 6 H+(aq) + 5 H2C2O4(aq) = 2 Mn+2(aq) + 8 H2O(l) + 10 CO2(aq)
B. Manipulation
1. Pour obtenir 100 mL de (S1) il faut diluer 10 fois la solution mère de permanganate de potassium à 5,0.10 -2 mol.L-1.
On utilise pour cela, la pipette jaugée de 10 mL et la fiole jaugée de 100 mL.
2. a. La masse d’acide oxalique cristallisé nécessaire est :
m(H2C2O4,2H2O) = n(H2C2O4) x M(H2C2O4,2H2O)
avec n(H2C2O4) = C2 V
et M(H2C2O4,2H2O) = 2x1,0 + 2x12,0 + 4x16,0 + 2x18 = 126,0 g.mol-1
donc m(H2C2O4,2H2O) = C1 V x M(H2C2O4,2H2O) = 50.10-3 x 0,100 x 126,0 = 6,3.10-1 g = 0,63 g
b. Pour obtenir 100 mL de (S2) il faut d’abord peser avec la balance les 0,63 g d’acide oxalique cristallisé puis les
dissoudre dans une fiole jaugée de 100 mL.
C. Étude expérimentale
1. Parmi les réactifs et les produits, la seule espèce colorée est l’ion permanganate MnO4-(aq) ; la mesure de
l’absorbance de la solution permet donc d’accéder à la concentration de cette espèce au cours du temps.
-
n0 (MnO4 ) 0,10
Pour t = 0 s on a n(MnO4-) = C1.V1 = 5,0.10-3 x 20.10-3 = 0,10 mmol donc [MnO4-] = = = 2,0 mmol.L-1.
V -3
50.10
TS Correction du DM 2 - Physique 2 et Chimie 2 Page 2/3
2. Équation chimique 2 MnO4-(aq) + 6 H+(aq) + 5 H2C2O4(aq) = 2 Mn+2(aq) + 8 H2O(l) + 10 CO2(aq)
État du système Avancement Quantités de matière
État initial 0 n0(MnO4-) Excès n0(H2C2O4) 0 Excès 0
État n0(MnO4-) – n0(H2C2O4) –
x(t) Excès 2 x(t) Excès 10 x(t)
intermédiaire 2 x(t) 5 x(t)
Selon le tableau d’avancement on peut écrire que n(MnO4-)(t) = n0(MnO4-) – 2 x(t) donc
- -
nMnO-4 0 - nMnO-4 t - MnO4 0 - MnO4 t .V
x t = or nMnO-4 = MnO4 .V donc x t =
2 2
ce qui donne :
t(s) 0 20 40 60 70 80 90 100 120 180
[MnO4-] (mmol.L ) -1
2,0 1,96 1,92 1,68 1,40 1,00 0,59 0,35 0,15 0,00
x(t) (μmol) 0,0 1,0 2,0 8,0 15 25 35 41 46 50
3. Pour t = 100 s, la composition du système est :
- n(MnO4-) = n0(MnO4-) – 2 x(t) = 100 - 2 x 41,2 = 17,6 μmol
- n(H2C2O4) = n0(H2C2O4) – 5 x(t) = C2 V2 - 5 x(t) = 50 x 30 - 5 x 41,2 = 1 500 – 206 = 1,3 mmol
- n(Mn+2) = 2 x(t) = 2 x 41,2 = 82,4 μmol
- n(CO2) = 10 x(t) = 10 x 41,2 = 412 μmol
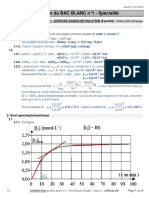
4. La courbe représentant x(t) en fonction du temps est :
60,0
50,0
40,0
x(t) (μmol)
30,0
20,0
10,0
0,0
0 20 40 60 80 100 120 140 160 180 200
t(s)
5. Pout t = 75 s on lit sur la courbe x(t) = 20 μmol, ce qui donne une composition du système de :
- n(MnO4-) = n0(MnO4-) – 2 x(t) = 100 - 2 x 20 = 60 μmol
- n(H2C2O4) = n0(H2C2O4) – 5 x(t) = 1 500 - 5 x 20 = 1,4 mmol
- n(Mn+2) = 2 x(t) = 2 x 20 = 40 μmol
- n(CO2) = 10 x(t) = 10 x 20 = 200 μmol
TS Correction du DM 2 - Physique 2 et Chimie 2 Page 3/3
Vous aimerez peut-être aussi
- DUNOD - Le Cours de Physique de Feynman - Mécanique 1 - R. FeynmanDocument362 pagesDUNOD - Le Cours de Physique de Feynman - Mécanique 1 - R. FeynmanJB_caesar100% (2)
- SP02DV0 Devoirs PDFDocument52 pagesSP02DV0 Devoirs PDFsalambox0% (2)
- Corrige CF 2015-2016 PDFDocument6 pagesCorrige CF 2015-2016 PDFAsmahane FaslaPas encore d'évaluation
- Présentataion+d avancement+de+ma+thèse+à+la+FS+30+01+2008Document23 pagesPrésentataion+d avancement+de+ma+thèse+à+la+FS+30+01+2008Farid Bou75% (4)
- Bichi KhiDocument4 pagesBichi KhiAli AourdouPas encore d'évaluation
- Cours Complet 1ere Chap13Document28 pagesCours Complet 1ere Chap13phytanjaPas encore d'évaluation
- Calcul Des Structures HyperstatiqueDocument234 pagesCalcul Des Structures HyperstatiquePisey100% (3)
- TS - BAC Blanc N°1 Corrigé - ObligatoireDocument4 pagesTS - BAC Blanc N°1 Corrigé - ObligatoirephytanjaPas encore d'évaluation
- Chimie (07 Points) : SujetDocument3 pagesChimie (07 Points) : SujetSarah Sara50% (2)
- Orient DBDocument27 pagesOrient DBKlaus ERBAKPas encore d'évaluation
- Devoir PC 2bac SP International FR s1 4Document2 pagesDevoir PC 2bac SP International FR s1 4Rim KdPas encore d'évaluation
- Devoir 3 Modele 3 Corrige 1Document5 pagesDevoir 3 Modele 3 Corrige 1hessasPas encore d'évaluation
- c1 s1 2BAC Prof - Diam (WWW - Pc1.ma)Document4 pagesc1 s1 2BAC Prof - Diam (WWW - Pc1.ma)ILIASS GERMANYPas encore d'évaluation
- CCcorecDocument5 pagesCCcorecla physique selon le programme FrançaisPas encore d'évaluation
- 3 DST 17 11 - Correctio Eleve PDFDocument5 pages3 DST 17 11 - Correctio Eleve PDFالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- 4 5949436273771940485Document2 pages4 5949436273771940485olivieralexandre954Pas encore d'évaluation
- 2008 Afrique Exo1 Correction Onde Voiture 7ptsDocument4 pages2008 Afrique Exo1 Correction Onde Voiture 7ptsla physique selon le programme FrançaisPas encore d'évaluation
- Sujet de Révision N°03Document7 pagesSujet de Révision N°03BI biPas encore d'évaluation
- 2009 Bac PC Ter s2 CorrigeDocument6 pages2009 Bac PC Ter s2 CorrigeLindoucha DadouchaPas encore d'évaluation
- Chimie (5points)Document7 pagesChimie (5points)melekPas encore d'évaluation
- Chimie (5points)Document7 pagesChimie (5points)khlifisamir19Pas encore d'évaluation
- 2ème SM A&B DS1-S1 2022-2023Document4 pages2ème SM A&B DS1-S1 2022-2023rcafraifra2020Pas encore d'évaluation
- Pages From Fisik Le Complet 3eme Teknik T1-3 (Devoirs Corrections)Document13 pagesPages From Fisik Le Complet 3eme Teknik T1-3 (Devoirs Corrections)Tarek BoualleguePas encore d'évaluation
- Tpxavpendulecorr (Réparé)Document6 pagesTpxavpendulecorr (Réparé)fatimetouPas encore d'évaluation
- Tpxavpendulecorr (Réparé)Document6 pagesTpxavpendulecorr (Réparé)fatimetouPas encore d'évaluation
- Tpxavpendulecorr (Réparé)Document6 pagesTpxavpendulecorr (Réparé)fatimetouPas encore d'évaluation
- Lycée Pilote Sfax DC 3 2012 1Document4 pagesLycée Pilote Sfax DC 3 2012 1Maram BouaskerPas encore d'évaluation
- Chimie Et Spéléologie - CPF0809Document5 pagesChimie Et Spéléologie - CPF0809Phobos ElfaPas encore d'évaluation
- Correction DC1 19 20Document3 pagesCorrection DC1 19 20amir bougachaPas encore d'évaluation
- Corrigé Sujet S2 1er Groupe PC Session Normale 2019 1Document7 pagesCorrigé Sujet S2 1er Groupe PC Session Normale 2019 1Mamadou NdiayePas encore d'évaluation
- Corriges Chimie 05Document3 pagesCorriges Chimie 05Ĥä MžãPas encore d'évaluation
- DsbisDocument8 pagesDsbisChimie FinePas encore d'évaluation
- FsimulationPS JouhariDocument6 pagesFsimulationPS JouhariYoussef ZghariPas encore d'évaluation
- Pentaoxyde DiazoteDocument3 pagesPentaoxyde DiazoteDriss EL Fadil100% (1)
- 0607 C Exo S VitesseDocument3 pages0607 C Exo S VitesseSeverin LouaPas encore d'évaluation
- Correction de La Fiche 1Document5 pagesCorrection de La Fiche 1LARIBIPas encore d'évaluation
- 1-Devoir Libre 2Document4 pages1-Devoir Libre 2mouhcinemoustaine1Pas encore d'évaluation
- Correction Révision OndesDocument4 pagesCorrection Révision OndesI2NI 81Pas encore d'évaluation
- DS2 Correction LMA 09 11 2019 Avancement - OxydoreductionDocument4 pagesDS2 Correction LMA 09 11 2019 Avancement - Oxydoreductiondiomande Aminata Sarah FatimPas encore d'évaluation
- Suivi Temporel D Une Transformation Chimique Vitesse de Reaction Cours 2Document5 pagesSuivi Temporel D Une Transformation Chimique Vitesse de Reaction Cours 2MOSTAFA HABIRKOUPas encore d'évaluation
- Chimie Et SpéléologieDocument5 pagesChimie Et SpéléologieقببقصPas encore d'évaluation
- Serie OndesDocument7 pagesSerie Ondesahpes hidouriPas encore d'évaluation
- Devoir 2Document2 pagesDevoir 2SAID yousfiPas encore d'évaluation
- Lycée Pilote Sfax DC 3 2010 CorrigéDocument3 pagesLycée Pilote Sfax DC 3 2010 CorrigéMaram BouaskerPas encore d'évaluation
- Devoir de Controle N°1Document3 pagesDevoir de Controle N°1kimou246Pas encore d'évaluation
- Devoir Surveillé N°1 Semestre 1 2ème Bac SP Biof Prof JaouadDocument2 pagesDevoir Surveillé N°1 Semestre 1 2ème Bac SP Biof Prof Jaouadnahli aya100% (1)
- 2011 Antilles Exo1 Correction Luminol 6 5pointsDocument3 pages2011 Antilles Exo1 Correction Luminol 6 5pointsmohamedPas encore d'évaluation
- Compte Rendu Du Travaux Pratiques Des Mecanique Solides Finale 1Document6 pagesCompte Rendu Du Travaux Pratiques Des Mecanique Solides Finale 1Fatima DahbiPas encore d'évaluation
- DS 1 S1 - 2SP BiofDocument3 pagesDS 1 S1 - 2SP BiofBa HassanPas encore d'évaluation
- DS 1 S1 - 2SP BIOF Prof - Razkaoui (WWW - Pc1.ma)Document3 pagesDS 1 S1 - 2SP BIOF Prof - Razkaoui (WWW - Pc1.ma)douaarachid2006rajaPas encore d'évaluation
- Série Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFDocument15 pagesSérie Corrigée de Révision - Sciences Physiques Correction de La Série de Révision Bac 2011 - Bac Mathématiques (2010-2011) MR Benaich PDFأبوأحمد الجزيري0% (1)
- Extherm1 20089Document28 pagesExtherm1 20089Driss ZiedPas encore d'évaluation
- 03 Solut JanvierDocument3 pages03 Solut JanvierDaoud El CaidPas encore d'évaluation
- DM5 Methodes de Suivi Cinetique CorrectionDocument4 pagesDM5 Methodes de Suivi Cinetique CorrectionIkram ChamixoPas encore d'évaluation
- Devoir 3 Modele 1 Corrige 1Document4 pagesDevoir 3 Modele 1 Corrige 1hessasPas encore d'évaluation
- Solution Exercices de Suivi Temporeldune Transformation Vitesse DereactionDocument13 pagesSolution Exercices de Suivi Temporeldune Transformation Vitesse DereactionTsu BakiPas encore d'évaluation
- Devoir 1/S1 - Matière: Physique Chimie - Classe: 2 Bac STEDocument3 pagesDevoir 1/S1 - Matière: Physique Chimie - Classe: 2 Bac STEElmessaoudi100% (1)
- Correction Onde SinusoidaleDocument4 pagesCorrection Onde SinusoidaleNiantsa RanPas encore d'évaluation
- Exam Chimie 1Document40 pagesExam Chimie 1Kawther KerroumPas encore d'évaluation
- DS 1 S1 2bac BiofDocument36 pagesDS 1 S1 2bac BiofLaa MeelaPas encore d'évaluation
- Corrige GEIPI Physique-Chimie 2003Document13 pagesCorrige GEIPI Physique-Chimie 2003ogmios_94Pas encore d'évaluation
- Epreuve de Physique Durée 1 Heure: F F V F FDocument8 pagesEpreuve de Physique Durée 1 Heure: F F V F FBadou DiagnePas encore d'évaluation
- Epreuve de Physique Durée 1 Heure: F F V F FDocument9 pagesEpreuve de Physique Durée 1 Heure: F F V F FBadou DiagnePas encore d'évaluation
- Controle À DomicileDocument4 pagesControle À DomicileZineb BicharPas encore d'évaluation
- Sujet Rév N°4Document6 pagesSujet Rév N°4Roua TliliPas encore d'évaluation
- TS - DM1 - Phys 1-Chim 2Document2 pagesTS - DM1 - Phys 1-Chim 2phytanjaPas encore d'évaluation
- 2005 USA Correction Exo2 Ondes 5ptsDocument2 pages2005 USA Correction Exo2 Ondes 5ptsphytanjaPas encore d'évaluation
- devoirsurvTS n1Document5 pagesdevoirsurvTS n1phytanjaPas encore d'évaluation
- DS1 Ondes Chap 1Document2 pagesDS1 Ondes Chap 1phytanja100% (1)
- Sujetchimie Ensa 06Document6 pagesSujetchimie Ensa 06phytanjaPas encore d'évaluation
- EX1C1 L'eau de Javel, Précaution D'emploi, StabilitéDocument1 pageEX1C1 L'eau de Javel, Précaution D'emploi, StabilitéphytanjaPas encore d'évaluation
- Preprint Cinetique ACXIXmeDocument14 pagesPreprint Cinetique ACXIXmephytanjaPas encore d'évaluation
- Suivi TemporelDocument8 pagesSuivi TemporelphytanjaPas encore d'évaluation
- Correc Devoir Ts 1Document4 pagesCorrec Devoir Ts 1phytanjaPas encore d'évaluation
- 2-Activite - Theoreme EcDocument2 pages2-Activite - Theoreme EcphytanjaPas encore d'évaluation
- Devoir Surveillé No 2Document2 pagesDevoir Surveillé No 2phytanjaPas encore d'évaluation
- Rotation D Un Solide Indeformable Autour D Un Axe Fixe CoursDocument10 pagesRotation D Un Solide Indeformable Autour D Un Axe Fixe Coursphytanja100% (1)
- Activités 3 Rotation Dun Solide Indéformable Autour D'un Axe FixeDocument5 pagesActivités 3 Rotation Dun Solide Indéformable Autour D'un Axe FixephytanjaPas encore d'évaluation
- Exercice (Type Bac) Suivi Temporel D - Une Transformation ChimiqueDocument2 pagesExercice (Type Bac) Suivi Temporel D - Une Transformation ChimiquephytanjaPas encore d'évaluation
- Activités 3 Rotation Dun Solide Indéfor...Document5 pagesActivités 3 Rotation Dun Solide Indéfor...phytanjaPas encore d'évaluation
- Cours VitesseDocument4 pagesCours VitessephytanjaPas encore d'évaluation
- Physique Chapitre2 Mouvement SolideDocument5 pagesPhysique Chapitre2 Mouvement SolidephytanjaPas encore d'évaluation
- 7 Cours Du Moment de ForceDocument5 pages7 Cours Du Moment de Forcephytanja100% (1)
- Les Ondes Mécaniques ProgressivesDocument16 pagesLes Ondes Mécaniques ProgressivesphytanjaPas encore d'évaluation
- TS - BAC Blanc N°1 Corrigé - Spécialité PDFDocument4 pagesTS - BAC Blanc N°1 Corrigé - Spécialité PDFphytanjaPas encore d'évaluation
- TS - BAC Blanc N°1 - ObligatoireDocument9 pagesTS - BAC Blanc N°1 - ObligatoirephytanjaPas encore d'évaluation
- TS - Chim 4 - ExosDocument2 pagesTS - Chim 4 - ExosphytanjaPas encore d'évaluation
- CoursExercices 01Document65 pagesCoursExercices 01phytanja100% (4)
- TS - Chim 4 - TP Ch2Document2 pagesTS - Chim 4 - TP Ch2phytanjaPas encore d'évaluation
- TS - DM 2 - Phys 2-Chim 3Document2 pagesTS - DM 2 - Phys 2-Chim 3phytanjaPas encore d'évaluation
- TS - Phys 3 - TP Ph2 DiffractionDocument2 pagesTS - Phys 3 - TP Ph2 DiffractionphytanjaPas encore d'évaluation
- TS - Phys 3 - Fiche Méthode - Figure de DiffractionDocument1 pageTS - Phys 3 - Fiche Méthode - Figure de DiffractionphytanjaPas encore d'évaluation
- Etude Du Concept LimiteDocument19 pagesEtude Du Concept LimitePhonecount PhonecountPas encore d'évaluation
- Atelier Asservissement CubotDocument25 pagesAtelier Asservissement CubotReda XiePas encore d'évaluation
- Compléments AFCDocument12 pagesCompléments AFCMustapha ZianiPas encore d'évaluation
- CoursinfoDocument52 pagesCoursinfontutaPas encore d'évaluation
- Curriculum Vitae PDFDocument2 pagesCurriculum Vitae PDFromel tekamPas encore d'évaluation
- Lab 1Document2 pagesLab 1Serge RINAUDOPas encore d'évaluation
- Proposition de Corrigé TD3Document5 pagesProposition de Corrigé TD3Amine HOUDNAPas encore d'évaluation
- TD3 Structure - 12 - 13Document7 pagesTD3 Structure - 12 - 13sidi mohamed el amine nekkal100% (1)
- Débuter en PythonDocument59 pagesDébuter en PythonFayssal AbaibatPas encore d'évaluation
- TS-chimie-C1-évolution Vers ÉquilibreDocument7 pagesTS-chimie-C1-évolution Vers Équilibrela physique selon le programme Français100% (2)
- Item 12 - ACE INDUS - Manuel Utilisateur Configuration SL7000Document13 pagesItem 12 - ACE INDUS - Manuel Utilisateur Configuration SL7000SALVADORPas encore d'évaluation
- Chapitre 3 KarnaughDocument5 pagesChapitre 3 KarnaughIdris IlungaPas encore d'évaluation
- AvantprojetDocument4 pagesAvantprojetwiam_alPas encore d'évaluation
- Chapitre4 JqueryDocument14 pagesChapitre4 Jquerybendhifsaber22Pas encore d'évaluation
- Varaiteur 160 KW AltivarDocument8 pagesVaraiteur 160 KW AltivarsaidloubarPas encore d'évaluation
- Cours Forces Pressantes Bep IndustrielDocument3 pagesCours Forces Pressantes Bep IndustrielFélix KouassiPas encore d'évaluation
- Cour Geotechnique Indice Des Vide Et AuteDocument5 pagesCour Geotechnique Indice Des Vide Et AuteCEDRIC SOBGUIPas encore d'évaluation
- Modelisation de l'IPC Au SenegalDocument32 pagesModelisation de l'IPC Au SenegalASSELOKA AmadouPas encore d'évaluation
- Arduino J FTDocument45 pagesArduino J FThissein ousmanPas encore d'évaluation
- 'Etude Parasismique Selon L'eurocode 8Document10 pages'Etude Parasismique Selon L'eurocode 8Mohamed SEHLIPas encore d'évaluation
- Rapport de Mini ProjetDocument9 pagesRapport de Mini ProjetAymen BenguessoumPas encore d'évaluation
- Cours BTS Puissance ElectromecaDocument11 pagesCours BTS Puissance ElectromecaAmadou SARRPas encore d'évaluation
- Base Et AcideDocument4 pagesBase Et AcideYves-donald MakoumbouPas encore d'évaluation
- Sa02 1112Document8 pagesSa02 1112Lawrence Mundene-timotheePas encore d'évaluation
- Cours3 IPM adressageIPDocument45 pagesCours3 IPM adressageIPAhmed MesaudaPas encore d'évaluation
- Fiche Technique Pont Roulant Bi Poutre 15 TDocument5 pagesFiche Technique Pont Roulant Bi Poutre 15 TChibane Azouz100% (1)