Académique Documents
Professionnel Documents
Culture Documents
Electrolyse
Transféré par
kanuni26Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Electrolyse
Transféré par
kanuni26Droits d'auteur :
Formats disponibles
Electrolyse
Daniel Abegg Alexandre Dumoulin Universit de Gen`ve, Science II, Laboratoire G e e Groupe 7 en collaboration avec le groupe 5 16 avril 2007
Rsum e e
Llectrolyse est un outil analytique. e Dans une exprience prcdente nous e e e avons utilis les prcipitations pour dnir e e e les espces prsentes et cette mthode e e e sappelait la gravimtrie. Lapplicae tion utilisant llectrolyse est appele e e llectrogravimtrie. La raction est ene e e gendre par un courant lectrique et permet e e notammant la fabrication des direntes e mati`res dont laluminium, le sodium et le e magnsium. e ll y a 3 modes de fonctionnement pour une cellule lectrochimique : le mode quilibre, e e o` il ny a pas de courant qui passe et u lon mesure seulement le potentiel. Le mode galvanique (que nous avons utilis e le derni`re fois), o` un courant circule e u avec aussi une rsistance. Finalement le e mode lectrolytique, o` il y a les mmes e u e composants que pour le mode galvanique mais un gnrateur externe force la raction e e e dans le sens inverse. Lon observe que le potentiel de base (mode quilibre) est e suprieur ` celui du mode galvanique mais e a infrieur au mode lectrolytique. e e La cellule lectrolytique nest en fait que la e 1
seule cellule o` lon plonge les 2 lectrodes. u e Llectrodposition est le processus qui e e dpose une couche dun mtal sur un e e autre, comme par exemple de largent sur une plaque de cuivre. Mais il nest pas facile dobtenir une couche uniforme car le courant doit avoir une bonne intensit. e La loi de Faraday nonce que Q = F ne et e la constante F est gale ` 96485 C/mol et e a reprsente la charge dune mole dlectron e e en Coulomb. Le gnrateur externe que nous allons e e utiliser sera soit en mode amprostatique e (courant constant) ou en mode potentiostatique (tension constante).
Introduction
Dans cette exprience les sections e lectrogravimtrie e e du cuivre et lectrodposition du nickel seront e e eectus par le groupe 5. e Dans ce TP nous allons commencer par tester llectrogravimtrie avec le cuivre. Puis e e nous calculerons la constante de Faraday. Ensuite nous utiliserons llectrodposition e e du nickel dans dirents millieux et pour e
nir nous ferons une lectosynth`se de e e 2 S2 O8 par lectrolsye puis nous trouverons e par des titrages la quantit exacte de e peroxodisulfate synthtis pour calculer le e e rendement.
Constante de Faraday
Transfert de 45 ml de CuSO4 1 M dans un bcher. Prparation de llectrode de e e e cuivre et de platine. Mise dune tension de +5 V pendant 60 minutes puis repesage de llectrode du cuivre. e m Qtot Cste Faraday Cste Faraday(th) Erreur rel. = 0.5713 g = 1912.5 C = 106347 C/mol = 96485 C/mol = 10.22 %
Mthodologie e
Electrogravimtrie e cuivre du
Analyse lectrogravimtrique e e du cuivre Electrodposition du nie
Mise des 2 lectrodes (cuivre et plae tine) dans de lthanol pendant quelques e minutes, puis lavage ` lH2 O, mise de a llectrode de cuivre de ltuve (110 C) e e pour 20 minutes et pese. e Prparation de 50 ml de CuSO4 5H2 O 1 M. e Pipetage de 5 ml de cette solution dans un autre ballon jaug de 50 ml et dilution avec e H2 O. La molarit est de 0.1 M. e Mise de 25 ml de CuSO4 0.1 M dans un bcher et ajout de 25 ml de HNO3 e 1 M. Immersion des 2 lectrodes (Cu et e Pt). Application dun courant constant de 0.5 A en agitant la solution avc un barreau magntique pendant 30 minutes. e La couleur bleu disspara Ajout de 1 g t. dure, puis une nouvelle attente de 10 mie nutes. Prise de quelques gouttes de la soltion et ajout de gouttes de NH3 4 M pour vrier quil ny a plus de Cu++ . e Lavage des lectrodes ` lH2 O et schage ` e a e a ltuve et pese. e e
ckel
Prparation de 4 plaques de cuivre (mme e e mthode que pour llectrode de cuivre ). e e Prparation de 250 ml de NiSO4 0.9 M + e Na2 SO4 0.2 M. Mise de 60 ml de cette solution dans un bcher et ajout de H2 SO4 e 4 M pour avoir un pH de 2. Immersion des lectrodes (plaque de Cu et Pt) et dun bare reau magntique. Application dun courant e constant de 0.5 A pendant 20 minutes. Puis apr`s rinag et schage, pese de la plaque e c e e de cuivre. La mme mthode est utilise pour les 3 e e e `me e autres plaques mais la 2 est avec un pH e de 5. La 3`me avec un pH de 2 et 1 g dacide e borique (B(OH)3) et la 4`me est ` pH 5 avec a 1 g de B(OH)3 . m(th) m1 m2 m3 m4 A1 A2 A3 A4 2 = = = = = = = = = 0.182 0.103 0.038 0.058 0.106 24.16 16.8 28.28 25 g g g g g cm2 cm2 cm2 cm2
CCuSO4 m CCu++ Erreur rel.
= = = =
0.104 0.173 0.109 4.808
M g M %
pH 2 5 2 5
B(OH)3 non non oui oui
R (%) 56.6 20.9 31,9 58.2
Epaisseur (m) 4.786 2.539 2.302 4.760
Analyse par iodomtrie e
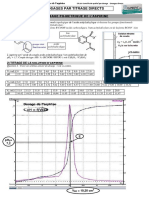
Mise de la solution de llectrolyse dan un e ballon jaug et dilution ` 250 ml avec H2 O. e a Dans un bcher : 10 ml de KI, 5 ml de la e solution du ballon jaug et une pipette pase teur de H2 SO4 4 M. Titrage avec du thiosulfate de sodium. Ajout damidon proche du point dquivalence. e VN a2 S2 O3 2 C S2 O 8 2 CS2 O8 (th) Rendement = = = = 22.8 0.1168 0.2488 46.947 ml M M %
Electrosynth`se de pere oxodisulfates
Electrolyse
Pese de 25 g de (NH4 )2 SO4 et de 0.2 g e de K2 CrO4 et ajout de 40 ml dH2 O. Lger chauage avec la plaque et aussi e avec le barreau magntique pour aider la e dissolution. Mise du pH ` 4 avec du H2 SO4 a 4 M et immersion des 2 lectrodes (fer et e platine). Le tout dans un bain de glace avec un courant constant de 2 A. On ajuste du pH toutes les 5 minutes car loxydation consomme les ions H3 O + . Llectrolyse e dure 100 minutes et se fait sous chapelle.
Discussion
Dans la premi`re exprience, lon remarque e e que llectrogravimtrie donne une valeur e e pour la concentration rel des ions Cu++ e prsent dans la solution et lon obtient e cette valeur plus rapidement et plus simplement que si lon devait faire des titrages. En eet car pendant la plupart du temps lexprience na pas besoin dtre contrle. e e oe Les sources derreurs pour cette exprience e sont les peses. e Pour la constante de Faraday la valeur trouve est ` 10% pr`s ,ce qui est quand e a e mme une assez grande erreur. Ici aussi e la principal source derreur sont les peses, e mais lapproximation de lintgrale. e Lexprience avec le nickel montre que les e 4 cas peuvent tre classs en 2 cas. Les 2 e e meilleurs rsulats sont ceux ` pH 2 sans e a B(OH)3 et pH 5 avec B(OH)3 , qui ont tous les 2 un rendement suprieur ` 50%. e a De ces valeurs on peut supposer que le rle de lacide borique est de permettre la o dposition dune bonne couche de nickel ` e a un pH plus lev. e e Dans la derni`re partie de ce TP nous e avons d activement surveiller llectrolyse u e et rguli`rement ajouter de lacide sulfue e rique. Le rendement de llectrolyse est e moyen car il se situe aux alentours de 50%. 3
Observation Pendant llectrolyse, il y a formation de e bulles (H2 ), la solution chaue et la couleur passe de jaune au jaune-vert.
Etalonnage du thiosulfate
Prparation dune solution de KIO3 e 0.02 M, de lindicateur damidon (135 mg), dune solution de Na2 S2 O3 0.05 M et dune solution de KI 0.2 M. Mise de 10 ml de KIO3 , dune pipette pasteur de H2 SO4 4 M et de 10 ml de KI et dun barreau magntique dans un bcher et titrage e e avec Na2 S2 O3 . Ajout damidon au point dquivalence. e Vmoyen = = CN a2 S2 O3 Ecart-type = 23.425 5.123 102 8.34 103 ml M
Mais nous ne sommes par totalement s r du u titrage car, il nous a fallu environ 2 heures pour faire 1 titrage (ce qui est beaucoup plus long que normal), se qui explique le fait que nous nen naions fait quun seul. Le probl`me tait que la cration de iode est e e e lente, ce qui a caus que la solution devenait e transparente ds lajout de 5 ml de thioe sulfate, pour quelle redevienne jaune-vert apr`s quelques instants. Nous avons donc e ajout le thiosulfate lentement et attendu. e Notre point dquivalence a t choisi apr`s e ee e avoir patient 5 minutes. e
Conclusion
Les rsultats qui ont t trouv sont ace ee e cetables, avec comme pire la constante de Faraday. Sinon les expriences ont t e ee agrables, sauf le dernier titrage. Nous e sommes donc satisfait de ce TP et le travaille avec le groupe 5, sest aussi tr`s bien e pass. e
Vous aimerez peut-être aussi
- Equilibre D'un Solide Mobile Autour D'un AxeDocument1 pageEquilibre D'un Solide Mobile Autour D'un Axekanuni26Pas encore d'évaluation
- Intro PythonDocument16 pagesIntro Pythonkanuni26Pas encore d'évaluation
- Cat ADP Cervicale++ PDFDocument4 pagesCat ADP Cervicale++ PDFkanuni26Pas encore d'évaluation
- Mécanique Du Point MatérielDocument151 pagesMécanique Du Point Matérieltortorou88% (8)
- Mecanique Generale - Cours Et Exercices Corriges PDFDocument277 pagesMecanique Generale - Cours Et Exercices Corriges PDFAlanbertro Omar100% (4)
- SmortierBlaisePascalPC Courbes Intensite Potentiel PDFDocument4 pagesSmortierBlaisePascalPC Courbes Intensite Potentiel PDFkanuni26Pas encore d'évaluation
- Spec AtomDocument43 pagesSpec AtomMouna MoonPas encore d'évaluation
- CR TP Magnétismes Moumene Ka AzzaouiDocument12 pagesCR TP Magnétismes Moumene Ka AzzaouiYahya MoumenePas encore d'évaluation
- Mecanique Des Fluides-Be8153Document18 pagesMecanique Des Fluides-Be8153Mouhamed Rassoul GueyePas encore d'évaluation
- AM1 TD2 2020 2021 CorrigéDocument5 pagesAM1 TD2 2020 2021 CorrigéSusan DaPas encore d'évaluation
- II - Ecoulements Ideaux L3ENGDocument18 pagesII - Ecoulements Ideaux L3ENGBilal BouakrifPas encore d'évaluation
- Duree: 1H Exercice N°1: La Lampe Euréka Electronique:: 0.5pt 1pt 0.5pt 2ptsDocument2 pagesDuree: 1H Exercice N°1: La Lampe Euréka Electronique:: 0.5pt 1pt 0.5pt 2ptsAyman Benamer0% (1)
- TIPE Thèse 1Document223 pagesTIPE Thèse 1Mr MitePas encore d'évaluation
- Fiche Technique GE 400 KVADocument8 pagesFiche Technique GE 400 KVAnoureddine loukiliPas encore d'évaluation
- Edt-Smpc S2 05-04-2021Document16 pagesEdt-Smpc S2 05-04-2021LORD WALIDPas encore d'évaluation
- 2018 TOU30165 ADocument209 pages2018 TOU30165 AWido PikalPas encore d'évaluation
- Transformateur Mono À Deux Colonnes de SecuritéDocument1 pageTransformateur Mono À Deux Colonnes de Securitéarbi jridiPas encore d'évaluation
- Batiss Securite Incendie CHDocument23 pagesBatiss Securite Incendie CHAchourPas encore d'évaluation
- ResumeThermodynamique 4 PDFDocument2 pagesResumeThermodynamique 4 PDFSaihi OussemaPas encore d'évaluation
- Science Des Materiaux 1Document10 pagesScience Des Materiaux 1Colin WilbaPas encore d'évaluation
- 14.13 (6648-1061-5-PS-OM-0001) Condensate Polishing Unit - II (Unit 1061) - FRDocument31 pages14.13 (6648-1061-5-PS-OM-0001) Condensate Polishing Unit - II (Unit 1061) - FRMohamed OuichaouiPas encore d'évaluation
- Support TP Chimie1Document21 pagesSupport TP Chimie1Âmįþăf BłłPas encore d'évaluation
- Cours de RemediationDocument43 pagesCours de RemediationKevin ObiangPas encore d'évaluation
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDocument5 pagesTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinanePas encore d'évaluation
- Chaine RespiratoireDocument30 pagesChaine RespiratoireMadra 30Pas encore d'évaluation
- Eu-0-Com - GRC-001-NHG STBVDocument38 pagesEu-0-Com - GRC-001-NHG STBVdiengPas encore d'évaluation
- TP (3) Biochimie AlimentaireDocument8 pagesTP (3) Biochimie AlimentaireAnissa DERDERPas encore d'évaluation
- Chimie de SurfaceDocument4 pagesChimie de SurfaceChui Spr VedettePas encore d'évaluation
- 0.TP CH02Document6 pages0.TP CH02Naouma ChahdPas encore d'évaluation
- I PhystatM1Document41 pagesI PhystatM1Juan Camilo GallegoPas encore d'évaluation
- DS 3 A - ÉnoncéDocument7 pagesDS 3 A - Énoncéhedidbz38Pas encore d'évaluation
- Les RoulementsDocument20 pagesLes RoulementsmathisPas encore d'évaluation
- Gnomique ProteomiqueDocument52 pagesGnomique ProteomiqueAsma PrettyangelPas encore d'évaluation
- Etinc Cours 2ac PC GuideDocument37 pagesEtinc Cours 2ac PC GuideXi Do86% (81)
- IlyesDocument14 pagesIlyesslmhh555Pas encore d'évaluation
- Katadyn PowerSurvivor 40E - ManualDocument40 pagesKatadyn PowerSurvivor 40E - ManualCaroline Delire-DieuPas encore d'évaluation
- Poly OUM1Document43 pagesPoly OUM1Houcine BendaoudPas encore d'évaluation